新型六氢吡啶-2,3-并吲哚化合物的合成及其抗肿瘤活性
2016-06-12张文会王丹丹刘欢欢刘雄利陈智勇李午戊
张文会, 王丹丹, 刘欢欢, 巩 艺, 刘雄利*, 陈智勇, 周 英*, 李午戊
(1. 贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳 550025;2. 咸阳师范学院 化学与化工学院,陕西 咸阳 712000)
·研究论文·
新型六氢吡啶-2,3-并吲哚化合物的合成及其抗肿瘤活性
张文会1, 王丹丹1, 刘欢欢1, 巩艺1, 刘雄利1*, 陈智勇1, 周英1*, 李午戊2
(1. 贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳550025;2. 咸阳师范学院 化学与化工学院,陕西 咸阳712000)
摘要:以3-取代氧化吲哚与丙烯酸酯为原料,经Michael加成反应制得中间体——3-丙酸酯取代氧化吲哚(3a~3d); 3a~3d与甲胺发生酰胺化反应制得3-丙酰胺取代氧化吲哚(4a~4d); 4a~4d用氢化铝锂还原-环化,合成了4个六氢吡啶-2,3-并吲哚化合物(5a~5d); 5a和5b用氢化铝锂还原合成了2个六氢吡啶-2,3-并吲哚化合物(6a和6b), 5a~5d, 6a和6b均为新化合物,总产率42%~61%,其结构经1H NMR,13C NMR和HR-ESI-MS表征。采用MTT法研究了5a~5d, 6a和6b对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:5b对A549, PC-3和K562的抑制活性均较好,其IC50分别为27.2 μmol·L-1, 37.5 μmol·L-1和21.7 μmol·L-1。
关键词:3-取代氧化吲哚; 六氢吡啶-2,3-并吲哚化合物; Michael加成反应; 酰胺化反应; 还原-环化反应; 合成; 抗肿瘤活性
六氢吡啶-2,3-并吲哚骨架广泛存在于许多吲哚生物碱中,且具有良好的生物活性。如Hirano A等[1]从曲霉培养液fg-551中分离得到的Neoxaline,可抑制细胞增殖,阻滞细胞分裂进程,表现出较强的抗癌活性。从青霉菌培养液中分离得到的9-epi-neoxaline[2], oxaline[3], glandicolins[4]和meleagrins[5]均具有抗癌活性。此外,Kapakahine A[6]也在抗肿瘤药物开发中有潜在的应用前景。
因此,合成含六氢吡啶-2,3-并吲哚骨架的化合物可为生物活性筛选提供来源,对寻找新型抗肿瘤活性先导化合物有实际意义。本文以3-取代氧化吲哚(1a~1d)与丙烯酸酯为原料,经Michael加成反应制得中间体——3-丙酸酯取代氧化吲哚(3a~3d); 3a~3d与甲胺发生酰胺化反应制得3-丙酰胺取代氧化吲哚(4a~4d); 4a~4d用氢化铝锂还原-环化,合成了4个六氢吡啶-2,3-并吲哚化合物(5a~5d); 5a和5b用氢化铝锂还原合成了2个六氢吡啶-2,3-并吲哚化合物(6a和6b), 5a~5d, 6a和6b均为新化合物,总收率42%~61%,其结构经1H NMR,13C NMR和HR-ESI-MS表征。采用MTT法研究了5a~5d, 6a和6b对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。
1实验部分
1. 1仪器与试剂
WRS-1B型熔点仪;Bruker-300 MHz型核磁共振仪(CD3Cl为溶剂,TMS为内标);MicroTMQ-TOF型高分辨质谱仪。
1a~1d按文献[7]方法合成;其余所用试剂均为分析纯。
1.2合成
(1) 3a~3d的合成(以3a为例)
在反应瓶中加入N-甲基-3-间甲基苄基氧化吲哚(1a)100.4 mg(0.4 mmol)和丙烯酸乙酯(2)97 mg(0.6 mmol),二氯甲烷5.0 mL,搅拌使其溶解;加入10 mol%四丁基溴化铵(TBAB)12.8 mg和20 mol%K2CO311.0 mg,氮气保护下于室温反应24 h(TLC检测)。反应液直接经硅胶柱层析[梯度洗脱剂A:V(乙酸乙酯) ∶V(石油醚)=10 ∶1~5 ∶1]纯化得黄色液体3a 127.8 mg,收率91%; HR-ESI-MSm/z: Calcd for C22H25NO3Na{[M+Na]+}374.173 2, found 374.173 9。
以1b~1d替换1a,用类似的方法合成3b~3d。
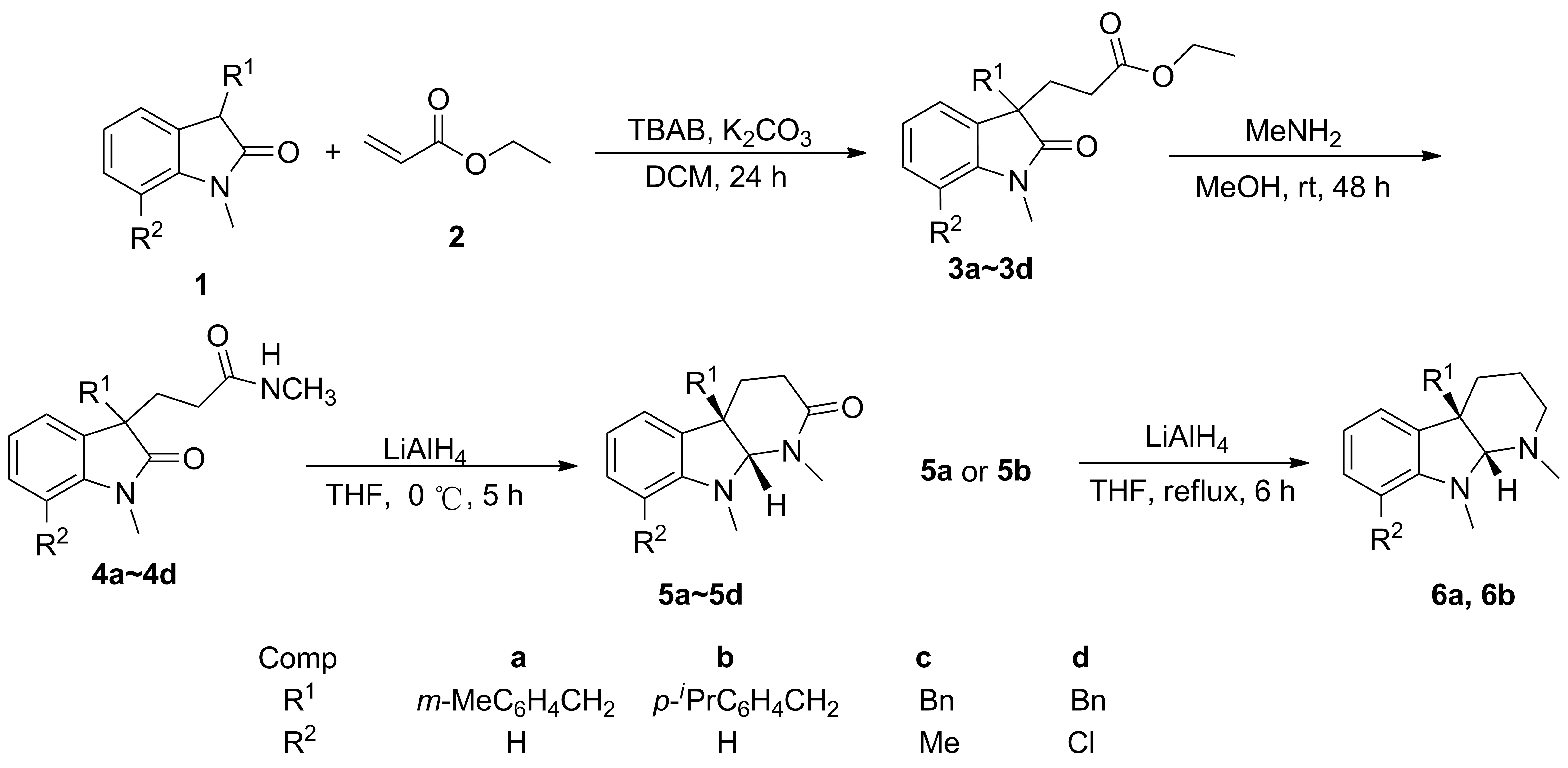
Scheme 1
(2) 4a~4d的合成通法
在反应瓶中加入3a~3d 0.40 mmol和MeOH 3.0 mL,搅拌使其溶解;加入30%MeNH23 mL,于室温反应48 h(TLC检测)。减压蒸除溶剂,残余物用二氯甲烷溶解后经硅胶柱层析(洗脱剂:A=5 ∶1)纯化得黄色液体4a~4d。
(3) 5a~5d的合成通法
在反应瓶中加入4a~4d 0.4 mmol和干燥THF 6.0 mL,搅拌使其溶解;于0 ℃加入LiAlH4152 mg,反应5 h(TLC检测)。用饱和NH4Cl溶液淬灭反应,用乙酸乙酯(3×60 mL)萃取,合并有机相,用硫酸钠干燥,减压蒸除溶剂,残余物用二氯甲烷溶解后经硅胶柱层析 (洗脱剂:A=3 ∶1)纯化得5a~5d。
5a: 苍黄色油状液体,收率56%;1H NMRδ: 2.06~2.28(m, 7H), 2.64(s, 3H), 2.84~2.88(m, 1H), 2.93~3.00(m, 4H), 4.63(s, 1H), 6.30~6.34(m, 1H), 6.67(s, 1H), 6.70~6.78(m, 2H), 6.90~6.94(m, 1H), 6.98~7.03(m, 1H), 7.07~7.15(m, 2H);13C NMRδ: 21.3, 29.9, 31.6, 34.6, 34.8, 47.4, 49.9, 86.9, 106.6, 118.2, 123.0, 127.4, 127.8, 128.6, 131.1, 132.0, 136.4, 137.5, 150.9, 173.6; HR-ESI-MSm/z: Calcd for C21H24N2ONa{[M+Na]+}343.178 6, found 343.178 6。
5b: 白色固体,收率53%; m.p.95.2~95.9 ℃;1H NMRδ: 1.19~1.22(m, 6H), 2.06~2.28(m, 4H), 2.64(s, 3H), 2.81~2.90(m, 2H), 2.92(s, 3H), 2.94~2.99(m, 1H), 4.62(s, 1H), 6.30~6.35(m, 1H), 6.72~6.77(m, 1H), 6.81~6.85(m, 2H), 6.90~6.95(m, 1H), 7.04~7.09(m, 2H), 7.10~7.15(m, 1H);13C NMRδ: 23.9, 24.0, 29.9, 31.7, 33.6, 34.6, 34.8, 46.9, 49.9, 86.9, 106.6, 118.2, 123.0, 126.0, 128.6, 130.2, 132.2, 133.7, 147.4, 150.8, 173.6; HR-ESI-MSm/z: Calcd for C23H28N2ONa{[M+Na]+}371.209 9, found 371.209 7。
5c: 苍黄色油状物,收率60%;1H NMRδ: 2.02~2.07(m, 2H), 2.13~2.23(m, 5H), 2.58(s, 3H), 2.81(d,J=8.2 Hz, 1H), 2.93(s, 3H), 2.97(d,J=9.0 Hz, 1H), 4.42(s, 1H), 6.73(d,J=4.0 Hz, 1H), 6.78~6.82(m, 3H), 6.92(d,J=8.0 Hz, 1H), 7.18~7.19(m, 3H);13C NMRδ: 18.5, 29.1, 29.6, 32.5, 40.4, 48.8, 50.2, 89.0, 120.4, 120.8, 122.2, 126.8, 127.8, 130.2, 131.2, 133.5, 136.5, 150.4, 171.7; HR-ESI-MSm/z: Calcd for C21H24N2ONa{[M+Na]+}343.178 6, found 343.178 9。
5d: 苍黄色油状物,收率61%;1H NMRδ: 2.04~2.09(m, 2H), 2.15~2.18(m, 1H), 2.17~2.27(m, 1H), 2.74(s, 3H), 2.82(d,J=8.2 Hz, 1H), 2.95(s, 3H), 2.98(d,J=9.0 Hz, 1H), 4.48(s, 1H), 6.78~6.81(m, 4H), 7.08~7.11(m, 1H), 7.20~7.21(m, 3H);13C NMRδ: 29.2, 29.7, 32.9, 39.2, 48.5, 50.4, 88.6, 117.9, 121.0, 121.3, 127.1, 128.0, 130.1, 130.4, 135.8, 136.0, 147.5, 171.6; HR-ESI-MSm/z: Calcd for C20H21N2OClNa{[M+Na]+}363.124 0, found 363.124 7。
(4) 6a和6b的合成通法
在反应瓶中加入5a或5b 0.4 mmol和干燥THF 6.0 mL,搅拌使其溶解;于0 ℃加入LiAlH4152 mg,回流反应6 h(TLC检测)。用饱和NH4Cl溶液淬灭反应,用乙酸乙酯(3×60 mL)萃取,合并有机相,用硫酸钠干燥,减压蒸除溶剂,残余物用二氯甲烷溶解后经硅胶柱层析(洗脱剂:A=3 ∶1)纯化得苍黄色油状液体6a或6b。
6a: 收率46%;1H NMRδ: 1.67~1.87(m, 4H), 2.21(s, 3H), 2.45~2.51(m, 1H), 2.52(s, 3H), 2.57(s, 3H), 2.58~2.66(m, 1H), 2.81(d,J=13.3 Hz, 1H), 2.92(d,J=13.3 Hz, 1H), 3.90(s, 1H), 6.34(d,J=7.8 Hz, 1H), 6.63~6.72(m, 3H), 6.84~6.96(m, 2H), 6.99~7.10(m, 2H);13C NMRδ: 18.9, 21.3, 29.6, 30.5, 36.8, 43.1, 45.6, 48.1, 88.8, 107.1, 117.3, 122.7, 126.7, 127.3, 127.5, 131.3, 134.3, 136.9, 137.7, 152.2; HR-ESI-MSm/z: Calcd for C21H26N2Na{[M+Na]+}329.199 3, found 329.199 6。
6b: 收率42%;1H NMRδ: 1.16~1.21(m, 6H), 1.30~1.39(m, 1H), 1.65~1.89(m, 3H), 2.46~2.50(m, 1H), 2.53(s, 3H), 2.56(s, 3H), 2.59~2.66(m, 1H), 2.78~2.85(m, 2H), 2.92~2.95(m, 1H), 3.91(s, 1H), 6.32~6.37(m, 1H), 6.66~6.71(m, 1H), 6.77~6.83(m, 2H), 6.87~6.92(m, 1H), 6.97~7.03(m, 2H), 7.04~7.10(m, 1H);13C NMRδ: 18.8, 24.0, 30.7, 33.6, 36.8, 43.1, 45.1, 45.6, 48.0, 88.7, 107.2, 117.3, 122.3, 125.6, 127.6, 130.4, 134.5, 135.1, 146.5, 152.2; HR-ESI-MSm/z: Calcd for C23H30N2Na{[M+Na]+}357.230 6, found 357.230 2。
1.3体外抗肿瘤活性测定
采用MTT法[8-9]测定了5a~5d, 6a和6b对A549, PC-3及K562的体外抗肿瘤活性,以顺铂为阳性对照药。
(1) 待测样制备
用DMEM培养基(含10%胎牛血清,100 U·mL-1青霉素和100 U·mL-1链霉素)培养A549。细胞以4 000个/孔浓度加入至96孔板中,于37 ℃, 5%CO2潮湿空气培养箱中培养24 h。以RPMI-1640培养基替代DMEM培养基,用类似的方法制备K562和PC-3待测样。
(2) 测定方法
将新配5a~5d, 6a和6b的二甲基亚砜溶液以加入孔中,终浓度分别为5 μmol·L-1, 10 μmol·L-1, 20 μmol·L-1, 40 μmol·L-1和80 μmol·L-1。静置48 h,每孔加入5 mg·mL-1MTT磷酸盐缓冲液10 μL,于37 ℃培养4 h。离心5 min除去未转化MTT,每孔加入二甲基亚砜150 μL,用酶标仪在波长490 nm处测定OD值,用Spss软件分析5和6对A549, K562和PC-3的IC50。
2结果与讨论
2.1合成
以3a的合成为模板反应,研究了催化剂,碱和溶剂对3收率的影响,结果见表1。
表13a的合成条件优化

Table 1 Optimization of reaction condition for synthesizing 3a
a10 mol%;b20 mol%;c5.0 mL;d分离收率。
由表1可见,以TBAB为催化剂,K2CO3为碱,Toluene为溶剂时,3a收率最高(91%)。
2.2抗肿瘤活性
表2为5和6的抗肿瘤活性。由表2可见,5b对A549, PC-3和K562的抑制活性均较好,其IC50分别为27.2 μmol·L-1, 37.5 μmol·L-1和21.7 μmol·L-1。
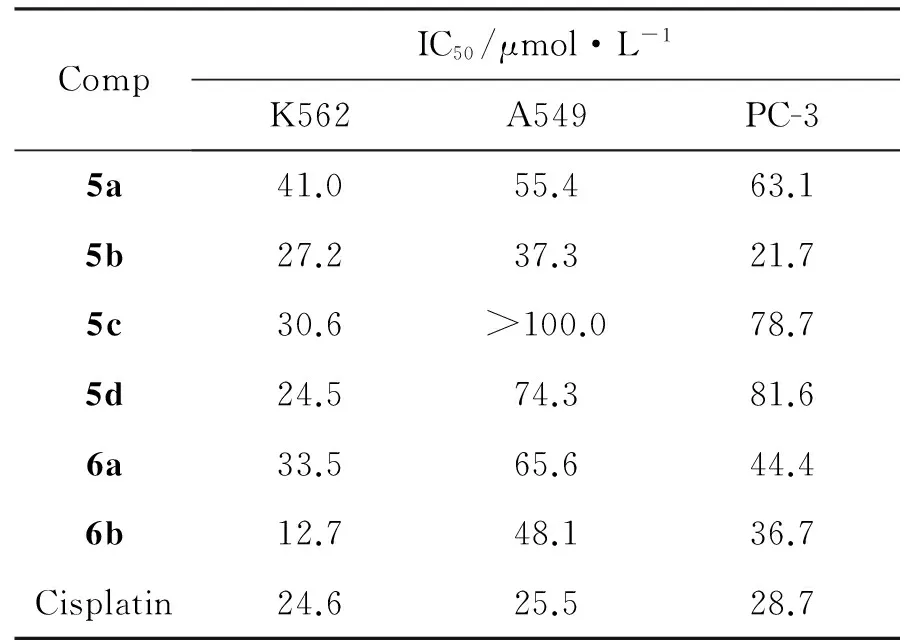
表2 5和6的体外抗肿瘤活性
3结论
合成了6个新型的六氢吡啶-2,3-并吲哚类化合物(5a~5d, 6a和6b)。采用MTT法研究了5a~5d, 6a和6b对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:5b对A549, PC-3和K562的抑制活性均较好,其IC50分别为27.2 μmol·L-1, 37.5 μmol·L-1和21.7 μmol·L-1。5和6可作为先导化合物进一步研究。其他相关药理活性正在进行中。
参考文献
[1]Hirano A, Iwai Y, Masuma R,etal. Neoxaline,a new alkaloid produced by aspergillus japonicas:Production,isolation and properties[J].J Antibiot,1979,32(8):781-785.
[2]Overy D P, Phipps R K, Frydenvang K,etal. Epi-neoxaline,a chemotaxonomic marker for Penicillium tulipae[J].Biochem Syst Ecol,2006,34(4):345-348.[3]Steyn P S. The isolation,structure and absolute configuration of secalonic acid D,the toxic metabolite of Penicillium oxalicum[J].Tetrahedron,1970,26(1):51-57.
[4]Kozlovsky A G, Vinokurova N G, Reshetilova T A,etal. New metabolites of Penicillium glandicola var.glandicola-glandicoline A and glandicoline B[J].Appl Biochem Microbiol,1994,30:334-337.
[5]Du L, Li D, Zhu T,etal. New alkaloids and diterpenes from a deep ocean sediment derived fungusPenicilliumsp.[J].Tetrahedron,2009,65(11):1033-1039.
[6]Nakao Y, Yeung B K S, Yoshida W Y,etal. Kapakahine B,a cyclic hexapeptide with an.alpha.-carboline ring system from the marine sponge Cribrochalina olemda[J].J Am Chem Soc,1995,117:8271-8272.
[7]Zhou F, Ding M, Zhou J,etal. Organocatalytic asymmetricα-amination of unprotected 3-aryl and 3-aliphatic substituted oxindoles using di-tert-butyl azodicarboxylate[J].Adv Synth Catal,2011,353:2945-2952.
[8]Mosman T J. Rapid colorimetric assay for eellulair growth and survival:Application and cytotxicity assays[J].Immunol Methods,1983,65:55-63.
[9]Alley M C, Scudiero D A, Monks A,etal.Feasibility of drug screening with panals of human tumor cell lines using a mycroculture tetrazolium assay[J].Cancer Res,1988,48:589-601.
Synthesis and Anti-tumor Activities of Novel Hexahydro-1H-pyrido[2,3-b]indole Compounds
ZHANG Wen-hui1,WANG Dan-dan1,LIU Huan-huan1,Gong Yi1,LIU Xiong-li1*,CHEN Zhi-yong1,ZHOU Ying1*,LI Wu-wu2
(1. Guizhou Engineering Center for Innovative Traditional Chinese Medicine and Ethnic Medicine,College of Pharmacy, Guizhou University, Guiyang 550025, China;2. College of Chemistry & Chemical Engineering, Xianyang Normal University, Xianyang 712000, China)
Abstract:Four intermediates, 3-propionate oxindole(3a~3d), were obtained by Michael addition, using 3-substituted oxindoles and acrylates as starting materials. 3-Propionamide oxindoles(4a~4d) were prepared by the reaction of 3a~3d with methylamine. Four novel hexahydro-1H-pyrido[2,3-b]indole compounds(5a~5d) were synthesized by reductive-cyclization from 4a~4d, using LiAlH4 as reductant. Two novel hexahydro-1H-pyrido[2,3-b]indole compounds(6a and 6d) were synthesized by reduction of 5a and 5b with LiAlH4. The overall yield of 5a~5d, 6a and 6b were 42%~61%. The structures were characterized by1H NMR,13C NMR and HR-ESI-MS. The in vitro anti-tumor activities of 5 and 6 against human prostate cancer cells(PC-3), human lung cancer cells(A549) and human
leukemia cells(K562) were investgated by MTT method. The results demonstrated that 5b exhibited better inhibition activity against K562, A549 and PC-3. IC50were 27.2 μmol·L-1, 37.5 μmol·L-1and 21.7 μmol·L-1, respectively.
Keywords:3-substituted oxindole; hexahydro-1H-pyrido[2,3-b]indole compound; Michael addition; amidation; reductive-cyclization; synthesis; anti-tumor activity
收稿日期:2016-02-23
基金项目:国家自然科学基金青年基金资助项目(21302024); 国家自然科学地区基金资助项目(81560563); 贵州省教学改革创新项目(SJJG201423); 贵州省制药工程专业学位研究生工作站[黔教研合JYSZ字(2014)002]; 咸阳师范学院专项科研基金资助项目(10XSYK311)
作者简介:张文会(1990-),女,土家族,贵州铜仁人,硕士研究生,主要从事天然活性物质全合成及结构修饰的研究。通信联系人: 刘雄利,副教授,硕士生导师, E-mail: ls.liuxl@gzu.edu.cn; 周英,教授,博士生导师, E-mail: yzhou@gzu.edu.cn
中图分类号:O625.6; O626.1
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16034
