银腺杨大孢子母细胞减数分裂及胚囊发育研究
2016-06-06崔彬彬魏俊杰曹柳青刘帅勇沈一岚孙宇涵
崔彬彬,魏俊杰,张 妍,曹柳青,刘帅勇,沈一岚,孙宇涵
(1 保定学院 生化系,河北 保定 071000;2 北京林业大学 林木育种国家工程实验室,生物科学与技术学院,北京 100083)
银腺杨大孢子母细胞减数分裂及胚囊发育研究
崔彬彬1,魏俊杰1,张妍1,曹柳青1,刘帅勇1,沈一岚2,孙宇涵2
(1 保定学院 生化系,河北 保定 071000;2 北京林业大学 林木育种国家工程实验室,生物科学与技术学院,北京 100083)
[摘要]【目的】 对银腺杨大孢子母细胞减数分裂和胚囊的发育进程进行研究,为确定染色体加倍的有效处理时期提供细胞学参考,以提高通过雌配子染色体加倍途径选育三倍体的效率。【方法】 2014年1月采集银腺杨雌花枝进行水培,48 h后每隔3 h采集花芽样品。采用石蜡切片法对银腺杨的大孢子母细胞减数分裂及胚囊发育进程进行研究,同步观察雌花芽的外部形态。【结果】 银腺杨大孢子母细胞减数分裂及胚囊发育进程与花芽的外部形态变化存在一定的相关性,花序微露时,大孢子母细胞进入减数分裂细线期;1/2花序伸出芽鳞,发育到减数分裂中期Ⅰ;花序全部露出、长约1.55 cm左右时,进入减数分裂四分体时期。授粉前12 h,功能大孢子进入胚囊发育时期,雌蕊柱头开裂角度约180°时发育到单核胚囊;授粉后24 h,柱头褐色,发育到二核胚囊;授粉后36 h,柱头开始萎蔫,发育到四核胚囊;授粉后60 h,柱头干枯,发育到八核胚囊。【结论】 根据银腺杨雌花芽外部形态可判断其大孢子母细胞减数分裂及胚囊发育时期,以适时进行染色体的加倍处理;同时,银腺杨大孢子母细胞减数分裂和胚囊发育进程呈现出明显的不同步性,同花芽的不同小花及同一小花的不同胚珠间均存在着明显的发育差异,这一特点对种群进化有重要意义。
[关键词]银腺杨;大孢子母细胞;减数分裂;胚囊发育
银腺杨(Populusalba×P.glandulosa)是白杨派的一种,具有生长快、树干通直挺拔、适应性强、主根和侧根发达、枝繁叶茂等特点,是重要的造林绿化树种。三倍体杨树具有速生、巨大等特性,可以获取更高的木材产量[1-2],同时三倍体育种综合了杂种优势育种和倍性育种的优势,可以通过一轮次育种过程实现林木的综合性状遗传改良[3],因此人工创造三倍体逐渐成为现代林木育种工作的重要手段,一般通过理化处理诱导2n花粉或2n雌配子的方式人工选育三倍体新品种[4]。但通过诱导2n花粉加倍时,由于加倍花粉在受精过程中竞争能力差[5],导致这种方式的三倍体得率较低[6];而通过诱导大孢子染色体加倍和胚囊染色体加倍形成的2n雌配子,不存在单倍性配子的竞争问题,因而越来越受到林木育种者的青睐。李艳华等[7]在诱导银腺杨大孢子染色体加倍时,以毛白杨为父本授粉,结果三倍体得率最高达16.7%;王君等[8]以秋水仙碱诱导青杨胚囊染色体加倍,三倍体得率最高为66.7%。显然,诱导杨树大孢子和胚囊染色体加倍是有效的多倍体诱导途径。染色体加倍技术的关键是对处理时期的把握,因此对大孢子减数分裂和胚囊发育进程的判断尤为重要,这就需要对其进行细胞学观察。在利用诱导花粉染色体加倍选育白杨三倍体的研究中,康向阳等[9]将细胞学技术与染色体加倍技术结合起来,证明了白杨花粉染色体加倍的有效处理时期为减数分裂粗线期。而在杨属植物中,有关小孢子母细胞减数分裂进程及其遗传变异方面的细胞学研究较多[10-13],由于大孢子母细胞及胚囊包裹于胚珠之中,有关其发育过程的细胞学研究相对较少,发育时期也难以即时判别,因此限制了2n雌配子诱导及其在育种中的应用。李艳华等[7]的研究证明,银腺杨的大、小孢子母细胞减数分裂进程存在对应关系,而将银腺杨大孢子母细胞减数分裂和胚囊发育的整个细胞学过程与其花芽发育的外部形态联系起来的研究尚未见报道。为此,本研究以银腺杨为材料,采用石蜡切片方法,对大孢子母细胞减数分裂和胚囊的发育进程进行了研究,同步观察雌花芽的外部形态,以期为确定染色体加倍的有效处理时期提供细胞学参考和技术支持,进而提高通过雌配子染色体加倍途径选育三倍体的效率。
1材料与方法
1.1材料
银腺杨雌花枝采集于国家重点林木良种基地山东冠县苗圃。2014年1月采集花芽饱满、无病虫害的健壮花枝,用塑料薄膜包裹严密,运至河北大学温室,避风低温保存备用。
1.2方法
于2014-01-23将银腺杨雌花枝在河北大学温室内进行切枝水培,温度保持在10~25 ℃,授粉前花枝水培48 h,每隔3 h采集4~5个花芽,去除鳞片,用FAA固定液(V(体积分数70%乙醇)∶V(乙酸)∶V(体积分数38%甲醛)=90∶5∶5)固定,共历时340 h,固定花芽500个左右,4 ℃低温保存。
收集银腺杨花粉,当银腺杨雌花序处于最佳授粉时期时对其授粉。授粉后每隔6 h用FAA 固定液固定雌花芽4~5个,授粉5 d后每 12 h固定1次,直至授粉后第7天,固定的雌花芽均于4 ℃低温保存备用。每次进行雌花芽固定时均记录下被固定花芽的外部形态特征,用游标卡尺测量其花芽长度,同时对新鲜材料做解剖,观察柱头的发育情况,采用Leica EZ4HD体式显微镜观察并拍照。
大孢子母细胞减数分裂及胚囊发育进程的观察采用石蜡切片法,从每个FAA固定液固定的雌花芽基部、中部和顶部各摘取4个小花,经过逐级酒精脱水,二甲苯透明,采用石蜡包埋、切片,切片厚度8 μm,铁矾苏木精染色,苦味酸饱和液分色,最后进行显微观察,并对发育过程各时期进行统计,以占优势比例的发育时期作为阶段标志性时期。所有制片均用Olympus BX51型显微镜观察并拍照。
2结果与分析
2.1银腺杨大孢子母细胞减数分裂进程
在温室水培条件下,银腺杨水培210 h后开始进入减数分裂,共历时105 h,其大孢子母细胞减数分裂进程与花芽的发育存在一定的相关性(表1),随着雌花芽逐渐膨大、伸长,直到花序完全露出芽鳞,大孢子母细胞从减数分裂的细线期发育到四分体。当银腺杨雌花枝在温室水培约8 d时,雌花芽开始膨大(图1-A),柱头透明(图1-B),此时从子房纵切面观察,珠心与珠被约呈45°夹角,可以看到珠心表皮下的孢原细胞体积增大发育为大孢子母细胞。
银腺杨雌花枝水培210 h,雌花芽长约0.76 cm,花序微露(图1-C),柱头黄色(图1-D),银腺杨大孢子母细胞开始进入减数分裂前期Ⅰ的细线期(图2-A),细胞核仁明显,核内出现细长如线的染色体。雌花枝水培222 h,花芽长约0.84 cm,约1/5雌花序露出芽鳞,子房比细线期稍大,减数分裂进入细线末期(图2-B),此时染色体在细胞核内发生极化,集中于核仁一侧呈花束状。雌花枝水培234 h,花芽长约0.96 cm,约1/4花序露出芽鳞(图1-E),柱头稍显红色(图1-F),大孢子母细胞减数分裂进入粗线期(图2-C),此时同源染色体联会,染色体缩短加粗,形态明显。雌花枝水培240 h,雌花芽外形变化不大,此时染色体进一步缩短变粗,联会的二价体因非姊妹染色单体相互排斥而松解,但仍有几个交叉联结在一起,大孢子母细胞减数分裂进入双线期(图2-D)。雌花枝水培245 h,花芽长约1.14 cm,约1/3花序露出芽鳞(图1-G),柱头微红(图1-H),多数大孢子母细胞减数分裂进入终变期(图2-E),染色体变得更为浓缩和粗短,分散在整个核内。雌花枝水培258 h,雌花芽长约1.20 cm,约1/2花序露出芽鳞(图1-I),柱头伸长,开始分叉(图1-J),大部分大孢子母细胞减数分裂发育到中期Ⅰ(图2-F),此时核仁消失,配对的同源染色体分布排列在赤道板中央,具有典型的细胞分裂相,容易识别。雌花枝水培270 h,花芽长约1.23 cm,约2/3花序露出芽鳞(图1-K),柱头呈红色(图1-L),大孢子母细胞进入减数分裂后期Ⅰ(图2-G),配对的同源染色体在纺锤丝的牵引下移向细胞两极,同源染色体分离,随后形成二分体,完成第一次减数分裂。雌花枝水培285 h,花芽长约1.52 cm,花序已全部露出(图1-M),柱头四叉明显,开裂角度小于30°(图1-N),大孢子母细胞进入减数分裂中期Ⅱ(图2-H)。继续水培至315 h,雌花芽长约1.55 cm,花序完全露出,柱头伸出,开裂角度约60°(图1-O),大孢子母细胞进入减数分裂四分体时期(图2-I)。

表 1 银腺杨大孢子母细胞减数分裂进程及雌花芽形态特征
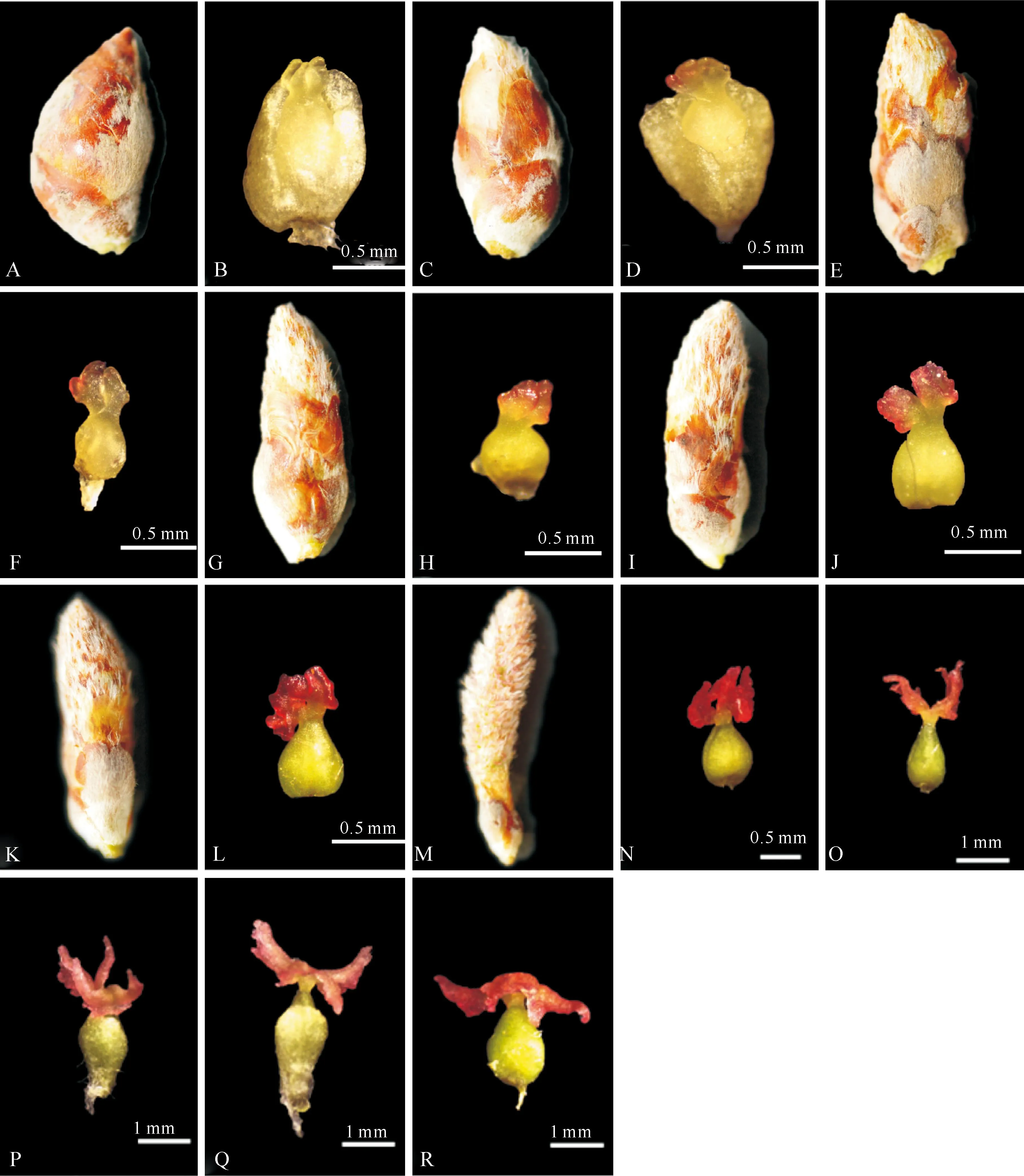
图 1银腺杨雌花芽及其柱头的发育进程
A,B.膨大的雌花芽及其柱头;C,D.花序微露的雌花芽及其柱头;E,F.1/4花序露出芽鳞的雌花芽及其柱头;
G,H.1/3花序露出芽鳞的雌花芽及其柱头;I,J.1/2花序露出芽鳞的雌花芽及其柱头;K,L.2/3花序露出芽鳞的雌花芽及其柱头;
M.花序全部露出芽鳞的雌花芽;N.开裂角度小于30°的柱头;O.开裂角度约60°的柱头;
P.开裂角度约90°的柱头;Q.开裂角度约120°的柱头;R.开裂角度约180°的柱头
Fig.1Female flower bud and its stigma development ofPopulusalba×P.glandulosa
A,B.Inflated female flower bud and its stigma;C,D.Female flower bud with a little catkin out and its stigma;
E,F.Female flower bud with 1/4 of the catkin out and its stigma;G,H.Female flower bud with 1/3 of the catkin out and its stigma;
I,J.Female flower bud with 1/2 of the catkin out and its stigma;K,L.Female flower bud with 2/3 of the
catkin out and its stigma;M.Female flower bud with all of catkin out;N.Stigma with cracking angle less than 30°;
O.Stigma with cracking angle about 60 °; P.Stigma with cracking angle about 90 °;
Q.Stigma with cracking angle about 120°;R.Stigma with cracking angle about 180°

图 2 银腺杨大孢子母细胞减数分裂进程
通过石蜡切片观察发现,银腺杨胚囊发育过程历时3~4 d,大孢子母细胞减数分裂进入四分体以后,珠孔端的3个大孢子退化,合点端的大孢子继续发育,形成功能大孢子(图3-A),功能大孢子经过3次有丝分裂形成成熟胚囊,成熟胚囊由位于合点端的3个反足细胞、珠孔端的2个助细胞、1个卵细胞及1个中央细胞组成,属于蓼型胚囊发育模式。在胚囊发育过程中,雌花序的外部形态也在不断发生变化(表2),从花序完全露出芽鳞,柱头红色,四叉完全张开到花粉可授期,授粉后花序不断伸长,柱头逐渐萎蔫、干枯,随着胚囊发育进程的完成,子房变得膨大饱满。
授粉前12 h左右,雌花序完全露出芽鳞,柱头红色,明显分叉,开裂角度约90°(图1-P),功能大孢子进入胚囊发育过程。继续水培12 h,雌蕊柱头的开裂角度不断变大(图1-Q),至开裂角度约180°(图1-R),四叉完全张开,到可授期,体积逐渐增大,细胞核位于中央,形成少量单核胚囊(图3-B)。授粉后12 h,雌花序外部形态变化不大,单核胚囊继续发育生长,经过1次有丝分裂,形成二核胚囊,可以观察到2个核处于中央(图3-C)。授粉后24 h,雌蕊柱头发暗变为褐色,2个核分别移向胚囊的两端(图3-D)。授粉后36 h,雌花序小花之间的距离稍拉开,花序变得松散,柱头开始萎蔫,二核胚囊位于珠孔端和合点端的2个细胞核进行第2次有丝分裂,形成四核胚囊(图3-E),两端各2个细胞核。授粉后48 h,雌花序进一步伸长,柱头萎蔫,四核胚囊占多数,少量发育快的四核胚囊进行第3次有丝分裂,形成八核胚囊(图3-F)。授粉后60 h,雌花序进一步伸长,柱头干枯,此时可看到大量的七细胞结构的八核胚囊。授粉后72 h,雌花序继续伸长,子房膨大,胚囊逐渐发育成熟。授粉后120 h,子房饱满,成熟胚囊已完成双受精,胚囊发育到胚和游离胚乳核时期。

图 3 银腺杨胚囊发育进程

授粉后时间/hAfterpollinationtime发育时期Developmentperiod花序特征Inflorescencecharacter-12四分体至单核胚囊Tetradtouni-nucleateembryosac花序完全露出,柱头红色,明显分叉,开裂角度约90°Allofcatkinstickedout;Thestigmawasredanditsbrancheswereobvious,anditscrackinganglewasabout90°0四分体至二核胚囊Tetradtotwo-nucleateembryosac花序完全露出,柱头四叉完全张开,开裂角度约180°,到可授期Allofcatkinstickedout;Fourbranchesofthestigmawereopencompletelyanditscrackinganglewasabout180°,andit’spollina-tiontime12单核胚囊至二核胚囊Uni-nucleatetotwo-nucleateembryosac花序变化不大,柱头红色Catkinhadfewchangesandthestigmawasred24单核胚囊至四核胚囊Uni-nucleatetofour-nucleateembryosac花序变化不大,柱头褐色Catkinhadfewchangesandthestigmawasbrown36单核胚囊至八核胚囊Uni-nucleatetoeight-nucleateembryosac花序开始松散,柱头开始萎蔫Thecatkinbecametobeincompactandthestigmasbegantowilt48二核胚囊至八核胚囊Two-nucleatetoeight-nucleateembryosac花序伸长,柱头萎蔫Catkinelongated;Stigmawilted60四核期至成熟胚囊Four-nucleatetoeight-nucleateembryosac花序伸长,柱头干枯Catkinelongated;Stigmaseared72成熟胚囊Matureembryosac花序伸长,子房膨大Catkinelongated;Ovaryswelled120胚与游离胚乳核时期Embryoandfreeendospermnuclearperiod子房饱满Plumpovary
3讨论与结论
在番茄、彩色马蹄莲等植物的细胞学研究中,研究者将雌花芽的形态特征用于判别其大孢子的发育进程[14-15]。本研究发现,银腺杨大孢子母细胞减数分裂和胚囊发育进程与花芽的外部形态变化存在一定的相关性,花序微露时,大孢子母细胞进入减数分裂细线期;1/4花序露出芽鳞时,减数分裂进入粗线期;1/3露出芽鳞时,发育到减数分裂终变期;1/2伸出芽鳞时,发育到减数分裂中期Ⅰ;2/3伸出芽鳞时,进入减数分裂后期Ⅰ;花序全部露出、长约1.55 cm时,进入减数分裂四分体时期。授粉前12 h,功能大孢子进入胚囊发育时期,雌蕊柱头开裂角度约180°时,发育到单核胚囊;授粉后24 h,柱头褐色,发育到二核胚囊;授粉后36 h,柱头开始萎蔫,发育到四核胚囊;授粉后60 h,柱头干枯,发育到八核胚囊。由此可根据雌花芽外部形态来判断大孢子母细胞减数分裂及胚囊发育进程。
2n雌配子受精后可以100%形成三倍体,具有很高的利用价值,但2n大孢子诱导处理时机较难把握。李艳华等[16]、侯延侠等[17]、张妍等[18]根据白杨、响叶杨、毛白杨雌雄配子发生、发育的时序性对应关系,以小孢子母细胞减数分裂进程为参照,即时判别大孢子母细胞的减数分裂时期,但大、小孢子母细胞减数分裂进程的相关性会随气候、温度等的变化有所差异。从银腺杨大孢子母细胞减数分裂及胚囊的发育与花芽外部形态的相关性看,依据雌花芽的外部形态特征,能够判别大孢子母细胞减数分裂和胚囊发育时期,适时进行染色体加倍处理,不需要以小孢子母细胞减数分裂进程为参照,实现了雌配子体发育时期的即时判别,并且花芽的外部形态特征受环境、气候影响较小,因此是一种简单、实用的技术方法。
本研究发现,银腺杨大孢子母细胞减数分裂进程呈现出明显的不同步性,这与李艳华等[16]的研究结果一致。同一花枝的不同花芽,同一花芽的不同小花,甚至同一小花的不同胚珠间均存在着明显的发育差异,因此在水培时间相同的情况下,同一来源的大孢子母细胞也可以观察到减数分裂的不同时期,如水培至270 h,发育快的大孢子母细胞进入减数分裂的后期Ⅰ,发育慢的尚处于终变期。胚囊的发育也同样存在不同步性,如授粉后60 h,发育快的已到成熟胚囊,发育慢的则还在四核胚囊时期,在白杨派其他树种如河北杨和青杨派树种[19-20]中也有相似的情况,显示了种群变异的多样性和丰富性,这一发育差异性特点对种群进化有重要意义。因此在对大孢子和胚囊进行大批量同期加倍处理时,取材部位应尽量一致,以保证花芽发育的大体一致性。
[参考文献]
[1]康向阳.毛白杨细胞遗传与三倍体选育 [M].北京:中国环境科学出版社,2002.
Kang X Y.Cytogenesis and triploid breeding of Chinese white poplar [M].Beijing:China Environmental Science Press,2002.(in Chinese)
[2]康向阳,朱之悌,张志毅.银腺杨与毛新杨正反交三倍体选育 [J].北京林业大学学报,2000,22(6):8-11.
Kang X Y,Zhu Z T,Zhang Z Y.Breeding of triploids by the reciprocal crossing ofPopulusalba×P.glandulosaandP.tomentosa×P.bolleana[J].Journal of Beijing Forestry University,2000,22(6):8-11.(in Chinese)
[3]Weisgerber H,Rau H M,Gartner E J,et al.25 years of forest tree breeding in Hessen [J].Allgemeing-forstzeitschriff,1980,26:665-672.
[4]康向阳,张平冬,高鹏,等.秋水仙碱诱导白杨三倍体新途径的发现 [J].北京林业大学学报,2004,26(1):1-4.
Kang X Y,Zhang P D,Gao P,et al.Discovery of a new way of poplar triploids induced with colchicine after pollination [J].Journal of Beijing Forestry University,2004,26(1):1-4.(in Chinese)
[5]康向阳,朱之悌.白杨2n花粉生命力测定方法及萌发特征的研究 [J].云南植物研究,1997,19(4):402-406.
Kang X Y,Zhu Z T.A study on the 2n pollen vitality and germinant characteristics of white poplars [J].Acta Botanica Yunnanica,1997,19(4):402-406.(in Chinese)
[6]康向阳,朱之悌,林惠斌.白杨不同倍性花粉的辐射敏感性及其应用 [J].遗传学报,2000,27(1):78-82.
Kang X Y,Zhu Z T,Lin H B.Radiosensitivity of different ploid pollen in poplar and its application [J].Acta Genetica Sinica,2000,27(1):78-82.(in Chinese)
[7]李艳华,康向阳.诱导大孢子染色体加倍选育白杨杂种三倍体 [J].北京林业大学学报,2007,29(5):22-25.
Li Y H,Kang X Y.Triploid induction in white poplars by chromosome doubling of megaspore [J].Journal of Beijing Forestry University,2007,29(5):22-25.(in Chinese)
[8]王君,康向阳,李代丽,等.授粉后施加秋水仙碱处理诱导青杨派异源三倍体 [J].北京林业大学学报,2007,29(5):18-21.
Wang J,Kang X Y,Li D L,et al.Induction of allo-triploid plants inPopulus(Section Tacamahaca) with colchicine after pollination [J].Journal of Beijing Forestry University,2007,29(5):18-21.(in Chinese)
[9]康向阳,朱之悌,林惠斌.杨树花粉染色体加倍有效处理时间的研究 [J].林业科学,1999,35(4):21-24.
Kang X Y,Zhu Z T,Lin H B.Study on the effective treating period for pollen chromosome doubling ofPopulustomentosa×P.bolleana[J].Scientia Silvae Sinicae,1999,35(4):21-24.(in Chinese)
[10]Posinia K.Meiosis and the distribution of chromosomes intetraploid aspen [J].Genetika Slechteni,1978,14(4):241-249.
[11]刘玉喜,张方,陆志华.中东杨小孢子的发生 [J].东北林学院学报,1979(2):1-4.
Liu Y X,Zhang F,Lu Z H.Microsporegenesis ofPopulousberolinensis[J].Journal of North-Eastern Forestry Institute,1979(2):1-4.(in Chinese)
[12]董源.毛白杨胚胎学观察:Ⅰ.花药的结构及花粉的发育 [J].北京林学院学报,1982(4):80-88.
Dong Y.Some embryological observations onPopulustomentosaCarr:Ⅰ.structure of anther and development of pollen [J].Journal of Beijing Forestry College,1982(4):80-88.(in Chinese)
[13]王君,康向阳,李代丽,等.通辽杨花粉母细胞减数分裂及其染色体行为研究 [J].西北植物学报,2006,26(11):2231-2238.
Wang J,Kang X Y,Li D L,et al.Meiosis and chromosome behavior of pollen mother cell inPopulussimoniiCarr.×P.nigraL.‘Tongliao’ [J].Acta Botanica Boreali-Occidentalia Sinica,2006, 26(11):2231-2238.(in Chinese)
[14]Brukhin V,Hernould M,Gonzalez N,et al.Flower development schedule in tomatoLycopersiconesculentumcv.Sweet cherry [J].Sex Plant Reprod,2003,15:311-320.
[15]卫尊征,熊敏,欧先梅,等.彩色马蹄莲大小孢子发生及雌雄配子体发育的研究 [J].上海交通大学学报(农业科学版),2015,33(2):18-26.
Wei Z Z,Xiong M,Ou X M,et al.Megasporogensis,microsporogenesis and development of male and female gametophytes inZantedeschiahybrid [J].Journal of Shanghai Jiaotong University (Agricultural Science),2015,33(2):18-26.(in Chinese).
[16]李艳华,马洁,康向阳.白杨大孢子母细胞减数分裂进程及其即时判别 [J].北京林业大学学报,2005,27(2):70-74.
Li Y H,Ma J,Kang X Y.Stages of MMC meiosis and its timely discrimination of white poplars [J].Journal of Beijing Forestry University,2005,27(2):70-74.(in Chinese)
[17]侯延侠,康向阳.响叶杨大、小孢子母细胞减数分裂进程及其对应关系 [J].西北植物学报,2006,21(1):46-49.
Hou Y X,Kang X Y.Meiosis stages and their corresponding relation ofPopulusadenopodamegasporocytes and microsporocytes [J].Acta Botanica Boreali-Occidentalia Sinica,2006,21(1):46-49.(in Chinese)
[18]张妍,崔彬彬,魏俊杰,等.毛白杨大、小孢子母细胞减数分裂进程的相关性 [J].西北农林科技大学学报(自然科学版),2015,43(11):63-70.
Zhang Y,Cui B B,Wei J J,et al.Correlations between megasporocytes and microsporocytes meiosis stages ofPopulustomentosaCarr [J].Journal of Northwest A&F University (Natural Science Edition),2015,43(11):63-70.(in Chinese)
[19]索玉静,王君,康向阳.河北杨胚囊发育的细胞学研究 [J].中国农学通报,2012,28(16):46-49.
Suo Y J,Wang J,Kang X Y.Cytological observations on the development ofPopulushopeiensisembryo sac [J].Chinese Agricultural Science Bulletin,2012,28(16):46-49.(in Chinese)
[20]王君,康向阳.小青杨大孢子发生、雌配子体发育及其系统学意义 [C]//中国林学会.第二届中国林业学术大会:S2 功能基因组时代的林木遗传与改良论文集.北京:化学工业出版社,2009:614-620.
Wang J,Kang X Y.Development of macrospore and female gametophytes ofPopuluspseudo-simoniiKitag and its phylogenetic significance [C]//China Forestry Association.The second China forestry conference:proceedings of forest genetics and improvement on S2 functional genomics era.Beijing:Chemical Industry Press,2009:614-620.(in Chinese)
Meiosis of megaspore mother cell and embryo sac development inPopulusalba×P.glandulosa
CUI Bin-bin1,WEI Jun-jie1,ZHANG Yan1,CAO Liu-qing1,LIU Shuai-yong1,SHEN Yi-lan2,SUN Yu-han2
(1DepartmentofBiochemistry,BaodingUniversity,Baoding,Hebei071000,China;2NationalEngineeringLaboratoryforTreeBreeding,CollegeofBiologicalSciencesandTechnology,BeijingForestryUniversity,Beijing100083,China)
Abstract:【Objective】 Meiosis of megaspore mother cells and embryo sac development process of Populus alba×P.glandulosa were studied to provide cytological reference for chromosome doubling treatment and improve the efficiency of triploid breeding by female gametes chromosome doubling. 【Method】 In January 2014,female flowering branches of P.alba×P.glandulosa were collected and water cultured,then flower bud were collected every 3 h after water culture 48 h.The meiosis of megasporocytes and development of embryo sacs of P.alba×P.glandulosa were studied by paraffin section method,and the flower bud morphology was observed simultaneously.【Result】 The megaspore mother cell meiosis and embryo sac development were related to flower bud morphology.When a little catkin appeared,the meiosis of megaspore mother cells entered leptotene.When the meiosis of megasporocytes entered metaphase Ⅰ,1/2 catkin ran out. When the catkin was ~1.55 cm long,the meiosis of megasporocytes entered tetrad period.At 12 h before pollination,functional megaspore entered embryo sac development period.When the cracking angle of stigma was ~180 °,the embryo sac entered uni-nucleate period.At 24 h after pollination,stigma was brown and the embryo sac entered two-nucleate period.At 36 h after pollination,stigma began wilting and the embryo sac entered four-nucleate period;while at 60 h after pollination,stigma was withered and the embryo sac entered eight-nucleate period.【Conclusion】 The flower bud morphology could be used to judge the megaspore mother cell meiosis and embryo sac development period,so that they could be treated by chromosome doubling technique timely.Meanwhile,meiosis stages of megaspore mother cells and development of embryo sacs presented asynchrony.There were significant development diversities in different florets of same inflorescence and different ovules in same floret,which has important significance for population evolution.
Key words:Populus alba×P.glandulosa;megaspore mother cell;meiosis;development of embryo sac
DOI:网络出版时间:2016-04-0709:0010.13207/j.cnki.jnwafu.2016.05.014
[收稿日期]2015-11-21
[基金项目]国家自然科学基金项目(31300562);河北省自然科学基金项目(C2013104053);保定学院首批科研团队(KYTD2013001);保定市科学技术协会自然科学课题(KX2014A27)
[作者简介]崔彬彬(1975-),女,河北保定人,副教授,博士,主要从事林木遗传育种与生物技术研究。E-mail:cbb0508@163.com[通信作者]孙宇涵(1983-),男,吉林长春人,讲师,博士,主要从事林木遗传育种与生物技术研究。E-mail:syh831008@163.com
[中图分类号]S792.119.04
[文献标志码]A
[文章编号]1671-9387(2016)05-0105-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160407.0900.028.html
