生产过程清洁验证残留物阿哌沙班的HPLC法测定
2016-06-03张璇于庆华王自远金垒
张璇+于庆华+王自远+金垒
摘 要 目的:建立清洁验证中残留物阿哌沙班含量测定的高效液相色谱法。方法:色谱柱为Waters Nova-Pak C18(3.9 mm×150 mm,5 μm),流动相为乙腈-水(30∶70),检测波长280 nm,流速1.0 ml/min,柱温30 ℃,进样量10 μl。结果:阿哌沙班在0.01~20 μg/ml范围内线性关系良好,r2=0.999 2;回收率为75.90%,RSD=2.33%(n=18)。结论:该方法操作简便、结果准确,可以用于清洁验证残留物阿哌沙班的定量分析。
关键词 高效液相色谱法 清洁验证 残留物 阿哌沙班
中图分类号:R973.2; O657.72 文献标识码:A 文章编号:1006-1533(2016)09-0076-03
Determination of apixaban residues in cleaning validation by HPLC
ZHANG Xuan*, YU Qinghua, WANG Ziyuan, JIN Lei
(Shanghai Shyndec Pharmaceutical Co. Ltd., Shanghai 200137, China)
ABSTRACT Objective: To establish a method for the determination of apixaban residues in the cleaning validation by HPLC. Methods: HPLC was carried out on a Waters Nova-Pak C18 column(3.9 mm×150 mm, 5 μm)with acetonitrilewater (30∶70) as the mobile phase at the detection wavelength of 280 nm and the flow velocity of 1.0 ml/min and the column temperature of 30 ℃ with sample size of 10 μl. Results: The standard curve of apixaban showed a good linear relationship in the range of 0.01 to 20 μg/ml with the correlation coefficient (r2) of 0.999 2. The average recovery of samples was 75.90% with RSD of 2.33% (n=18). Conclusion: This method is convenient and accurate and suitable for the quantitative determination of apixaban residues in the cleaning validation.
KEY WORDS HPLC; cleaning validation; residue; apixaban
作为Xa因子抑制剂的阿哌沙班是一种用于预防和治疗血栓的新型口服抗凝药物[1],其制剂阿哌沙班片是我们公司研发中心研制的新药,在上海浦东基地与其他产品共线生产。为确保该产品与其他产品在生产中不造成交叉污染、降低阿哌沙班片的生产对其他产品造成的质量风险,本研究参考GMP验证要求确定了阿哌沙班片清洁验证设备残留限度(86 μg/25 cm2)后[2-3],参考药典要求[4]、根据活性物阿哌沙班的结构特征和HPLC测定特点建立了阿哌沙班的残留物HPLC分析方法,通过对阿哌沙班片生产用设备清洁验证的检验,确定该方法可以用于阿哌沙班片在生产过程清洁验证中的残留物检测,保证清洁验证的准确性,并对每个验证参数设立可接受标准,结果表明高效液相色谱法(HPLC)简便,准确,可在清洁验证中用于阿哌沙班残留物的定量分析。
1 试验仪器与试验样品
高效液相色谱仪LC20AD(日本岛津公司),电子天平(瑞士Mettler XS205),阿哌沙班对照品(批号:1403008,含量:99.47%,上海现代制药股份有限公司),乙醇(AR,国药集团化学试剂有限公司),乙腈(HPLC纯,默克公司)。
2 方法与结果
2.1 色谱条件
色谱柱为Waters Nova-Pak C18(3.9 mm×150 mm,5 μm),流动相为乙腈-水(30∶70),检测波长280 nm,流速1.0 ml/min,柱温30 ℃,进样量10 μl。
2.2 专属性试验
精密称取阿哌沙班对照品约50 mg,置于50 ml量瓶中用乙醇溶解并稀释至刻度,精密量取1.0 ml置于100 ml量瓶中,用乙醇稀释至刻度作为对照品溶液(10μg/ml)。用镊子夹取医用脱脂棉两小团,用乙醇润湿后放入10 ml具塞试管中,加入10 ml乙醇,超声15 min,放置20 min,期间不时振摇,取上清液作为空白医用脱脂棉浸出液。按色谱条件分别对阿哌沙班对照品溶液、空白乙醇和空白医用脱脂棉浸出液进样测定,结果表明乙醇空白和空白医用脱脂棉浸出液的各杂质出峰时间对检验标的物阿哌沙班的出峰不造成干扰(图1)。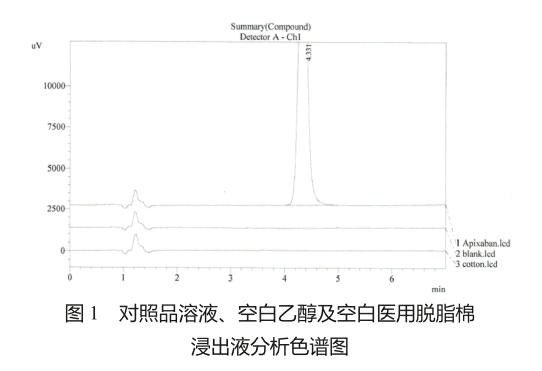
2.3 线性关系试验
取阿哌沙班对照品和乙醇分别制备成对照品溶液线性关系试验溶液(0.01、0.1、0.5、1、10和20 μg/ml),各浓度溶液分别进样2次,每次10 μl,得各色谱图。统计出阿哌沙班峰面积线性关系,建立校正曲线。
以阿哌沙班测得的平均峰面积X为横坐标,以线性溶液溶度Y为纵坐标,进行线性回归,得回归方程为:Y=5.0×10-6X,相关系数R2=0.999 2;结果表明该方法在0.01~20 μg/ml浓度范围内,线性关系良好。
2.4 检测限和定量限
采用信噪比法,取线性研究中合适浓度的溶液逐步稀释得已知低浓度溶液,以信噪比10∶1时的相应浓度为进样量10 μl时的定量限;以信噪比3∶1时的相应浓度为进样量10 μl时的检出限。结果确定该法的检出限为0.003 7 μg/ml,定量限为0.011 2 μg/ml。
2.5 重复性试验
根据擦拭取样限度“86 μg/25 cm2”计算可知供试品溶液的检出限度应为“8.6 μg/ml”,选择与供试品溶液限度接近的“专属性试验”中配制的对照品溶液(10 μg/ml)进行重复性试验。重复进样5次测定,计算5次所得阿哌沙班峰面积的RSD值为0.16%(表1),表明该方法重复性良好。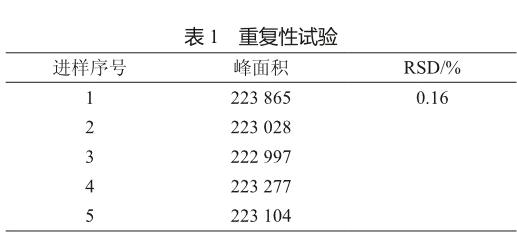
2.6 回收率试验
在一块面积为25 cm×25 cm的平整光洁的不锈钢板上用钢锥每隔5 cm划线,形成25块5 cm×5 cm的正方块。精密量取“专属性试验”中配制的对照品浓溶液(1 mg/ml)0.1 ml均匀地滴加在不锈钢板中间的1个5 cm×5 cm的正方块上,让稀释液自然挥发。用镊子夹取一小团脱脂棉花,先用乙醇润湿,并将其靠在溶剂瓶上以除去多余的水。将棉团平稳而缓慢地从水平方向擦拭整个取样表面(面积为5 cm×5 cm)。然后,翻转棉团,让其从垂直方向也进行擦拭取样(图2)。擦拭好的棉团立即放入10 ml的具塞试管中,另取一新的用乙醇润湿的棉团,将方块中残留的溶液擦拭干净,放入同一支10 ml具塞试管中,加入10 ml乙醇,超声15 min,放置20 min,期间不时振摇。
一个取样人员平行擦拭三组,每组擦拭六次。擦拭结果如表2。计算三组平均回收率为75.90%,RSD为1.04%。
3 讨论
设备清洁验证是制药企业生产产品过程中避免共线产品交叉污染、保证产品质量、确保患者用药安全的重要手段之一。清洁验证中,确保清洁效果、影响验证结果的因素众多,如清洁验证范围、产品评估、设备评估、标记物的选择和评估、清洗程序的选择和评估、检验方法的选择和评估等等[5-6],而其中,检验方法是通过分析方法的验证来保证分析结果的真实可靠的[7],进而确保整个清洁验证结果准确可靠的。
文中试验的验证结果表明,HPLC法测定清洁验证中的残留物阿哌沙班的含量方法专属性试验、线性关系、重复性、回收率均符合相应要求,定量限、检出限足以满足残留限度检验要求,该方法可用于阿哌沙班片相关设备清洁验证中活性成分阿哌沙班的定量分析。在清洁验证时,应采用乙醇作为溶剂、医用脱脂棉蘸取乙醇后擦拭取样;测定限值为“阿哌沙班残留量限值×回收率”,按最严格要求取回收率为各组平均回收率的最小值,故测定限值为“65 μg/25 cm2”。
在清洁验证中,设备取样回收率实验容易被忽略,使用擦拭法取样时,由于设备材质不同,设备表面的平滑程度不同以及擦拭力度的差异,对采用结果会有不同程度的影响[8],故在设备材质确定的情况下,应由方法验证进行回收率试验时的取样人员、采用同等力度进行擦拭取样,如需更换取样人员应重新进行相应方法擦拭回收率试验。同时,在日常清洁中,对员工的培训与管理、确保清洁过程按照验证程序进行,也是保证设备清洁维持在验证状态、清洁验证结果对生产清洁过程有指导性意义的前提[9-10]。
参考文献
[1] DRUGBANK. Apixaban[EB/OL]. [2016-02-25]. http://www. drugbank.ca/drugs/DB06605.
[2] 国家食品药品监督管理局药品安全监管司/药品认证管理中心. 药品生产验证指南(2003)[M]. 北京:化学工业出版社,2003: 191-208, 466-471.
[3] 国家食品药品监督管理局药品认证管理中心. 药品GMP指南:口服固体制剂[M]. 北京:中国医药科技出版社,2011: 183-191.
[4] 国家药典委员会. 中华人民共和国药典(2015年版)四部[M]. 北京:中国医药科技出版社,2015: 374-377.
[5] 王守斌, 聂杰, 陈如柳, 等. 浅析药品生产设备的清洁验证[J]. 天津药学, 2014, 26(5): 72-76.
[6] 周庆凯, 孙巍, 曹凤兰, 等. 关于药品GMP生产设备的清洁验证的探讨[J]. 海峡药学, 2011, 23(12): 258-260.
[7] 陈雯秋. 清洁验证中的分析方法验证[J]. 中国药业, 2005, 14(4): 17-19.
[8] 刘华本, 陈晓平, 范愿军. 制药设备清洁验证的关键步骤[J]. 药事管理, 2009, 28(5): 681-683.
[9] 洪丽萍, 黄加秀, 蔡亚兰, 等. HPLC测定清洁验证残留物非诺贝特的含量[J]. 中国执业药师, 2015, 12(8): 28-31.
[10] 蔡亚兰, 洪丽萍, 黄加秀, 等. HPLC测定清洁验证中残留物硝酸益康唑的含量[J]. 中国实用医药, 2015, 10(1): 237-238.
