番茄APX基因的分离及表达分析
2016-06-02段明王兴春元旭朝
段明,王兴春,元旭朝
(1.山西农业大学 实验教学中心, 山西 太谷 030801; 2.山西农业大学 生命科学学院, 山西 太谷 030801;3.山西农业大学 农学院, 山西 太谷 030801)
番茄APX基因的分离及表达分析
段明1,王兴春2,元旭朝3
(1.山西农业大学 实验教学中心, 山西 太谷 030801; 2.山西农业大学 生命科学学院, 山西 太谷 030801;3.山西农业大学 农学院, 山西 太谷 030801)
摘要:植物体内代谢的不平衡会导致活性氧的大量积累, 若未及时清除,细胞将受到严重的氧化伤害。在抗氧化系统中,抗坏血酸过氧化物酶是其中的关键酶,对于保护细胞组分免受活性氧的破坏是至关重要的。本研究利用RT-PCR方法从番茄中克隆得到抗坏血酸过氧化物酶基因,命名为LeAPX,序列全长1 412 bp,开放阅读框1 266 bp,编码421个氨基酸。系统发育树比对表明,LeAPX氨基酸序列与马铃薯、胡麻、烟草的APX序列同源性较高。氨基酸序列分析表明番茄APX和其它植物一样,含有两个保守的功能域。对其启动子序列分析显示,该片段富含HSE、LTR、GT1等响应胁迫的顺式作用元件。定量分析表明,LetAPX基因在叶片中的表达量最高。
关键词:番茄; 抗坏血酸; APX基因
非生物胁迫是影响植物生长发育的主要因素之一。当植物遭受高温、低温、盐渍和干旱等恶劣环境时,植物的生长会受到抑制,伴随而来的是氧化伤害。这主要是由于体内产生大量的活性氧(reactive oxygen species, ROS),如过氧化氢(H2O2)、超氧阴离子自由基等[1]。ROS会破坏细胞内的核酸、脂类以及蛋白质等生物大分子,最终导致植株死亡[2,3]。
为了响应和防御氧化胁迫,植物形成了自己的一套保护机制[4]。主要包括一些抗氧化酶类,如过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等, 以及一些小分子物质,如谷胱甘肽、抗坏血酸和维生素E等[5]。其中,APX和CAT可以通过不同的代谢反应清除H2O2,但是,与CAT不同,APX功能的发挥依赖于抗坏血酸和谷胱甘肽的循环再生,所以又称为抗坏血酸-谷胱甘肽循环(ascorbate-glutathion, AsA-Glu)。
H2O2除了作为氧化剂对植物造成伤害外,还具有积极的作用。研究表明,H2O2还可起到信号传递作用,参与调控各种生理过程[6]。如植物的生长发育、形态建成、代谢途径、胁迫响应等,这主要依赖于它与植物体内激素的相互作用(如脱落酸、生长素、乙烯等)[7]。如玉米根的向地性和生长素的信号转导、枸杞种子的胚胎发育[8,9]。从长时间响应来看,H2O2在非生物和生物胁迫中也起到信号转导的作用。Matsuda等人发现,外施低浓度的H2O2可诱导植物产生对胁迫的抗性,体内会产生一些物质,这些物质与低温胁迫下植物体内产生的抗性物质相似[10]。研究人员发现,拟南芥遭受低温干旱共胁迫时,APX1发挥关键性的作用,这也主要是由于体内H2O2的大量产生造成APX的过量表达。在各种类型的ROS中,H2O2是唯一可以通过水孔蛋白穿越细胞膜的分子,可移动到细胞内的其它部位发挥作用[11,12]。此外,正是由于它的稳定性被用来作为信号分子,研究它对植物体内各种生理生化过程的调控机制。
在高等植物中,APX属于庞大的基因家族。研究得知,在拟南芥中APX有9个同源基因,水稻中有8个,番茄中有7个。它们分布在不同的组织器官中,主要包括:叶绿体中的基质型APX(sAPX)和类囊体膜型APX(tAPX),微体型APX(mAPX)、线粒体型APX(mitAPX)以及胞质APX(cAPX)。
植物体内高效的抗氧化系统维持了ROS的动态平衡。APX在H2O2还原成H2O的过程中发挥着重要的作用。拟南芥胞质APX在抵抗非生物胁迫(强光、高温、甲基紫精、干旱)中起着决定性的作用。Kangasjärvi等人研究发现,拟南芥sAPX基因在植物抵御氧化胁迫时起着更重要的作用[13]。随后,Maruta等人也对拟南芥sapx和tapx突变体做了相关研究[14],他认为,当受到氧化胁迫时,两种叶绿体型APX都重要,尤其是类囊体膜型APX基因,扮演着更为重要的角色。
本研究利用RT-PCR方法分离了番茄APX基因,并对基因编码序列、上游启动子序列以及氨基酸序列进行了生物信息学分析,用定量的方法分析了该基因在番茄植株不同组织器官中的表达模式,为初步了解该基因在番茄中的功能奠定基础。
1材料与方法
1.1材料与试剂
植物材料:选用番茄品种‘中蔬六号’为研究材料,种植于人工气候室中。
载体和菌株:克隆载体pMD18-T vector和大肠杆菌DH5α感受态细胞购于北京天根生化科技有限公司。
PCR引物:引物序列利用DANMAN软件设计,由上海生工有限公司合成。
主要试剂:高保真PCR酶-KOD-Plus购于东洋纺(上海)生物科技有限公司;限制性内切酶SalⅠ和XbaⅠ,T4DNA连接酶购于大连宝生物公司;胶回收试剂盒和质粒提取试剂盒购于全式金生物公司。
1.2方法
1.2.1LeAPX基因的克隆
根据NCBI上公布的番茄APX基因序列,设计特异引物,以番茄cDNA为模板,扩增长度为1 412 bp,引物序列为:
LeAPX-F;5′-CCAATGACTTCCCTCACAG GC-3′;
LeAPX-R;5′-AATGCTGATATAAAGCGCAC-3′。
扩增体系为25 μL,具体成分如下:模板2 μL;反应缓冲液2.5 μL;氯化镁1 μL;dNTP 2.5 μL;上游引物和下游引物各1.5 μL;Taq酶2 μL;ddH2O 12 μL。PCR反应程序如下,
94 ℃预变性2 min

68 ℃后延伸10 min
1.2.2qPCR体系
将反转录cDNA样品中各取5 μL混合,分别依次稀释1倍、10倍、100倍、1 000倍、10 000倍,绘制标准曲线。
反应体系如下:

试剂体积/μL模板2荧光染料9引物1无菌水8
2结果与分析
2.1抗坏血酸过氧化物酶LeAPX基因的分离
采用RNA提取试剂盒从番茄叶片中提取总RNA。上下游特异引物扩增得到1 412 bp的条带(图1a)。
将扩增得到的目的基因与克隆载体连接,并进行转化实验,酶切鉴定结果与PCR扩增结果一致(图1b)。测序后在数据库中比对,确定该片段就是LeAPX基因全长(GenBank注册号:AK319984)。

图1 LeAPX基因的扩增和酶切Fig.1 Isolation of LeAPX from tomato and restriction analysis 注:a,b:LeAPX基因全长和酶切鉴定Note: a,b:Isolation of LeAPX and restriction of in cloning vetor.
2.2LeAPX序列的生物信息学分析
测序结果表明,LeAPX全长1 412 bp,开放阅读框1 266 bp,编码421个氨基酸。另含有长度不等的5′端非编码区和3′端非编码区。
氨基酸序列比对表明,番茄抗坏血酸过氧化物酶与马铃薯、胡麻、烟草、大豆等植物的抗坏血酸过氧化物酶高度同源(图2)。

图2 不同植物中抗坏血酸过氧化物酶氨基酸序列的系统发育树分析Fig.2 Phylogenetic tree of the deduced amino acid sequences of APX in different plants 注:发育树由MEGA5软件完成。番茄:LeAPX (AAY89389.1),Lycopersicon esculentum; 烟草:NtAPX (XP_009629388.1),Nicotiana tabacum; 胡麻:SiAPX (XP_011069499.1),Sesamum indicum; 马铃薯:StAPX (XP_006351908.1),Solanum tuberosum; 大豆:GmAPX (XP_003523435.2), Glycine max; 合瓣花:EgAPX (XP_012854861.1), Erythranthe guttata; 葡萄:VvAPX (XP_002285865.1), Vitis vinifera; 可可:TcAPX (XP_007019110.1) , Theobroma cacao. Note:LeAPX (AAY89389.1), Lycopersicon esculentum; NtAPX(XP_009629388.1), Nicotiana tabacum; SiAPX (XP_011069499.1), Sesamum indicum; StAPX (XP_006351908.1), Solanum tuberosum; GmAPX (XP_003523435.2), Glycine max; EgAPX (XP_012854861.1), Erythranthe guttata; VvAPX (XP_002285865.1), Vitis vinifera; TcAPX (XP_007019110.1) , Theobroma cacao.
结构域同源性比较发现,LeAPX基因所编码的氨基酸与其它植物中的氨基酸序列一样,都具有两个序列保守区域(A,H)(图3)。
2.3番茄APX基因启动子的调控元件分析
PlantCARE在线软件分析LeAPX启动子元件表明(表1),LeAPX启动子中含有多种响应激素和参与逆境胁迫的应答元件,如参与高温胁迫的HSE转录因子结合位点、LTR响应元件、茉莉酸甲酯响应元件(MeJA-responsiveness,CGTCA-motif )、光响应元件(light-responsive element,Box 4)等。
2.4LetAPX基因的组织特异性表达分析
荧光定量PCR结果表明,番茄LeAPX基因在根、茎、叶和花中均有表达。叶片中的表达量最高(图4)。
3讨论与结论
本研究采用RT-PCR技术,获得全长1 412 bp的APX基因,该序列开放阅读框1 266 bp,编码421个APX前体多肽。ChloroP 1.1 Server在线预测前体多肽中含有叶绿体转运肽,可以将APX蛋白定位到叶绿体中行使功能。启动子元件分析表明,APX含有多个与光响应的元件,这也与APX的定位相符合。ProtParam tool预测该基因编码的蛋白质分子量46.1 kD,等电点(pI)为8.2。基因组分析得知,我们所分离到的APX基因定位于番茄第11号染色体上,包含有12个外显子和11个内含子,是APX基因家族中序列最长的一个。系统发育树和氨基酸序列分析表明,LeAPX与马铃薯、胡麻、烟草、大豆等植物高度同源,都具有两个序列保守的区域(A和H),分别位于101~117和423~442,其中A是APX的活性位点,保守序列为CHPILVRLGWHDAGTYN,H区域保守序列KEIVALSGAHTLG,位于APX的中间区域,是该酶与血红素的结合位点,对APX的活性具有重要作用。

图3 LeAPX基因氨基酸序列的比较Fig.3 Comparison of the LeAPX deduced amino acid sequence
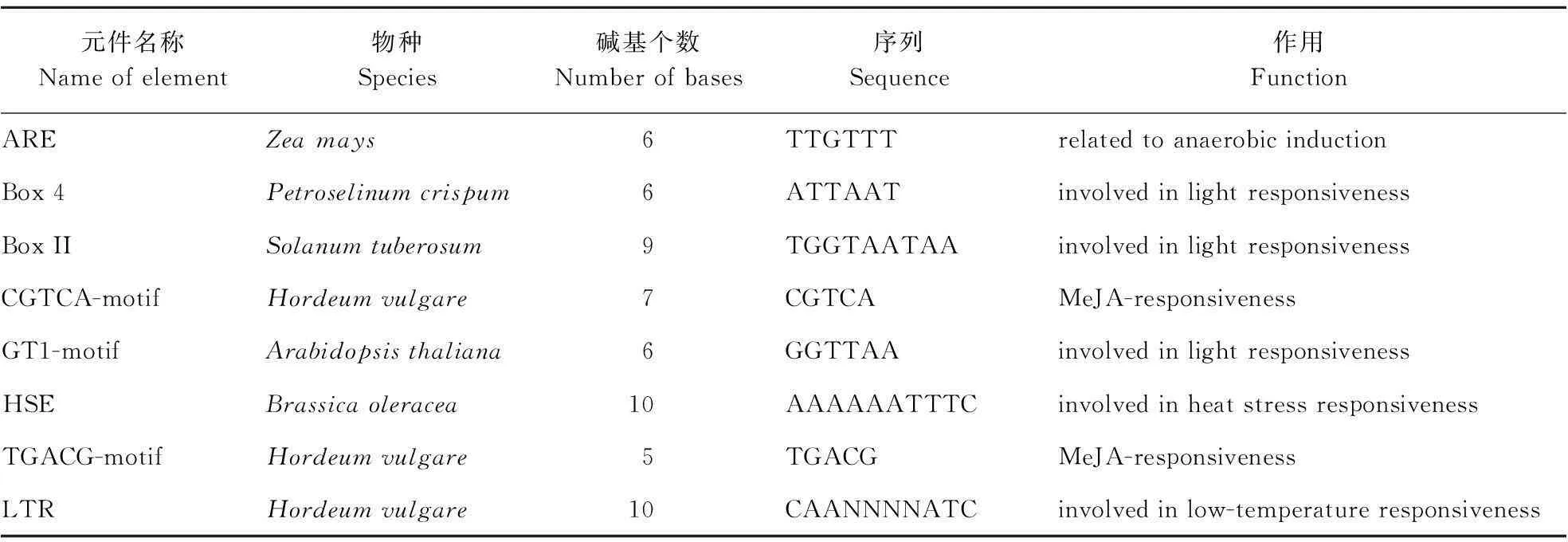
元件名称Nameofelement物种Species碱基个数Numberofbases序列Sequence作用FunctionAREZeamays6TTGTTTrelatedtoanaerobicinductionBox4Petroselinumcrispum6ATTAATinvolvedinlightresponsivenessBoxIISolanumtuberosum9TGGTAATAAinvolvedinlightresponsivenessCGTCA-motifHordeumvulgare7CGTCAMeJA-responsivenessGT1-motifArabidopsisthaliana6GGTTAAinvolvedinlightresponsivenessHSEBrassicaoleracea10AAAAAATTTCinvolvedinheatstressresponsivenessTGACG-motifHordeumvulgare5TGACGMeJA-responsivenessLTRHordeumvulgare10CAANNNNATCinvolvedinlow-temperatureresponsiveness
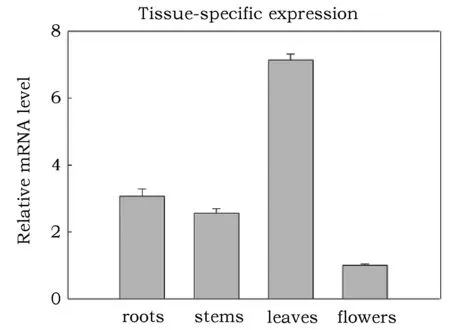
图4 番茄不同组织器官LeAPX的表达分析Fig.4 qPCR expression analysis of LeAPX in different organs
定量分析表明,在番茄中,APX基因在叶片中的表达量最高,是其它组织的2~3倍,这或许与它定位于叶绿体有关,在绿色组织含量较多的部位含量最多,有利于叶绿体受到氧化伤害时能够快速反应合成大量的APX消除过氧化氢。
番茄、甜椒等冷敏感植物作为我国北方地区重要的蔬菜,在越冬期间经常会遇到冷害。其中,氧化胁迫是冷害的主要原因之一。因此,研究APX的生物学功能对蔬菜作物的抗逆生产具有重要意义。
参考文献
[1]Halliwell B. Reactive species and antioxidants. Redox biology is a fundamental theme of aerobic life[J]. Plant Physiol, 2006, 141(12): 312-322.
[2]Kültz D. Molecular and evolutionary basis of the cellular stress response[J]. Annu Rev Physiol, 2005, 67(1): 225-257.
[3]Anjum SA, Xie XY, Wang LC, et al.Morphological, physiological and biochemical responses of plants to drought stress[J] Afr J Agr Res, 2011, 6(9): 2026-2032.
[4]Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci, 2002, 7(9): 405-410.
[5]岳晓翔,陈敏,段迪,等. 绿色和紫红色表型盐地碱蓬叶片抗氧化系统比较研究[J].山东师范大学学报, 2008, 23(1):121-124.
[6]Kovalchuk I. Multiple roles of radicals in plants. In Reactive Oxygen Species and Antioxidants in Higher Plants, 1st ed.; Gupta, S.D., Ed.; CRC Press: New York, NY, USA, 2010:31-44.
[8]Joo JH, Bae YS, Lee JS. Role of auxin-induced reactive oxygen species in root gravitropism[J]. Plant Physiol, 2001, 126(3):1055-1060.
[9]Cui K, Xing G, Liu X, et al. Effect of hydrogen peroxide on somatic embryogenesis ofLyciumbarbarumL[J]. Plant Sci, 1999, 146(99): 9-16.
[10]Matsuda Y, Okuda T, Sagisaka S, et al. Regulation of protein synthesis by hydrogen peroxide in crowns of winter wheat[J]. Biosci Biotechnol Biochem, 1994, 58(5): 906-909.
[11]Bienert GP, Moller AB, Kristiansen KA, et al. Specific aquaporins facilitate the diffusion of hydrogen peroxide across membranes[J]. J Biol Chem, 2007, 282(2): 1183-1192.
[12]Dynowski M, Schaaf G, Loque D, et al. Plant plasma membrane waterchannels conduct the signaling molecule H2O2[J]. Biochem J, 2008, 414(1): 53-61.
[13]Kangasjärvi S, Lepistö A, Hännikäinen K, et al. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses[J]. Biochem J, 2008, 412(2): 275-85.
[14]Maruta T, Tanouchi A, Tamoi M, et al.Arabidopsischloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress[J]. Plant Cell Physiol, 2010, 51(2): 190-200.
(编辑:武英耀)
Isolation and expression analysis ofLeAPXgene in tomato
Duan Ming1, Wang Xingchun2, Yuan Xuzhao3
(1.Experimentalandteachingcenter,ShanxiAgriculturalUniversity,Taigu030801,China; 2.CollegeofLifeSciences,ShanxiAgriculturalUniversity,Taigu030801,China; 3.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:Imbalance of metabolism can cause increased accumulation of ROS. If it could not be scavenge timely, it will lead to damage to cellular components. In antioxidative system, Ascorbate peroxidase (APX) has been considered as pivotal enzyme for scanvenging ROS in chloroplasts and protecting cellular components. In the present study, we isolated an APX gene, designated LeAPX, from tomato. The 1 412 bp cDNA contained an open reading frame (ORF) comprising of 1 266 nucleotides (nt) which encodes a polypepetide of 421 amino acid residues. The deduced amino acid sequence showed high identity with APXs from Solanum tuberosum, Sesamum indicum and Nicotiana tabacum. Amino acid sequence alignment indicated that the APX contained two domains. Sequence analysis of the promoter indicates that it is rich in acting elements such as HSE、LTR、GT1. qPCR indicated that the gene showed the highest expression level in leaves comparing with other organs.
Key words:Tomato; Ascorbate; APX gene
中图分类号:Q78
文献标识码:A
文章编号:1671-8151(2016)05-0315-05
基金项目:山西省青年科技研究基金(2015021142);山西农业大学科技创新基金(20142-12)
作者简介:段明(1984-),男(汉),山东威海人,讲师、博士,研究方向:植物抗逆分子生物学
收稿日期:2016-03-02 修回日期:2016-03-29
