不同因素对狭叶柴胡悬浮细胞生长的影响
2016-06-02程玉鹏林进华高宁王博田蓓蓓王瑶
程玉鹏,林进华,高宁,王博,田蓓蓓,王瑶
(1.黑龙江中医药大学 药学院, 哈尔滨 150040; 2.哈尔滨师范大学 生命科学与技术学院, 哈尔滨 150024)
不同因素对狭叶柴胡悬浮细胞生长的影响
程玉鹏1,2,林进华1,高宁1,王博1,田蓓蓓1,王瑶1
(1.黑龙江中医药大学 药学院, 哈尔滨 150040; 2.哈尔滨师范大学 生命科学与技术学院, 哈尔滨 150024)
摘要:为了通过悬浮细胞培养的方法获取柴胡的生物活性成分,本文对愈伤组织接种量、摇瓶溶氧水平、茉莉酸甲酯可能影响悬浮细胞生长的因素进行了考察,并建立了一个快速生长的狭叶柴胡悬浮细胞培养体系。实验结果表明狭叶柴胡悬浮细胞生长最佳条件为:无菌条件下狭叶柴胡愈伤组织接种量为2.0 g;250 mL锥形瓶中添加MS培养液体积为100 mL;培养液中加入的茉莉酸甲酯浓度为22.5 mg·L-1。该研究表明通过调节接种量、培养液体积、茉莉酸甲酯浓度,可有效地促进狭叶柴胡悬浮细胞的生长,为今后柴胡生物活性成分的研究奠定基础。
关键词:狭叶柴胡;悬浮细胞;茉莉酸甲酯
Effects of different factors on suspension cell growth ofBupleurumscorzonerifoliumwilld
Cheng Yupeng1,2, Lin Jinhua1, Gao Ning1, Wang Bo1, Tian Beibei1, Wang Yao1
(1.CollegeofPharmacy,HeilongjiangUniversityofChineseMedicine,Harbin150040,China; 2.CollegeofLifeScienceandTechnology,HarbinNormalUniversity,Harbin150024,China)Abstract:To obtain bioactive components fromBupleurumscorzonerifoliumWilld using suspension cells, the effects of inoculum size, dissolved oxygen and methyl jasmonate(MJ) on suspension cell growth were investigated and a rapid suspension cell growth system ofB.scorzonerifoliumWilld was established. The results showed that the optimal condition for suspension cultures was MS medium 100 mL, callus 2.0 g and MJ 22.5 mg·L-1in a 250 mL flask. The study indicated the suspension cell cultures was efficiently promoted by the optimized inoculum size, medium volume and concentration of MJ. It can lay a foundation for further investigation on bioactive compounds ofB.scorzonerifoliumWilld.
Key words:Bupleurum scorzonerifolium Willd; Cell suspension culture; Methyl jasmonate
狭叶柴胡BupleurumscorzonerifoliumWilld为伞形科(Umbelliferae)柴胡属(BupleurumL.) 多年生草本植物,入药部位为其干燥的根,具有舒肝生阳、疏散退热的药效[1]。柴胡的主要活性成分为柴胡皂苷类化合物,药理研究表明其具有解热、镇静、镇痛、保肝等多种作用[2]。然而,柴胡对生长环境要求苛刻,且入药部位特殊(根及根茎),加之人们过度采挖,使柴胡资源供不应求[3]。为了保持柴胡资源的可持续发展和利用,目前迫切需要考虑通过其他的方法来获得更多的柴胡。
植物细胞悬浮培养技术是利用植物离体外植体加入装有特定培养基的培养瓶中,摇床中震荡培养,是得到高价值的植物代谢产物资源的重要途径之一[4,5],是保护枯竭中药资源的一种有效方法,在很多濒危珍稀药用植物的资源保护,人工替代品研究中都取得了重要进展[6]。在植物悬浮细胞系的建立过程中,细胞的生长速率和生物量通常受许多因素所影响。Gorret等[7]认为合适的愈伤组织接种量对悬浮细胞培养生物量的积累起着积极作用。也有报导称通过调控蔗糖浓度可以提高Micrococcussp.悬浮培养中的细胞生物量[8]。本文通过考察愈伤接种量、培养基体积和茉莉酸甲酯浓度这3个不同因素,旨在提高悬浮细胞系的生长速率,获得更多的生物量,以建立一个生长稳定、产量较高的狭叶柴胡悬浮细胞培养系。
1材料与方法
1.1实验材料
狭叶柴胡愈伤组织:以萌发的狭叶柴胡种子下胚轴为外植体诱导而获得。
1.2试剂与仪器
试剂:75%医用酒精;茉莉酸甲酯(MJ) (Sigma公司);95%乙醇:工业级(哈尔滨市新达化工厂);MS培养基所用试剂(分析纯)。
仪器:光照培养箱SPX-250B-G型(上海博讯实业有限公司医疗设备厂);恒温振荡器DLHR-Q200(北京东联哈尔仪器制造有限公司);HVE-50自动高压灭菌器(日本平山制造有限公司);超净工作台(上海博讯);摩尔实验室超纯水器(上海摩勒科学仪器有限公司);FA1204B电子天平(上海精科天美科学仪器有限公司)。
1.3实验方法
1.3.1狭叶柴胡悬浮细胞培养条件的优化
狭叶柴胡愈伤组织接种量:无菌条件下分别称取松散的柴胡愈伤组织0.5 g、1.0 g、2.0 g、2.5 g、3.0 g接入附加6-BA 2.5 mg·L-1+ 2,4-D 0.1 mg·L-1+KT 0.9 mg·L-1的MS培养液中,每瓶MS液体培养基为100 mL。在25 ℃,120 r·min-1的振荡培养箱中黑暗培养3周。
摇瓶溶氧水平:无菌条件下分别将不同接种量的愈伤组织依次分别接入培养体积为50 mL、75 mL、100 mL、125 mL、150 mL(250 mL锥形瓶)的培养瓶中在25 ℃,120 r·min-1的振荡培养箱中黑暗培养3周。
茉莉酸甲酯(MeJA)使用浓度:无菌条件下取松散的柴胡愈伤组织2.0 g分别接入附加6-BA 2.5 mg·L-1+ 2,4-D 0.1 mg·L-1+ KT 0.9 mg·L-1的MS培养液中(1~5号瓶)。在细胞培养的第9d分别向1~5号瓶中添加茉莉酸甲酯,使最终浓度分别为11.25 mg·L-1、22.5 mg·L-1、45 mg·L-1、90 mg·L-1、180 mg·L-1。在25 ℃,120 r·min-1的振荡培养箱中黑暗培养21 d。
1.3.2狭叶柴胡悬浮细胞培养条件的优化
无菌条件下分别取松散的柴胡愈伤组织2.0 g接入附加6-BA 2.5 mg·L-1+ 2,4-D 0.1 mg·L-1+ KT 0.9 mg·L-1的MS培养液中(1~11号瓶),分别在第1、3、5、7、9、11、13、15、17、19、21 d收集悬浮细胞。根据细胞的鲜重变化绘制细胞生长曲线。
2结果与分析
2.1愈伤接种量对悬浮细胞生长的影响
在悬浮细胞培养的过程中,悬浮细胞的生长与悬浮细胞初始接种量有相当紧密的关系,根据悬浮细胞生长具有群聚效应这一特点,若培养基中细胞密度过低,细胞的生长会十分缓慢,而如果细胞密度太高,细胞液泡膨胀,容易积累有害物质,从而降低悬浮细胞生长的速率和减弱次生代谢产物的合成的能力[9~11]。故本实验从愈伤组织接种量角度考察了悬浮细胞优化培养的条件,据表1可知,细胞鲜重随着接种量的增加而增加,当细胞接种量从0.5 g逐渐增加到2 g,其悬浮细胞收获量有明显增加,而在持续增加接种量后,悬浮细胞收获量会有微小的减少。如图1所示,明显看出当愈伤组织接种量为2.0 g时,其悬浮细胞收获量达到最佳,鲜重为4.342 g。
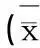
表1 愈伤组织不同接种量下的细胞收获量±S.D.)
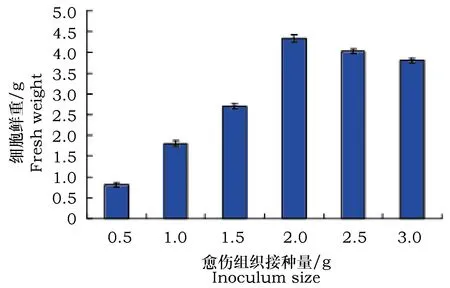
图1 愈伤组织不同接种量下的细胞收获量Fig.1 Cell harvest of different inoculum size
2.2摇瓶溶氧水平对悬浮细胞生长的影响
在悬浮细胞培养过程中,通常会改变摇床转速和培养液体积调节溶氧量。当摇床转速过低时,培养液中溶氧量低且细胞分散不均匀,而摇床转速太高,会使细胞之间发生碰撞,造成机械损伤[12]。鉴于不同溶氧水平对狭叶柴胡愈伤组织的生长有一定影响,将转速选定为120 r·min-1,对其培养液体积与接种量的关系进行考察。据表2可知,在改变培养基体积和愈伤接种量时,悬浮细胞增重量有所不同,再如图2所示,在选定的培养基体积下,将愈伤接种量从1 g逐步增加到2 g时,细胞增重量明显增加,接种量持续增加其细胞增重量有微小降低,而当在选定接种量,将培养基体积从50 mL逐步增加至100 mL时,细胞增重量明显增加,若持续增加培养基体积,细胞增重量则明显下降。综上所述,当愈伤组织接种量在2.0 g发酵液培养体积为100 mL (250 mL锥形瓶) 的体系中培养时,细胞鲜重增最大,为2.342 g。

表2 不同细胞发酵液体积及接种量下的细胞收获量±S.D.)

图2 不同细胞发酵液体积及接种量下的细胞收获量Fig.2 Cell harvest of different culture volume and inoculum size
2.3茉莉酸甲酯(MJ)添加量对悬浮细胞生长的影响
研究表明诱导子可提高悬浮细胞的生物量和次级代谢产物的表达量,而茉莉酸甲酯(MJ)是具有广泛生理作用的诱导子[13],故在上述愈伤组织考察结果条件下,以最佳愈伤组织接种量2.0 g为初始接种量,100 mL 为培养基体积,考察了茉莉酸甲酯不同使用浓度对悬浮细胞优化培养的条件。据表3可知,茉莉酸甲酯在低浓度条件时,细胞鲜重会随着茉莉酸甲酯使用浓度的增加而增加,然而随着茉莉酸甲酯浓度的不断增加,悬浮细胞的生长受到轻微抑制,如图3所示,在茉莉酸甲酯的使用浓度为22.5 mg·L-1时,悬浮细胞收获达到最佳重量,鲜重为5.245 g。

图3 茉莉酸甲酯不同浓度下的细胞收获量Fig.3 Cell harvest of different concentrations of methyl jasmonate (MJ)
Table 3Cell harvest of different concentrations of methyl jasmonate(MJ)
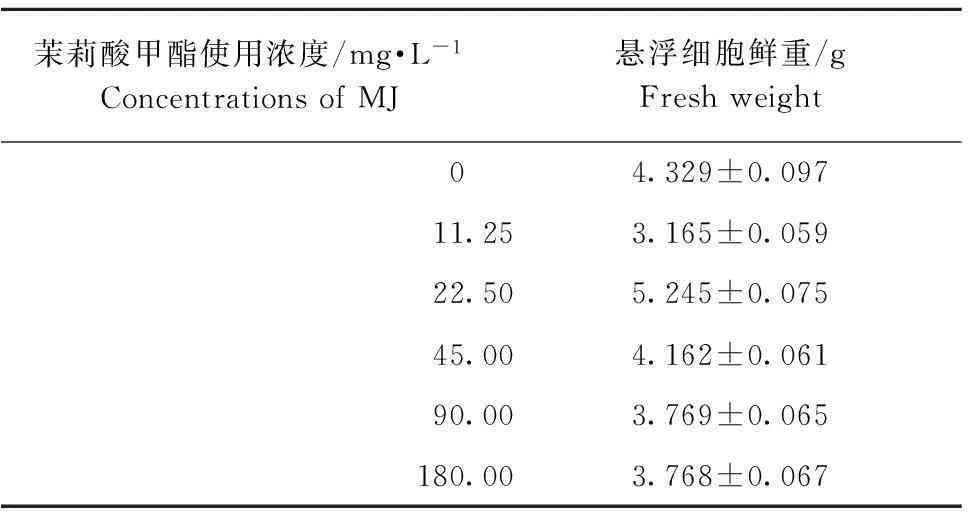
茉莉酸甲酯使用浓度/mg·L-1ConcentrationsofMJ悬浮细胞鲜重/gFreshweight04.329±0.09711.253.165±0.05922.505.245±0.07545.004.162±0.06190.003.769±0.065180.003.768±0.067
2.4悬浮细胞的生长曲线
根据狭叶柴胡悬浮细胞在不同培养时间段的细胞鲜重收获量(表4)绘制生长曲线(图4),由生长曲线可知:悬浮细胞在接种的1~5 d内,细胞鲜重和干重增加不明显,此为生长延滞期,而7~12 d,细胞生长速率加快,鲜重和干重增加明显,故为对数期,13~16 d细胞生长基本停止,鲜重和干重基本维持不变,为稳定期,17~21 d细胞进入衰亡期,细胞鲜重和干重出现小幅度下降。综上所述,将细胞继代培养选择在对数生长期的末期,即第15天进行。

表4 悬浮细胞不同培养时间段的收获量±S.D.)

图4 狭叶柴胡悬浮细胞生长曲线Fig.4 Growth curve of suspension cell
3讨论
本实验对诱导狭叶柴胡悬浮细胞的生长进行了初步研究,通过改变细胞初始接种量、培养液体积和茉莉酸甲酯浓度,获得狭叶柴胡悬浮细胞系最优培养条件。本实验室的前期研究结果表明,6-BA,2, 4-D 和KT 3种激素对愈伤组织的培养最佳。在狭叶柴胡细胞的悬浮培养中,以250 mL锥形瓶为培养瓶,加入最佳激素组合6-BA 2.5 mg·L-1+ 2,4-D 0.1 mg·L-1+ KT 0.9 mg·L-1时,细胞的生长状态达到最优,且获得的悬浮细胞量最大。
在悬浮细胞培养的过程中,悬浮细胞需具一定的初始密度才能进行生长分裂,可能是由于细胞分裂的开始需要细胞内特定的条件因子达到一定的内源水平。当初始接种量太低时,这些条件因子在短时间内达不到满足细胞生长的需求,因此,限制了细胞的进一步增殖。初始接种量过多时,这些条件因子迅速达到细胞分裂所需的内源水平,细胞生长迅速启动,缩短了迟滞期,但由于细胞生长会迅速消耗培养基中的大量养分,进而导致细胞过早衰老死亡[14,15]。因此,本实验对初始接种量进行考察,当愈伤组织接种量为2.0 g时,其悬浮细胞收获量达到最佳,高于或低于该接种量都会对细胞的生长产生影响,实验数据和结果与上述结论相符。
在悬浮细胞培养过程中,通常会改变摇床转速和培养液体积调节溶氧量。原晓勇等[16]在西洋参细胞悬浮培养中发现,转速为120 r·min-1时是西洋参悬浮细胞培养的最佳转速。改变培养液体积则是影响溶氧量的另一个重要因素,其原因是在相同的容器中,不同体积的培养液会导致培养瓶中培养物的搅动程度不同,导致培养基与空气接触面积不同。因此,本实验通过选定一个转速,然后改变培养液体积,考察狭叶柴胡悬浮细胞培养的最佳溶氧条件。结果表明当愈伤组织接种量在2.0 g发酵液培养体积为100 mL (250mL锥形瓶)的体系中培养时,为其最佳溶氧量。其溶氧特征与先前的报道相一致。
茉莉酸甲酯(MJ)是一种小的信号分子,它可以作为细胞信使,参与植物细胞的代谢过程,使植物细胞产生抗逆反应,激活防御相关基因,从而促使细胞合成抗逆产物[17]。同时,也对悬浮细胞的生长及次级代谢物的积累都有一定影响,在一定的浓度范围内,随着茉莉酸甲酯使用浓度的增加,甘草细胞的生物量下降,而当MJ的浓度为120 μmol·L-1时,细胞严重褐化,可能是大多数细胞已经死亡,而在另一浓度茉莉酸甲酯的范围内,随着浓度的增加,甘草细胞中总黄酮产量也增加,二者浓度均为100 μmol·L-1时,甘草细胞中总黄酮产量最大[18]。本实验结果与上述结论相符,茉莉酸甲酯对狭叶柴胡悬浮细胞生长有明显的促进,但是随着MJ的浓度提高,狭叶柴胡悬浮细胞出现褐化和死亡。当MJ浓度为22.5 mg·L-1时,作用效果最好。
能够影响植物悬浮细胞生长的因素还有很多,如赵倩[15]等在建立紫茉莉悬浮细胞培养体系的过程中,考察了PH值对细胞生长的影响,发现当培养基pH为5.5~5.9时,紫茉莉悬浮细胞的增值系数最大,细胞生长最旺盛,pH 高于或低于这一范围时,都不利于悬浮细胞生长。Zhao等[19]研究发现在长春花细胞培养中,5%~6%的蔗糖含量有助于生物量的提高。因此,除了上述的一些因素之外,能够增加植物悬浮细胞生物量的因素还有很多,本文仅对其中一部分进行研究。因此,对于其他因素的分析以及各因素作用机制的研究将是我们今后工作的方向。总之,本研究为进一步开发狭叶柴胡资源提供新思路和可靠的实验数据。特别是面临柴胡资源日益紧张的现状,如果能够通过不断的优化培养条件,使其应用在工业大批量生产上,将不仅为药物的获取开辟了新的途径,同时也可缓解日益紧张的植物资源短缺问题。
参考文献
[1]谭利,张庆英,李教社,等.南柴胡根中木脂素苷类化合物的研究[J].药学学报,2005,40(5):428-431.
[2]安玉明,接传胤,祝世伟.柴胡的研究进展[J].人参研究,2001,13(1):11-13.
[3]王玉庆,牛颜冰,秦雪梅.野生柴胡资源调查[J].山西农业大学学报(自然科学版),2007,27(1):103-107.
[4]Rao S R, Ravishankar G A. Plant cell cultures :chemical factories of secondary metabolites[J]. Biotechnol Adv,2002,20(2):101-153.
[5]Stafford A M. Plant cell cultures as a source of bioactive small molecules[J]. Current Opinion in Drug Discovery Development,2002,5(2):296-303.
[6]吕建军,胡高升,李经奎,等.前体饲喂和真菌诱导子对肉苁蓉悬浮培养细胞次生代谢产物的影响[J].中药材,2009, 32(2):171-173.
[7]Gorre N, Rosli S K B, Oppenheim S F, et al. Bioreactor culture of oil palm (Elaeis guineensis) and effects of nitrogen source, inoculum size, and conditioned medium on biomass production[J]. Journal of biotechnology, 2004,108(3):253-263.
[8]Kim M H, Kong Y J, Baek H, et al. Optimization of culture conditions and medium composition for the production of micrococcin GO5 by Micrococcus sp.GO5[J]. Journal of biotechnology, 2005,121(1):54-61.
[9]欧阳杰,武彦文,王晓东,等.肉苁蓉细胞悬浮培养体系的建立[J].中草药, 2008, 39(3): 426-429.
[10]方文娟,韩烈保,曾会明.植物细胞悬浮培养影响因子研究[J].生物技术通报, 2005(5): 11-15.
[11]Krogstrup P. Effect of culture densities on cell proliferation and regeneration from embryogenic cell suspensions of Picea sitchensis[J]. Plant Science,1990,72:115-123.
[12]王欣,闫会,顾向华,等.徐薯55-2的胚性细胞悬浮培养[J].西北农业学报,2014,23(1):132-137.
[13]刘燕,宾金华,王小菁,等. 茉莉酸及其衍生物与植物有性生殖某些过程的关系[J].植物生理学通讯,2007,43 (2):211-217.
[14]李浚明,朱登云.植物组织培养教程[M]. 北京:中国农业大学出版社,2005:80-100.
[15]赵倩,林景卫,冯雅萍,等.紫茉莉悬浮细胞培养体系的建立[J].热带亚热带植物学报,2013,21(5): 453-458.
[16]原晓勇,张来琦,李宝璋,等. 西洋参悬浮细胞培养条件的研究[J].西北大学学报:自然科学版, 1994,24(1):51-55.
[17]宾金华,潘瑞炽. 茉莉酸甲酯诱导烟草幼苗抗病与过氧化物酶活性和木质素含量的关系[J].应用与环境生物学报, 1999,5(2):160-164.
[18]杨英,郑辉,李赟,等. 茉莉酸甲酯与二氢茉莉酮酸甲酯对悬浮培养的甘草细胞生长和黄酮积累的影响[J].植物生理学通讯,2008,44(5):903-906.
[19]Zhao J, Zhu W, Hu Q. Enhanced catharanthine production in catharanthus roseus cell cultures by combined elicitor treatment in shake flasks and bioreactors[J]. Enzyme and Microbial Technology, 2001,28(7-8):673-681.
(编辑:梁文俊)
中图分类号:Q813.1
文献标识码:A
文章编号:1671-8151(2016)05-0305-05
基金项目:黑龙江省教育厅基金(12531621)
作者简介:程玉鹏(1966-),男(汉),黑龙江哈尔滨人,副教授,博士,研究方向:中药生物技术
收稿日期:2015-12-16 修回日期:2016-02-03
