山西西葫芦花叶病病原鉴定与部分序列分析
2016-06-02王德富时晓丽寇丽莎庞小静刘勇牛颜冰
王德富,时晓丽,寇丽莎,庞小静,刘勇,牛颜冰*
(1.山西农业大学 生命科学学院, 山西 太谷 030801; 2.湖南省植物保护研究所,湖南 长沙 410125)
山西西葫芦花叶病病原鉴定与部分序列分析
王德富1,时晓丽1,寇丽莎1,庞小静1,刘勇2,牛颜冰1*
(1.山西农业大学 生命科学学院, 山西 太谷 030801; 2.湖南省植物保护研究所,湖南 长沙 410125)
摘要:利用双链RNA(double-stranded RNA, dsRNA)技术和非序列依赖PCR扩增(sequence-independent amplification,SIA)方法对感病西葫芦进行了分子鉴定。序列测定及分析发现,具有明显花叶和斑驳症状的西葫芦受到黄瓜花叶病毒(Cucumber mosaic virus,CMV)的侵染。为进一步明确黄瓜花叶病毒山西西葫芦分离物(CMV-XHL)的分类地位,克隆了CMV-XHL RNA3的外壳蛋白和移动蛋白基因全序列。通过序列比对分析,发现CMV-XHL CP核苷酸序列和氨基酸序列与CMV亚组ⅠB中CMV烟草分离物(CMV-SG)的相似性最高,分别为98.6%和99.5%; MP核苷酸序列和氨基酸序列与CMV亚组Ⅰ分离物的相似性最高,为93.2%~94.6%。MP和CP氨基酸序列系统进化分析表明,CMV-XHL与中国大多数CMV分离物聚为一类,属于CMV亚组Ⅰ中的成员。研究结果对西葫芦病毒病的防治提供一定的理论依据。
关键词:西葫芦;黄瓜花叶病毒;病原鉴定;序列分析
西葫芦(CucurbitapepoL.)又名美洲南瓜、意大利瓜,为葫芦科蔬菜家族的重要成员,因具有较高的营养价值和独特的口感,深受广大消费者的喜爱。近年来,随着人们消费水平的提高和生活方式的转变,人们开始倡导健康的消费理念,对瓜类蔬菜的品质要求越来越高,这就迫使人们进行规范化的集中栽培和管理,以保证质量安全。但在西葫芦的大规模栽培过程中,病毒病害对西葫芦造成的危害也日趋严重[1]。目前,西葫芦主要受到小西葫芦黄花叶病毒[1]、南瓜花叶病毒、烟草环斑病毒、西瓜花叶病毒和甜瓜花叶病毒等多种病毒的单独或复合侵染[2]。笔者于2014年8月在山西晋中地区西葫芦主产区进行病毒病害调查时,发现许多西葫芦叶片出现褪绿斑点、瓜表面有环状绿色斑驳、皱缩,果形出现扭曲变小等严重症状,有的田块病株率甚至高达80%。为明确引起西葫芦花叶、斑驳和果形扭曲等症状的病原,本试验利用dsRNA技术[3]和非序列依赖PCR扩增方法[4]对采集的西葫芦疑似病毒病样品进行分子鉴定,结果发现西葫芦受到黄瓜花叶病毒(Cucumbermosaicvirus,CMV)的侵染,并将其命名为CMV-XHL;同时,对CMV-XHL RNA3外壳蛋白基因全序列和移动蛋白基因全序列进行了克隆和系统进化关系分析,明确了其分类地位,并将其归属于CMV亚组Ⅰ,这为进一步获得黄瓜花叶病毒山西西葫芦分离物(CMV-XHL)的基因组全序列奠定了一定的基础,也为西葫芦病毒病的防治工作提供了参考依据。
1材料和方法
1.1供试材料
西葫芦病叶于2014年8月采自山西晋中地区,主要症状为叶片出现褪绿斑点、瓜果表面出现斑驳和皱缩等(图1)。

图1 西葫芦感病田间症状Fig.1 Symptoms of Cucurbita pepo L.infected by virus
主要试剂:反转录酶(M-MLV)、RNasin核酸酶抑制剂(Promega公司),克隆载体pMD19-T(TaKaRa公司),Taq DNA polymerse和DNA回收试剂盒等(Sangon Biotech公司),CF-11(Whatman公司)。
1.2方法
1.2.1植物病原dsRNA的提取
参考Tzanetakis等[3]和牛颜冰等[4]的方法进行。
1.2.2非序列依赖性PCR和RT-PCR检测
以提取的病样dsRNA为模板,用XTN269随机引物反转录获得病毒cDNA;再利用XTN177引物进行SIA检测, 具体反应程序和体系参照Bright等[5]和牛颜冰等[6]的方法进行。反应结束后,进行琼脂糖凝胶电泳检测。明确侵染西葫芦病毒病原后,根据病毒的外壳蛋白和移动蛋白基因全序列分别设计特异引物进行RT-PCR扩增,同时以健康西葫芦植株为阴性对照。所使用的引物序列见表1。
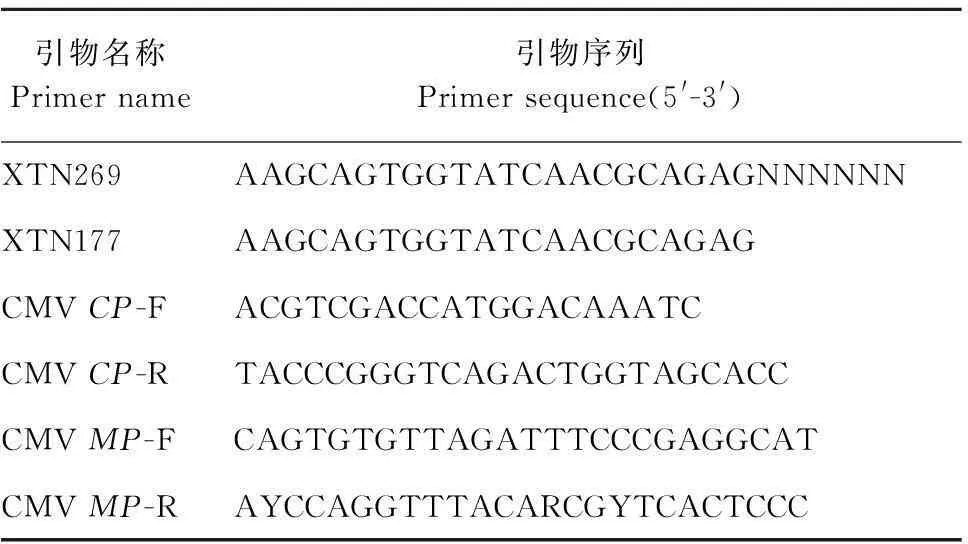
表1 本研究中使用的引物
1.2.3PCR扩增产物克隆与序列分析
PCR产物纯化回收后进行连接和转化实验,经菌落PCR鉴定后的阳性克隆随机选取3个进行测序。测序结果利用NCBI中的BLAST工具检索相关同源序列;序列相似性比较采用DNAMAN 6.0软件进行分析;CP和MP氨基酸序列的系统进化树利用MEGA 5.2软件进行构建。
2结果与分析
2.1双链RNA的提取
对采集的西葫芦病毒疑似样品提取病毒dsRNA,并以健康植株作阴性对照,经1%琼脂糖凝胶电泳分离后得到3个条带(图2),与黄瓜花叶病毒的基因组结构和大小相一致,推测其为CMV。

图2 双链RNA提取电泳结果Fig.1 Electrophoresis analysis of dsRNA products 注:M:DL 10 000 DNA marker;1:感病植株;2:健康植株Note:M:DL 10 000 DNA marker;1:Infected plant;2:Healthy plant
2.2非序列依赖性PCR检测
以反转录所获得的病毒cDNA为模板,利用XTN177引物进行SIA扩增,得到大小为633 bp的目的片段,而对照样品中未扩增出相应的条带(图3)。经BLAST同源性搜索发现目的片段的测序结果与已报道的CMV亚组Ⅰ的相似性最高,为93.5%~98.6%,初步说明西葫芦被CMV所侵染,并将其命名为CMV-XHL。
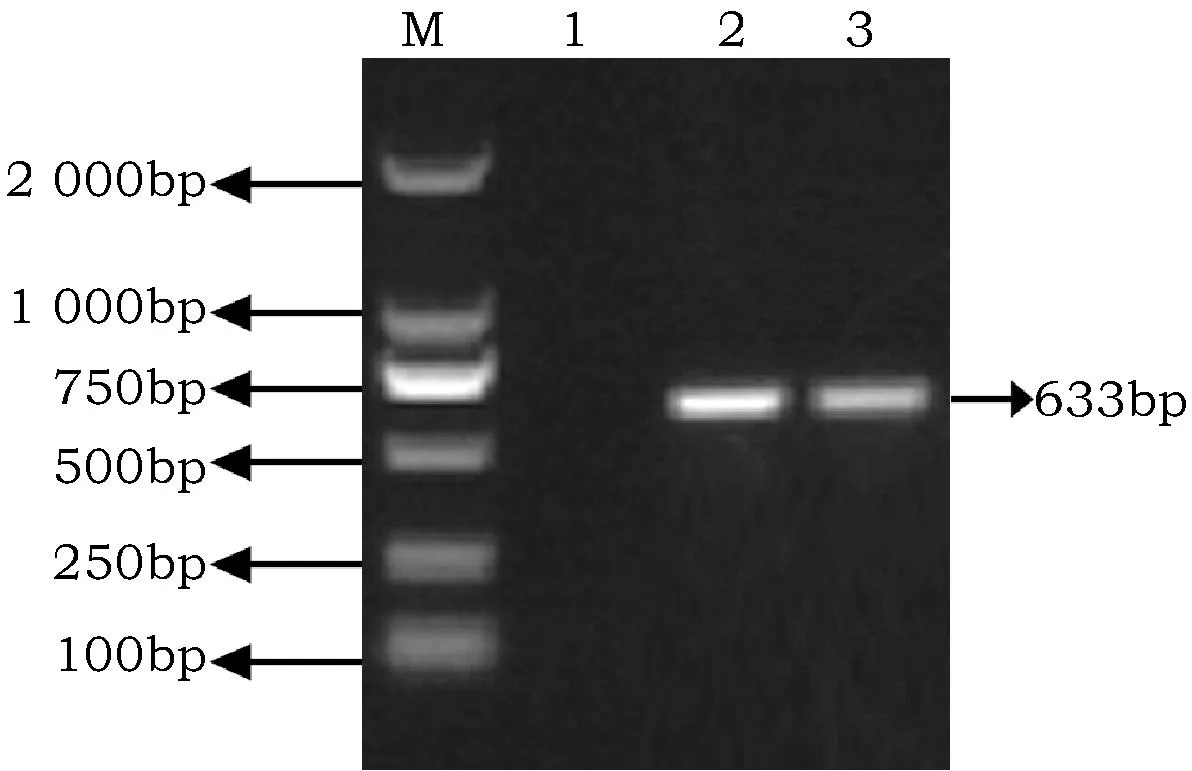
图3 SIA扩增产物电泳结果Fig.3 Electrophoresis analysis of SIA products 注:M:DL 2 000TM DNA marker;1: 健康植株;2、3:感病植株Note:M: DL 2 000TM DNA marker; 1: Healthy plant; 2、3: Infected plant
2.3RT-PCR检测
为进一步确定西葫芦的病毒病原,以提取的西葫芦病毒dsRNA为模板,以CMV-CP-F/CMV-CP-R、CMV-MP-F/CMV-MP-R为引物进行RT-PCR检测,电泳后分别得到大小为657 bp(GenBank登录号:JQ700201)(图4A)和1 123 bp(GenBank登录号:JQ700202)(图4B)的目的条带,而健康样品中未扩增出相应大小的片段,说明引起西葫芦花叶症状的病毒病原确实为CMV。

A:CMV-XHL CP扩增结果; B:CMV-XHL MP扩增结果A.Electrophoresis of PCR products for CMV-XHL CP; B.Electrophoresis of PCR products for CMV-XHL MP图4 CP和MP特异引物PCR检测结果Fig.4 Electrophoresis analysis of PCR products for specific primer 注: 图A中,M:DL 2 000TM DNA marker;1:健康植株; 2、3:感病植株。图B中,M:DL 2 000TM DNA marker;1、2:感病植株; 3:健康植株Note:In figure 4A,M: DL 2 000TM DNA marker; 1: Healthy plant; 2、3: Infected plant. In figure 4B,M: DL 2 000TM DNA marker; 1、2: Healthy plant; 3: Infected plant
2.4CMV-XHL与CMV其他分离物的序列相似性比较
对CMV-XHL的CP基因与来自中国、澳大利亚、日本、美国、匈牙利、韩国和印度的20个CMV株系进行核苷酸和氨基酸序列的相似性比较(表2),分析结果表明CMV-XHLCP基因与CMV亚组Ⅰ代表株系的核苷酸同源性为93.5%~94.1%,氨基酸序列同源性为95.4%~97.7%;而与CMV亚组Ⅱ代表株系的核苷酸序列同源性仅为76.6%~78.7%,氨基酸序列同源性仅为80.6%~84.3%;对CMV-XHL编码的MP基因与来自中国、日本、澳大利亚、匈牙利和美国的10个CMV株系进行核苷酸和氨基酸序列的一致性比较(表3),结果发现CMV-XHLMP基因与CMV亚组Ⅰ代表株系的核苷酸序列相似性为93.5%~93.8%,氨基酸序列相似性为93.2%~94.6%;而与CMV亚组Ⅱ代表株系的核苷酸序列同源性仅为72.4%~77.9%,氨基酸序列同源性仅为81.7%~82.8%, 说明CMV-XHL属于CMV亚组Ⅰ成员。
2.5CMV-XHL的系统发育分析
为进一步明确CMV-XHL的分子进化关系,利用MEGA 5.2对CMV-XHL的CP基因和MP基因所编码氨基酸序列与已报道的其他CMV分离物进行了系统发育分析(图5、图6)。从图5可以看出,CMV-XHL CP与CMV亚组Ⅰ代表株系形成一个独立分支,其中与亚组ⅠB中的SG株系亲缘关系最近,聚为一簇;CMV-XHL MP也与CMV亚组Ⅰ形成单独的分支(图6),但二者与PSV的亲缘关系最远,这进一步说明CMV-XHL属于CMV亚组Ⅰ成员。
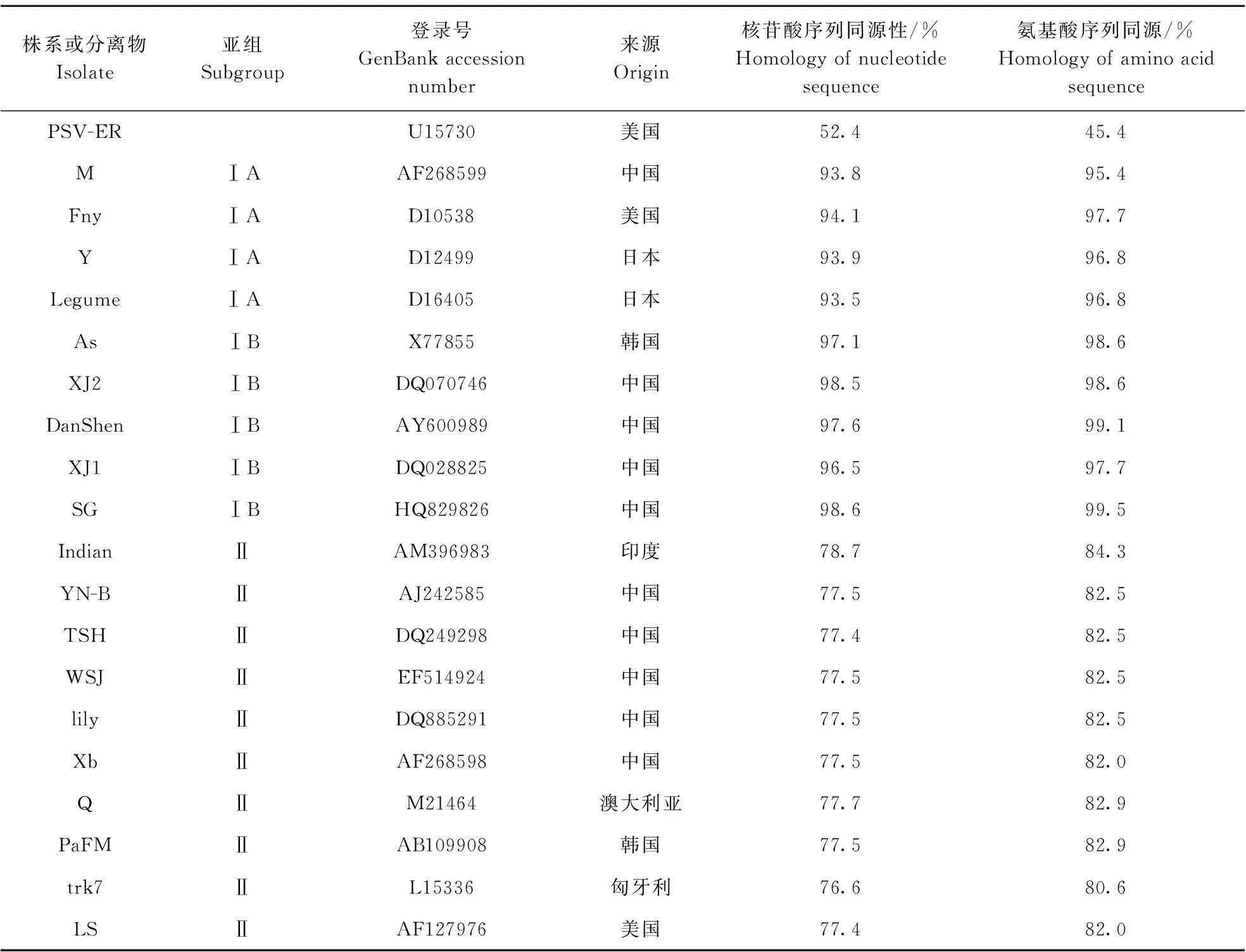
表2 CMV-XHL CP与已报道的CMV分离物核苷酸和氨基酸序列的同源性比较
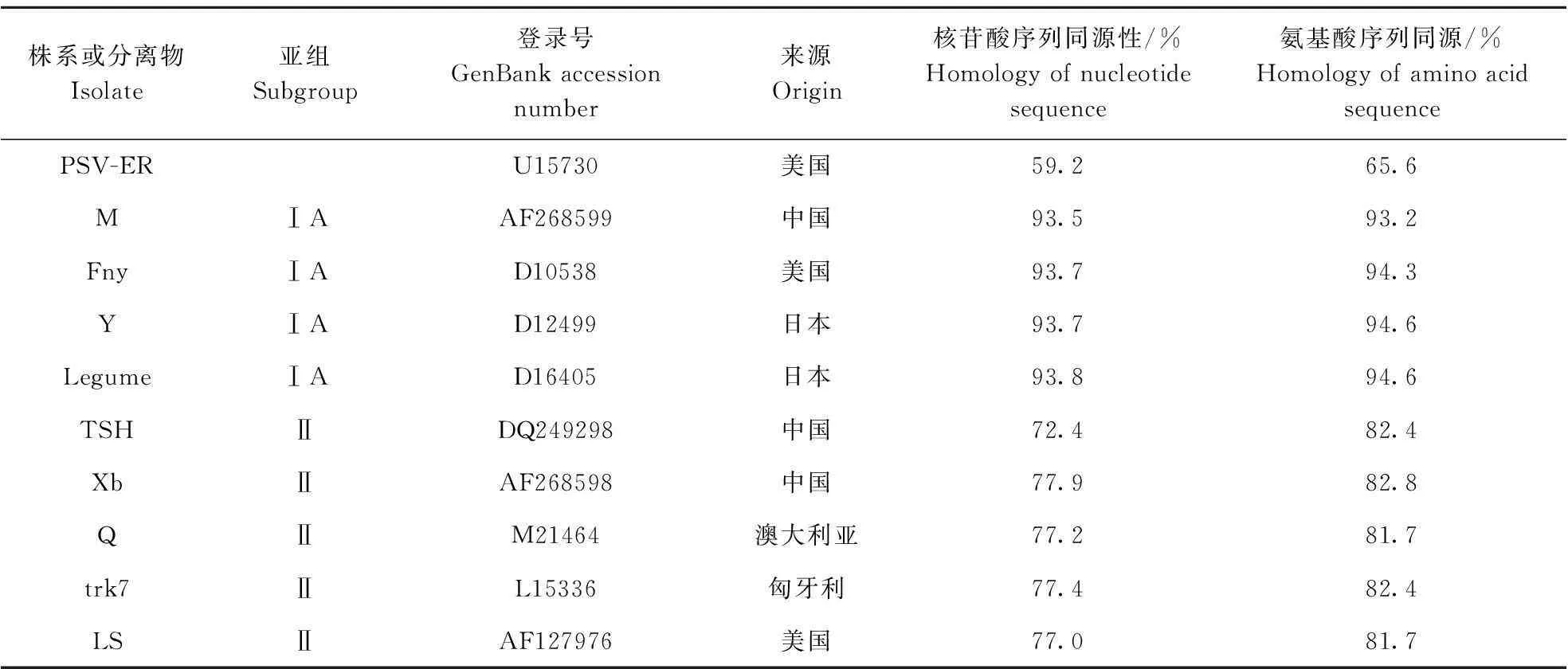
表3 CMV-XHL MP与已报道的CMV分离物核苷酸和氨基酸序列的同源性比较

图5 CMV-XHL CP基因编码产物的系统发育分析Fig.5 Phylogenetic analysis on deduced amino acid sequence of CMV-XHL CP and other reported isolates

图6 CMV-XHL MP基因编码产物的系统发育分析Fig.6 Phylogenetic analysis on deduced amino acid sequence of CMV-XHL MP and other reported isolates
3讨论与结论
植物病毒病害是葫芦科蔬菜的主要为害之一,常常导致西葫芦产量降低、品质变劣,严重时甚至导致绝产[1]。2014年对山西晋中地区西葫芦产区进行病害调查,发现西葫芦的病毒病发生率在80%以上。采用dsRNA技术和SIA、RT-PCR检测方法,对感病西葫芦进行分子鉴定,确定其受到CMV的侵染,这为西葫芦病毒病的有效防治提供
一定的理论依据。
引起山西晋中地区西葫芦花叶、斑驳和果形扭曲等症状的病毒为黄瓜花叶病毒(Cucumbermosaicvirus,CMV),通过对CP和MP的核苷酸全序列的相似性分析和氨基酸序列的系统进化分析,确定CMV-XHL属于CMV亚组Ⅰ成员。
黄瓜花叶病毒(Cucumbermosaicvirus,CMV)是世界范围内分布的危害较严重的病毒种类之一,它能侵染禾谷类作物、木本和草本观赏植物以及葫芦科蔬菜等多种植物[7]。据Palukaitis等[8]的研究报道,CMV株系按寄主范围、血清学以及CP基因序列差异等特点,可被分为亚组Ⅰ和亚组Ⅱ,而亚组Ⅰ又可依据RNA3 5′端非编码序列间存在的差异,划分为亚组ⅠA和亚组ⅠB[9,10]。田兆丰等[11]对采自我国不同地方的33个感染了CMV的辣椒样品进行检测,结果发现CMV亚组Ⅰ所占的比例较大,为94%,而亚组Ⅱ仅占6%。本试验对CMV-XHL的CP进行核苷酸序列相似性和氨基酸序列的系统进化分析,发现CMV-XHL属于CMV亚组ⅠB成员。另外,笔者在白术、天南星和红花上也获得了CMV分离物,经研究发现它们也都归属于CMV亚组Ⅰ成员(待发表)。本试验结果与李晶晶等[12]的研究结果相一致,证明了CMV亚组Ⅰ在我国较普遍发生,而且大部分CMV分离物都属于亚组ⅠB,而亚组Ⅱ在我国发生较少。CMV亚组Ⅱ在我国较少发生的原因可能有3个:一是我国大部分生态环境不适合CMV亚组Ⅱ分离物的生存;二是目前我们所收集和分析的样品数目还不够多或者所取样品代表性不强;三是CMV亚组Ⅱ分离物侵染植物后所引起的发病症状本身较轻,还没有引起人们的足够重视。因此,在本研究的基础上,继续进行全国范围内的西葫芦病毒病样采集,特别是对发病症状轻的西葫芦植株进行病原鉴定,将是今后西葫芦病毒检测工作的一个重点和首要任务。
参考文献
[1]文朝慧, 刘雅莉. 甘肃省南瓜及西葫芦小西葫芦黄花叶病毒病鉴定[J]. 植物保护, 2010, 36(4): 120-122.
[2]于新美,王海燕,杨福仓. 西葫芦病毒病发生的原因及防治方法[J]. 安徽农学通报,2009, 15(16):152-153.
[3]Tzanetakis I E, Martin R R. A new method for extraction of double-stranded RNA from plants [J]. Journal of Virological Methods, 2008, 149(1): 167-170.
[4]牛颜冰,时晓丽,赵慧琪,等. 白术矮化病毒病病原的分子鉴定和部分序列分析[J]. 植物病理学报,2014,44(4): 357-362.
[5]Bright O A, Monday O A, Leslie L D, et al. Application of sequence-independent amplification (SIA) for the identification of RNA virus in bioenergy crops [J]. Journal of Virological Methods, 2010, 169(1): 119-128.
[6]牛颜冰,时晓丽,张西梅,等. 侵染白术的蚕豆萎蔫病毒2号的分子检测与序列分析[J]. 病毒学报, 2015, 31(1): 58-64.
[7]曾蓉, 陈燕飞, 严师节, 等. 侵染白菜的黄瓜花叶病毒分离物基因组的全序列分析[J]. 园艺学报, 2008, 35(2): 213-220.
[8]Palukaitis P, Garcia-Arenal F. Cucumoviruses [J]. Advances in Virus Research, 2003, 62(4): 241-323.
[9]Roossinck M J, Zhang L, Hellwald K H. Rearrangements in the 5’nontranslated region and phylogenetic analyses ofCucumbermoasicvirusRNA3 indicate radial evolution of three subgroups [J]. Journal of Virology, 1999, 73(8): 6752-6758.
[10]Roossinck M J. Evolutionary history ofCucumbermosaicvirusdeduced by phylogenetic analyses [J]. Journal of Virology, 2002, 76(7): 3382-3387.
[11]田兆丰, 裘季燕, 刘伟成, 等. 我国部分省市甜椒黄瓜花叶病毒的亚组鉴定[J]. 植物病理学报, 2004, 34(2): 190-192.
[12]李晶晶, 邓召花, 曾静, 等. 侵染万寿菊的黄瓜花叶病毒外壳蛋白基因的克隆与序列分析[J]. 生物技术通报, 2007(6): 93-96.
(编辑:马荣博)
Identification and partial sequence analysis of the pathogen causingCucurbitapepoL.mosaic disease in Shanxi province
Wang Defu1, Shi Xiaoli1, Kou Lisha1, Pang Xiaojing1, Liu Yong2, Niu Yanbing1*
(1.CollegeofLifeSciences,ShanxiAgriculturalUniversity,Taigu030801,China; 2.HunanPlantProtectionInstitute,Changsha410125,China)
Abstract:To identify the viruses that induced Cucurbita pepo L.mosaic disease, dsRNA technology and sequence-independent amplification (SIA) were used. Results of SIA and sequencing showed that Cucurbita pepo L.was infected by Cucumber mosaic virus (CMV). To further characterize the Shanxi isolate of Cucumber mosaic virus (CMV-XHL), the coat protein gene (CP) and movement protein gene (MP) coded by CMV-XHL RNA3 were cloned and sequenced. Sequence alignments showed that CMV-XHL has the highest identities of 98.6% in nucleotide level and 99.5% in deduced amino acid level with the strain SG which belong to CMV subgroupⅠB and 93.2%~94.6% in CMV Subgroup Ⅰ. Phylogenetic analysis of CP and MP suggested that CMV-XHL belongs to CMV subgroupⅠ. The results of this study may serve as a theoretical basis to prevent and control Cucumber mosaic virus.
Key words:Cucurbita pepo L.; Cucumber mosaic virus; Pathogen identification; Sequence analysis
中图分类号:S432.41
文献标识码:A
文章编号:1671-8151(2016)05-0310-05
基金项目:公益性行业(农业)科研专项 (No.201303028);山西农业大学科技创新基金(20142-10);山西农业大学引进人才科研启动基金(2014YJ05)
作者简介:王德富(1983-),男(汉),博士,讲师,研究方向:分子植物病毒学*通讯作者:牛颜冰,教授,博士。Tel:13835400019,E-mail:niuyanbingbest@163.com
收稿日期:2016-01-19 修回日期:2016-02-18
