木薯NAC转录因子Rd26基因克隆及表达
2016-05-30丁泽红颜彦付莉莉黄猛铁韦韦胡伟
丁泽红 颜彦 付莉莉 黄猛 铁韦韦 胡伟
摘要:【目的】克隆木薯NAC转录因子Rd26基因(MeRd26)并检测其在干旱胁迫下的表达量,为Rd26基因抗旱调控机制研究打下基础。【方法】利用反RT-PCR克隆木薯叶片中的MeRd26基因,对其进行序列比对及系统发育进化树构建,研究其在栽培种Ku50和野生种W14间的变异情况,并用实时荧光定量PCR(qPCR)检测PEG-6000干旱胁迫下的MeRd26基因表达量。【结果】从木薯叶片中克隆获得的MeRd26基因,长度为1288 bp,包含1041 bp的开放阅读框,编码346个氨基酸,且含NAC保守结构域。系统发育进化树分析结果表明,MeRd26蛋白与杨树(Potri.011G123300.1)和杞柳(SapurV1A.0127s0020.1)的Rd26蛋白亲缘关系较近。基因结构变异分析结果显示,MeRd26基因有33個SNP位点和7个InDel位点,且大部分变异分布在非编码区及最后一个外显子的后半区域。基因表达检测结果显示,在正常大田种植条件下,栽培种Ku50叶片的MeRd26基因表达量是野生种W14的130倍,但在根中表达量差异较小;在干旱胁迫下,栽培种Ku50未展开叶、老叶和根中MeRd26基因表达被快速诱导,表达量随胁迫时间的延长而增加,在根中表达量最高,但在第1片完全展开叶中,MeRd26基因的表达被抑制,其表达量明显降低。【结论】MeRd26基因在转录水平上参与了木薯抗干旱胁迫反应,可作为候选基因用于木薯抗旱机制研究。
关键词: 木薯;NAC转录因子;Rd26基因;克隆;表达
中图分类号: S533 文献标志码:A 文章编号:2095-1191(2016)11-1822-05
Abstract:【Objective】The present experiment was conducted to clone NAC transcription factor Rd26 gene(MeRd26) from Manihot esculenta Crantz and detect its expression level under drought stress,in order to provide a foundation for further research on regulation mechanism of MeRd26 gene in response to drought. 【Method】MeRd26 gene was cloned from M. esculenta leaf by RT-PCR,and its sequence was aligned with sequences of other species,then their phylogenetic tree was constructed. Subsequently,its structural variation between wild variety W14 and cultivated variety Ku50 was revealed,and its expression level under PEG-6000 drought stress was detected by quantitive real-time PCR(qPCR). 【Result】MeRd26 gene was cloned successfully from M. esculenta leaf,with length of 1288 bp,containing open reading frame(1041 bp),encoding 346 amino acids,containing NAC conserved domain. Phylogenetic tree showed that,MeRd26 protein had close genetic relationship with Rd26 protein of Populus trichocarpa(Potri.011G123300.1) and Salix purpurea(SapurV1A.0127s0020.1). Gene structure variation analysis revealed that MeRd26 gene had 33 SNPs and 7 InDels,and most of these variations were located in the non-coding region and second half of last exon. Expression analysis showed that,MeRd26 gene in leaf of cultivated variety Ku50 was expressed 130 times as that in wild variety W14,while difference was small in root. Under drought stress,expression of MeRd26 gene was rapidly increased in folded leaf,bottom leaf and root with increase of drought stress time,especially in root with the highest expression level. On the contrary,expression of MeRd26 gene was inhibited and reduced obviously in the first fully expanded leaf. 【Conclusion】MeRd26 gene is involved in drought-resistant reaction at transcriptional level,so it can be served as a candidate gene to further study its role in drought-resistant mechanism of M. esculenta.
Key words: Manihot esculenta Crantz; NAC transcription factor; Rd26 gene; clone; expression
0 引言
【研究意义】木薯(Manihot esculenta Crantz)是重要的粮食作物和经济作物,虽然具有抗旱的生物学特性,但干旱胁迫仍会影响木薯的生长和发育,导致木薯块根产量减少(Okogbenin et al.,2013)。NAC是一类重要的转录因子,在植物干旱等逆境胁迫中发挥重要作用(李伟等,2011;孙利军等,2012)。因此,克隆木薯NAC相关基因,对研究其在木薯抗旱中的调控机制具有重要意义。【前人研究进展】自1996年Souer等首次从矮牵牛中克隆获得NAC基因以来,陆续在水稻、拟南芥、马铃薯、小麦、油菜等物种中发现NAC成员。经研究证实,大多数NAC转录因子含有一个保守的N端DNA结合域、一个C端可变结构域和一个核定位信号(Hu et al.,2006)。NAC是一个庞大的基因家族,如水稻和拟南芥分别含有140和105个NAC成员。Rd26是一个重要的NAC转录因子(Fujita et al.,2004)。Tran等(2007)研究报道,拟南芥过量表达Rd26基因(ANAC072),能显著提高其抗旱能力,其原因是过量表达Rd26基因的拟南芥会对脱落酸极度敏感,脱落酸应答基因均上调表达,而Rd26基因功能丧失的植株对脱落酸不敏感,脱落酸应答基因的表达受到抑制,表明Rd26基因通过调控依赖脱落酸抗逆信号途径参与抗旱胁迫反应(Fujita et al.,2004)。此外,Rd26基因还与锌指蛋白ZFHD1直接互作,激活下游基因表达参与抗旱胁迫反应(Tran et al.,2007),且其表达受盐、衰老、活性氧、病原体防御等诱导影响(Nuruzzaman et al.,2013)。【本研究切入点】目前已有拟南芥(Tran et al.,2007)、马铃薯(Singh et al.,2013)、麻疯树(Zhang et al.,2015)等作物Rd26基因参与干旱胁迫的研究报道,但关于木薯Rd26基因的研究极少,仅利用cDNA微阵列技术从3个木薯品种中分离出168个干旱胁迫诱导基因,其中包含Rd26基因(Utsumi et al.,2012),但并未对其进行深入研究。【拟解决的关键问题】克隆木薯NAC转录因子Rd26基因(命名为MeRd26),并对其基因结构变异、启动子顺式作用元件,基因表达和系统发育进化树展开研究,为揭示MeRd26基因抗旱调控机制打下基础。
1 材料与方法
1. 1 试验材料
供试木薯栽培种Ku50和野生种W14由中国热带农业科学院热带生物技术研究所提供。RNA提取试剂盒购自天根生化科技(北京)有限公司;Revert Aid First Strand cDNA Synthesis Kit购自Fermentas公司;SYBR GreenⅠ试剂盒购自TaKaRa公司。主要仪器设备:Mx 3005P荧光定量PCR仪、Biometra PCR扩增仪、DYY-2C稳流稳压电泳仪及Biorad GelDoc XR凝胶成像系统。
1. 2 干旱胁迫处理
在木薯种植季节,将栽培种Ku50种茎切成长度约15 cm的茎段,挑选带有芽眼(3~4个/茎段)且粗细均匀的茎段扦插于塑料盆(高18.8 cm,上直径18.5 cm,下直径14.8 cm)中,1茎段/盆。栽培基质是由营养土与蛭石按1∶1体积比配制而成。木薯种植10 d后进行间苗,保留1苗/盆。种植60 d后,选取长势一致的植株用20% PEG-6000溶液模拟干旱胁迫,以未经PEG-6000干旱胁迫为对照。干旱胁迫处理0、3和24 h后,分别提取叶片(包括未展开叶、第1片完全展开叶和老叶)和根的RNA进行qRT-PCR分析。此外,收集正常大田种植的木薯野生种W14和栽培种Ku50的叶片(种植90 d后)和储藏根(种植150 d后),用于qRT-PCR分析。
1. 3 RNA提取及cDNA合成
木薯叶片和根总RNA的提取按照RNA提取试剂盒说明进行操作。利用Revert Aid First Strand cDNA Synthesis Kit 将总RNA反转录为cDNA,-20 ℃保存备用。
1. 4 引物合成及qPCR
根据木薯基因组数据库提供的序列(Manes.15G084800.1),利用Primer 6.0设计引物,包括MeRd26基因全长引物(L1:5'-TCTACCTCCATTTTCTCTCGT
CC-3'和R1:5'-ACATATGCTCCCCGGAAAAGAA-3')、actin基因(内参基因)引物(L2:5'-TGATGAGTCTGGTCCATCCA-3'和R2:5'-CCTCCTACGACCCAATCT
CA-3')(Xu et al.,2013)和MeRd26基因qPCR特异性引物(L3:5'-GCCCGAGATTGATGACCGAT-3'和R3:5'-
TGGAACCGAGTTAAACCCGG-3'),由生工生物工程(上海)股份有限公司合成。按照SYBR GreenⅠ试剂盒说明进行pRT-PCR。扩增程序:95 ℃预变性30 s;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行40个循环;95 ℃ 60 s,55 ℃ 30 s,95 ℃ 30 s。每样品设置3个重复,表达量按照2-ΔΔCt进行计算(胡伟等,2015)。PCR产物送至深圳华大基因科技有限公司进行测序。
1. 5 生物信息学分析
用BLAST搜索Phytozome数据库,获取与其他物种同源性较高的序列;用ClustalX进行序列比对和保守结構分析;用MEGA 5.2构建系统发育进化树;用DnaSP v5.0进行SNP分析及ka/ks计算;用PlantCARE进行启动子元件分析。
2 結果与分析
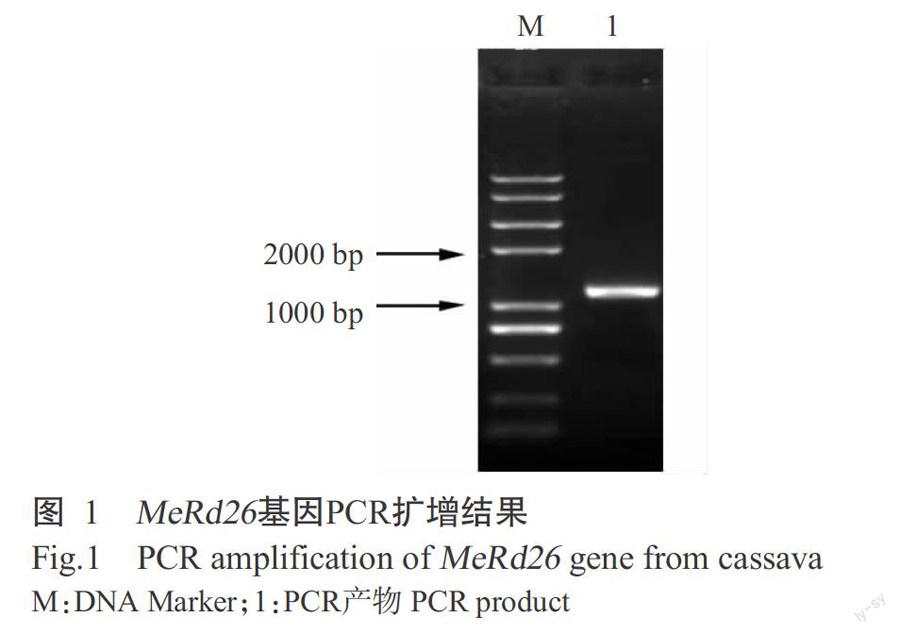
2. 1 目的基因的克隆
从采集的叶片中扩增出一个长度为1288 bp的片段(图1),将其测序结果提交至拟南芥蛋白质数据库进行BLAST比对,序列相似度达69.9%,表明已成功获得MeRd26基因。序列分析结果显示,该片段包含81 bp的5'UTR、1041 bp的开放阅读框和166 bp的3'UTR;共编码346个氨基酸,与Phytozome木薯(栽培品种AM506)基因组注释信息一致。经基因组信息比对,发现MeRd26基因含3个外显子和2个内含子。
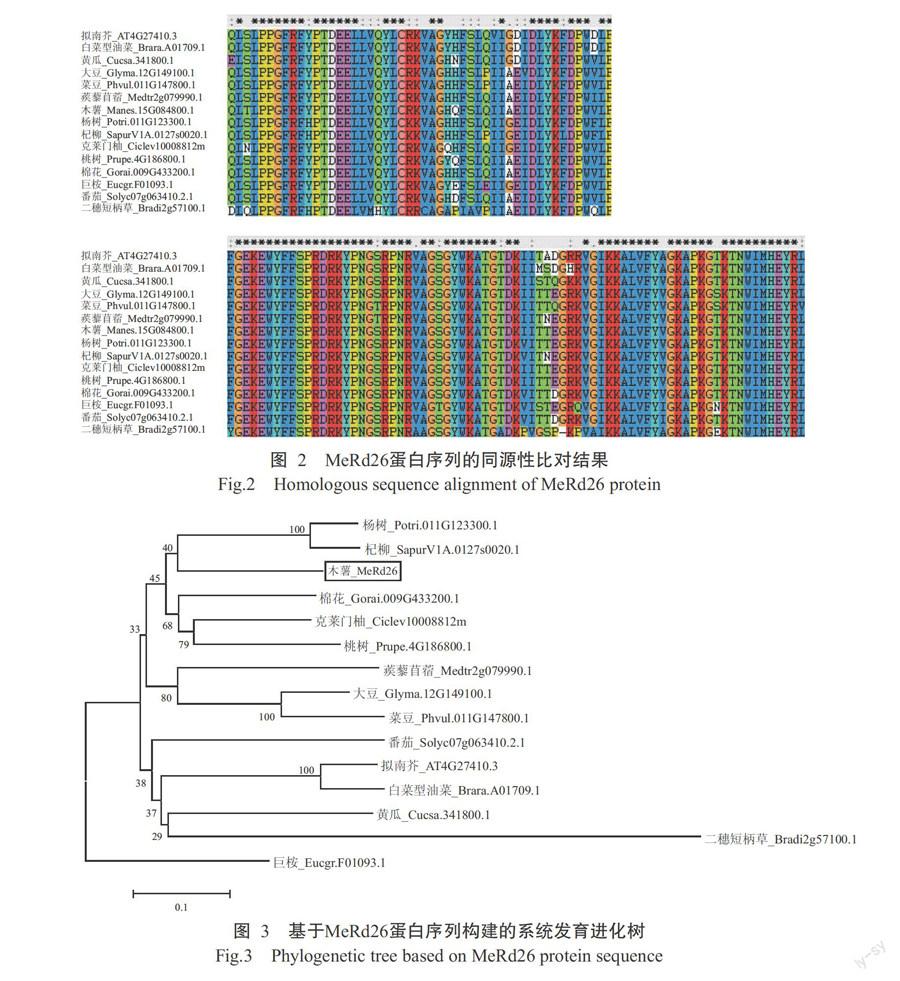
2. 2 系统发育进化树分析结果
蛋白序列同源性比对结果(图2)表明,不同物种的Rd26蛋白均含一个高度保守的NAC结构域,推测该结构域是蛋白的功能域。基于Rd26蛋白序列构建的系统发育进化树分析结果(图3)表明,MeRd26蛋白与杨树(Potri.011G123300.1)和杞柳(SapurV1A.0127s0020.1)的Rd26蛋白亲缘关系较近,同源性分别为73.22%和73.09%。
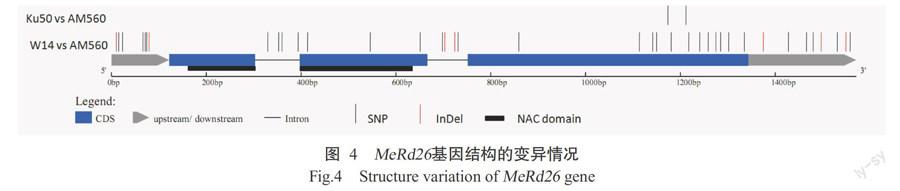
2. 3 基因结构变异分析结果
将克隆获得的MeRd26基因与Phytozome数据库中的3个木薯材料W14、Ku50和AM506进行序列比对,结果(图4)发现,MeRd26基因有33个SNP位点和7个InDel位点,且大部分变异分布在非编码区(5'UTR、内含子和3'UTR)及最后一个外显子的后半区域;其NAC结构域序列较保守,仅发现2个SNP位点且均属于同义突变。此外,将木薯栽培种Ku50和野生种W14的MeRd26基因序列分别与栽培种(AM560)进行比对,结果显示MeRd26基因结构变异主要来自于野生种与栽培种间的差异,栽培种与栽培种间的差异较小,仅有2个SNP位点,且栽培种与野生种ka/ks值为0.305~ 0.385,表明MeRd26基因在木薯进化中受到纯化选择。
2. 4 启动子元件分析结果
对MeRd26基因起始密码子上游1500 bp序列进行启动子元件分析,发现存在大量激素相关的元件,如ABRE(脱落酸顺式作用元件)、TCA-element(水杨酸顺式作用元件)和GARE-motif(赤霉素顺式作用元件)等;此外,还发现大量光相关的元件,如ACE、Box I和G-box等,表明MeRd26基因可能参与调控激素和光相关的代谢。
2. 5 基因表达分析结果
为了验证MeRd26基因在木薯野生种和栽培种间的变异是否引起其表达水平变化,对正常大田种植的栽培种Ku50和野生种W14的叶片和根MeRd26基因的表达量进行检测,结果如图5所示。栽培种Ku50叶片的MeRd26基因表达量是野生种W14的130倍,但在根中表达量差异较小,表明木薯进化过程中,碱基变异主要影响MeRd26基因在叶片中的表达。这可能与该基因的启动子序列变异有关。
对干旱胁迫下MeRd26基因在不同木薯组织中表达量进行检测,结果如图6所示。栽培种Ku50的未展开叶、老叶和根中MeRd26基因表达被快速诱导,表达量随胁迫时间的延长而增加;在根中表达量最高,与胁迫前相比,胁迫3和24 h后的表达量显著提高了15倍和21倍(P<0.05,下同);但在第1片完全展开叶中,MeRd26基因的表达被抑制,与胁迫前相比,胁迫3和24 h后其表达量显著下降了200%和300%。综上所述,MeRd26基因在转录水平上参与了木薯抗干旱胁迫反应,但在不同组织具有不同的调控功能。
3 讨论
由于NAC家族成员的庞大及基因功能的冗余性(李鹏等,2010),其转基因植株难以获得预期的表型。因此,须将NAC转录因子的结构与功能相联系进行研究(李伟等,2011)。本研究从木薯中克隆获得的MeRd26基因,编码346个氨基酸,含3个外显子和2个内含子,与大部分NAC基因家族成员一致(李鹏等,2010)。此外,无论是栽培种还是野生种,在MeRd26基因编码蛋白的N端均有一个高度保守的NAC结构域,但C端具有高度的多态性,C端的变异均远高于N端。这与李鹏等(2010)报道的在不同物种中N端是高度保守,C端是高度变异区域的结论一致,其原因可能与C端是转录调控区,具有转录激活或转录抑制活性有关(孙利军等,2012)。本研究还发现MeRd26基因在木薯栽培种Ku50中的表达量明显高于野生种W14,据此推测木薯野生种和栽培种间C端碱基变异导致MeRd26基因表达水平不同。
Rd26基因表达可被干旱、高盐、低温等多种非生物胁迫诱导(Tran et al.,2004;Nuruzzaman et al.,2013),因此,本研究利用PEG-6000溶液对木薯进行干旱胁迫,并检测MeRd26基因在不同组织中的表达量,结果发现MeRd26基因的表达在不同叶片(未展开叶、第1片完全展开叶和老叶)和根中均存在显著差异,与在拟南芥中的研究结果一致(Fujii et al.,2011)。此外,Rd26基因的表达可被病原菌侵染等生物胁迫诱导(孙利军等,2012;Nuruzzaman et al.,2015),但其是否与木薯抗病相关尚需进一步探究。
4 结论
本研究克隆获得的MeRd26基因在转录水平上参与了木薯抗干旱胁迫,可作为候选基因用于木薯抗旱机制研究。
参考文献:
胡伟,颜彦,韦运谢,王文泉,夏志强,卢诚,侯晓婉,彭明. 2015. 木薯MeASR基因克隆及表达分析[J]. 生物技术通报31(10):125-130.
Hu W, Yan Y, Wei Y X, Wang W Q, Xia Z Q, Lu C, Hou X W, Peng M. 2015. Clone and expression of MeASR gene in cassava[J]. Biotechnology Bulletin, 31(10): 125-130.
李鵬, 黄耿青, 李学宝. 2010. 植物NAC转录因子[J]. 植物生理学通讯,46(3): 294-300.
Li P, Huang G Q, Li X B. 2010. Plant NAC transcription factors[J]. Plant Physiology Communications, 46(3): 294-300.
李伟, 韩蕾, 钱永强, 孙振元. 2011. 植物 NAC转录因子的种类、特征及功能[J]. 应用与环境生物学报, 17(4): 596-606.
Li W, Han L, Qian Y Q, Sun Z Y. 2011. Characteristics and functions of NAC transcription factors in plants[J]. Chinese Journal of Applied & Environmental Biology,17(4): 596-606.
孙利军,李大勇,张慧娟,宋凤鸣. 2012. NAC转录因子在植物抗病和抗非生物胁迫反应中的作用[J]. 遗传,34(8): 993-1002.
Sun L J, Li D Y, Zhang H J, Song F M. 2012. Function of NAC transcription factors in biotic and abiotic stress response in plants[J]. Hereditas, 34(8): 993-1002.
Fujii H,Verslues P E,Zhu J K. 2011. Arabidopsis decuple mutant reveals the importance of SnRK2 kinases in osmotic stress responses in vivo[J]. Proceedings of the National Academy of Sciences, 108(4): 1717-1722.
Fujita M,Fujita Y,Maruyama K,Seki M,Hiratsu K,Ohme-Ta-
kagi M,Tran L S P,Yamaguchi-Shinozaki K,Shinozaki K. 2004. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway[J]. The Plant Journal, 39(6): 863-876.
Hu H H,Dai M Q,Yao J L,Xiao B Z,Li X H,Zhang Q F,Xiong L Z. 2006. Overexpressing a NAM, ATAF, and CUC(NAC) transcription factor enhances drought resistance and salt tolerance in rice[J]. Proceedings of the National Academy of Sciences, 103(35): 12987-12992.
Nuruzzaman M, Sharoni A M, Kikuchi S. 2013. Roles of NAC transcription factors in the regulation of biotic and abiotic stress responses in plants[J]. Frontiers in Microbiology, 4: 248.
Okogbenin E, Setter T L, Ferguson M, Mutegi R, Ceballos H, Olasanmi B, Fregene M. 2013. Phenotypic approaches to drought in cassava: review[J]. Frontiers in Physilogy, 4: 93.
Singh A K, Sharma V, Pal A K, Acharya V, Ahuja P S. 2013. Genome-wide organization and expression profiling of the NAC transcription factor family in potato(Solanum tuberosum L.)[J]. DNA Research, 20(4): 403-423.
Souer E, van Houwelingen A, Kloos D, Mol J, Koes R. 1996. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J]. Cell, 85(2): 159-170.
Tran L S P, Nakashima K, Sakuma Y, Osakabe Y, Qin F, Simpson S D, Maruyama K, Fujita Y, Shinozaki K, Yamaguchi-Shinozaki K. 2007. Co-expression of the stress inducible zinc finger homeodomain ZFHD1 and NAC transcription factors enhances expression of the ERD1 gene in Arabidopsis[J]. The Plant Journal, 49(1): 46-63.
Tran L S P, Nakashima K, Sakuma Y, Simpson S D, Fujita Y, Maruyama K, Fujita M, Seki M, Shinozaki K, Yamaguchi-Shinozaki K. 2004. Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J]. The Plant Cell, 16(9): 2481-2498.
Utsumi Y, Tanaka M, Morosawa T, Kurotani A, Yoshida T, Mochida K, Matsui A, Umemura Y, Ishitani M, Shinozaki K, Sakurai T, Seki M. 2012. Transcriptome analysis using a high-density oligomicroarray under drought stress in various genotypes of cassava: an important tropical crop[J]. DNA Research, 19(4): 335-345.
Xu J, Duan X G, Yang J, Beeching J R, Zhang P. 2013. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiology, 161(3): 1517-1528.
Zhang C, Zhang L, Zhang S, Zhu S, Wu P Z, Chen Y P, Li M R, Jiang H W, Wu G J. 2015. Global analysis of gene expression profiles in physic nut(Jatropha curcas L.) seedlings exposed to drought stress[J]. BMC Plant Biology, 15(1): 1-14.
(責任编辑 陈 燕)
