黄曲霉野生型及LaeA缺陷型菌株胞外差异蛋白鉴定
2016-05-30雷阳吕扬勇张帅兵陈菲吕昂胡元森
雷阳 吕扬勇 张帅兵 陈菲 吕昂 胡元森

摘要:【目的】分析黄曲霉野生型产毒株及LaeA缺陷型无毒株在以小麦、玉米为培养基质中生长时的胞外差异蛋白,为进一步明确LaeA因子在黄曲霉产毒调控中的作用提供基础数据。【方法】将小麦及玉米籽粒粉碎后灭菌并加水配制成培养黄曲霉菌的基质,在产毒株(黄曲霉CA14野生型)及无毒株(LaeA缺陷型)培养0、48和72 h时取样,采用SDS-PAGE分别分析黄曲霉毒素B1(AFB1)及胞外差异蛋白,并采用液质联用四极杆飞行时间质谱技术[LC-MS-MS(Q-TOF)]对获得的胞外差异蛋白进行鉴定。【结果】黄曲霉野生型及LaeA缺陷型菌株均能将小麦和玉米基质中的小分子蛋白迅速转化,随着培养时间延长,LaeA缺陷型菌株的胞外蛋白较野生型菌株略少,不产生黄曲霉毒素。产毒株及无毒株胞外差异蛋白条带共有7个,主要为淀粉酶A、碱性蛋白酶、木聚糖酶F3和亮氨酸氨基肽酶A等生理酶类。【结论】黄曲霉产毒株与无毒株的胞外差异蛋白为生理酶类蛋白,该类酶蛋白主要与营养摄入有关,且影响黄曲霉菌丝的生长。
关键词: 黄曲霉;胞外蛋白;小麦和玉米;调控因子LaeA
中图分类号: S182 文献标志码:A 文章编号:2095-1191(2016)11-1827-05
Abstract:【Objective】The present study was conducted to analyze extracellular differential proteins of Aspergillus flavus wild type and LaeA deficient strains cultured in wheat and corn substrates, in order to provide data for further understanding the roles of regulatory factor LaeA in regulation of aflatoxin production. 【Method】 The wheat and corn grains were grinded, sterilized and made into culture substrate by adding proper amount of water. Samples were taken at 0, 48 and 72 h after being inoculated with toxigenic strains(A. flavus CA14 wild type) and avirulent strains(LaeA deficient type) in substrates. SDS-PAGE was applied to analyze aflatoxin B1(AFB1) and extracellular differential proteins, and LC-MS-MS(Q-TOF) technology was employed to identify the extracellular differential proteins. 【Result】A. flavus wild type and LaeA deficient strains could degrade small molecular proteins in wheat and corn substrates quickly. As time extended, LaeA deficient strains contained fewer extracellular differential proteins than wild type strains and produced no aflatoxin. There were seven extracellular differential protein bands in toxigenic strains and avirulent strains, which were mainly biological enzymes such as alpha-amylase A, alkaline protease, 1,4-beta-xylanase F3 and leucine aminopeptidase A. 【Conclusion】The extracellular differential proteins in A. flavus toxigenic strains and avirulent strains belong to biological enzymes. These enzymes are related to nutrition intake and affect the growth of A. flavus mycelia.
Key words: Aspergillus flavus; extracellular protein; wheat and corn; regulatory factor LaeA
0 引言
【研究意義】黄曲霉毒素(Aflatoxin,AF)是由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生的次生代谢产物,具有极强的毒性,普遍存在于小麦、玉米、花生等大宗农产品中(Georgianna et al., 2010)。据报道,由于食用被黄曲霉毒素污染的饲料,每年给牧畜业造成重大损失,黄曲霉毒素引起的食品安全事件也时有发生(Schmidt-Heydt et al.,2009;计成和赵丽红,2010)。LaeA是近年来在真菌中发现的一个主要的全局性调控因子,其在黄曲霉中的缺失导致AF的生物合成受阻及菌核数量减少,过量表达则提高aflR的转录水平,并促进AF和菌核的生成量(Kale et al., 2008)。目前,关于LaeA对AF合成调控的研究主要集中在基因转录水平,其在蛋白水平的研究鲜有报道。因此,利用黄曲霉野生型产毒株及LaeA缺陷型无毒株为材料,分析两者在培养基中胞外蛋白差异,对了解LaeA对AF合成的调控作用,确定黄曲霉菌株生物防治的作用靶点具有重要意义。【前人研究进展】Bok和Keller(2004)、Kale等(2008)分别报道了LaeA的发现及其对包括AF在内多种真菌次级代谢产物的调控作用。进一步研究表明,LaeA不仅在基因转录水平调控AFB1的合成,还能通过影响黄曲霉胞外蛋白的分泌种类来调控毒素合成(Bok and Keller,2004)。Bayram等(2008)指出LaeA与光调节相关的转录因子VeA及VelB形成核复合物后,依靠VeA的核定位信号进入细胞核,从而调控次级代谢产物的生成和表型分化。Kale等(2008)在研究产毒株与LaeA基因缺失株特性时发现,LaeA基因缺失菌株在花生颗粒表面生长趋势减弱;进一步揭示LaeA基因缺失影响脂肪酶的分泌,从而影响菌丝生长及AF形成。Amaike和Keller(2009)研究发现,LaeA基因缺失菌株无法分解种子中的脂类物质,其致病性也出现降低。Chang等(2012)研究发现,LaeA基因缺失后,菌株分生孢子产生量增加而细胞的疏水性降低。【本研究切入点】目前,关于黄曲霉菌LaeA调控因子通过对胞外蛋白种类的影响从而调控黄曲霉毒素合成的研究较少。【拟解决的关键问题】通过液质联用四极杆飞行时间质谱技术[LC-MS-MS(Q-TOF)]对黄曲霉野生型产毒株和LaeA缺陷型无毒株在主要粮食作物小麦和玉米中培养时分泌的胞外蛋白进行比较分析,并鉴别由于LaeA因子缺失而影响表达的胞外蛋白种类,为明确LaeA通过影响黄曲霉胞外蛋白调节黄曲霉毒素B1(AFB1)的合成机制提供基础数据。
1 材料与方法
1. 1 试验材料
供试菌种:黄曲霉CA14(Aspergillus flavus CA14,产毒株)野生型和LaeA缺陷型(Aspergillus flavus CA14ΔLaeA,无毒株)分别由华南理工大学潘力教授及美国农业部Perng-Kuang Chang教授惠赠。
试剂及仪器:牛血清蛋白(BSA)、苯甲基磺酰氟(PMSF)、黄曲霉毒素B1标准品及考马斯亮蓝G-250均购自北京鼎国生物技术有限责任公司;微型植物组织粉碎机(FZ102型,北京市永光明医疗仪器厂);高效液相色谱(Prominence nano 2D,岛津Shimazhu),柱子:C18柱,5 μm(美国Eprogen),流速:400 nL/min;质谱仪(MicrOTOF-QII,Bruker Daltonics);分光光度计(UV-
1001,上海美谱达仪器有限公司)。
1. 2 试验方法
1. 2. 1 小麦、玉米基质制备及接种 称取小麦和玉米籽粒各25 g,分别用植物组织粉碎机粉碎,高温灭菌(115 ℃,20 min)后冷却至室温;参照蔡静平等(2012)的方法对粉碎、灭菌的小麦和玉米初始水含量进行测定,并用无菌水调节水含量至40%(李军军等,2012)。将用PDA培养基培养好的黄曲霉产毒株及无毒株的孢子制成悬浮液,按1.0×107个/g干基分别接种到调好水含量的小麦和玉米基质中,立即混合均匀,平铺在直径为16 cm的无菌培养皿中,30 ℃恒温培养。
1. 2. 2 胞外蛋白的提取、含量测定及电泳分离 胞外蛋白的提取采用乙酸盐法(梁燕嫦,2009):取60 mL乙酸盐缓冲液(50 mmol/L,含2 mmol/L PMSF)浸泡25 g小麦或玉米基质培养物10 h,采用0.45 μm滤膜过滤浸提液或12000 g离心去除孢子等固形物,然后用终浓度为10%的三氯乙酸(TCA)进行沉淀,再用丙酮洗涤3次后得到较纯的胞外蛋白,对蛋白进行SDS-PAGE电泳和含量测定。蛋白含量测定采用Bradford法,根据测得的水含量,按照以下公式计算得到干基质量的蛋白含量。
蛋白含量(mg/g干基)=[蛋白提取液质量浓度(mg/mL)×60 mL]/[25×(1-水含量%)]
利用1×蛋白上样缓冲液室温溶解2 h得到蛋白溶液,通过测定蛋白浓度确定蛋白电泳的上样量为11 μg蛋白/泳道。蛋白电泳采用10%分离胶进行分离。电泳结束后,使用无菌手术刀片分别将野生型产毒株及LaeA缺陷型无毒株的差异蛋白条带切割下来,置于含有超纯水的1.5 mL 离心管中,4 ℃保存,送至北京华大基因研究院进行蛋白质谱鉴定。
1. 2. 3 蛋白质谱鉴定及数据分析 蛋白质谱鉴定及数据分析由北京华大基因研究院蛋白部提供技术服务。流程如下:超纯水清洗胶条后加入消化脱色液(50%乙腈,25 mmol/L碳酸氢铵)清洗2次,然后用乙腈脱水至胶粒完全变白,再加入10 mmol/L DTT,56 ℃孵育1 h。孵育结束后加入55 mmol/L碘代乙酰胺(IAM),暗室孵育45 min,再加入25 mmol/L碳酸氢铵洗涤2次,将1 μg/μL酶储液用25 mmol/L碳酸氢铵稀释15倍后37 ℃水浴消化过夜,加入终浓度为0.1%的FA终止消化,取10 μL進样进行质谱检测。
液相流动相为A液:100% H2O,B液:100% ACN,二者均含有0.1% FA;流速为400 nL/min。MS/MS扫描范围为50~2200 m/z;数据采集软件使用Bruker Daltonics micro TOF control;数据分析软件为Data Analysis Software;数据搜索引擎为Mascot search engine version 2.3.01,提取质谱数据后,利用Data Analysis标峰后,进行MASCOT搜索,数据库选择真菌蛋白数据库。
1. 2. 4 黄曲霉毒素定性分析 AFB1提取及含量和定性分析参考文献(Kale et al., 2008; Amaike and Keller, 2009)并稍作修改:收集黄曲霉产毒株及无毒株不同培养时间的培养物,加入一定量的无菌水搅拌均匀后加入等体积的氯仿萃取,室温放置30 min,再用8层纱布过滤除去固形物,取下层有机相进行旋转蒸发,获得固形物溶解于适量氯仿中进行TLC检测。TLC展开剂为氯仿∶丙酮(95∶5,v/v),使用硅胶板GF254检测。
2 结果与分析
2. 1 黄曲霉在小麦、玉米基质中生长时胞外蛋白含量变化
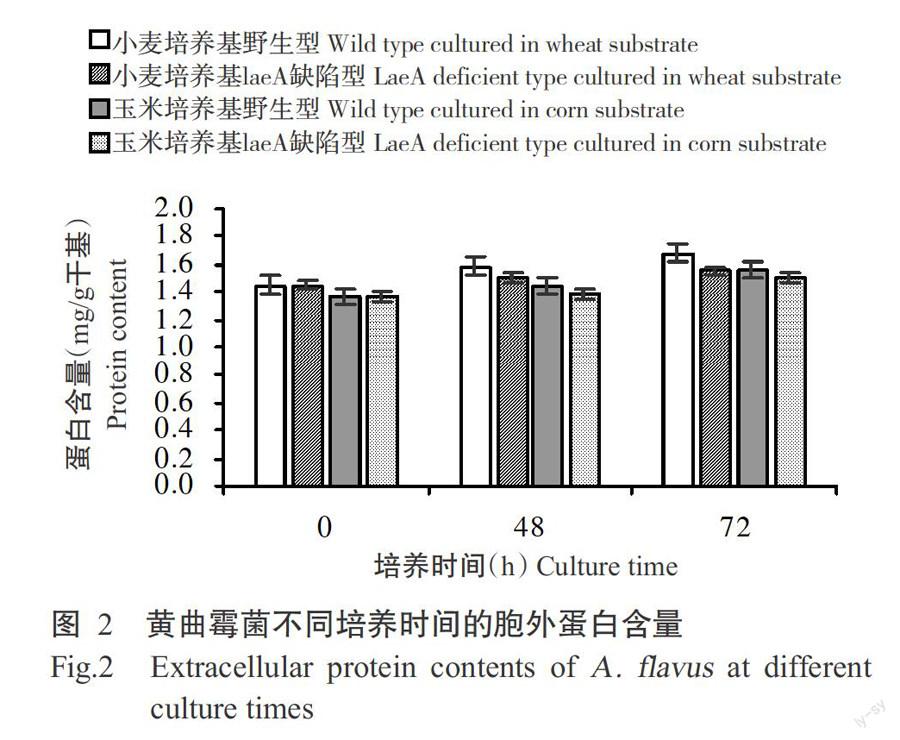
分别提取黄曲霉CA14野生型产毒株及LaeA缺陷型无毒株在小麦、玉米基质中培养0、48和72 h的胞外总蛋白,并采用Bradford法测定培养过程中的蛋白含量。Bradford法得到的标准曲线如图1所示,OD595光密度值(y)与蛋白浓度(x)间的方程式为:y=0.78929x-
0.00681, R2=0.99512。据此推测,OD595光密度值在0.0~0.8 nm,其与蛋白浓度线性关系较强,拟合度好。按此标准曲线计算胞外蛋白浓度如图2。图2显示,小麦基质的初始(0 h)时蛋白含量略高于玉米培养基,可能与小麦籽粒中蛋白含量高于玉米有关;在两种培养基中,随着培养时间的延长,黄曲霉无毒株及产毒株在48和72 h时的蛋白含量均较初始(0 h)时有所增加,但与野生型相比,LaeA缺陷菌株胞外蛋白的产生能力稍弱。
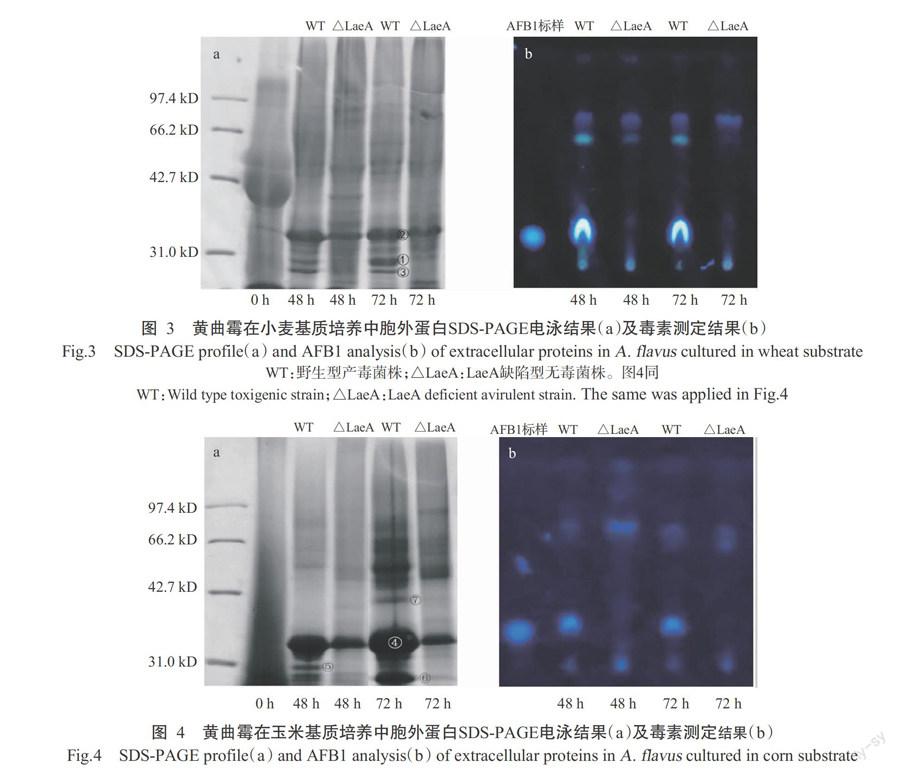
2. 2 黄曲霉胞外蛋白分析及黄曲霉毒素测定结果
分别选取黄曲霉产毒株及无毒株在48和72 h的培养物提取胞外蛋白和AFB1,分别进行SDS-PAGE电泳并定性分析。图3-a显示,0 h时即初始小麦培养基中的蛋白含量较高,但蛋白分子量大小不一,电泳结果未见明显的条带,呈弥散状分布;培养48 h后蛋白含量略有增加,蛋白条带也明显增多,说明小麦培养基中的营养成分被黄曲霉利用,同时黄曲霉自身向外分泌蛋白;72 h后,胞外蛋白条带更加清晰,并伴随有个别条带消失,暗示黄曲霉分泌蛋白酶降解了部分小麦蛋白,少数胞外蛋白含量不断增加。本研究还发现,培养48 h后,黄曲霉在小麦培养基表面产生大量孢子,TLC检测显示,野生型菌株在该基质中产生了AFB1,而LaeA缺陷型菌株未发现AFB1(图3-b)。
从图3-a中可以看出,小麦培养基中的蛋白在黄曲霉培养过程中被逐渐利用,消除了背景蛋白对黄曲霉胞外差异蛋白鉴定的影响。培养48和72 h时,野生型产毒株有3个蛋白条带灰度较LaeA缺陷型菌株明显增强(图中标示①②③),将该蛋白条带切割后进行质谱鉴定及比对分析。
图4-a显示,与小麦中提取得到的蛋白相比(图3-a,0 h),玉米中的蛋白多为小分子,易被黄曲霉吸收利用(图4-a,0 h);随着培养时间的延长,黄曲霉逐渐积累和分泌胞外蛋白,在48~72 h内,胞外蛋白条带逐渐增多,培养基蛋白不断减少。TLC分析测定结果表明,黄曲霉产毒株在48 h时就检测到AFB1产生,而LaeA缺陷型菌株在72 h内还未形成(图4-b)。
从图4-a可看出,玉米培养基中的蛋白在培养过程中被黄曲霉利用,对差异蛋白(图4-a中标示为④⑤⑥⑦)鉴定的影响较小。将标记的差异蛋白条带切胶后送北京华大基因研究院蛋白部进行鉴定。
2. 3 黄曲霉胞外差异蛋白鉴定
图3和图4中标注的7个差异蛋白的质谱鉴定结果见表1。经鉴定,7个差异蛋白条带与黄曲霉中5个基因相对应。条带1和条带6均被鉴定为碱性蛋白酶(Oryzin,分子量42.546 kD)前体,对应黄曲霉的基因号为AFL2T_01995;条带2、条带4和条带5经鉴定均为淀粉酶A前体,对应米曲霉基因组中amyC/amy1(AO090023000944)基因,在黄曲霉中对应的基因号为AFL2T_02658,图4中SDS-PAGE电泳结果显示其表达量在以碳水化合物为主要基质的玉米培养基中较高;在小麦培养基中,条带3被鉴定为木聚糖酶F3(1,4-beta-xylanase F3)前体,对应黄曲霉中基因编号为AFL2T_07437,与黄曲霉具有利用麸皮中纤维素、半纤维素原料的能力相关;玉米培养基中,分子量约41.308 kD的条带7,经鉴定为亮氨酸氨基肽酶A前体,在米曲霉中对应的基因号为AO090011000052,对应黄曲霉中基因号分别为AFL2T_04856和AFL2T_ 12404,其作用主要是将多肽降解为氨基酸及小肽,促进培养基中蛋白的降解。
3 讨论
黄曲霉及其次生代谢产物黄曲霉毒素在小麦、玉米及花生等大宗农产品中广泛存在,其菌丝在生长过程中分泌的胞外酶对菌丝体生长发育及毒素的产生具有重要作用。本研究发现,随着培养时间的延长,培养基中的蛋白不断消耗,黄曲霉产毒株及无毒株胞外蛋白分泌量逐渐增多,说明两个株型均能合成蛋白酶,将基质中的蛋白水解供其自身生长所需。这与其近缘种米曲霉相似,该菌在以大豆为原料进行酱油酿造过程中胞外蛋白酶的表达量较高,与其降解大曲培养基中大豆蛋白的需要有关(陈红梅等, 2008;潘力等, 2010;Yoon et al., 2011)。本研究还发现,不管以小麦还是以玉米为培养基,LaeA缺陷型无毒株胞外蛋白分泌量总是较同时间段的野生型菌株少,暗示LaeA调控因子不仅影响黄曲霉毒素合成,还影响菌体胞外蛋白分泌。这与Kale等(2008)的研究结果相似,即黄曲霉中LaeA因子缺失影响了菌株脂肪酶分泌,从而影响菌丝生长及AF形成。
在SDS-PAGE蛋白图谱中,条带1和条带6为野生型菌株中分泌的表达量较大的蛋白条带,经LC-MS-MS鉴定为蛋白酶前体,暗示野生型菌株较LaeA缺陷菌株合成更多的蛋白酶,对基质中的蛋白类营养利用更充分。条带2、条带4和条带5也表现相似的结果,该条带经鉴定为淀粉酶,也预示野生型菌株对淀粉原料利用占有优势,保证了菌丝生长所需的能量。该结果可解释LaeA缺陷型无毒株菌丝生长较缓慢的原因。
在以小麦和玉米为培养基时,黄曲霉产毒株较无毒株增加的蛋白种类有碱性蛋白酶前体、木聚糖酶F3前体和亮氨酸氨基肽酶A前体。潘力等(2010)在研究米曲霉种曲、大曲的胞外蛋白中也发现存在木聚糖酶及亮氨酸氨基肽酶A,这些酶类多为诱导酶,是黄曲霉菌以小麦和玉米为培养基质中生长时由基质中多种复合多糖、蛋白质等营养物质诱导产生。综上所述,黄曲霉菌中LaeA因子缺失对菌丝营养功能影响较大,并继而影响菌丝生长,但营养功能是否影响其对毒素调控的作用机制还需进一步研究。
4 结论
黄曲霉野生型(产毒株)及LaeA缺陷型(无毒株)在小麦、玉米为基质培养过程中发现7个明显的胞外差异蛋白,经鉴定,该蛋白种类包括淀粉酶A前体、碱性蛋白酶前体、木聚糖酶F3前体和亮氨酸氨基肽酶A前体,该类酶蛋白主要与营养摄入有关,影响黄曲霉菌丝生长。
参考文献:
蔡静平,魏鑫,黄淑霞,张航. 2012. 温度对小麦安全储藏水分及霉菌活动的影响[J]. 粮食与饲料工业,(5): 18-21.
Cai J P, Wei X, Huang S X, Zhang H. 2012. Effects of temperature on safe moisture and mould development of stored wheat[J]. Cereal & Feed Industry,(5): 18-21.
陈红梅,李方方,潘力,杨慧林,王超. 2008. 米曲霉沪酿3.042制曲过程中碱性蛋白酶的表達分析[J]. 中国酿造,27(19): 62-63.
Chen H M, Li F F, Pan L, Yang H L, Wang C. 2008. Analysis of the expression of alkaline protease from Aspergillus oryzae 3.042 during seeding leaven[J]. Chinese Brewing, 27(19): 62-63.
计成, 赵丽红. 2010. 黄曲霉毒素生物降解的研究及前景展望[J]. 动物营养学报,22(2):241-245.
Ji C, Zhao L H. 2010. Research and prospects of aflatoxin biological detoxification[J]. Chinese Journal of Animal Nutrition, 22(2):241-245.
李军军,崔波,檀琮萍. 2012. 米曲霉固态发酵玉米胚芽粕制备玉米肽的研究[J]. 中国食品添加剂,(2):75-80.
Li J J, Cui B, Tan C P. 2012. Preparation of hydrophobic corn peptides by Aspergillus oryzaer solid-state fermentation [J]. Chinese Food Additives,(2):75-80.
梁燕嫦. 2009. 米曲霉胞内外蛋白的分析研究[D]. 广州: 华南理工大学.
Liang Y C. 2009. Analysis of intracellular and extracellular proteins of Aspergillus oryzae[D]. Guangzhou:South China University of Technology.
潘力,苗小康,梁燕嫦. 2010. 酱油酿造米曲霉 AS3. 951(沪酿 3.042)种曲胞外蛋白谱鉴定与分析[J]. 食品科学, 31(7): 182-185.
Pan L, Miao X K, Liang Y C. 2010. Identification of extracellular protein profile of Aspergillus oryzae AS 3.951 grown on wheat bran koji[J]. Food Science, 31(7):182-185.
Amaike S, Keller N P. 2009. Distinct roles for VeA and LaeA in development and pathogenesis of Aspergillus flavus[J]. Eukaryotic cell, 8(7):1051-1060.
Bayram ■, Krappmann S, Ni M, Bok J W, Helmstaedt K, Valerius O, Braus-Stromeyer S, Kwon N J, Keller N P, Yu J H,Braus G H. 2008. VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism[J]. Science, 320(5882): 1504-1506.
Bok J W, Keller N P. 2004. LaeA, a regulator of secondary meta-
bolism in Aspergillus spp.[J]. Eukaryotic Cell, 3(2): 527-535.
Chang P K, Scharfenstein L L, Ehrlich K C, Wei Q, Bhatnagar D, Ingber B F. 2012. Effects of laeA deletion on Aspergillus flavus conidial development and hydrophobicity may contribute to loss of aflatoxin production[J]. Fungal biology, 116(2): 298-307.
Georgianna D R, Fedorova N D, Burroughs J L, Dolezal A L, Bok J W, Horowitz-Brown S, Woloshuk C P, Yu J J, Keller N P, Payne G A. 2010. Beyond aflatoxin: four distinct expression patterns and functional roles associated with Aspergillus flavus secondary metabolism gene clusters[J]. Molecular Plant Pathology, 11(2): 213-226.
Kale S P, Milde L, Trapp M K, Frisvad J C, Keller N P, Bok J W. 2008. Requirement of LaeA for secondary metabolism and sclerotial production in Aspergillus flavus[J]. Fungal Genetics and Biology, 45(10):1422-1429.
Schmidt-Heydt M, Abdel-Hadi A, Magan N, Geisen R. 2009. Complex regulation of the aflatoxin biosynthesis gene cluster of Aspergillus flavus in relation to various combinations of water activity and temperature[J]. International Journal of Food Microbiology, 135(3): 231-237.
Yoon J, Maruyama J, Kitamoto K. 2011. Disruption of ten protease genes in the filamentous fungus Aspergillus oryzae highly improves production of heterologous proteins[J]. Applied Microbiology Biotechnology, 89(3): 747-759.
(責任编辑 麻小燕)
