基于慢性缺血应激建立血管性抑郁症动物模型
2016-05-30雷小明王彦云潘菊华黄世敬张永超陈宇霞李多娇
谭 赛 雷小明 王彦云 潘菊华 张 颖 黄世敬 张永超 郑 军 陈 朝 陈宇霞 李多娇
(中国中医科学院广安门医院中药研发中心,北京 100053)
基于慢性缺血应激建立血管性抑郁症动物模型
谭赛雷小明王彦云潘菊华张颖黄世敬*张永超郑军陈朝陈宇霞李多娇
(中国中医科学院广安门医院中药研发中心,北京 100053)
【摘要】目的 旨在建立血管性抑郁症(vascular depression, VD)的理想动物模型。方法选用SD大鼠40只,采用数字表法随机分为4组:①手术组:双侧颈总动脉结扎(ligation of bilateral common carotid arteries, LBCCA);②假手术组:同手术组处理,但不结扎;③抑郁组:慢性不可预见性温和应激(chronic unpredictable mild stress, CUMS)结合孤养,不进行手术;④模型组:LBCCA叠加CUMS,结合孤养。连续观察21 d,观测大鼠体质量变化、行为学改变、脑血流量变化以及大鼠大脑基质金属蛋白酶(matrix metalloproteinases, MMPs)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、酪氨酸激酶受体B (tropomyosin related kinase B, TrkB)蛋白及其mRNA表达水平的变化。结果与假手术组比较,模型组和抑郁组大鼠体质量、糖水消耗百分率、旷场试验运动距离及站立次数均明显降低(P<0.05或P<0.01),手术组及模型组大鼠脑血流量明显降低(P<0.01),手术组及模型组MMP-2及MMP-2 mRNA表达水平显著增高(P<0.01),抑郁组及模型组海马内BDNF/TrkB及BDNF/TrkB mRNA表达均明显降低(P<0.01或P<0.05)。结论LBCCA叠加CUMS结合孤养方法较好地模拟了抑郁核心症状快感缺乏、运动和探索能下降的行为特征和神经血管单元(neurovascular unit, NVU)稳态失衡的病理机制,是较为理想的血管性抑郁模型,可用于药理实验及治疗效果机制研究。
【关键词】血管性抑郁症;动物模型;神经血管单元;基质金属蛋白酶;脑源性神经营养因子(BDNF);酪氨酸激酶受体B
血管性抑郁症(vascular depression, VD)是一种与脑血管疾病或血管危险因素相关的老年期抑郁综合征,其概念首次由Alexopoulos[1]提出。随着人口老龄化及心脑血管疾病发病率增加,VD的发病率呈逐年上升趋势,并严重影响患者的治疗和预后。VD已成为关乎人口健康和社会公共卫生的重大问题,并成为国内外研究热点。目前在动物实验研究方面,对于抑郁症动物模型的建立与评价方法,国内外已有较多文献[2-3]报道,主要采用应激模型、孤养或分养模型、脑损伤模型、药理学抑郁模型等,但由于脑血管病后引起的抑郁症动物模型(即血管性抑郁症动物模型)国内外仅有少数报道。本研究主要从动物实验模型着手,探寻理想的VD动物模型,为VD的进一步研究奠定基础。
1材料与方法
1.1实验动物
SPF级成年雄性SD大鼠40只,体质量240~260 g,北京维通利华实验动物中心提供,实验动物合格证号:SCXK(京)2009-0007。
1.2主要药品及试剂
青霉素钠(80万U/支,批号:D1204117)华北制药股份有限公司;大脑基质金属蛋白酶 (matrix metalloproteinases, MMP)-2(8B4)一抗(sc-13595)、MMP-9(C-20)一抗(sc-6840),美国Santa Cruz公司;兔超敏二步法免疫组织化学检测试剂PV-9001、小鼠超敏二步法免疫组织化学检测试剂PV-9002、山羊超敏二步法免疫组织化学检测试剂PV-9003,北京中杉金桥公司;DAB显色试剂盒,武汉博士德公司;Trizol Reagent (批号:36010), 美国Invitrogen 公司;Fermentas K1622 RT反转录试剂盒(批号:00102954),美国MBI公司;SYBR Green PCR Master Mix试剂盒(批号:4367659),美国应用生物系统公司。
1.3主要仪器
旷场实验敞箱(自制);TM-vision行为学实验系统,成都泰盟科技有限公司;PeriCam PSI激光散斑血流成像仪,瑞典Perimed AB公司;7900型荧光定量PCR仪,美国应用生物系统公司。
1.4实验方法
1)动物分组与处理:实验前,大鼠每笼5只正常饲养,适应环境1周后,进行行为学评分,选行为学得分相近的大鼠,采用数字表法进行随机分组。(1)假手术组(sham-operated group, SM):手术过程同双侧颈总动脉结扎(ligation of bilateral common carotid arteries, LBCCA),只穿线不结扎,不剪断双侧颈总动脉,每笼5只正常饲养至实验结束;(2)抑郁组(depression group, DP): 慢性不可预见性温和应激(chronic unpredictable mild stress, CUMS)结合孤养致慢性应激抑郁模型,分笼孤养,并同时开始CUMS;(3)手术组:双侧颈总动脉结扎,不进行CUMS,不单笼饲养;(4)模型组(model group, MD):LBCCA加CUMS,结合孤养。
所有大鼠共分为4组。其中,假手术组为对照组,抑郁组、手术组和模型组对本病大鼠模型进行探讨。
2)动物模型:采用LBCCA基础上叠加CUMS以及分笼孤养,建立大鼠慢性低灌注脑缺血性抑郁模型。
(1)LBCCA:假手术组、手术组、模型组大鼠禁食12 h,正常饮水。10%(体积分数)水合氯醛350 mg/kg腹腔麻醉消毒后,沿颈部正中切开约1.5 cm,蚊式止血钳钝性分离两侧颈总动脉,5号丝线分别结扎双侧颈总动脉的近心端和远心端,中间剪断,两侧结扎可间隔0.5 h。其中,假手术组只穿线不结扎,不剪断颈总动脉。术后用青霉素钠水溶液(20万U/只)皮下注射预防感染,并将大鼠置于37 ℃恒温垫上保温,苏醒后返回鼠笼,正常食水。
(2)CUMS:给予大鼠空瓶放置1 h,夹尾1 min,4 ℃冰水游泳5 min,45 ℃环境5 min,明暗颠倒24 h,45°倾斜鼠笼24 h,禁水24 h,禁食24 h,潮湿垫料24 h,水平振荡3 min(160 r/min),电击足底5 min (60 V,1 mA电流,每隔1 min刺激1次,每次10 s)等方法应激。术后7 d后每天随机采取一种应激方法,使动物不能预料应激发生,共持续刺激21 d。
(3)隔离饲养:抑郁组及模型组同时进行单笼隔离饲养。
3)观察指标:(1)体质量测量:在手术前、CUMS 3周后(术后28 d)进行体质量测量,详见表1。
(2)糖水偏嗜实验:详见参考文献[4]。记录每只大鼠的糖水消耗量、纯水消耗量,计算糖水消耗百分率,详见表2。
(3)旷场实验:详见参考文献[4]。术后28 d,采用TM-vision行为学实验系统:OFT-100开场实验视频分析系统进行旷场实验测试。
(4)脑血流量测定:大鼠在LBCCA手术前后实时监测脑血流量变化。所有大鼠在最后一次行为学实验结束后,对各组大鼠脑血流量进行测定。用瑞典Perimed公司的PeriCam PSI血流视频监测系统实时监测脑血流量1 min,经PIMSoft软件程序处理,计算平均值。
(5)免疫组织化学测定大鼠皮质MMP-2/MMP-9及海马脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)/酪氨酸激酶受体B (tropomyosin related kinase B, TrkB)蛋白表达:上述检测完毕后,断头取脑,脑组织于4%(体积分数)多聚甲醛固定过夜,石蜡包埋、切片,按试剂盒说明进行免疫组织化学染色,测定大鼠皮质MMP-2/MMP-9、BDNF/TrkB蛋白表达。
(6)RT-PCR测定大鼠皮质脑组织MMP-2/MMP-9及BDNF/TrkB基因表达:大鼠腹腔取血后迅速用 4 ℃, 0.9%(质量分数)氯化钠注射液灌流,断头取脑,完整脑组织放于超净台冰盒上,剥离皮质及海马组织,放于EP管中,加0.5 mL Trizol,低温研磨匀浆后,冻存于-80 ℃ 冰箱。提取RNA,并进行实时荧光定量PCR。
1.5 统计学方法
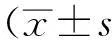
2结果
2.1体质量变化
各组大鼠术前体质量经F检验,组间差异无统计学意义(F=0.456,P=0.716),基线良好,具有可比性。CUMS后3周,各组大鼠体质量经F检验,组间差异有统计学意义(F=6.461,P=0.002)。与假手术组相比,抑郁组、模型组大鼠体质量增长明显减慢(P<0.05,P<0.01);与模型组比,手术组大鼠体质量增长明显加快(P<0.01),详见表1。
2.2 糖水偏嗜试验
经F检验,各组大鼠术前糖水偏嗜实验组间差异无统计学意义(F=0.237,P=0.870),基线良好,具有可比性。术后28 d,各组大鼠糖水消耗百分率经F检验,组间差异无统计学意义(F=2.437,P=0.089)。与假手术组比较,模型组大鼠糖水消耗百分率降低(P<0.05),抑郁组有下降趋势,图1中红色部分代表脑血流,比较白色圈线部分脑血流量改变。差异无统计学意义(P>0.05)。与模型组比较,手术组消耗百分率增加(P<0.05),详见表2。
表1各组大鼠体质量变化
Tab.1The changes of weight in each rat group
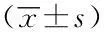

GroupNumberofcaseBeforeLBCCACUMS3weekSM7252.00±7.79550.86±51.76OP7249.14±3.89524.00±42.36ΔΔDP6249.00±14.68491.50±51.93*MD8254.12±10.52460.88±15.40**F0.4566.461P0.7160.002
*P<0.05,**P<0.01vssham-operated group;ΔΔP<0.01vsmodel group; LBCCA:ligation of bilateral common carotid arteries; CUMS:chronic unpredictable mild stress; SM: sham-operated group; OP: operation group; DP: depression group; MD: model group.
表2各组糖水偏嗜实验结果
Tab.2Experimental results of sucrose preference

)
*P<0.05vssham-operated group,ΔΔP<0.01vsmodel group; LBCCA:ligation of bilateral common carotid arteries; SM: sham-operated group; OP: operation group; DP: depression group; MD: model group.
2.3旷场试验
经F检验,各组大鼠术前旷场试验结果组间差异无统计学意义(F=0.639,P=0.597;F=1.264,P=0.309)。术后28 d,经F检验,大鼠运动距离组间差异有统计学意义(F=3.279,P=0.038),站立次数组间差异无统计学意义(F=2.099,P=0.127)。与假手术组相比,模型组及抑郁组运动距离明显下降(P<0.05),手术组有下降趋势,差异无统计学意义(P<0.05);模型组站立次数明显下降(P<0.05),抑郁组和模型组有下降趋势,差异无统计学意义(P>0.05),详见表3。
2.4 脑血流量
LBCCA手术大鼠,在术后大脑血流量显著下降;而假手术组大鼠,术前术后脑血流量无明显差异。从脑血流量改变说明LBCCA手术造模成功(图1)。
左、右脑脑血流量经F检验,组间差异有统计学意义(F=5.563,P=0.005;F=5.140,P=0.007)与假手术组相比,手术组及模型组大鼠脑血流量明显降低(P<0.01),抑郁组有下降趋势,差异无统计学意义;与模型组相比,抑郁组大鼠脑血流量明显增加 (P<0.05),手术组差异无统计学意义,详见表4。

表3 旷场试验结果

图1 LBCCA与假手术大鼠手术前后脑血流监测图
A: cortical blood flow (CBF) before LBCCA in VD rats; B: CBF after LBCCA in VD rats; C: CBF before sham operation in VD rats; D: CBF after sham operation in VD rats;LBCCA: ligation of bilateral common carotid arteries; VD:vascular depression.
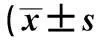
表4 脑血流量数据结果
**P<0.01vssham-operated group;ΔP<0.05vsmodel group; SM: sham-operated group; OP: operation group; DP: depression group; MD: model group; PU: perfusion unit.
2.5 MMPs蛋白表达及其mRNA表达
与假手术组相比,手术组、模型组 MMP-2表达水平显著增高(P<0.01),抑郁组差异无统计学意义 (P>0.05);与模型组相比,抑郁组MMP-2表达水平显著降低(P<0.01),手术组差异无统计学意义(P>0.05);与假手术组相比,手术组、模型组MMP-2 mRNA表达水平均有显著增高(P<0.05),抑郁组有增高趋势,差异无统计学意义(P>0.05),详见图2。
2.6BDNF及TrkB蛋白及其mRNA表达
与假手术组比较,模型组及抑郁组大鼠海马内BDNF及BDNF mRNA表达水平均明显降低(P<0.05或P<0.05),TrkB及TrkB mRNA表达水平均明显降低(P<0.01),手术组差异无统计学意义(P>0.05);与模型组相比,手术组大鼠海马内TrkB明显升高(P<0.05),TrkB mRNA表达水平明显升高(P<0.01),抑郁组差异无统计学意义(P>0.05)。详见图3。

图2 MMP-2蛋白及其mRNA表达
A: expression of MMP-2 protein; B: expression of MMP-2mRNA;*P<0.05,**P<0.01vssham-operated group;ΔP<0.05,ΔΔP<0.01vsmodel group; MMP:matrix metalloproteinases;SM: sham-operated group; OP: operation group; DP: depression group; MD: model group.
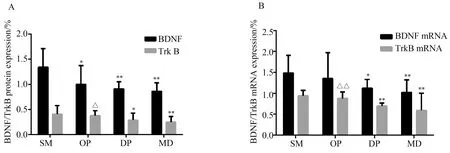
图3 BDNF/TrkB蛋白及其mRNA表达
A: expression of BDNF/TrkB protein; B: expression of BDNF/TrkBmRNA;*P<0.05,**P<0.01vssham-operated group;ΔP<0.05,ΔΔP<0.01vsmodel group; BDNF:brain-derived neurotrophic factor; TrkB:tropomyosin related kinase B; SM: sham-operated group;OP: operation group; DP: depression group; MD: model group.
3讨论
血管性抑郁症主要病理改变为脑白质损害[5],其发病机制可能与慢性缺血及应激引起神经血管单元失稳态及重构障碍相关,而应激抑郁状态与心脑血管疾病存在螺旋增长关系,互相致病,加快疾病发展。为了深入探究其发病机制,血管性抑郁动物模型的正确建立显得尤为重要。本课题组多年潜心致力于血管性抑郁症的研究,前期曾用维生素D3(vitamin D3, VD3)负荷量加高脂饲养叠加CUMS方法造模,较好地模拟了VD临床表现,但未从疾病的发病机制做进一步探究[6]。本实验主要基于慢性缺血应激造模,并从神经血管单元稳态失衡角度选取指标加以验证。
国内外使用的脑缺血动物模型有很多,常用的有大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型、双侧颈总动脉闭塞模型、双侧颈总动脉结扎模型(LBCCA)、去皮层血管脑缺血模型等[7-8]。其中LBCCA是该领域应用最广泛慢性缺血性脑白质损害动物模型,该模型操作简便,重复性好,成功率高。同时研究证明,LBCCA术后导致大脑慢性低灌注并会引起大鼠大脑内脑白质病变的发生[9-10]。早期使用的应激抑郁大鼠模型多使用强光刺激、强噪音及长时间行为限制等强刺激的方法建立,此类模型易引发动物的激越行为,不能全面模拟人类长期处于持续刺激生活中而诱发抑郁症的发病机制,慢性不可预见性温和刺激的造模方法是目前抑郁症抗抑郁药物治疗和生理病理机制研究最常使用的应激动物模型[11-13]。本次实验研究表明,LBCCA结合CUMS联合孤养的复合造模方法使模型大鼠在体质量、行为学、脑血流量等方面发生改变:(1)模型大鼠体质量减轻明显;(2)大鼠发生抑郁样行为学改变,反应表现为快感缺乏、运动能力和探索能力下降等,其中糖水偏嗜实验与大鼠快感有关,旷场实验中穿越格子数反应大鼠的活动度,站立次数反应大鼠对新鲜事物的好奇度和探索能力;(3)模型大鼠脑血流供应降低。从整体上看,该模型符合VD具有的慢性缺血病理和抑郁状态双重特点,与临床具有较高的相似度。
神经血管单元(NVU) 是美国国立神经病学与卒中研究所(National Institute of Neurological Disease and Stroke, NINDS)率先提出的治疗卒中的概念模型[14-18]。脑卒中后抑郁是脑卒中的重要合并症之一,发生率约为25%~80%,而脑卒中后抑郁属于VD范畴,因此VD的发病与神经血管单元失稳态密切相关。实验研究[17-19]发现MMP-2则在慢性脑缺血后7 d、14 d及60 d均有不同程度高表达, MMP-2在慢性缺血脑白质损害中对BBB破坏和胶质细胞激活起关键作用。本次实验结果显示血管性抑郁模型大鼠MMP-2表达水平显著增高(P<0.01),从慢性缺血角度验证了该模型的可行性。BDNF可由神经元及星形胶质细胞产生,其抗抑郁可能机制[20]:①促进海马神经元的神经发生;②对兴奋性氨基酸的清除;③对5-羟色胺能神经系统的激活作用及对神经元的保护作用,并可通过与其受体TrkB结合BDNF发挥抗抑郁的神经保护机制[21-23]。实验及相关临床研究发现抑郁症患者或抑郁大鼠海马及前额叶皮质部位BDNF水平明显减少,给予抗抑郁药物治疗后,脑内BDNF表达增加[24-26]。本实验发现血管性抑郁模型大鼠海马区BDNF及TrkB显著降低,与之前研究结果一致。尽管有关BDNF抗抑郁机制尚存在争议,但结果可间接验证与血管性抑郁症的关系。
本实验旨在建立慢性低灌注脑缺血性抑郁模型(血管性抑郁模型),由于多普勒超声为有创操作,考虑到大鼠存活率的问题,未对实验大鼠造模前后脑血流量进行监测,在今后的研究中将进一步完善;同时,在验证发病机制上选取指标主要与脑缺血损伤和神经元修复有关,还应结合与情感神经递质如单胺类递质水平及其受体表达、情感神经环路、神经免疫内分泌等相关指标进行综合评价,将更加全面反映该模型的客观性及其科学应用价值。
4参考文献
[1] Alexopoulos G S. Vascular depression hypothesis [J]. Arch Gen Psychiat, 1997, 54(10): 915.
[2] Willner P. Animal models of depression: an overview [J]. Pharmacol Ther, 1990, 45(3): 425-455.
[3] 李晓秋,许晶. 抑郁动物模型的研究进展[J]. 中华精神科杂志,2002, 35(3): 184-185.
[4] 王彦云,郑军,李多娇,等. 开心解郁汤对血管性抑郁大鼠行为的影响[J]. 北京中医药大学学报, 2010, 33(2): 98-102.
[5] 黄世敬,王彦云,陈宇霞. 血管性抑郁与脑白质损害[J]. 国际精神病学杂志,2009, 36(1): 20-23.
[6] 潘菊华,王彦云,黄世敬,等. 血管性抑郁大鼠模型的建立[J]. 首都医科大学学报,2007, 28(6): 760-762.
[7] Gaur V, Kumar A. Behavioral, biochemical and cellular correlates in the protective effect of sertraline against transient global ischemia induced behavioral despair: possible involvement of nitric oxide-cyclic guanosine monophosphate study pathway [J]. Brain Res Bull, 2010, 82(1-2): 57-64.
[8] 唐启盛,裴清华,侯秀娟,等. 脑卒中后抑郁状态动物模型的建立[J]. 北京中医药大学学报,2004, 27(3): 33-36.
[9] Farkas E, Luiten P G, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion-related neurodegenerative diseases [J]. Brain Res Rev, 2007, 54(1): 162-180.
[10] Watanabe T, Zhang N, Liu M, et al. Cilostazol protects against brain white matter damage and cognitive impairment in a rat model of chronic cerebral hypoperfusion [J]. Stroke, 2006, 37(6): 1539-1545.
[11] Herken H, Gurel A, Selek S, et al. Adenosine deaminase, nitric oxide, superoxide dismutase, and xanthine oxidase in patients with major depression: impact of antidepressant treatment [J]. Arch Med Res, 2007, 38(2): 247-252.
[12] Vry J D, Schreiber R. The chronic mild stress depression model: future developments from a drug discovery perspective [J]. Psychopharmacology, 1997, 134(4):349-350.
[13] Reines A, Cereseto M, Ferrero A, et al. Maintenance treatment with fluoxetine is necessary to sustain normal levels of synaptic markers in an experimental model of depression: correlation with behavioral response [J]. Neuropsychopharmacology, 2008, 33(8): 1896-1908.
[14] Gregory J.Stroke and neurovascular protection [J]. N Engl J Med, 2006, 354(6): 553-555.
[15] Lo E H. Experimental models, neurovascular mechanisms and translational issues in stroke research [J]. Br J Pharmacol, 2008, 153(S1): S396-S405.
[16] Green A R. Pharmacological approaches to acute ischaemic stoke: reperfusion certainly, neuroprotection possibly [J]. Br J Pharmacol, 2008, 153 (S1): S325-S338.
[17] 毛玲,查运红,黄敬,等. 慢性全脑低灌注大鼠血脑屏障的改变及MMP-9表达的实验研究[J]. 卒中与神经疾病, 2007, 14(1): 32-36.
[18] 魏微. 慢性低灌注大鼠神经血管单元与淀粉样物质的关系及丁苯酞的神经保护的研究[D].重庆: 第三军医大学, 2012.
[19] Nakaji K, Ihara M, Takahashi C, et al. Matrix metalloproteinase-2 plays a critical role in the pathogenesis of white matter lesions after chronic cerebral hypoperfusion in rodents [J]. Stroke, 2006, 37(11): 2816-2823.
[20] 董爱国,赵丽丽,李海红. BDNF在抑郁症发病机制中的作用及其抗抑郁作用机制的研究进展[J]. 中国医疗前
沿, 2011, 6(6): 16-18, 87.
[21] 李欣,李海红,方泽漫,等.白介素-1β对原代培养海马神经元毒性的研究[J]. 中华行为医学和脑科学杂志, 2009, 18(12): 1061-1063.
[22] Taliaz D, Stall N. Knockdown of brain-derived neurotrophic factor in specific brain sites precipitates behaviors associated with depression and reduces neurogenesis [J]. Mol Psychiat, 2010, 15(1): 80-92.
[23] Taliaz D, Stall N, Dar D E, et al. BDNF in schizophrenia, depression and corresponding animal models [J]. Mol Psychiat, 2005, 10(4): 345-352.
[24] 梅利平, 刘宏军,方向华,等. 北京社区缺血性卒中后抑郁与卒中再发和死亡关系的研究[J]. 中国脑血管病杂志,2013,10(5) :239-244.
[25] 康笑,隋汝波,张磊,等. 小脑-下丘脑通路在卒中后抑郁发病机制中的作用[J]. 中国医科大学学报,2015,44(5) :389-394.
[26] 王雨. 血清皮质醇水平与脑卒中后抑郁的相关性及其对治疗的指导意义[J]. 解放军医药杂志, 2015,27(11) :85-88.
编辑慕萌
Construction of vascular depression animal model based on chronic ischemic and stress
Tan Sai, Lei Xiaoming, Wang Yanyun, Pan Juhua, Zhang Ying, Huang Shijing*, Zhang Yongchao, Zheng Jun, Chen Zhao, Chen Yuxia, Li Duojiao
(TraditionalChineseDrugResearchandDevelopmentCenter,GuanganmenHospital,AcademyofChineseMedicalSciences,Beijing100053,China)
【Abstract】Objective To build the ideal animal model for depression. MethodsForty SD rats were divided randomly into 4 groups: ①sham-operated group; ②operation group: bilateral common carotid artery ligation (LBCCA); ③depression group: chronic unpredictable mild stress (CUMS) combining with solitary, with no surgery; ④model group: LBCCA +CUMS and solitary. We observe animals continuously for 21 days to detect the variation of weight, behavioristics, cerebral blood flow and expression level of matrix metalloproteinases (MMPs), brain-derived neurotrophic factor (BDNF)/tropomyosin related kinase B (TrkB) and MMPs mRNA, BDNF/TrkB mRNA. ResultsCompared with the sham-operated group, model group rats and depression group rats were significantly decreased (P<0.05 or P<0.01) in weight, sucrose consumption, movement distance and the number of rearing in open-field test; the blood flow of rats of operation group and model group were significantly decreased (P<0.01); the expression level of MMP-2 and MMPs mRNA in model group and operation group were increased markedly (P<0.01), the expression level of BDNF/TrkB and BDNF/TrkB mRNA in model group and depression group were decreased significantly (P<0.01). ConclusionThe method of LBCCA superposition CUMS combined with solitary simulate well the core symptoms of depression (lack of sensation, decline of movement and exploration) and the pathomechanism of unbalance of nerve vascular unit. It’s an ideal model for vascular depression, and it can be used in the study of pharmacological experiment and the mechanism of curative effect.
【Key words】vascular depression(VD); animal model; neurovascular unit; matrix metalloproteinases (MMPs); brain-derived neurotrophic factor (BDNF); tropomyosin related kinase B (TrkB)
(收稿日期:2015-01-05)
【中图分类号】R 743.31
[doi:10.3969/j.issn.1006-7795.2016.02.017]
*Corresponding author, E-mail:gamhsj@126.com
基金项目:国家自然科学基金(81072801),北京市科技计划项目(Z141100002214014),中央级公益性科研院所基本科研业务费专项资金项目(ZZ0708076)。This study was supported by National Natural Science Foundation of China (81072801), Beijing Municipal Science and Technology Plan Projects(Z141100002214014), Special Funds for Scientific Research of Basic Business Expenses Projects of Central Public Welfare Scientific Research (ZZ0708076).
网络出版时间:2016-04-1221∶14网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160412.2114.048.html
· 基础研究 ·
