三江平原棘跳对环境温度的响应研究
2016-05-28王雪峰高梅香吴东辉
刘 晶,王雪峰,常 亮,高梅香,3,4,孙 新,吴东辉
(1.中国科学院 东北地理与农业生态研究所 湿地生态与环境重点实验室,吉林 长春130102;2. 中国科学院大学,北京100049;3. 哈尔滨师范大学 地理科学学院,黑龙江 哈尔滨150025;4. 黑龙江省普通高等学校 地理环境遥感监测重点实验室,黑龙江 哈尔滨 150025)
三江平原棘跳对环境温度的响应研究
刘晶1,2,王雪峰1,常亮1,高梅香1,3,4,孙新1,吴东辉1
(1.中国科学院 东北地理与农业生态研究所 湿地生态与环境重点实验室,吉林 长春130102;2. 中国科学院大学,北京100049;3. 哈尔滨师范大学 地理科学学院,黑龙江 哈尔滨150025;4. 黑龙江省普通高等学校 地理环境遥感监测重点实验室,黑龙江 哈尔滨 150025)
摘要:土壤跳虫是土壤中重要的无脊椎动物类群之一,对其种群生存策略的认识有利于理解陆地生态系统的演替过程及区域生物多样性维持机制。温度适应是跳虫重要的生存策略之一。在对三江平原野外土壤动物群落调查过程中,发现真土生棘跳(Protaphorura bicampata(Gisin,1956))是农田及湿地中的重要种群之一,具有区域代表性。文章研究了该种棘跳在不同温度下的生长及发育情况,从其最适生长、发育温度的角度探讨三江平原温度对区域生物多样性维持及土壤动物群落形成的影响机制。结果显示,棘跳的最适生长及繁殖温度均在20℃以上,低于15℃其发育停滞、繁殖终止。研究结果说明,相对极地或高纬度及三江平原的抗低温土壤跳虫(可在-30℃下存活)而言,研究对象—棘跳并非代表性的冬季活跃的跳虫种类,其区域优势地位的建立是夏季生存竞争的结果。推测其对冬季低温的抵抗主要得益于冬眠,垂直迁移可能是其越冬的行为基础。图3,参24。
关键词:土壤跳虫; 低温适应; 最适温度; 湿地生态系统
0引言
跳虫(Springtails)是弹尾纲动物(Collembola)的俗称,因其腹部第4节腹面生有能用于弹跳的器官而得名,隶属于节肢动物门(Arthropoda),是土壤中一类重要的中小型无脊椎动物[1],也是土壤动物多样性的最重要组成部分之一。跳虫与其生存环境密切相关,对土壤环境污染及农业森林资源利用方式和生态系统健康程度具有指示作用[2-4]。跳虫是生态系统食物链的重要成分之一[5-6],是土壤生态系统重要的分解者,例如有些种类能够调节土壤真菌的生长发育[7-9],因而跳虫能够加速土壤营养成分的循环和利用[10-11],对土壤生态过程具有重要的调节作用。目前关于跳虫的研究较多的集中于森林、草原等的生态系统,实际上湿地同样存在较高的跳虫多样性[12-14]。跳虫生存于湿地土壤、水体表面及植株表面,是湿地生态系统的重要组成部分,然而关于湿地及其相关生态系统跳虫的生理习性和生态系统等研究略显不足。
目前,三江平原湿地农田化面积正逐年增加,湿地农田化对土壤跳虫多样性及群落组成影响很大。野外实验研究显示,湿地农田化后,部分湿地特有种类消失,而若干土壤普适性种类却呈爆发的趋势,如一些棘跳[15]。随着区域经济发展速度的不断加快以及全球变化的影响不断加深,三江平原土壤跳虫对农田环境和湿地环境的适应均面临严峻的挑战,除了要面对季节性大面积的水文波动以及农药和化肥外,跳虫还要对抗冬季低温的伤害。研究区域上这些优势及代表性的土壤跳虫如何适应冬季低温并维持种群存在,有助于理解三江平原农田和湿地中中小型土壤动物生物多样性维持和群落的形成机制,并为未来全球变暖下预测区域生物多样性的变化提供支持。
1实验材料与方法
1.1材料获取
研究所用棘跳来源于中国科学院东北地理与农业生态研究所三江平原湿地生态试验站(133°31′E,47°35′N)农田(农作物为大豆)土壤及凋落物层中。标本来源区域为季节性冻土区域,年平均空气温度1.9℃,一月平均气温为-21℃,七月平均气温为20℃,二月10 cm深度土壤平均温度为-3.4℃,见图1。采集农田试验站大豆田地面以下5 cm土壤样品及地表凋落物。将采集的土壤及凋落物转移入实验室,利用Tullgren漏斗法结合培养基接取及水淹分离法从土壤及凋落物中分离活体棘跳。将分离出的标本置于石膏活性炭培养基中(石膏∶活性炭=9∶3)放置于20℃培养箱中培养、备用。每日滴入培养基2~3滴蒸馏水保持培养基湿润,喂食跳虫新鲜干酵母。
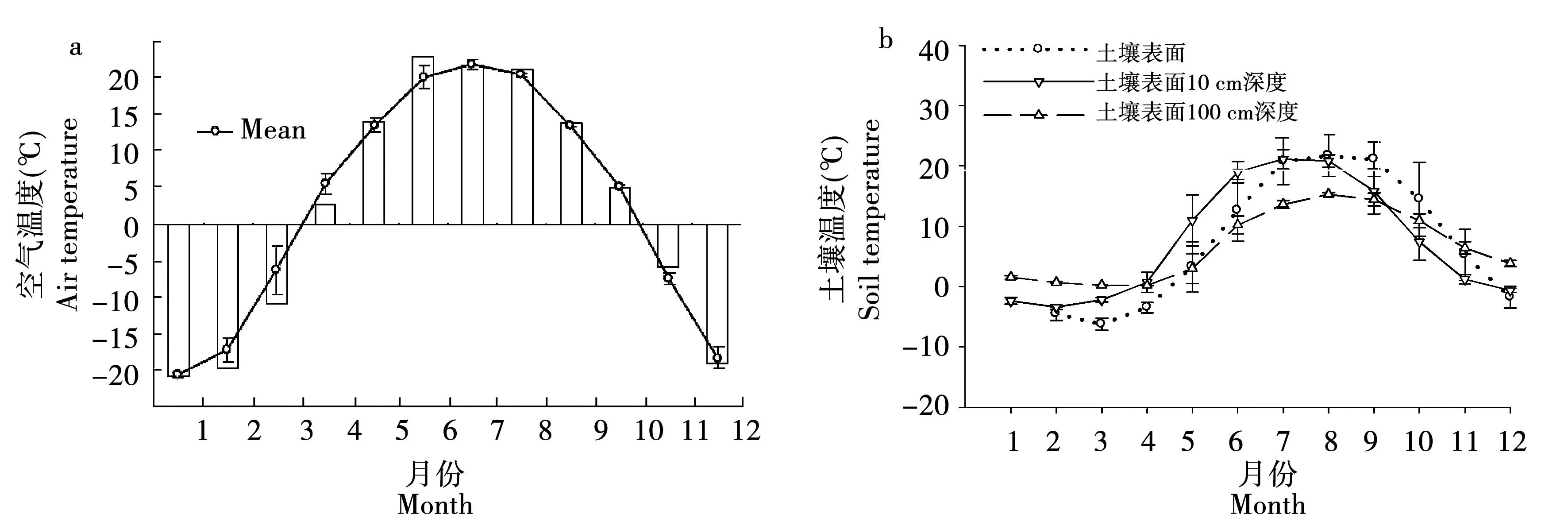
图1 三江平原湿地环境温度曲线Fig.1 Curve of temperature of Sanjiang wetland in 2010注:a:空气温度[16];b:土壤温度,数据来源于三江平原生态试验站野外监测。Note:a:air temperature[16]; b: soil temperature. Data is from field monitoring of Sanjiang wetland.
1.2实验设计
1.2.1棘跳最适生长温度研究。将野外采集分离的棘跳置于培养基中培养,待跳虫产卵后进行同步化处理,将3天之内孵化的幼虫转移至实验处理的培养基中。分别设置15℃、20℃和25℃三个培养温度,每一培养皿中放入10只刚孵化的跳虫,每一温度设置3个重复。使用Nikon SMZ800 显微镜并配合Nikon Digital Sight Ds-Fil相机拍摄每只棘跳个体的生长情况,并每两天记录一次棘跳的体长数据。体长的测量以及数据的分析均利用尼康图像摄影软件Nikon-NIS-Elements来完成。
1.2.2棘跳繁殖的最适温度。基于前述实验的设置,将每一处理中跳虫所产的卵转移至新的培养皿中,同样设置15℃、20℃和25℃三个培养温度梯度。观察培养基中卵的孵化情况,记录每一培养基中卵孵化的数量,计算跳虫种群的产卵率及卵的孵化率。
2结果
2.1棘跳最适生长温度
在15℃~20℃温度范围内,棘跳的生长随温度的升高而加快,并随着培养时间的推移,各温度下土壤体长的差距越明显,见图2。28天以内,棘跳的生长发育速度随时间的增加有逐渐增强的趋势,但总体而言,体长与时间成正相关。25℃与20℃的发育速度相当,而15℃温度下培养的跳虫体长明显低于20℃和25℃时的温度(p<0.05)。20℃与25℃是棘跳生长发育的最适温度,温度低至15℃抑制了棘跳个体的生长。
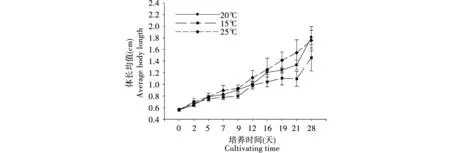
图2 不同温度下棘跳体长数据Fig.2 Curve of body length of P.bicampata(Gisin,1956) under different temperature
2.2棘跳繁殖的最适温度
棘跳生长发育周期的实验监测时间为90天。实验周期内15℃培养条件下未检测到棘跳产卵。20℃时,棘跳在培养35天后开始产卵,成熟周期明显缩短。而25℃时,其成熟周期缩短至28天。不同的培养温度对跳虫产卵周期产生了明显的影响。同时,对比20℃和25℃培养条件下跳虫的产卵率,25℃培养明显高于20℃培养时的产卵率,见图3A。然而,20℃培养处理中卵的孵化率没有显著差异,见图3B。

图3 培养于20℃和25℃温度中的棘跳产卵率(A)及卵的孵化率(B)(r-ANOVA,p<0.05)Fig.3 Spawning rate(A)and hatching rate(B) of P.bicampata(Gisin,1956) temperature 20℃ and 25℃Bars marked with a,b showed the significant difference(r-ANOVA,p<0.05).
3讨论
3.1棘跳对生境温度的适应性
跳虫的生长发育、繁殖受温度的调控。但不同的种类受温度的影响不同。热带本地物种,如Willowsiajacobsoni(Börner)的最适的胚胎发育温度能够达到33℃[17]。温带地区的物种,如Paronychiuruskimi虫体的最适生长温度为25℃[18],而极地种类Hypogastruratullbergi则为21℃[19]。不同种类胚胎发育的温度阈值也不尽相同,W.jacobsoni(Börner)在13℃和40℃时,胚胎发育均停止,而H.tullbergi的胚胎发育阈值能够达到-1.3℃。虽然,未作温度阈值的检测实验,但棘跳的发育实验结果显示,15℃ ~ 25℃范围内,其最适生长、发育温度为25℃,见图2和图3。结合文章得出的结果,根据Won Il Choi对朝鲜种类P.kimi生物学描述,我们推测,三江地区的优势棘跳与P.kimi有相似的生物学特征,其最适生长温度为25℃。受温带大陆性季风气候影响,三江平原每年经历大幅度的温度波动,跳虫的发育生物学说明,三江平原的优势类群棘跳更适应生境夏季的温度特点,充分利用了夏季的食物、水分等有利的环境因子确立其优势地位。
3.2棘跳的越冬方式推测
南极地区存在的跳虫种类能够耐受极度低温的胁迫,可抵抗-60℃~-50℃的环境低温,土壤螨类甚至能够在-30℃下活动、繁殖[20]。三江平原同样存在耐低温种类跳虫,如雪地跳虫(Desoriasp.),它们能够在-5℃~5℃下活动,10℃便开始繁殖。但文章采用的棘跳的发育及繁殖实验显示,在温度低于15℃时其生长发育滞后、繁殖中止,见图2。可见,三江平原的该种跳虫并未进化出极强的抗低温能力,仍为不耐低温种类。虽然没有冬季低温发育的数据支持,不能排除棘跳具有耐结冰(Freezing tolerance)或避免结冰(Freezing avoidance)等抵抗低温的生理特征[21]。棘跳的最适生长及产卵温度为25℃,而卵的孵化率于20℃达到最大,说明,在冬季到来前跳虫类群已经完成繁殖过程,低于15℃的土壤中此种类的卵的存在数量相对较低。冬季低温极其不适宜跳虫的生活,卵的孵化温度说明此种类的越冬方式主要以成体越冬为主,可能经历冬眠[22]。
垂直迁移行为是跳虫适应低温环境的主要策略之一[23-24]。深层土壤环境对温度波动具有一定的缓冲能力,跳虫利用垂直迁移更有利于顺利度过寒冷的冬季,见图1b。但真土生种类通常进化出极强的耐低氧能力,而垂直迁移可使如棘跳这样的真土生种类获得深层土壤的保护而不会受到低氧的伤害。而表土生种类受到氧需求的限制,无法在较深层土壤中躲避冬季低温的伤害,这也可能是棘跳在三江平原成为优势类群的原因之一。
4结论
三江平原农田土壤中的真土生棘跳生长发育繁殖的最适温度结果显示,优势种类棘跳的生长发育繁殖受土壤温度的调控,当温度低至15℃时,其生长速度明显降低,产卵能力受到抑制。而三江平原地区受温带湿润、半湿润大陆性季风气候影响冬季寒冷干燥,月平均气温可达-20℃左右,即使在土壤的缓冲作用下,冬季10 cm层深度农田土壤温度也能够达到-5℃~8℃。由此可见,冬季低温是棘跳种群冬季越冬的主要温度障碍。根据发育结果我们推测此跳虫的越冬方式主要通过成体越冬,可能通过冬眠及垂直迁移。冬季向深层土壤的迁移行为显示了棘跳做为真土生无脊椎动物较强的耐低氧能力,是有利的生理适应性特征之一。
参考文献:
[1]尹文英等. 中国亚热带土壤动物[M]. 北京:科学出版社,1994.
[2]Blakely J K,Neher D A,Spongberg A L. Soil invertebrate and microbial communities,and decomposition as indicators of polycyclic aromatic hydrocarbon contamination[J]. Applied Soil Ecology,2002,21(1): 71-88.
[3]Cassagnea N,Gauquelinb T,BalSerinc M C,et al. Endemic Collembola,privileged bioindicators of forest management[J]. Pedobiologia,2006,50(2): 127-134.
[4]Bourne M,Nicotra A B,Colloff M J,et al. Collembola as alternative prey sustaining spiders in arable ecosystems: Prey detection within predators using molecular markers[J]. Molecular Ecology,2003,12: 3467-3475.
[5]Bilde T,Axelsen J A,Toft S. The value of Collembola from agricultural soils as food for a generalist predator[J]. Journal of Applied Ecology 2000,37(4): 672-683.
[6]Chernova N M,Bokova A I,Varshav E V,et al. Zoophagy in Collembola[J]. Entomological Review,2007,87(7): 799-811.
[7]Bengtsson G,Hedlund K,Rundgren S. Patchiness and compensatory growth in a fungus-Collembola system[J]. Oecologia,1993,93(2):296-302.
[8]Becker J,Makus P,Schrader S. Interactions between soil micro- and mesofauna and plants in an ecofarming system[J]. European Journal of Soil Biololy,2001,37(4): 245-249.
[9]Bretherton S,Tordoff G M,Jones T HJ ,et al. Compensatory growth of Phanerochaete velutina mycelial systems grazed byFolsomiacandida(Collembola)[J]. FEMS Microbiololy Ecololy,2006,58(1): 33-40.
[10]Butterfield J. Changes in decomposition rates and Collembola densities during the forestry cycle in conifer plantations[J]. Journal of Applied Ecology,1999,36(1): 92-100.
[11]Bourne M,Nicotra A B,Colloff M J,et al. Effect of soil biota on growth and allocation byEucalyptusmicrocarpa[J]. Plant and Soil,2007,305(1): 145-156.
[12]Deharveng L,D′Haese C A,Bedos A. Global diversity of springtails (Collembola; Hexapoda)in freshwater[J]. Hydrobiologia,2007,595(1): 329-338.
[13]Ramel G,Baquero E,Jordana R. Biodiversity of the Collembola Fauna of Wetland Kerkini(N. Greece),with description of the sexual dimorphism ofEntomobryaatrocinctaSchött 1896 (Collembola: Entomobryomorpha)[J]. Annales- Societe Entomologique de France,2008,44(1):113-128.
[14]Shaw P,Dunscombe M,Robertson A. Collembola in the hyporheos of a karstic river an overlooked habitat for collembola containing a new genus for the UK[J]. Soil Organisms,2011,83(3): 507-514.
[15]窦永静. 三江平原湿地双向演替过程中土壤跳虫群落及多样性的研究[D]. 长春: 中国科学院东北地理与农业生态研究所,2015.
[16]Wu H T,Lu X G,Wu D H,et al. Ant mounds alter spatial and temporal patterns of CO2,CH4and N2O emissions from a marsh soil[J]. Soil Biology and Biochemistry. 2013,57: 884-891.
[17]MariMutt J A,Reyes Almodovar R G,Diez I R,et al. Effects of temperature on the embryonic development ofWillowsiajacobsoni(börner) (Collembola: Entomobryidae)[J]. Caribbean Journal of Sciences,1984,20(1-2): 57-65.
[18]Choi W,Ryoo M,Kim J G. Biology ofParonychiuruskimi(Collembola:Onychiuridae) under the influence of temperature,humidity and nutrition[J]. Pedobiologia,2002,46(6): 548-557.
[19]Birkemoe T,Leinaas H P. Effects of temperature on the development of an arctic Collembola(Hypogastruratullbergi)[J]. Functional Ecology,2000,14(6): 693-700.
[20]Block W. Low temperature effects on Micro-Arthropods[J]. Journal of Thermal Biology,1981,6(4): 215-218.
[21]Hawes T C,Bale J S. Plasticity in arthropodcryotypes[J]. The Journal of Experimental Biology,2007,210(15): 2585-2592.
[22]Block W,Zettel J. Activity and dormancy in relation to body water and cold tolerance in a winter-active springtail (collembola)[J]. European Journal of Entomology,2003,100(3): 305-312.
[23]Leinaas H P. Activity of Arthropoda in snow within a coniferous forest,with special reference to collembolan[J]. Ecography,1981,4(2): 127-138.
[24]刘晶,王云彪,吴东辉.土壤跳虫适应低温环境的策略与机制研究进展[J].应用生态学报.2012,23(12): 3526-3532.
Temperature Response of Local Soil SpringtailProtaphorurabicampata(Gisin,1956) (Collembola:Onychiuridae) in Sanjiang Plain
LIU Jing1,2,WANG Xuefeng1,CHANG Liang1,GAO Meixiang1,3,4,SUN Xin1,WU Donghui1
(1.KeyLaboratoryofWetlandEcologyandEnvironment,NortheastInstituteofGeogrophyandAgroecology,CAS,Changchun130102,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China;3.CollegeofGeographicalSciences,HarbinNormalUniversity,Harbin150025,China; 4.KeyLaboratoryofRemoteSensingMonitoringofGeographicEnvironment,CollegeofHeilongjiangProvince,HarbinNormalUniversity,Harbin150025,China)
Abstract:Soil Collembola is one of vital meso-faunal invertebrates in soil ecosystem and most important compartment of soil biodiversity. The knowledge of survival strategy of Collembola is helpful for understanding the transforming procession of terrestrial ecosystem and mechanism of regional maintaining of biological diversity. Low temperature adaptation is one of the important issues of survival strategy of Collembola in wetland of Sanjiang Area,Northeast China. The soil fauna investigated in Sanjiang Plain showed that the species Protaphorura bicampata(Gisin,1956) was the dominant Collembola population in the cultivated field and the wetland of Sanjiang Plain. The results showed that the most favorable temperature for growing and eggs hatching rate of P.bicampata(Gisin,1956) was 25℃,but the optimal breeding temperature was 20℃. When temperature was below 15℃,the growing slowed down and breeding stopped. The results illustrated that the dominant Collembola,P.bicampata(Gisin,1956) was not an extreme winter active species compared to some Antarctic collembola species which can live even below -30℃.P.bicampata(Gisin,1956) might overwinter via eggs but not adults and the main survival strategy might be dormancy or vertical migration. As a behavior adaptation,vertical migration might be fundamental for over-wintering.
Key words:soil springtail; low temperature adaptive; optimum temperature; wetland ecosystem
中图分类号:S154
文献标识码:A
第一作者简介:刘晶(1983-),女,吉林永吉人,在读博士,研究方向为土壤生物多样性.通讯作者:吴东辉(1971-),男,黑龙江望奎人,研究员,研究方向为土壤生物多样性.
基金项目:国家自然科学基金(31370532,41430857,41201245,41471037).
收稿日期:2016-01-24;修回日期:2016-02-25.
文章编号:2095-2961(2016)02 -0110-05
doi:10.11689/j.issn.2095-2961.2016.02.007
