高考复习中结构不良氧化还原反应方程式书写的策略探讨
2016-05-14陶杰李远蓉
陶杰 李远蓉
摘要:在分析结构不良氧化还原反应方程式书写障碍的基础上,运用分解策略将结构不良氧化还原反应方程式分为两个“电极反应”,分别配平后根据得失电子守恒将两个“半反应”合起来得到完整的反应方程式。将电子守恒的配平放在最后一步,克服了“化合价升降法”的缺点,也为氧化还原反应与电化学的融合复习提供借鉴。
关键词:学习情景;探究式学习;原则;方法
文章编号:1008-0546(2016)06-0011-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.06.003
Reitman(1965)首次从认知心理学的角度区分了结构良好问题和结构不良问题,前者是初始状态、目标状态和算子都很明确的问题,而后者则是上述三者至少有一个没有明确界定的问题[1]。学生在化学课堂上遇到的常常是具有预设性的结构良好问题,而现实生活中客观存在的却大多是结构不良问题。这种由模拟与实际之间的差异性铸成的壁垒阻碍了学生知识与能力之间的相互转化,将学生的课堂知识与实际生活无形地割裂开来。可喜的是随着课改的深入,结构不良问题在化学教学中得到了应有的重视,最直接的体现就是高考化学越来越趋向于对结构不良问题解决能力的考查。氧化还原反应属于高中化学重要的知识,其与生活实际的密切联系为其以结构不良问题的形式出现于高考信息题中奠定了基础,这对学生知识与能力间的转换机制提出了新挑战。
一、 结构不良氧化还原反应方程式书写的障碍分析
结构不良氧化还原反应方程式的书写应遵循结构不良问题的解决过程,即问题框架表征、问题解决、监控与评价等,该过程涉及到认知、元认知、非认知变量、辩护能力等成分。基于题目线索,学生对问题框架的表征和监控评价通常不存在缺失,但在问题解决阶段存在着不同程度的障碍,仔细分析学生的错误,将障碍确定为如下几点:
1. 出现子问题再表征障碍,反应物或产物判断不全
在对问题框架进行表征及确定问题空间之后,需根据元素守恒、电荷守恒、质量守恒等原则初步判断出氧化还原反应的反应物和产物。但由于一些反应物或产物(通常为H2O、OH-、H+、O2等)具有模糊性而使学生出现子问题的再表征障碍。而运用氧化还原反应理论对所给的信息进行精细加工是障碍突破成为可能的必要条件之一。遗憾的是受认知成分中氧化还原反应具体知识结构化程度较低等因素的影响,学生无法通过类比已有的结构良好问题解决图式对子问题信息进行精细加工,从而无法生成解决结构不良问题的新图式,最终表现为由于反应物或产物判断不全而无法书写方程式。
例如,(2013重庆,11) 化学在环境保护中有着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
②上述反应离子方程式为 。
本问题只给出了主要反应物和产物,属于典型的结构不良问题。学生对本问题框架的表征较为顺畅,根据信息和元素守恒也较容易写出主要反应物和产物,得出离子方程式基本框架:H2+NO3-—N2+OH-,但学生根据化合价升降等常规配平方法进行配平时发现无法配平,使得本题无法解答,原因在于从表面上看,该框架中反应物与产物元素已经守恒,无法再表征出隐含的产物H2O。
2. 知识结构较零散,容易忽视溶液环境对反应的影响
对于水溶液体系中的氧化还原反应而言,溶液环境对其影响可谓是首当其冲的。但在解决结构不良氧化还原反应问题时,学生容易顾此失彼,忽视溶液环境对氧化还原反应的影响,从而导致出错。这也许与平时教学中教师忽视分析环境对物质化学性质也有较大的影响有关。
例如,1.1例子中学生发现无法配平之后,开始寻求另一做法,将离子反应基本框架改为H2+H++NO3- —N2+H2O,配平后将离子方程式确定为:2H2+2H++ 2NO3-N2↑+3H2O,由于学生知识结构呈现出零散状态,只能以能否配平作为衡量方程式书写正确与否的标准,从而忽视本题溶液体系为中性,没有可直接参与反应的游离H+,导致本问题无法正确解决。
3. 对氧化还原反应理论的认知水平较低,无法配平方程式
研究发现只有当学生氧化还原反应理论达到理解和应用水平时,才能促进其对复杂化学方程式的学习[2]。结构不良氧化还原反应方程式属于“三重表征”中的符号表征,其书写理应建立在对氧化还原反应客观事实(宏观表征)和微观过程(微观表征)的本质学习基础之上。然而学生由于对氧化还原反应理论的认知水平较低,不能促进其对结构不良反应方程式的学习,进而不能将结构不良氧化还原反应方程式与其对应的微观过程和现象联系起来,最终无法配平系数较大的方程式。
二、分解策略在结构不良氧化还原反应方程式书写中的运用
认知灵活理论将学习划分为初级学习和高级学习,前者针对的是结构良好领域的知识,后者针对结构不良知识[3]。高级学习需要高级思维的参与,分解策略在其中起着举足轻重的作用。原电池是根据氧化还原反应设计而成的装置,因此氧化还原反应方程式的书写可借鉴电极反应的书写方式。先根据元素守恒、电荷守恒、质量守恒将反应分为两个电极反应且配平后,再根据电子得失守恒,将电极反应合起来即得到总反应。下面结合例子谈谈如何运用分解策略将结构不良氧化还原反应分解为两个电极反应,最终合成完整方程式。
1. 酸性环境中
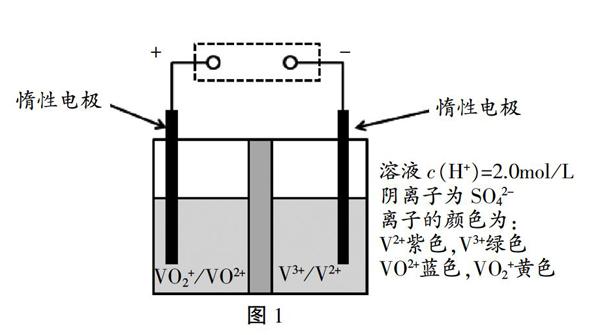
例1.(2010重庆高考)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图1所示。
当左槽溶液逐渐由黄变蓝时,其电极反应式为
。
分析:该问题只给出了主要反应物和生成物,属于常见的结构不良问题。
典型的解法 [4]是先将反应方程式框架确定为:VO2+-VO2+,再分析出V元素化合价由+5价变为+4价,得到1个电子,在反应式的左边加上1个电子得:VO2++e—VO2+。常规的电极反应多属于“化合物或单质生成离子”型,所以到这一步后,只要根据溶液的酸碱性在缺电子或多电子的一端补上OH-或H+以平衡电荷,最后根据元素守恒在另一端加上H2O来平衡之前加的H+或OH-即可(氧元素会由于H2O的加入而自动平衡)。但本题属于“离子生成离子”型,学生按这种方法写出VO2++e—VO2+后,会由于电荷已经守恒而无法进行“加H+或OH-来平衡电荷”这一步,导致学生思维混乱。即使学生识别出需要在右边加一个H2O来平衡氧元素,但由于同时右边会多出2个H元素,需要再重新配平,过程较为复杂,不利于问题的解决。
策略:
第1步,写出反应式主要框架,配平所有除氧、氢元素以外的其他元素:
VO2+—VO2+
第2步,无论酸性还是碱性环境都在少氧的一端加H2O去平衡,得:
VO2+—VO2+ + H2O
第3步,由于H2O的加入使得左边少2个H元素,且溶液为酸性环境,有可参加反应的游离H+,因此只需在左端加2个H+去平衡便可,得:
2H++VO2+—VO2++H2O
第4步,根据电荷守恒在左边加上2个电子即可:2H++VO2++eVO2++H2O
第5步,根据元素守恒进行检验。
例2.(2013苏北三市(徐州、淮安、宿迁)调研,18(2))已知:黄铁矿(FeS2)中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:
分析:本题依旧属于结构不良问题,通常学生的做法是根据信息及元素守恒确定出方程式基本框架:FeS2+ClO3-—SO42-+Fe3++ClO2,由于从元素守恒看生成物基本包含了反应物的所有元素,所以到此有学生就已经开始试着运用化合价升降法对反应框架进行配平。出现配平障碍后,学生考虑到溶液显酸性,可能H+也参与了反应,就把H+加在反应物一边,同时也在右边加上了H2O以平衡H元素,使得框架变成:H++ FeS2+ClO3-—SO42-+Fe3++ClO2+H2O。学生又开始用化合价升降法配平,但由于系数太大,耗时较久甚至无法得出答案。
策略:
第1步,将氧化反应和还原反应独立开来,把除氢、氧元素外的其他元素配平,得:
氧化反应:FeS2—2SO42-+Fe3+,
还原反应:ClO3-— ClO2。
第2步,在少氧的一端加H2O平衡,氧化反应的左端少了8个氧,加8个H2O;还原反应的右端少1个氧,加1个H2O,得:
氧化反应:FeS2+8H2O— 2SO42-+Fe3+,
还原反应:ClO3-—ClO2+H2O。
第3步,该反应处于酸性环境中,因此有可参与反应的游离H+。所以在氧化反应的右端加16个H+,还原反应左端加2个H+,得:
氧化反应:FeS2+8H2O—2SO42-+Fe3++16H+ ,
还原反应:2H++ClO3-—ClO2+H2O。
第4步,氧化反应右端缺了15个电子,加15个电子;还原反应右端缺了1个电子,加1个电子,得:
氧化反应:FeS2+8H2O—2SO42-+Fe3++16H++15e,
还原反应:2H++ClO3-+e —ClO2+H2O。
第5步,氧化、还原反应得失电子数目要相等,所以氧化反应乘以系数1,还原反应乘以系数15,得:
氧化反应:FeS2+8H2O—2SO42-+Fe3++16H++15e,
还原反应:30H++15ClO3-+15e —15ClO2+15H2O。
第6步,二者相加得到总反应方程式,将“同类项”合并,得:
FeS2+14H++15ClO3-2SO42-+Fe3++15ClO2↑+7H2O。
2.中性、碱性环境中
中性、碱性环境与酸性环境不同之处在于前两者只能靠H2O来提供反应所需的H+,而H2O是弱电解质,在离子反应中不可拆,这将会导致方程式附加上相应数目的OH-。为了平衡要在另一端加上多余的OH-;而中性与碱性环境不同点在于产物中若有H+生成,中性环境里H+可以游离地存在,而碱性环境中只能与OH-反应生成H2O。
例3.(2013重庆,11)化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
②上述反应离子方程式为 。
策略:
第1步,将氧化反应和还原反应独立开来,把除氢、氧元素外的其他元素配平,得:
氧化反应:H2 —, 还原反应:2NO3- —N2 。
第2步,氧化反应的右端少2个H原子,中性环境H+可以游离存在,所以右边加2个H+;还原反应右端少6个O原子,加6个H2O,得:
氧化反应:H2—2H+,
还原反应:2NO3-—N2+ 6H2O。
第3步,根据pH可得出,溶液起初为中性,因此还原反应左边少的12个H,只能由12个H2O提供,同时在右端加上多余的12个OH-,这刚好符合了溶液pH随着反应的进行而增加的事实,得:
氧化反应:H2—2H+,
还原反应:12H2O + 2NO3- —N2+6H2O+12OH- 。
第4步,氧化反应的右端加2个电子,还原反应的左端加10个电子,合并“同类项”,得:
氧化反应:H2—2H++2e,
还原反应:6H2O+2NO3-+ 10e —N2+12OH-。
第5步,根据得失电子守恒,氧化反应乘以系数5,得:
氧化反应:5H2—10H++10e ,
还原反应:6H2O+2NO3-+10e —N2+12OH-。
第6步,二者相加,消除电子,合并“同类项”得总反应(生成的H+要与生成的OH-结合),得:5H2+ 2NO3-N2+4H2O+2OH-。
例4.(2012新课标全国卷26 (4))FeCl3和 KClO 在强碱性条件下反应可制取 K2FeO4,其反应的离子方程式为 。
策略:
第1步,将氧化反应和还原反应独立开来,把除氢、氧元素外的其他元素配平,得:
氧化反应:Fe3+—FeO42- ,
还原反应:ClO- — Cl- 。
第2步,氧化反应右端加4个H2O平衡氧,还原反应的右端加1个H2O平衡氧,得:
氧化反应: 4H2O+Fe3+—FeO42-,
还原反应:ClO-— Cl-+ H2O。
第3步,氧化反应右边少了8个H+,若是中性、酸性环境,则生成8个H+即可,但碱性环境H+不能共存,应该结合OH-成为8个H2O,把附加的8个OH-补在左边,合并“同类项”;同理还原反应的左边加上2个H2O后,再在右边补上附加的2个OH-,得:
氧化反应:8OH-+Fe3+—FeO42-+4H2O,
还原反应:H2O+ClO-—Cl-+2OH-。
第4步,氧化反应右端加3个电子,还原反应左端加2个电子,得:
氧化反应:8OH-+Fe3++3e—FeO42-+4H2O,
还原反应:H2O+ClO-+2e—Cl-+2OH-。
第5步,电子得失守恒,氧化反应乘以系数2,还原反应乘以系数3,二式相加,合并“同类项”,得
10OH-+2Fe3++3ClO-2FeO42-+5H2O+3Cl-。
三、结语
学生对结构良好方程式的单纯记忆,并不能促进学生有效地生成解决结构不良氧化还原反应问题的图式,因为结构不良问题的解决需要学生高级思维的参与,需要学生有较高的氧化还原反应理论认知水平。在氧化还原反应理论与电化学严重分离的中学阶段,采用分解策略,灵活运用化学方程式书写的三原则将氧化还原反应方程式与电极反应式的书写结合起来,无疑是将知识抽象成氧化还原反应大概念或将氧化还原反应理论科学本质明细化的良方。
参考文献
[1] 李同吉,吴庆麟.论解决结构不良问题的能力及其培养[J]. 华东师范大学学报(教育科学版),2006,24(1):63
[2] 姬广敏,毕华林.高中生氧化还原反应理论认知水平对其化学方程式学习影响的研究[J].化学教育,2012,(12):35
[3] 宋婷.基于认知灵活理论的高中化学概念教学策略研究[D].重庆:西南大学,2014:7
[4] 经志俊.新课程实践中“氧化还原反应方程式配平”的教学策略[J].化学教学,2013,(4):39-41
