快速核酸提取环介导等温扩增检测技术在肺结核诊断中的应用评价
2016-05-12欧喜超夏辉李强逄宇赵冰张治英李俊晨赵雁林
欧喜超 夏辉 李强 逄宇 赵冰 张治英 李俊晨 赵雁林
·论著·
快速核酸提取环介导等温扩增检测技术在肺结核诊断中的应用评价
欧喜超 夏辉 李强 逄宇 赵冰 张治英 李俊晨 赵雁林
目的 评估快速核酸提取环介导等温扩增检测(PURE-LAMP)技术在肺结核临床诊断中的应用价值。方法 选取2012年4月至2013年1月在河南省新乡市结核病防治所和获嘉县疾病预防控制中心就诊的初诊肺结核可疑症状者作为研究对象,共1378例。每例患者留取3份痰标本,分别进行痰涂片镜检、固体培养和PURE-LAMP检测。以临床诊断结果为标准,比较痰涂片镜检、固体培养和PURE-LAMP法检测MTB的效能;以固体培养试验结果为标准,评估PURE-LAMP检测MTB的效能。结果 以临床诊断结果为标准,痰涂片镜检、固体培养和PURE-LAMP检测MTB的敏感度分别为23.40%(168/718)、58.91%(423/718)和49.44%(355/718)。PURE-LAMP检测敏感度高于痰涂片镜检(χ2=185.02,P=0.000),但低于固体培养试验(χ2=46.24,P=0.000)。以固体培养试验结果为标准,PURE-LAMP检测MTB的敏感度和特异度分别为90.24%(333/369)和96.86%(924/954),涂阴患者中检测敏感度和特异度分别为82.52%(170/206)和97.06%(924/952)。结论 PURE-LAMP检测操作简单,敏感度和特异度较高,在我国县(区)级结核病防治机构具有一定的应用前景。
分枝杆菌,结核; 核酸扩增技术; 诊断
传统的结核病实验室诊断方法中,涂片显微镜检查敏感度较低,虽然固体培养具有较高的敏感度,但是获得实验结果至少需要3~8周,耗时较长。随着分子生物学技术的发展,近年来涌现出许多可用于MTB快速诊断及鉴定的方法[1-2]。环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)在等温条件下可高效、快速、高特异地扩增靶核苷酸序列[3]。Iwamoto等[4]针对MTB的gyrB基因设计6条种属特异性引物,将LAMP技术应用到MTB复合群的检测。2010年,研发者通过对MTB核酸提取和LAMP检测技术进行优化设计,研制出MTB快速核酸提取环介导等温扩增检测试剂盒(PURE-LAMP),平均手工操作时间为40 min,接近于涂片镜检所需时间,通过使用封闭装置进行核酸提取,并且扩增反应和结果判读在一个加热装置内即可完成,操作方便并降低了污染发生的可能性。为探讨该方法在区县级结核病实验室推广应用的可行性,笔者选取河南省新乡市和获嘉县作为研究现场,通过与临床诊断结果和固体培养试验结果比较,评价PURE-LAMP方法在临床样本中检测MTB的效能。
材料和方法
1. 研究对象:选取2012年4月至2013年1月在河南省新乡市结核病防治所和获嘉县疾病预防控制中心就诊的初诊肺结核可疑症状者作为研究对象,共1378例。由接受过培训的临床医生详细询问研究对象的一般信息、本次就诊症状及病史,逐项确认后填写临床信息表。每例患者留取3份痰标本,分别进行涂片镜检、固体培养和PURE-LAMP检测。
2. 痰涂片检查:涂片检查遵照《痰涂片镜检标准化操作及质量保证手册》[7]中的标准化操作程序执行。
3. 固体培养:简单法固体培养试验遵照《分枝杆菌分离培养标准化操作程序及质量保证手册》[8]中的标准化操作程序执行。
4. PURE-LAMP检测:使用移液器将60 μl痰液和阴性对照加入到加热管内,将加热管在PURE-LAMP反应仪后端的加热模块于90 ℃加热5 min后,取出加热管并将其用力旋入吸附管,拧紧并充分混合。取出注射帽,将其推入吸附管,旋紧固定,此装置即为LAMP反应纯化装置。持续挤压纯化装置的吸附管,滴加反应液至含有扩增试剂的反应管的两个刻度线之间,所有核酸样本和阴性对照均加入到反应管后,使用毛细管吸取30 μl阳性对照液到PURE-LAMP反应管。盖紧反应管并倒置2 min,使干燥的PURE-LAMP试剂与反应液充分混合。然后将反应管放置到反应仪前端的反应模块中。当反应模块温度达到(67±0.5) ℃后,按下右侧反应模块计时开关,开始LAMP反应,反应时间为40 min。反应结束后取出反应管,放入荧光检测模块,如果阳性对照管显示荧光而阴性对照管没有荧光,则观察各样品是否有荧光显示,有荧光显示为阳性,没有荧光显示为阴性;否则为检测失败,需要重复检测。
5.菌群鉴定:培养阳性菌株进行16S~23S rDNA 转录间隔区测序分析,区分MTB和NTM。上游引物为5′-GGCCTAACCCTCGGGAGGGAG-3′,下游引物为5′-CCCGAGGCATATCGCAGCCTC-3′。测序引物由生工生物工程(上海)股份有限公司合成。用PCR直接测序法,在ABI PRISM 377DNA自动测序仪上对扩增产物进行测序。测序结果在NCBI网站进行比对分析。
6. 临床诊断及随访:患者就诊时,临床医生根据痰涂片、X线胸片和临床检查结果对纳入患者进行诊断(PURE-LAMP检测作为评估技术不能用于患者诊断),对确诊肺结核患者开始抗结核治疗。对PURE-LAMP阴性排除肺结核者于2个月后进行随访。随访时除询问患者就诊症状外,还要进行胸部X线摄片复查,并收取患者痰标本进行涂片镜检。2个月末,根据初诊痰涂片、固体培养、PURE-LAMP检测和临床检查结果,将纳入患者分为5类:涂阳肺结核、涂阴培阳肺结核、涂阴培阴临床诊断肺结核、LAMP阳性排除肺结核和LAMP阴性排除肺结核。涂阴培阴临床诊断肺结核患者如果在2个月末时随访症状无明显改善,则定义为不确定病例,不确定病例和未完成随访患者均排除分析。
7. 统计学分析:使用SPSS 17.50软件,采用卡方检验对不同检测方法的检测效能进行比较分析,以P<0.05为差异有统计学意义。
结 果
1. 基本情况:1378例肺结核可疑患者中,男923例(67.0%),女455例(33.0%);20岁以下患者58例(4.2%),20~岁 499例(36.2%),40~岁465例(33.8%),60岁及以上患者356例(25.8%)。
2.诊断类型及随访情况:在1378例肺结核可疑患者中,1例无临床信息。1377例纳入患者中,涂阳肺结核168例,涂阴培阳肺结核257例,涂阴培阴临床诊断肺结核355例,LAMP阴性排除肺结核患者585例,LAMP阳性排除肺结核患者12例。
对临床诊断患者和LAMP阳性排除肺结核患者于2个月后进行随访。355例临床诊断患者中,302例完成随访,随访完成率85.1%;12例LAMP阳性排除肺结核患者中,5例完成随访。总计60例患者未完成随访,9例为不配合,7例失去联系,9例外出,5例住院,30例为其他原因。302例完成随访的临床诊断患者中,293例被确诊为临床诊断病例,9例为不确定病例。5例LAMP阳性排除肺结核患者随访后均被确诊为非结核病患者,见图1。
3. 3种方法检测效能评价:以临床诊断结果为标准,对痰涂片、固体培养及PURE-LAMP检测法进行检测效能评价。在1377例有临床信息患者中,排除60例未完成随访和9例不确定患者,共1308例患者的诊断结果可用于诊断效能评价,其中2例患者培养污染。痰涂片镜检、固体培养和PURE-LAMP检测MTB的敏感度分别为23.40%(168/718),58.91%(423/718)和49.44%(355/718),PURE-LAMP检测敏感度高于痰涂片镜检(χ2=185.02,P=0.000),但低于固体培养试验(χ2=46.24,P=0.000),见表1。
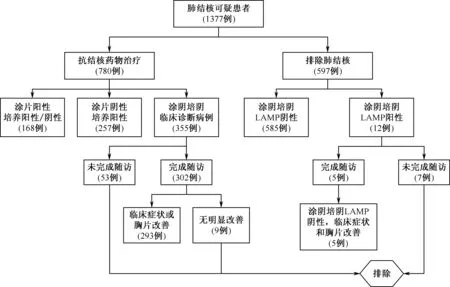
图1 研究对象纳入与随访流程图
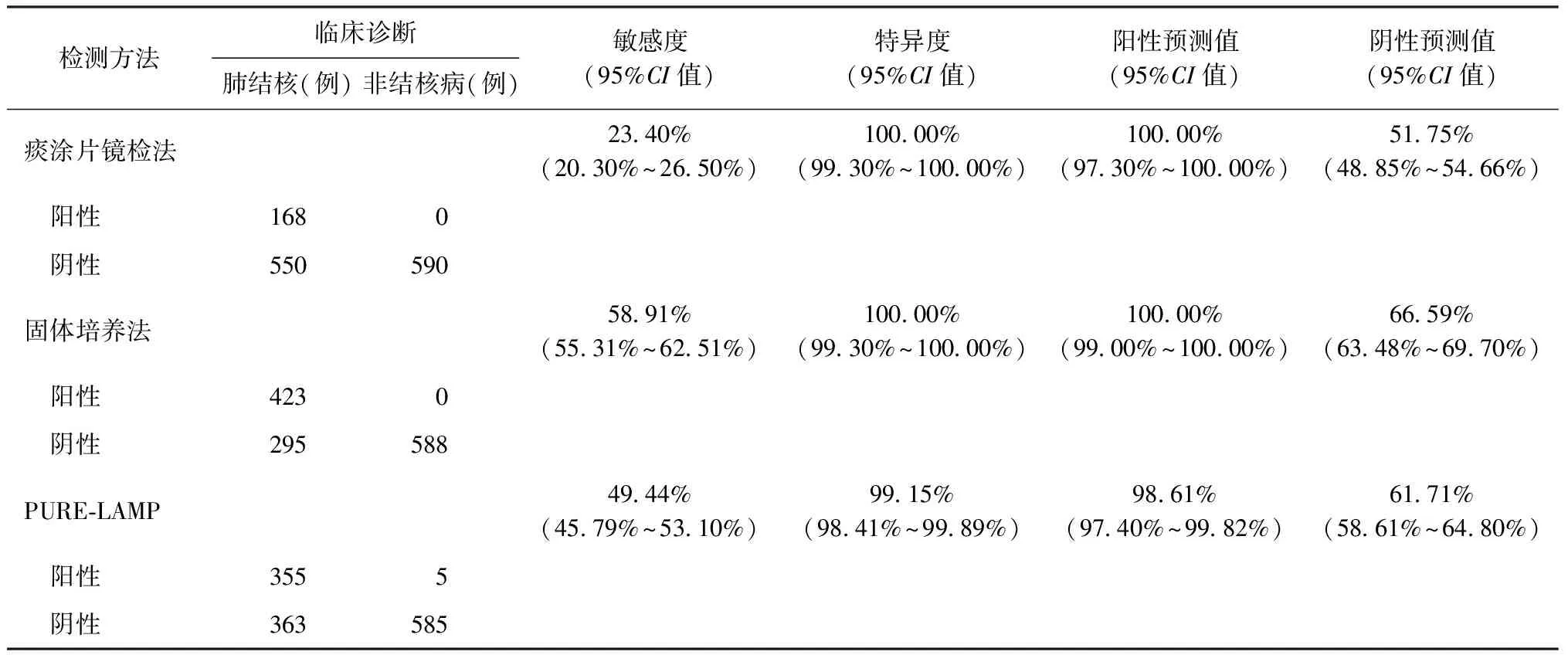
检测方法临床诊断肺结核(例)非结核病(例)敏感度(95%CI值)特异度(95%CI值)阳性预测值(95%CI值)阴性预测值(95%CI值)痰涂片镜检法2340%(2030%~2650%)10000%(9930%~10000%)10000%(9730%~10000%)5175%(4885%~5466%) 阳性1680 阴性550590固体培养法5891%(5531%~6251%)10000%(9930%~10000%)10000%(9900%~10000%)6659%(6348%~6970%) 阳性4230 阴性295588PURE⁃LAMP4944%(4579%~5310%)9915%(9841%~9989%)9861%(9740%~9982%)6171%(5861%~6480%) 阳性3555 阴性363585
注 PURE-LAMP:快速核酸提取环介导等温扩增检测。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%
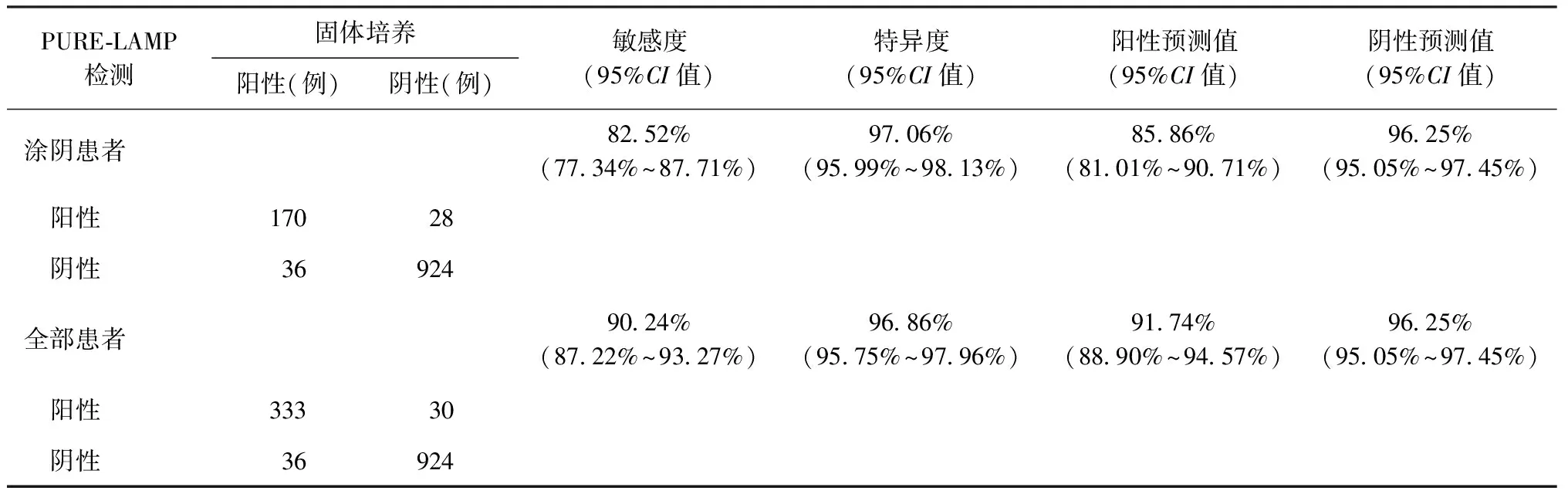
表2 以固体培养试验结果为标准比较PURE-LAMP检测结核分枝杆菌效能
注 PURE-LAMP:快速核酸提取环介导等温扩增检测。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%
4.固体培养试验与PURE-LAMP法检测效能的比较:在1378例纳入患者中,排除1例培养污染、7例测序菌群鉴定失败、41例非结核分枝杆菌感染以及6例测序鉴定后为非结核分枝杆菌感染的患者,共1323例患者可进行PURE-LAMP检测效能分析,其中涂片阴性患者1158例。
在1323例纳入患者中,以固体培养和测序菌群鉴定结果为标准,PURE-LAMP检测MTB敏感度和特异度分别为90.24%(333/369)和96.86%(924/954)。在1158例涂片阴性患者中,PURE-LAMP检测结核分枝杆菌的敏感度和特异度分别为82.52%(170/206)和97.06%(924/952),见表2。
讨 论
本研究通过比较涂片镜检、固体培养和PURE-LAMP检测诊断肺结核可疑症状者是否感染MTB,结果发现PURE-LAMP检测操作简单,实验技术人员通过肉眼观察荧光浊度进行结果判读,简单方便且未发现结果无法判读标本。以临床诊断结果为标准[9-10],PURE-LAMP检测MTB的敏感度明显高于涂片镜检,低于固体培养试验,同时低于之前研究报道的Xpert MTB/RIF检测MTB的敏感度(58.82%)[10]。以固体培养试验结果为标准,PURE-LAMP检测敏感度和特异度分别为90.24%和96.86%,尤其是在涂阴患者中敏感度达到82.52%,检测效能高于国内外相关研究[5-6,11]。以上发现提示,PURE-LAMP检测的临床应用价值高于传统涂片镜检,可更好地辅助临床医生对初诊肺结核可疑症状者进行早期诊断和治疗。
PURE-LAMP检测与其他分子生物学检测一样都存在着一定的局限性,均不能得到活菌。由于MTB培养可得到活菌,因此,其在结核病细菌学检查中仍占有不可替代的重要位置,但经过短期药物治疗的患者感染细菌受到损伤会导致其在培养基上难以生长,同时,培养试验阳性并不能排除NTM感染,需要继续进行后续的菌种鉴定试验。目前,我国大多数县(区)级结防机构均不具备开展菌种鉴定试验的能力,故培养试验在进行初诊肺结核可疑症状者的筛查方面也存在一定的局限性。
PURE-LAMP检测操作简单,所有反应只需在1个加热装置内即可完成,封闭的反应装置降低了污染发生的可能性。研究发现,5例LAMP阳性排除肺结核患者随访后均被确诊为非结核病,提示初诊PURE-LAMP检测为假阳性。由于实验室检测的准确性对于患者的治疗结果具有重要意义,特别是对于假阳性患者的鉴别对于减少患者个体损伤十分重要。因此,在分子生物学诊断技术的推广应用过程中,临床医生在对就诊患者进行诊断时,需要综合实验室、胸部X线摄片和临床检查结果,进行最终诊断,避免出现漏诊或过诊。
结核病患者的临床表现差别很大。随着社会经济条件的改善,因典型结核病临床表现就诊的患者越来越少,多数就诊可疑患者痰标本量很少,使得实验室和临床医生的诊断难度逐渐增大。PURE-LAMP检测快速且敏感度高,可更好地辅助临床医生进行诊断,同时该方法具有操作简单、所需痰标本量少(60 μl)以及对实验室生物安全要求低等优点,适合在实验室工作条件较差的地区推广使用。基于本次评估结果提出如下应用建议:(1)由于PURE-LAMP检测对实验室硬件要求并不高,推荐在县(区)级实验室使用PURE-LAMP检测。但需要注意,PURE-LAMP检测技术属于分子生物学检测技术,基层工作人员接触较少,因此,对于接受完整培训(约1周时间)的基层人员而言,需要1个月的试运行试验以保证检测结果的准确性。(2)PURE-LAMP检测在每批实验中需要完成阴性和阳性对照,从成本和对技术的熟练程度考虑,建议优先在每日痰标本接收大于10份的实验室中开展。
志谢 感谢比尔及梅琳达·盖茨基金会对本项目的支持。感谢美国帕斯适宜卫生科技组织(PATH)在项目设计、实施和数据分析过程中的协助。感谢河南省疾病预防控制中心、新乡市结核病防治所和获嘉县疾病预防控制中心的实验室和项目管理人员在项目实施过程中给予的支持和帮助!
[1] Small PM, Pai M. Tuberculosis diagnosis-time for a game change. N Engl J Med, 2010, 363(11): 1070-1071.
[2] Pai M, Kalantri S, Dheda K. New tools and emerging technolo-gies for the diagnosis of tuberculosis: part Ⅱ. Active tuber-culosis and drug resistance. Expert Rev Mol Diagn, 2006, 6(3): 423-432.
[3] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res, 2000, 28(12): 63.
[4] Iwamoto T, Sonobe T, Hayashi K. Loop-mediated isothermal amplification for direct detection ofMycobacteriumtuberculosiscomplex,M.avium, andM.intracellularein sputum samples. J Clin Microbiol, 2003, 41(6): 2616-2622.
[5] Boehme CC, Nabeta P, Henostroza G, et al. Operational feasibility of using loop-mediated isothermal amplification for diagnosis of pulmonary tuberculosis in microscopy centers of developing countries. J Clin Microbiol, 2007, 45(6): 1936-1940.
[6] Mitarai S, Okumura M, Toyota E, et al. Evaluation of a simple loop-mediated isothermal ampli cation test kit for the diagnosis of tuberculosis. Int J Tuberc Lung Dis, 2011, 15(9): 1211-1217.
[7] 赵雁林,姜广路. 痰涂片镜检标准化操作及质量保证手册. 北京:中国协和医科大学出版社,2009.
[8] 赵雁林,王黎霞. 分枝杆菌分离培养标准化操作程序及质量保证手册.北京:人民卫生出版社,2013.
[9] Nhu NT, Ha DT, Anh ND, et al. Evaluation of Xpert MTB/RIF and MODS assay for the diagnosis of pediatric tuberculosis. BMC Infect Dis, 2013,13: 31.
[10] 赵冰,欧喜超, 夏辉. Xpert Mtb/RIF检测技术在结核病诊断中的应用评价. 中国防痨杂志, 2014, 36(6):462-466.
[11] 陈涛, 周琳, 周杰, 等. 环介导等温扩增法快速检测结核分枝杆菌的临床应用评估. 中国防痨杂志, 2012, 34(7):413-418.
(本文编辑:李敬文)
Evaluation of rapid nucleic acid extraction loop-mediated isothermal amplification technology in the diagnosis of pulmonary tuberculosis
OUXi-chao,XIAHui,LIQiang,PANGYu,ZHAOBing,ZHANGZhi-ying,LIJun-chen,ZHAOYan-lin.
NationalTuberculosisReferenceLaboratory,NationalCenterforTuberculosisControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
Correspondingauthor:ZHAOYan-lin,Email:zhaoyanlin@chinatb.org
Objective To evaluate the rapid nucleic acid extraction loop-mediated isothermal amplification technology (PURE-LAMP) in the diagnosis of pulmonary tuberculosis (TB). Methods A total of 1378 TB suspects were continuously recruited in Xinxiang tuberculosis dispensary and Huojia CDC from April 2102 to January 2013, three sputum specimens collecting from each patient were examined by smear, solid culture and PURE-LAMP. Then, compare sensitivities of smear, solid culture and PURE-LAMP based on the diagnosis and evaluate the sensitivity of PURE-LAMP according to solid culture result. Results Based on the diagnosis, the sensitivities of smear microscopy, solid culture and PURE-LAMP were 23.40% (168/718), 58.91% (423/718) and 49.44% (355/718), respectively. The sensitivity of PURE-LAMP was higher than that of smear (χ2=185.02,P=0.000), but lower than that of solid culture (χ2=46.24,P=0.000). Based on solid culture result, the sensitivity and specificity of PURE-LAMP were 90.24% (333/369) and 96.86% (924/954), respectively; while the sensitivity and specificity in smear negative patients were 82.52% (170/206) and 97.06% (924/952), respectively. Conclusion PURE-LAMP is easily operated, its sensitivity and specificity is relatively higher. It should be widely used in tuberculosis dispensary at county (district) level.
Mycobacteriumtuberculosis; Nucleic acid amplification technique; Diagnosis
10.3969/j.issn.1000-6621.2016.05.014
中国卫计委与比尔及梅琳达·盖茨基金会结核病防治项目(2009-04-01)
102206 北京,中国疾病预防控制中心结核病预防控制中心 国家结核病参比实验室(欧喜超、夏辉、李强、逄宇、赵冰、赵雁林);帕斯适宜卫生科技组织(张治英、李俊晨)
赵雁林,Email:zhaoyanlin@chinatb.org
2016-02-01)
