ACE2/Apelin在睡眠呼吸暂停低氧大鼠肺损伤中的表达及意义
2016-05-09寇育乐王立民王红阳张嘉宾谭曦舒
寇育乐,王立民,王红阳,张嘉宾,谭曦舒,张 敏
(河北理工大学附属医院呼吸科,河北唐山 063000)
ACE2/Apelin在睡眠呼吸暂停低氧大鼠肺损伤中的表达及意义
寇育乐,王立民,王红阳,张嘉宾,谭曦舒,张 敏
(河北理工大学附属医院呼吸科,河北唐山 063000)
目的 观察慢性睡眠呼吸暂停低氧诱发大鼠肺损伤发病过程中肾素-血管紧张素-醛固酮(RAS)系统部分成员人血管紧张素转化酶相关肽2(ACE2)、Apelin及血管紧张素Ⅱ(AngⅡ)的动态变化,并探讨其在睡眠呼吸暂停低氧诱发肺损伤发病机制中的作用。方法 采用随机数字表法将72只雄性Wistar大鼠分为对照组(UC组)、5%间歇低氧组(CIH组)和实验对照组(SC组),根据暴露时间不同分为1、2、3、4周4个亚组,每个亚组6只,CIH组大鼠循环给予氮气和压缩空气,UC组不给予任何处理,SC组大鼠循环给予压缩空气,于不同时间点分别观察各亚组大鼠肺组织病理、Apelin蛋白及Apelin、ACE2、AngⅡmRNA的表达。结果 UC组及SC组未见明显病理损害,而CIH组肺泡壁水肿增厚,部分肺泡萎陷不张,肺间质及支气管上皮内也可见中性粒细胞浸润,且随时间延长病理损伤逐渐加重。与UC组及SC组比较,CIH组Apelin蛋白表达在各个时间点呈现先逐渐降低,于2周达到低谷后逐渐增高(P<0.05),而CIH各亚组Apelin mRNA较UC组及SC组未见显著变化(P>0.05);ACE2mRNA表达初期呈轻度逐渐增高趋势(P<0.05),于2周达到峰值后逐渐下降;AngⅡmRNA于各时间点的表达逐渐增加(P<0.05),于4周达峰值。结论 在慢性间歇低氧肺损伤中Apelin蛋白呈先低后高,而ACE2变化趋势相反,提示Apelin蛋白可能与ACE2的降解以及AngⅡ的变化密切相关。
阻塞性睡眠呼吸暂停低通气综合征(OSAHS);间歇性低氧;ACE2;Apelin;AngⅡ;肺损伤
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160202.1720.028.html(2016-02-02)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)患者在睡眠过程中反复出现呼吸暂停或低通气,长期可导致多种靶器官损害,其中呼吸系统不可避免受到累及,但具体发病机制至今未明。1998年,研究人员以反向药理学方法从牛胃组织提取物中分离纯化出了一种小分子血管活性肽Apelin,是肾素-血管紧张素-醛固酮系统(renin-angiotensin system,RAS)中新的重要组成部分,是一种重要的内源性生理调节肽。初步研究发现,Apelin具有舒张血管、利尿、调节免疫反应及抗氧化等功能[1-2]。2002年,两个研究小组先后通过克隆技术新发现的一种金属蛋白酶、人血管紧张素转化酶相关肽2(angiotensin-converting enzyme 2,ACE2),既是RAS系统中的的负性调节因素,也是迄今为止发现的唯一可以降解Apelin的酶[3]。已有文献报道,Apelin及ACE2在肺组织中均有极高的表达[4]。本研究通过免疫组化及实时荧光定量PCR法检测ACE2及AngⅡ在慢性间歇低氧肺损伤中的表达,探讨Apelin在间歇低氧肺损伤发生、发展中的作用机制及其与ACE2、AngⅡ的关系,探讨Apelin在OSHSA发病机制中的作用。
1 材料与方法
1.1 实验动物及分组 采用随机数字表法将清洁级健康的成年雄性Wistar大鼠72只[许可证编号:SCXK(津)2009- 0001],体质量(150±10)g,购于天津市山川红实验动物科技有限公司,大鼠分为空白对照组(UC)、5%间歇低氧组(CIH)、实验对照组(SC),各组又依据干预时间分为1、2、3、4周时间点亚组,每个时间亚组各6只。
1.2 间歇低氧模型的建立及各组干预情况 通过氮气稀释原理,依据文献[5],UC组暴露于空气中,CIH组循环暴露于氮气和压缩空气中(每一循环120s,使舱内最低氧体积分数达5%,然后恢复至21%,8h/d;SC组:向低氧箱内持续注入压缩空气120s,流速为10L/min,监测氧体积分数维持在21%,用数字测氧仪监测舱内氧体积分数变化,维持各组氧体积分数,波动范围在±0.5%以内。
实验结束后取出实验动物,送入常规饲养箱内自由饮水与摄食,生活环境及饲养条件相同。分别在实验第1、2、3、4周结束后,腹腔麻醉(300mg/只)下开胸,经右心室插管至肺动脉,将右侧肺组织固定于40g/L多聚甲醛,进行HE染色及免疫组化检测。取左肺上下叶经液氮速冻后保存于-80℃冰箱行实时荧光定量PCR检测。
1.3 各组大鼠肺组织HE染色 肺组织经40g/L多聚甲醛固定,常规石蜡包埋,选取平行肺门方向切片(德国LEICA),片厚4μm。常规苏木素-伊红染色。镜下观察并摄片,取各组各时间点每只大鼠10张切片,在光学显微镜下以相同倍数(20×10)分别选取不同部位摄片。
1.4 Apelin蛋白免疫组化染色 肺组织石蜡切片常规脱蜡至水,枸橼酸盐高压修复,一抗为Apelin兔抗鼠多克隆抗体(1︰200,北京博奥森生物技术有限公司),湿盒中4℃放置12h,IgG抗体-HRP多聚体(PV二步法,北京中杉金桥生物技术有限公司),以PBS代替一抗作阴性对照。镜下观察并摄片,取各组各时间点6张标本片在光学显微镜下,以相同放大倍数(20×10)分别选取不同部位摄片,利用Motic医学图像分析系统的免疫组化分析模块中单点分割法分析,取相同面积阳性目标的积分吸光度值(IA)。
1.5 实时荧光定量PCR法检测肺组织Apelin、ACE2及AngⅡmRNA表达 冰上分别取材各组冻存的左肺组织约30mg,用组织RNA提取试剂盒(北京博迈德生物有限公司)提取RNA并测定浓度,琼脂糖凝胶电泳判断RNA完整性。采用TaKaRa试剂盒合成cDNA,严格按照试剂盒说明书进行操作。20μL体系扩增,上下游引物各0.4μL,cDNA模板2.0μL,ROX1 0.4μL,荧光(避光)10μL。扩增条件为95℃预变性30s,95℃5s,60℃31s,共40个循环。其中各上下游引物由上海生工合成。Apelin的正向引物:3′-CAGCAGGAATAGCACCCTCT-5′;反向引物:5′-AAGTTGGGCATCAGGCTCT-3′;ACE2的正向引物3′-ACGAAGCCGAAGACCTGTT-3′;反向引物:5′-GGAAGGTGTGGACTGTTCCT-3′;AngⅡ的正向引物:5′-GGGAAGGGAATGAGGCTTAC-3′;反向引物:5′-GGTTGGCTGATGCTGCTTAT-3′。分别得到扩增曲线、溶解曲线和待测样本表达量,应用分析软件Rotor-Gene3000判断溶解曲线特异性及扩增曲线是否为阳性,采用2-△△Ct相对定量分析法计算出各组ACE2、AngⅡmRNA的相对含量。
1.6 统计学处理 采用SPSS16.0统计软件包进行数据分析,数据用均数±标准差(珔x±s)表示,多组间比较采用单因素方差分析,经检验有统计学意义后用最小显著差异法(LSD)进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理变化 UC组及SC组未见明显肺损伤;CIH组可见肺泡壁增厚伴少量的肺泡萎缩不张,肺间质内及支气管上皮可见中性粒细胞浸润,随时间延长病理损伤越重(图1)。

图1 各组大鼠肺组织病理改变Fig.1The pathological changes of pulmonary tissues in different groups of rats(HE,×200)
2.2 各组大鼠Apelin蛋白的表达情况 免疫组化结果显示,各组、各时间点均有Apelin蛋白表达,主要表达于肺泡上皮细胞及支气管上皮细胞。光学显微镜下观察阳性细胞以胞质表达为主,呈棕黄色或浅黄色(图2)。UC组有一定的基础表达。与UC、SC组比较,CIH组Apelin蛋白总体表达呈先降低后升高过程,于2周时表达量最低,后又逐渐升高,于4周时表达量最高(表1)。

表1 各组大鼠肺组织中Apelin蛋白表达水平Tab.1 The protein level of Apelin in the rats’pulmonary tissues in different groups (珔x±s)

图2 免疫组化检测各组大鼠Apelin蛋白的表达情况Fig.2The expression of Apelin protein in the lung in different groups of rats(SP,×200)
2.3 各组大鼠Apelin、ACE2及AngⅡmRNA的表达情况CIH组Apelin mRNA与UC组及SC组比较,无明显差异(P>0.05,表2);与UC组及SC组比较,CIH组ACE2mRNA总体呈先高后低趋势,于2周即出现最强表达量,随后表达逐渐下降(表3);CIH组AngⅡmRNA表达于各时间点与UC组比较,均逐渐增高(P<0.05),于4周表达最强(表4)。
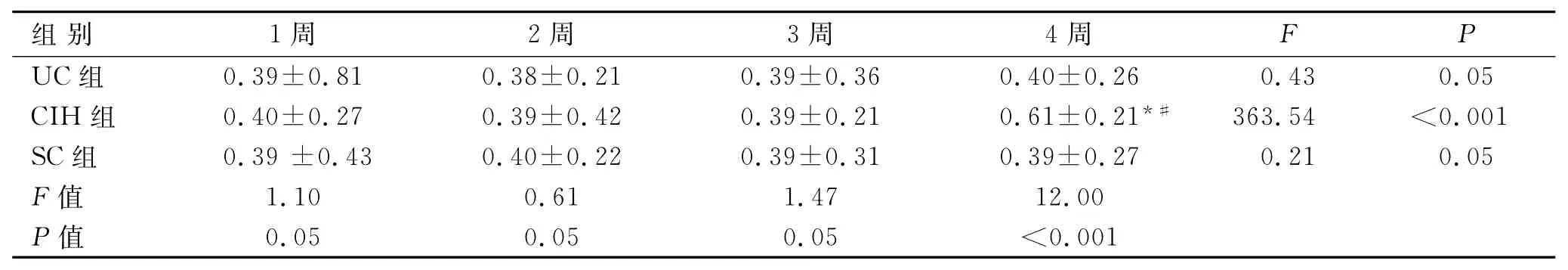
表2 各组大鼠肺组织中Apelin mRNA水平Tab.2 The mRNA level of Apelin in the rats’pulmonary tissues in different groups (珔x±s)

表3 各组大鼠肺组织中ACE2mRNA水平Tab.3 The mRNA level ACE2in the rats’pulmonary tissues in different groups (珔x±s)

表4 各组慢性间歇低氧肺组织中AngⅡmRNA水平Tab.4 The mRNA level of AngⅡin the rats’pulmonary tissues in different groups (珔x±s)
3 讨论
OSAHS是一种累及全身多系统的睡眠呼吸障碍性疾病。临床统计未经治疗的OSAHS患者5年病死率高达11%~13%。全球每天约有3 000人的死亡与OSAHS有关[6]。有研究表明,OSAHS患者中COPD的发病率为10%~20%[7],肺动脉高压的发病率为17%~42%[8-9],且与其他呼吸系统疾病如慢性咳嗽、哮喘发作等有极高的共存率。本研究中CIH组与UC组及SC组相比,出现明显病理损伤,且随间歇低氧时间延长,病理损伤愈显著。提示CIH可能是导致OSAHS相关性肺组织病理损害的机制之一。
近年研究发现,RAS系统参与了OSAHS的发生发展,但鲜见局部RAS系统如肺组织RAS通路在OSAHS相关呼吸系统疾病中作用机制的研究。有报道RAS的主要效应物质AngⅡ在OSAHS患者体内显著升高,并且经CPAP治疗后可恢复正常[9]。模拟OSAHS的间歇低氧模型中反复出现的低氧复氧过程类似于缺血再灌注,曾有研究报道在肺缺血再灌注损伤中AngⅡ显著升高[10-11],其作为一种前炎症调节因子,调节炎症介质表达、氧化应激、促进细胞凋亡等,参与肺组织损伤的发生发展。本研究发现间歇低氧大鼠肺组织中AngⅡ蛋白表达升高,说明AngⅡ参与慢性间歇低氧所致的肺损伤过程,并与间歇低氧持续时间密切相关。
GOETZE等[12]报道了慢性肺疾病患者的Apelin水平较正常组显著降低。在心肌与脑组织缺血再灌注损伤模型中亦证实局部组织的Apelin蛋白明显减少,从而对抗AngⅡ的作用减弱[13]。此外,研究表明外源性给予超早期Apelin干预可以增强局部抗氧化作用减轻组织损伤[14]。本研究结果显示,随着间歇低氧肺损伤的出现,各亚组Apeiln mRNA无明显变化,与其基因表达变化不同的是,肺组织Apelin蛋白水平随间歇低氧时间的延长呈先降后升的变化趋势,具体表现为1、2周组Apelin表达量减少,自3、4周组开始升高。CIH组大鼠肺组织Apelni mRNA与蛋白表达变化的这种差异的确切机制尚不清楚,可能与Apelin转录体翻译、翻译后修饰某个环节有关。有报道OSHSA患者体内存在RAS系统激活以及AngⅡ升高,Apelin作为心血管保护因子,可以对抗RAS系统的效应[7]。因此,推测间歇低氧肺组织中,Apelin可能通过对抗AngⅡ及抗炎、抗氧化等机制起着肺组织保护作用。
研究发现,ACE2在RAS系统中的作用与ACE截然相反,其可以通过降解AngⅡ产生血管紧张素1~7(angiotensin 1~7,Ang 1~7),可促使血管扩张、抗增殖以及促进细胞凋亡。体外研究发现,ACE2对AngⅡ的催化效率要比AngⅠ高出近400倍,并且这种催化效率不受ACE抑制剂的影响。由此可见,催化AngⅡ为Ang(1~7)是ACE2的主要保护机制。随着研究的进展,发现ACE2参与多种肺部疾病的病理过程,在相同强度的致病因子打击下(如脓毒血症),ACE2基因敲除小鼠急性肺损伤比野生型小鼠更显著,而给这两种小鼠注射重组人ACE2均能够减轻急性肺损伤的程度[15]。本研究中CIH2组1、2周组的肺组织病理损伤较轻,ACE2呈高表达,由此推测在疾病发生早期ACE2高表达是机体的一种代偿性保护机制,而3、4周组肺组织病理损伤较重,AngⅡ含量显著升高,ACE2显著下降,提示间歇低氧作用下,ACE2的降低使血清中AngⅡ的降解减少,高水平的AngⅡ进一步导致肺组织损伤。因此,ACE2是负性调节因子,对肺组织有显著保护作用;而RAS系统中主要效应因子AngⅡ则促进间歇低氧肺损伤的发生、发展。
ACE2作为Apelin目前已知的唯一降解酶,对Apelin的体内浓度变化具有重要影响。初步推测,在初期Apelin的表达下降可能与ACE2升高导致Apelin降解,后期又因ACE2下降时对Apelin降解减少,Apelin含量较前有所升高。临床研究表明OSAHS患者血浆Apelin较健康对照组低;有动物实验表明,低氧性肺动脉高压模型研究中肺组织Apelin表达在低氧第4周、第7周时上调[16],再结合本研究间歇低氧肺损伤研究结果,推测在OSAHS相关肺损伤发展过程中,肺组织Apelin水平可能出现先低后高再低的过程,其高低水平变化可以作为机体肺组织疾病转归的一种变化。
综上所述,本研究表明在慢性间歇性低氧肺损伤中出现RAS系统失衡,主要的损伤效应因子AngⅡ随间歇低氧暴露时间延长逐渐升高趋势,Apelin蛋白呈先高后低表达趋势,而ACE2呈先高后低变化,且ACE2作为Apelin目前已知的唯一降解酶,提示Apelin蛋白的变化可能与ACE2的降解及AngⅡ的变化关系密切并起重要作用。
[1]KAGIYAMA S,FUKUHARA M,MATSUMURA K,et al.Central and peripheral cardiovascular actions of apelin in conscious rats[J].Regul Pept,2005,125(1-3):55-59.
[2]LEE DK,CHENG R,NGUYEN T,et al.Characterization of Apelin,the ligand for the APJ receptor[J].J Neurochem,2000,74(1):34-41.
[3]IWAI M,HORIUCHI M.Devil and angel in the renin-angiotensin system:ACE-angiotensinⅡ-AT1 receptor axis vs ACE2-angiotensin-(1-7)-Mas receptor axis[J].Hypertens Res,2009,32:533-536.
[4]HOSOYA M,KAWAMATA Y,FUKUSUMI S,et al.Molecular and functional characteristics of APJ.Tissue distribution of mRNA and interaction with the endogenous ligand Apelin[J].J Biol Chem,2000,275(28):21061-21067.
[5]冯靖,陈宝元.间歇低氧气体环境模型的建立[J].天津医科大学学报,2006,12(4):509-515.
[6]SHANASUZZAMAN AS,GERSH BJ,SOMERS VK.Obstructive sleep apnea:implications for cardiac and vascular disease[J].JAMA,2003,290:1906-1914.
[7]FLEETHAM JA.Is chronic obstructive pulmonary disease related to sleep apnea hypopnea syndrome[J].Am J Respir Crit Care Med,2003,167:3-4.
[8]JELIC S,PADELETTI M,KAWUT SM,et al.Inflammation,oxidative stress,and repair capacity of the vascular endothelium in obstructive sleep apnea[J].Circulation,2008,117(17):2270-2278.
[9]向永红,苏晓丽,贺弱曦,等.不同低氧方式对大鼠血清和组织局部肾素血管紧张素系统的影响[J].中华结核和呼吸杂志,2012,35(1):33-36.
[11]CHEN LN,YANG XH,NISSEN DH,et al.Dysregulated renin-angiotensin system contributes to acute lung injury caused by hind-limb ischemia-reperfusion in mice[J].Shock,2013,40:420-429.
[12]GOETZE JP,REHFELD JF,CARLSEN J,et al.Apelin:a new plasma marker of cardiopulmonary disease[J].Regul Pept,2006,133(1-3):134-138.
[13]JIA YX,PAN CS,ZHANG J,et al.Apelin protects myocardial in jury induced by isoproterenol in rats[J].Regul Pept,2006,133 (1-3):147-154.
[14]COOK DR,GLEICHMAN AJ,CROSS SA,et al.NMDA receptor modulation by the neuropetide apelin:implication for excitotoxic injury[J].J Neurochem,2011,118:1113-1123.
[15]IMAI Y,KUBA K,RAO S,et al.Angiotensin-converting enzyme 2 protects from severe acute lung failure[J].Nature,2005,436:112-116.
[16]陈思,薛峰,金海龙,等.游泳运动对低氧性肺动脉高压大鼠肺组织apelin及其受体表达的影响[J].中国应用生理学杂志,2012,28(1):5-8.
(编辑 国 荣)(编辑 卓选鹏)(编辑 卓选鹏)(编辑 卓选鹏)
R563
B
10.7652/jdyxb201602032
2015-06-30
2015-11-18
河北省重大医学科研课题(No.zd2013091)Supported by Major Project of Medical Science of Hebei Province(No.zd2013091)
王红阳.E-mail:tsmywhy@163.com
