姜黄素和脑源性神经营养因子对阿尔茨海默病记忆的改善作用
2016-05-09耿晓英张爱香张璐璐
耿晓英,张爱香,骞 健,郭 刚,张璐璐,王 静
(西安交通大学附属广仁医院,西安市第四医院,陕西西安 710004)
姜黄素和脑源性神经营养因子对阿尔茨海默病记忆的改善作用
耿晓英,张爱香,骞 健,郭 刚,张璐璐,王 静
(西安交通大学附属广仁医院,西安市第四医院,陕西西安 710004)
目的 研究姜黄素对阿尔茨海默病(Alzheimer’s disease,AD)模型大鼠学习记忆能力的影响及其作用机制。方法 采用脑室内注射Aβ1-42的方法,制备AD动物模型。单次腹腔注射(急性治疗组)或连续6d腹腔注射(慢性治疗组)50、100、300mg/kg剂量的姜黄素,结合海马内微量注射脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)(每侧1.0μg)、BDNF shRNA慢病毒(每侧2.0×105单位),分析大鼠Y迷宫、Morris水迷宫及旷场行为变化,并应用Western blot检测海马BDNF表达变化。结果 姜黄素急性治疗对AD模型大鼠自主改变行为、总活动距离、水迷宫潜伏期没有显著作用。300mg/kg姜黄素慢性治疗后AD大鼠自主改变行为(P<0.000 1)及在水迷宫测试中记忆能力(P<0.05)比盐水对照组显著增高。100和300mg/kg姜黄素慢性治疗组海马BDNF表达和盐水对照组相比显著上升(P分别<0.05和<0.000 1)。海马内注射BDNF的AD大鼠水迷宫潜伏期显著下降(F4,295=5.813,P<0.01)。姜黄素慢性治疗+shBDNF组大鼠在2号象限内的游泳时间与盐水对照组无差异(P=0.657),而100 mg/kg姜黄素组、BDNF组、假手术组大鼠的停留时间比盐水对照组显著增高(P值分别<0.05、<0.05、<0.000 1)。结论 姜黄素可能通过上调BDNF的表达继而激活下游信号通路,最终对Aβ诱导的AD大鼠学习记忆能力起到改善作用。
阿尔茨海默病;姜黄素;海马;脑源性神经营养因子;Y迷宫;Morris水迷宫;旷场实验;shRNA
阿尔茨海默病(Alzheimer’s disease,AD)是临床最常见的一种痴呆(dementia)病症,是老年人常见的神经退行性疾病。AD患者典型的主要临床表现为进行性的认知障碍、记忆功能减退、日常生活能力降低及人格改变[1]。其典型的组织学改变包括神经毒素淀粉质β多肽(amyloid beta peptide,Aβ)在细胞外大量沉淀,减低突触可塑性,引起突触丢失,促成氧化损伤,进而引起神经元内的tau蛋白超磷酸化[2],然而AD的病因和确切发病机制尚未完全阐明。
姜黄素(curcumin,Cur)是一种传统草药姜黄(Curcuma longa)的主要多酚类成分提取物。其功能有抗细菌、抗病毒、广泛的分子靶向作用、抗氧化、类蛋白激酶作用,从而影响信号转导,改善认知[3-4]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族的一员,在人的大脑皮质和海马组织有高水平表达,并能在功能和形态上调节突触可塑性。目前尚未见报道姜黄素对AD治疗作用是否与BDNF有关。本研究采用向大鼠脑室内注射Aβ1-42,建立AD模型,用姜黄素治疗及/或BDNF干预或改变其活性时,观察模型大鼠行为学改变,以揭示姜黄素治疗AD发病的部分机制。
1 材料与方法
1.1 实验动物与试剂 成年Sprague-Dawley(SD)雄性大鼠共150只,体质量200~220g。姜黄素及Aβ1-42标准品购自Sigma-Aldrich公司。BDNF全长蛋白质及兔抗BDNF多克隆抗体购自Abcam公司。小鼠抗GAPDH抗体购自Millipore公司。BDNF shRNA慢病毒颗粒、非靶向性对照慢病毒颗粒、辣根过氧化物酶标记的山羊抗兔或山羊抗小鼠IgG二抗皆购自Santa Cruz公司。
1.2 AD模型建立 采用脑室内注射Aβ1-42的方法制备AD动物模型。用生理盐水配制Aβ1-42为5mg/mL溶液,于37℃孵育72h进行活化。大鼠腹腔注射350mg/kg体质量的水合氯醛麻醉后置于脑立体定位装置(深圳沃瑞德生命科技公司)上固定。大鼠头部去毛并消毒皮肤,头顶正中切开皮肤,充分暴露前囟,依照大鼠脑立位图谱(坐标为:AP=-1.9mm,ML=±1.4mm,DV=-2.9mm),钻开颅骨并以微量注射器自脑表面垂直进针,向侧脑室内缓慢注入2μL配制好的5mg/mL预激活的Aβ1-42。注射时间不少于5min,注射后继续留针2min以确保Aβ1-42溶液充分扩散至脑室。部分需进行海马内药物注射的大鼠按照大鼠脑立位图谱(坐标为:AP=-3.6mm,ML=±2.0mm,DV=-2.8mm)颅骨打孔并置入微量注射导管,以牙科水泥封闭固定。所有步骤均无菌操作,术后大鼠连续6d腹腔注射青霉素防止感染。模型组注射等量生理盐水代替Aβ1-42,假手术组不进行注射,其余操作均与造模组相同。
1.3 分组 实验共分3部分进行。第一部分为姜黄素急性给药,大鼠随机分为5组,每组12只:假手术组、模型组、AD模型+急性姜黄素50、100、300mg/kg组(仅在行为学实验前30min腹腔注射1次相应剂量姜黄素)。
第二部分为姜黄素慢性给药,大鼠随机分为5组,每组12只:假手术组、模型组、AD模型+慢性姜黄素50、100、300mg/kg组(连续给药6d,每天腹腔注射1次相应剂量姜黄素,第6天最后1次注射30min后进行各项行为测试)。
第三部分为海马内BDNF干预,大鼠随机分为5组,每组12只:假手术组、模型组、AD模型+慢性姜黄素(100mg/kg)组、AD模型+BDNF组、AD模型+慢性姜黄素(100mg/kg)+海马内注射shBDNF慢病毒组(注射姜黄素同时海马内微量注射每侧1.0 μg BDNF蛋白,并设对照组,即每侧注射约2.0×105单位shBDNF慢病毒颗粒或等体积生理盐水作为对照,注射体积为1.0μL每侧;注射时使用10μL规格的微量进样器,将针头插进微量注射导管缓慢进行注射,注射时间不少于5min。
实验期间大鼠自由饮食,室温22~25℃,每日12h/12h循环光照。
1.4 旷场实验 旷场实验箱体为黑色正方形(100cm ×100cm×60cm),顶部敞开。大鼠置于旷场中央并自由探索60min,由视频追踪软件记录并分析其总活动距离。
1.5 Y迷宫实验 Y迷宫为黑色的3个塑料长臂组成,每个臂之间相隔120°角。每个臂长30cm,宽10cm,高25cm。实验室中等强度光照,实验开始时,大鼠置于Y迷宫中心并自由探索5min,Anymaze视频追踪软件(美国Stoelting公司)记录并分析各臂的进入顺序、进入次数及进入时间。根据TYPLT等[5]的描述,大鼠进行1次不重复探索完3个臂为1次“自主改变行为”,其占各臂总进入次数的百分比反映了工作记忆的强度。
1.6 Morris水迷宫实验 Morris水迷宫直径150cm,高60cm,室温及水温均保持在(22±2)℃。整个迷宫划分为等面积的4个扇形象限,每个象限附近设有1个特征显著的标识物。在2号象限内放有1个10cm ×10cm大小的透明平台,平台顶部低于水面1.0cm。平台仅在训练期放置于迷宫中,测试期则取出平台。
各组大鼠分别于术后进行Morris水迷宫训练,每天上下午各训练1次,连续5d。训练时固定1个入水点,将大鼠面向池壁放入水中,观察并记录大鼠平均游泳速度、寻找并爬上平台的路线及所需时间(潜伏期)。如果大鼠在120s内未找到平台,需将其引导至平台并停留10s。于第6天进行空间定位航行测试(navigation probe-task),测试期间移除平台,大鼠自由探索120s并记录大鼠游至原平台所在位置的次数、所需时间及2号象限的游泳距离和时间。数据采集和处理由视频追踪软件自动监视处理完成。
1.7 Western blot检测BDNF表达 大鼠断头处死,冰上剥离大脑并切取海马组织,经预冷RIPA组织裂解液(含磷酸酶抑制剂及蛋白酶抑制剂)提取蛋白。在100g/L SDS-PAGE凝胶中电泳,半干法转移到PVDF膜上,TBST室温封闭1h,分别加入BDNF、抗GAPDH抗体(抗体稀释比例均为1∶1 000),4℃孵育过夜。TBST洗膜后再用相应的二抗室温孵育1h。洗膜后化学发光,凝胶图像处理系统照相并分析目标带的灰度值。
1.8 统计学分析 采用统计软件包GraphPad Prism 5.0对数据进行处理,实验结果用均数±标准差表示。各组之间用单因素方差分析或重复测量的双因素方差分析,结合Dunnet’s多重检验(设定AD模型+盐水组为对照),进行数据的处理和比较。以P<0.05表示差异具有统计学意义。
2 结果
2.1 姜黄素急性治疗对AD模型大鼠学习记忆能力的作用 姜黄素急性治疗各剂量组大鼠进行旷场实验的结果进行双因素方差分析表明,急性治疗对各组大鼠总活动距离无显著影响(治疗:F4,210=1.403,P=0.234;时间:F5,210=22.16,P<0.000 1),各组大鼠活动能力均无差异(图1A)。大鼠在旷场实验结束1h后进行Y迷宫测试结果(图1B)显示,模型组自主改变行为显著低于假手术组(P<0.000 1),表明AD模型大鼠工作记忆能力明显受损。而50、100、300 mg/kg急性姜黄素组大鼠的自主改变行为与模型组相比无显著差异(分别为P=0.341、P=0.411和P=0.427),表明急性姜黄素未能改善大鼠工作记忆能力。
大鼠单独进行水迷宫训练及测试时,在实验开始后的前5d不注射任何药物,进行Morris水迷宫训练。训练结果(图1C)显示,随着训练次数增多,大鼠水迷宫游泳潜伏期均呈现降低趋势(时间:F4,190=4.216,P<0.01),而模型组大鼠潜伏期则普遍高于假手术对照组(Aβ1-42:F1,190=19.80,P<0.000 1)。在probe测试前大鼠急性腹腔注射姜黄素的结果(图1D)显示,模型组与假手术组相比,在2号象限内的停留时间百分比显著降低(P<0.000 1),表明AD模型大鼠空间参考记忆明显受损。而50、100、300mg/kg急性姜黄素组大鼠在2号象限内的停留时间与模型组相比无显著差异(分别为P=0.341、P=0.411和P=0.427),说明50、100、300mg/kg急性姜黄素治疗对AD模型大鼠空间参考记忆能力没有显著作用。
2.2 姜黄素慢性治疗对AD模型大鼠学习记忆能力的作用 姜黄素慢性治疗实验中,在连续6d腹腔注射姜黄素后进行旷场实验,结果(图2A)显示,慢性姜黄素对大鼠总活动距离无显著影响(给药:F4,210=1.637,P=0.421;时间:F5,210=19.31,P<0.000 1)。Y迷宫测试结果(图2B)显示,50mg/kg慢性姜黄素组大鼠自主改变行为与模型组相比无显著改变P=0.097),然而100、300mg/kg慢性姜黄素组大鼠的自主改变行为比模型组显著增高(分别为P<0.05和P<0.000 1),表明100和300mg/kg慢性姜黄素治疗改善了大鼠工作记忆能力。
在水迷宫训练及测试实验期间,连续6d腹腔注射姜黄素并进行训练。结果(图2C)显示,100、300 mg/kg慢性姜黄素组大鼠潜伏期下降显著(时间:F4,295=4.824,P<0.01)。Probe测试大鼠典型游泳轨迹(图2D)显示,50mg/kg姜黄素组与模型组大鼠在2号象限内的停留时间无差异(P=0.518),而100、300mg/kg慢性姜黄素组大鼠在平台象限内的游泳时间显著高于模型组(分别为P<0.000 1和P<0.01),说明100mg/kg以上剂量的姜黄素慢性治疗能显著改善AD模型大鼠空间参考记忆能力。
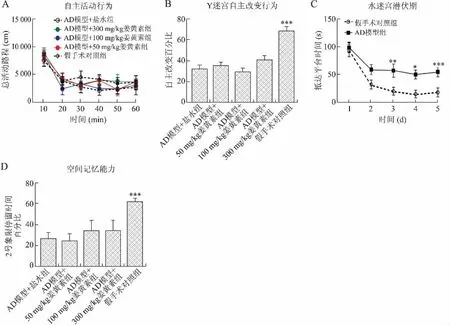
图1 姜黄素急性给药后AD模型大鼠学习记忆实验中的行为变化Fig.1Behavioral changes in the learning and memory tests in AD model rats after acute curcumin injection

图2 姜黄素慢性给药后AD模型大鼠学习记忆实验中的行为变化Fig.2Behavioral changes in the learning and memory tests in AD model rats after chronic curcumin injection
2.3 姜黄素慢性治疗对海马内BDNF表达的影响大鼠在连续6d腹腔注射姜黄素后断头处死,检测海马内BDNF表达变化,结果(图3)进行单因素方差分析显示,姜黄素对海马BDNF表达有显著影响(F4,35=12.445,P<0.000 1)。多重检验发现50mg/kg姜黄素组BDNF表达与模型组无差异(P=0.768),而100、300mg/kg姜黄素组的海马BDNF表达则比模型组表达水平显著增高(分别为P<0.05、P<0.000 1)。
2.4 姜黄素慢性治疗及海马内BDNF对AD模型大鼠学习记忆能力的影响 为研究姜黄素慢性治疗是否通过影响海马内BDNF表达继而调控AD进展,采用注射BDNF蛋白和shBDNF慢病毒颗粒两种方法,分别上调/下调海马内BDNF水平。训练期结果(图4A)显示各药物处理均未对大鼠游泳速度造成影响(药物因素:F4,167=0.169 1,P=0.927;时间因素:F4,167=0.103 4,P=0.969 7),表明大鼠运动能力正常。100mg/kg姜黄素慢性组和海马BDNF注射组大鼠的潜伏期下降显著(时间:F4,295=5.813,P<0.01;图4B),而海马内注射BDNF-shRNA慢病毒组潜伏期与模型组相比无差异,表明完全消除了慢性姜黄素治疗的记忆改善作用。Probe测试中AD模型+慢性姜黄素+shBDNF组大鼠在2号象限内的游泳时间与模型组无差异(P=0.657),而AD模型+BDNF组、AD模型+100mg/kg姜黄素组、假手术组大鼠的停留时间比模型组显著增高(P值分别<0.01、<0.05、<0.000 1,图4C),说明海马内BDNF可能介导了慢性姜黄素治疗对记忆能力的改善作用。此外,各组大鼠平台穿越次数也有显著改变(F4,35=12.813,P<0.05;图4D)。

图3 姜黄素慢性治疗对海马内BDNF表达的影响Fig.3Effects of chronic curcumin injection on hippocampal BDNF expression

图4 姜黄素慢性治疗及海马内注射BDNF对AD模型大鼠学习记忆能力的影响Fig.4Effects of chronic curcumin and hippocampal BDNF protein injection on the learning and memory abilities of the AD model rats
3 讨论
大量在体及体外相关研究发现,Aβ在AD病理发生发展过程中具有重要作用。AD患者脑内Aβ水平增高与其认知能力的降低有显著关联[6-7]。向啮齿类动物侧脑室内直接注射Aβ1-42可以引起明显记忆缺陷,从而模拟出AD患者的认知能力减弱,因此,脑室内注射Aβ成为一种重要的AD动物模型建立手段[8]。本研究在大鼠脑室内注射Aβ1-42后,在运动能力未受影响的情况下表现出训练潜伏期长,在原平台象限内的时间显著减少,说明脑室内注射Aβ1-42使大鼠空间认知和记忆能力严重受损,较成功建立了大鼠AD模型。
有研究报道,姜黄素具有改善老龄相关的认知能力降低、痴呆和其他情绪障碍的功效,并且介导了突触内多种蛋白的合成[9-10]。HOPPE等[11]在最近的研究中报道,Aβ对海马脑切片中的神经元突触传导造成损害,而姜黄素则可通过调控突触内的蛋白活性如突触素Ⅰ(synapsinⅠ)和钙离子/钙调蛋白依赖的蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)的激活,消除Aβ的有害效果。AD模型动物通常会表现出明显的海马依赖的短时和长时空间学习和记忆能力缺陷[12-13]。Y迷宫是经典的工作记忆(working memory)检测手段之一,其自主改变行为反映了大鼠的短时记忆能力,而Morris水迷宫则是最广泛使用的检测长时空间参考记忆的实验方法[8]。因此,本研究分别采用了Y迷宫和Morris水迷宫检测姜黄素急性、慢性治疗对大鼠认知能力的影响。结果表明,急性治疗和50mg/kg姜黄素慢性治疗对AD大鼠短时记忆和长时记忆均无显著作用,而100~300mg/kg姜黄素慢性治疗可以显著逆转Aβ所造成的学习记忆损害。此外,各组大鼠在旷场实验中的结果均无差别,进一步说明大鼠迷宫实验中的记忆能力改变确实为药物作用的结果,与其活动能力无关。
血清中的BDNF被认为反映了大脑中BDNF的总体水平,研究发现AD患者血清中BDNF比同龄对照人群显著减少,而高水平的血清BDNF则与AD病情严重程度成负相关[14]。对AD患者脑组织检查发现海马内BDNF出现显著降低,这一结果在动物模型中也被证实[15-16]。本研究结果与此一致,即Aβ抑制了海马内BDNF表达,而姜黄素(100~300mg/kg)慢性治疗可以提高海马内BDNF的表达,这提示姜黄素可能是通过调控BDNF来发挥其记忆改善作用。
随后,通过海马内微量注射BDNF蛋白来增强BDNF信号通路,海马内微量注射BDNF shRNA来特异性阻断BDNF基因表达,研究BDNF在姜黄素治疗效应中的作用。结果显示,各组大鼠平均游泳速度没有差别,说明大鼠活动能力正常。水迷宫结果发现注射BDNF蛋白完全模拟了姜黄素对长时程记忆的改善作用,而阻断BDNF表达后姜黄素的治疗作用也被阻断,这提示BDNF可能是姜黄素的必要调控分子。有证据表明BDNF可通过结合于其受体TrkB,继而激活诸多下游信号转导通路,例如CaMKII、ERK等,调控海马神经元突触可塑性并加强学习记忆能力。无论是在AD患者[17]还是AD动物模型中[18],均有报道脑内ERK的mRNA和蛋白表达异常。TONG等[19]曾报导Aβ能抑制许多BDNF诱导的关键转录因子的激活,例如,Aβ通过Ras-MAPK/ERK或PI3K/Akt通路抑制cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的激活,而这些通路都可被BDNFTrkB所调控。据此推测,姜黄素可能是通过上调BDNF的表达,继而激活BDNF-TrkB-ERK-CREB信号通路,最终对Aβ诱导的AD大鼠学习记忆能力起到改善作用。这还需要更多实验证据进行验证。
[1]DEVANAND DP.Whatever happened to new treatments for Alzheimer’s disease?[J].J Clin Psychiatry,2014,75(7):775-776.
[2]ACOSTA D,WORTMANN M.Alzheimer’s Disease International World Alzheimer Report 2009[J].Prince M,2009,4 (5):1-92.
[3]QIN XY,CHENG Y,YU LC,et al.Potential protection of curcumin against intracellular amyloid beta-induced toxicity in cultured rat prefrontal cortical neurons[J].Neurosci Lett,2010,480(1):21-24.
[4]YE J,ZHANG Y.Curcumin protects against intracellular amyloid toxicity in rat primary neurons[J].Int J Clin Exp Med,2012,5(1):44-49.
[5]TYPLT M,MIRKOWSKI M,AZZOPARDI E,et al.Mice with deficient BK channel function show impaired prepulse inhibition and spatial learning,but normal working and spatial reference memory[J].PLoS One,2013,8(11):e81270.
[6]SELKOE DJ.The molecular pathology of Alzheimer's disease [J].Neuron,1991,6(4):487-498.
[7]HARDY J,ALLSOP D.Amyloid deposition as the central event in the aetiology of Alzheimer’s disease[J].Trends Pharmacol Sci,1991,12(10):383-388.
[8]HOPPE JB,CORADINI K,FROZZA RL,et al.Free and nanoencapsulated curcumin suppress beta-amyloid-induced cognitive impairments in rats:involvement of BDNF and Akt/GSK-3beta signaling pathway[J].Neurobiol Learn Mem,2013,106(11):134-144.
[9]SUN CY,QI SS,ZHOU P,et al.Neurobiological and pharmacological validity of curcumin in ameliorating memory performance of senescence-accelerated mice[J].Pharmacol Biochem Behav,2013,105(4):76-82.
[10]XU Y,LIN D,LI S,et al.Curcumin reverses impaired cognition and neuronal plasticity induced by chronic stress[J].Neuropharmacology,2009,57(4):463-471.
[11]HOPPE JB,HAAG M,WHALLEY BJ,et al.Curcumin protects organotypic hippocampal slice cultures from Abeta1-42-induced synaptic toxicity[J].Toxicol In Vitro,2013,27(8):2325-2330.
[12]WANG Y,LIU J,ZHANG Z,et al.Anti-neuroinflammation effect of ginsenoside Rbl in a rat model of Alzheimer disease [J].Neurosci Lett,2011,487(1):70-72.
[13]ZHU X,CHEN C,YE D,et al.Diammonium glycyrrhizinate upregulates PGC-1alpha and protects against Abeta1-42-induced neurotoxicity[J].PLoS One,2012,7(4):e35823.
[14]LASKE C,STELLOS K,HOFFMANN N,et al.Higher BDNF serum levels predict slower cognitive decline in Alzheimer’s disease patients[J].Int J Neuropsychopharmacol,2011,14(3):399-404.
[15]LEE J,FUKUMOTO H,ORNE J,et al.Decreased levels of BDNF protein in Alzheimer temporal cortex are independent of BDNF polymorphisms[J].Exp Neurol,2005,194(1):91-96.
[16]PENG S,WUU J,MUFSON EJ,et al.Precursor form of brainderived neurotrophic factor and mature brain-derived neurotrophic factor are decreased in the pre-clinical stages of Alzheimer’s disease [J].J Neurochem,2005,93(6):1412-1421.
[17]WEBSTER B,HANSEN L,ADAME A,et al.Astroglial activation of extracellular-regulated kinase in early stages of Alzheimer disease[J].J Neuropathol Exp Neurol,2006,65(2):142-151.
[18]DINELEY KT,WESTERMAN M,BUI D,et al.Beta-amyloid activates the mitogen-activated protein kinase cascade via hippocampal alpha7 nicotinic acetylcholine receptors:In vitro and in vivo mechanisms related to Alzheimer’s disease[J].J Neurosci,2001,21(12):4125-4133.
[19]TONG L,BALAZS R,THORNTON PL,et al.Beta-amyloid peptide at sublethal concentrations downregulates brain-derived neurotrophic factor functions in cultured cortical neurons[J].J Neurosci,2004,24(30):6799-6809.
Therapeutic effect of curcumin and hippocampal brain-derived neurotrophic factor on a rat model of Alzheimer’s disease
GENG Xiao-ying,ZHANG Ai-xiang,QIAN Jian,GUO Gang,ZHANG Lu-lu,WANG Jing
(Guangren Hospital Affiliated to Xi’an Jiaotong University;the Fourth Hospital of Xi’an,Xi’an 710004,China)
Objective To study the effect of curcumin on the learning and memory ability in a rat model of Alzheimer’s disease(AD).Methods AD rat model was prepared using intraventricular injection of Aβ1-42.Curcumin was acutely(single injection before the behavioral tests)or chronically(injected for 6 consecutive days)injected intraperitoneally at doses of 50,100 or 300 mg/kg.Brain-derived neurotrophic factor(BDNF)protein (1μg/side)or BDNF shRNA(2×105units/side)was infused into the hippocampus.The behavioral changes in Y-maze,open field test and Morris water maze and the expression of BDNF in the hippocampus were analyzed.Results Acute treatment with curcumin had no significant effects on the spontaneous alteration,locomotor activity or water maze latency of AD rats.AD rats treated chronically with curcumin(300 mg/kg)showed significant elevation in the spontaneous alternation(P<0.000 1)in Y-maze and memory ability in the water maze test(P<0.05)compared with those in the saline group.Chronic treatment with 100 and 300 mg/kg of curcumin induced an increased level of BDNF in the hippocampus as compared with the saline controls(P<0.05 and<0.000 1).Intrahippocampal injection of BDNF significantly decreased the escape latency of AD rats in the water maze(F4,295=5.813,P<0.01).Rats chronically injected with curcumin combined with shBDNF showed no difference in the swimming time inⅡquadrant as compared with saline controls(P=0.657).However,rats in100 mg/kgcurcumin group,BDNF group and sham group had significantly increased swimming time than the saline controls(P<0.05,P<0.05 and P<0.000 1,respectively).Conclusion Curcumin may activate the downstream signaling pathways by upregulating the expression of BDNF and ultimately contribute to the improvement of learning and memory in AD rats.
Alzheimer’s disease;curcumin;hippocampus;brain-derived neurotrophic factor;Y maze;Morris water maze;open field test;shRNA
R741
A
10.7652/jdyxb201602026
2015-03-03
2015-04-21
国家自然科学基金资助项目(No.31100900)Supported by the National Natural Science Foundation of China(No.31100900)
耿晓英.E-mail:gengxiaoying001@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160202.1529.018.html(2016-02-02)
