心肌球源性干细胞对急性心肌梗死的治疗作用及机制*
2016-05-07岳荣川廖翔王伟罗瑜杨德忠张荣驿刘思刘杰曾春雨
岳荣川 廖翔 王伟 罗瑜 杨德忠 张荣驿 刘思 刘杰 曾春雨
心肌球源性干细胞对急性心肌梗死的治疗作用及机制*
岳荣川1廖翔2王伟2罗瑜1杨德忠2张荣驿1刘思1刘杰1曾春雨2
(1.川北医学院附属医院心内科, 四川 南充 637000; 2.第三军医大学大坪医院心血管内科, 重庆 400042)
目的 探讨心肌球源性干细胞(cardiosphere-derived cells,CDCs)在急性心肌梗死模型中的保护作用及机制。方法 建立心肌球源性干细胞的培养方法,将成年的SD大鼠随机分为3组:对照组(假手术)、心梗组(通过结扎冠状动脉前降支建立大鼠心肌梗死模型并向梗死区域周围心肌内注射PBS)和CDCs+心梗组(通过结扎冠状动脉前降支建立大鼠心肌梗死模型并向梗死区域周围心肌内注射CDCs)。检测各组心肌组织中活化的caspase-3蛋白表达水平,通过TUNEL染色检测心肌组织中细胞凋亡情况,通过TTC染色检测各组心肌梗死面积的差异。结果 心肌梗死以后心肌组织中活化的caspase-3蛋白表达水平、凋亡细胞数目及心肌梗死面积均明显增加,而通过向梗死心肌边缘区域注射CDCs能使活化的caspase-3 蛋白表达水平显著降低,凋亡细胞数目明显减少,心肌梗死面积明显减小(均P<0.05)。结论 CDCs可以通过抑制心肌细胞凋亡,减小梗死面积,从而对大鼠急性心肌梗死起到保护作用。
心肌球源性干细胞; 急性心肌梗死; 凋亡
心血管疾病是人类健康的第一杀手,随着经济社会的发展和人口老龄化,我国心血管疾病的患病率持续增加,心肌梗死的发生率也日益升高[1]。心肌梗死导致心肌细胞的凋亡和坏死,大量心肌细胞的丢失会引起一系列复杂的病理过程并最终导致心力衰竭。目前的介入或药物等治疗方法只能延缓心力衰竭的进展,而无法彻底恢复受损的心脏功能[2]。随着新的心肌再生理论的发展,干细胞移植已成为治疗心肌梗死的新策略[3]。近年已有多种干细胞被尝试用于治疗心肌梗死,如诱导多功能干细胞(induced pluripotent stem cells, iPS)、骨髓干细胞(bone marrow stem cells, BMCs)、胚胎干细胞(embryonic stem cell, ESC)等,虽然研究证实这些干细胞可以显著提高心脏功能,改善心室重塑,但也同时存在免疫排斥反应、生存率低、潜在致瘤性等不足[4, 5]。因此,探索新的干细胞治疗策略已成为目前研究的热点问题。
心肌球源性干细胞(cardiosphere-derived cells,CDCs)是从心肌组织中获得的一种具有多向分化潜能的心肌细胞,在哺乳动物出生早期心房中的含量最多。因为具有无免疫排斥反应、良好的心肌分化潜能、低致瘤性、容易获得、易成活等特点,在心肌梗死治疗领域具有很好的应用前景。已有研究表明,CDCs能够明显改善心肌梗死后的心脏功能[6, 7],并认为其发挥保护作用的机制主要与其向心肌细胞及血管细胞的分化有关,因此治疗时机一般选在急性心肌梗死后的第3天。然而其发挥治疗作用的机制是否与其前期的抗凋亡作用有关目前还不清楚,需要进一步地研究证实。此问题的阐释将有助于进一步深入了解CDCs发挥保护作用的机制并优化心肌梗死后CDCs的治疗时机。为此,在本实验中我们成功建立了CDCs培养方法,并在急性心肌梗死发生后立即向心肌组织中注射体外培养的CDCs,48小时以后观察心肌组织中活化的caspase-3蛋白的表达、心肌细胞凋亡率以及心肌梗死面积等指标,以明确CDCs是否可以通过发挥急性期抗凋亡作用而缩小心肌梗死后的梗死面积。
1 材料与方法
1.1 CDCs的培养方法 我们综合现有文献报道[8~10],在实践中不断摸索和调整,并在细节上进行了优化和改进,摸索出了本文所述的CDCs培养方法如下。
1.1.1 物品准备 CGM培养基(按65%DMEM-F12/35%IMDM比例混合液中含7%胎牛血清,0.1 mmol/L巯基乙醇,10 ng/ml表皮生长因子,20 ng/ml碱性成纤维细胞生长因子,40 nmol/L心肌营养素,40 nmol/L凝血酶,100U/ml青霉素,100 μg/ml 链霉素,2 mmol/L L-谷氨酰胺);CEM培养基(IMDM培养基中含有20%胎牛血清,100U/ml青霉素,100 μg/ml 链霉素,2 mmol/L L-谷氨酰胺,0.1 mmol/L巯基乙醇);0.2%胰蛋白酶;0.1%胶原酶IV;无钙镁离子的PBS;0.53 mmol/L EDTA;2mg/ml多聚赖氨酸,1 μg/ml层粘连蛋白,4 μg/ml纤维蛋白连接素。
1.1.2 心肌组织的接种与培养 将剪成小块的大鼠心肌组织用0.2%胰蛋白酶和0.1%胶原酶IV的混合液消化1分钟(37℃),在CEM培养基中进一步将组织块剪碎,然后将细小的心肌组织接种于用层黏连蛋白包被过的细胞培养皿中,向培养皿中加入适量CEM培养基后放入细胞培养箱中进行培养,24小时后补充CEM培养基,之后每两天更换一次培养基。
1.1.3 心肌组织来源的细胞收集与接种 接种于CEM培养基中的心肌组织会爬出两种细胞,一种细胞呈扁平状,紧贴于细胞培养瓶底部向周围扩散;另一种为小圆细胞,分布在心肌组织移植物周围贴敷于扁平细胞之上。用0.05%的胰蛋白酶及0.53 mmol/L EDTA将小圆细胞消化下来,用培养基中和消化,用200目滤网过滤以后将细胞密度调整为1×105/ml后接种于用0.2 mg/ml多聚赖氨酸包被过的24孔板中,观察心肌球的形成情况。
1.1.4 心肌球的收集与接种 将收集的小圆细胞接种于多聚赖氨酸包被过的细胞培养皿后3天左右会观察到心肌球的形成,用培养基及PBS反复轻轻吹打使心肌球脱落后收集于离心管中。然后将心肌球接种于用4μg/ml纤维蛋白连接素包被过的细胞培养瓶中。
1.1.5 CDCs的获得与传代 接种于细胞培养瓶中的心肌球会逐渐向周围爬出大量的细胞就是我们要得到的CDCs,当细胞培养瓶长满以后就可以进行传代,我们将第2代至第6代的细胞用于后续实验之中。
1.2 心梗模型的建立及干细胞移植
1.2.1 实验动物 雄性Sprague-Dawley(SD)大鼠(180~200 g)由第三军医大学第三附属医院实验动物中心提供。动物的饲养和实验遵守第三军医大学实验动物管理和使用规定并遵循中国实验动物管理条例(1998 年卫生部第 55 号文件)。实验动物自由进食、饮水,饲养于定湿、定温的动物室内,实验前禁食 12小时,实验在室温条件下进行。
1.2.2 心梗模型建立 按我们之前的实验方法[11],通过腹腔注射戊巴比妥钠(50 mg/kg)将大鼠麻醉,给予呼吸机支持呼吸,胸前备皮,用碘酒、酒精消毒手术区皮肤,于左侧胸前第四五肋间剪开皮肤(横向)约3厘米,剪肋间第一二层肌肉,稍加分离,钝性分离肋间第三层肌肉,上开胸器暴露心脏,分开心包膜,于左心耳下2~3毫米处结扎冠状动脉左前降支,结扎后可见左心室前壁组织由红色变为黄白色证明结扎成功;如颜色未变,需重新结扎1次。选择缺血区域周围的4个部位,向心肌中注射CDCs(将2 × 106个CDCs混悬于100 μl PBS中)或等量PBS。
1.3 estern blot检测激活的caspase-3蛋白表达 心梗48小时后,根据我们之前的方法提取坏死周边区域心肌组织蛋白[11, 12],按BCA试剂盒说明书测定蛋白浓度并将蛋白定量、分装。取等量蛋白,SDS-PAGE凝胶电泳后将分离的蛋白质转移至PVDF膜上,用脱脂奶粉封闭2 小时,分别加入caspase-3 单克隆抗体和内参照蛋白GAPDH,4℃孵育过夜,洗膜后加入与一抗相匹配的二抗,室温下避光孵育1 小时,再次洗膜后利用ODYSSEY-红外凝胶扫描系统扫描NC膜显示条带,通过条带的灰度值进行定量分析。
1.4 心肌组织TUNEL染色 心梗手术48小时后将心脏取出,置于4%多聚甲醛溶液中继续固定24 小时。将固定后的组织进行梯度脱水后石蜡包埋。然后做组织切片,参照我们之前的实验方法[13, 14],用末端脱氧核苷酰基转移酶介导性dUTP切口末端标记(TUNEL)和DAPI共染色的方法检测坏死周边区域心肌细胞凋亡发生情况。
1.5 TTC染色计算心肌梗死面积 参照我们之前的实验方法[11],先用PBS配制1%的TTC溶液置于冰上避光备用,心梗手术48小时以后将心脏迅速取出,放在-80℃冰箱中冷冻10分钟,然后用刀片自心尖至心底依次垂直于长轴横切成1 mm左右的心肌片段,接着将心肌片浸入1%TTC溶液中,放入37℃恒温箱中孵育10 分钟,再用4%多聚甲醛固定8小时,最后照相,统计心肌梗死面积。
2 结果

图1 大鼠心肌球接种及CDCs的扩增方法
Figure 1 Specimen processing for rat cardiosphere growth and CDC expansion
2.1 大鼠心肌球接种及CDCs的培养 大鼠的心脏取出(图1A)后置于冰的PBS液中,将心肌组织剪碎后种植于铺有层黏连蛋白处理过的细胞培养皿中(图1B),7天后可见到心肌组织会爬出两种细胞,一种细胞呈扁平状,紧贴于细胞培养皿底部向周围扩散,另一种为小圆细胞,分布在心肌组织移植物周围贴敷于扁平细胞之上(图1C、D),将小圆细胞收集后接种于多聚赖氨酸包被过的细胞培养板后3天左右会观察到心肌球的形成(图1E、F),将心肌球细胞收集种于用纤维蛋白连接素包被过的细胞培养瓶中(图G),4天后可以看到从心肌球扩增出大量的细胞(图H),就是我们所需要的CDCs。
2.2 活化的caspase-3蛋白表达水平的变化 由图2中Western Blot的结果可见,与对照组(0.05±0.02)相比,行心肌梗死手术大鼠心肌组织中活化的caspase-3蛋白的表达水平(0.24±0.04)明显升高(P<0.05)。而心肌梗死后注射CDCs能使心肌组织中活化的caspase-3蛋白的表达水平明显降低(0.14±0.02),差异有统计学意义(P<0.05)。
2.3 不同组心肌组织中细胞凋亡率的变化 我们通过TUNEL染色对不同处理大鼠心肌组织中的细胞凋亡率进行检测。与对照组(0.7±1.2%)相比,心肌梗死组大鼠心肌组织中TUNEL阳性细胞比例[(16.3±2.1)%]明显增加(P<0.05)。然而心肌梗死后注射CDCs能使心肌组织中TUNEL阳性细胞比例明显下降[(9.1±2.1)%],差异有统计学意义(P<0.05,图3)。

图2 CDCs对活化的caspase-3蛋白水平的影响
Figure 2 The effects of CDCs on protein levels of activated caspase-3
注:n=6, 与对照组比较,①P<0.05 ; 与心梗组比较,②P<0.05
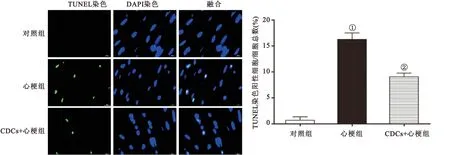
图3 CDCs对心梗后心肌中TUNEL阳性细胞比例的影响
Figure 3 The effects of CDCs on the rate of TUNEL positive cells in myocardial tissue
注:n=6, 与对照组比较,①P<0.05 ; 与心梗组比较,②P<0.05
2.4 不同组心肌梗死面积的比较 与对照组[(0±0)%]相比,行心梗手术组的大鼠心肌的梗死面积[(27.2±5.5)%]明显增加(P<0.05)。与单纯心肌梗死组相比,心梗手术后立即注射CDCs组的大鼠的心肌梗死面积[(17.8±5.7)%]明显减小(P<0.05,图4)。
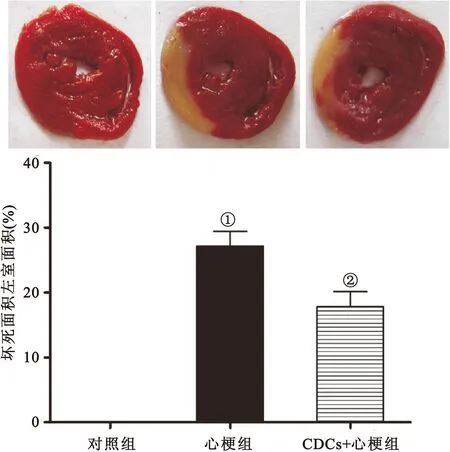
图4 CDCs对心梗后心肌梗死面积的影响
Figure 4 The effects of CDCs on infarct size after myocardial infarction
注:n=6, 与对照组比较,①P<0.05 ; 与心梗组比较,②P<0.05
3 讨论
心肌梗死以后的病理过程主要分为两个阶段,急性期主要以大量的心肌细胞凋亡或坏死为主,而在代偿期会不可逆地发生心肌组织重构,重构过程一般在心梗以后1周开始,4周左右逐渐趋于稳定[15, 16]。再灌注策略的主要目的是在急性期尽可能挽救心肌,减少心肌细胞的凋亡和坏死,很多药物治疗的目的则是基于延缓心肌重构的进程[16]。
新兴的干细胞治疗策略寄希望于干细胞能够分化成为心肌细胞、血管细胞等以实现心肌再生,从根本上抑制心肌重构的进程。同时也有另外的观点认为,植入的干细胞向心肌细胞及血管细胞的分化能力有限,其改善心脏功能的作用主要与其旁分泌的作用有关(通过旁分泌因子到周围组织,发挥保护作用)[17~19]。
传统观念认为,成年心肌组织是不可再生的,心脏不能进行内源性的修复。然而近年来科学家们发现了心脏干细胞的存在,可以向心肌、内皮及平滑肌分化[20]。Messina E等[8]率先将心脏组织块进行培养,之后收集向外生长的小圆细胞,将这些收集的细胞进一步培养,获得球样成簇的细胞团,称为心肌球,然后将心肌球放置于铺有纤维连接蛋白的培养瓶中进一步培养,向外生长的细胞称为CDCs。CDCs具有多项分化潜能,并且具有无免疫排斥反应、良好的心肌分化潜能、低致瘤性、容易获得等特点。因此,被认为是一种治疗心血管疾病颇有前景的心脏干细胞。既往已经有研究证明其对心肌梗死具有治疗作用,但目前的研究方向主要集中于其向心肌细胞及血管细胞的分化能力上,其保护作用是否与抗凋亡作用有关,目前还不清楚[21, 22]。为了进一步明确其对心肌梗死的保护作用是否与改善急性期的心肌细胞凋亡与坏死有关,我们在国内率先成功建立了CDCs的培养方法,并在心肌梗死后立即向缺血心肌周围注射培养的CDCs,观察其对急性期心肌梗死是否具有保护作用。
我们对心肌组织中活化的caspase-3蛋白表达水平、心肌细胞凋亡以及心肌梗死面积进行了检测,发现心肌梗死后立即向梗死心肌周围组织注射CDCs能使心肌组织中caspase-3蛋白表达水平明显降低,使心肌组织中的凋亡细胞比例明显降低,最终使心肌梗死面积明显减小。
4 结论
CDCs可以通过抑制急性心肌梗死后引起的心肌细胞凋亡来减小心肌梗死面积,从而对心肌梗死起到保护作用。
[1]Moran A, Gu D, Zhao D,etal. Future cardiovascular disease in china: markov model and risk factor scenario projections from the coronary heart disease policy model-china[J]. Circulation Cardiovascular quality and outcomes, 2010, 3(3):243-252.
[2]Christoffels V Regenerative medicine. Muscle for a damaged heart[J]. Nature, 2011, 474(7353):585-586.
[3]Angoulvant D, Ivanes F, Ferrera R,etal. Mesenchymal stem cell conditioned media attenuates in vitro and ex vivo myocardial reperfusion injury[J]. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation, 2011, 30(1):95-102.
[4]Henning RJ. Stem cells in cardiac repair[J]. Future cardiology, 2011, 7(1):99-117.
[5]Deveza L, Choi J, Imanbayev G,etal. Paracrine release from nonviral engineered adipose-derived stem cells promotes endothelial cell survival and migration in vitro[J]. Stem cells and development, 2013, 22(3):483-491.
[6]Segers VF, Lee RT. Stem-cell therapy for cardiac disease[J]. Nature, 2008, 451(7181):937-942.
[7]Nguyen BK, Maltais S, Perrault LP,etal. Improved function and myocardial repair of infarcted heart by intracoronary injection of mesenchymal stem cell-derived growth factors[J]. Journal of cardiovascular translational research, 2010, 3(5):547-558.
[8]Messina E, De Angelis L, Frati G,etal: Isolation and expansion of adult cardiac stem cells from human and murine heart[J]. Circulation research, 2004, 95(9):911-921.
[9]Smith RR, Barile L, Cho HC,etal. Regenerative potential of cardiosphere-derived cells expanded from percutaneous endomyocardial biopsy specimens[J]. Circulation, 2007, 115(7):896-908.
[10] de Couto G, Liu W, Tseliou E,etal. Macrophages mediate cardioprotective cellular postconditioning in acute myocardial infarction[J]. The Journal of clinical investigation, 2015, 125(8):3147-3162.
[11] Yue R, Xia X, Jiang J,etal. Mitochondrial DNA oxidative damage contributes to cardiomyocyte ischemia/reperfusion-injury in rats: cardioprotective role of lycopene[J]. Journal of cellular physiology, 2015, 230(9):2128-2141.
[12] Luo T, Yue R, Hu H,etal. PD150606 protects against ischemia/reperfusion injury by preventing mu-calpain-induced mitochondrial apoptosis[J]. Archives of biochemistry and biophysics, 2015,62(5):1641-1653.
[13] Yue R, Hu H, Yiu KH,etal. Lycopene protects against hypoxia/reoxygenation-induced apoptosis by preventing mitochondrial dysfunction in primary neonatal mouse cardiomyocytes[J]. PloS one, 2012, 7(11):e50778.
[14] Hu H, Xenocostas A, Chin-Yee N,etal. Transfusion of fresh but not old stored blood reduces infarct size and improves cardiac function after acute myocardial infarction in anemic rats[J]. Critical care medicine, 2012, 40(3):740-746.
[15] Dobaczewski M, Bujak M, Zymek P,etal. Extracellular matrix remodeling in canine and mouse myocardial infarcts[J]. Cell and tissue research, 2006, 324(3):475-488.
[16] Reddy K, Khaliq A, Henning RJ. Recent advances in the diagnosis and treatment of acute myocardial infarction[J]. World journal of cardiology, 2015, 7(5):243-276.
[17] Bartolucci J, Verdugo FJ, Larrea R,etal. Figueroa FE: Stem cells for the treatment of cardiovascular diseases An update[J]. Revista medica de Chile, 2014, 142(8):1034-1046.
[18] Liao SY, Tse HF. Multipotent (adult) and pluripotent stem cells for heart regeneration: what are the pros and cons[J]. Stem cell research & therapy, 2013, 4(6):151.
[19] Atsma DE, Fibbe WE, Rabelink TJ. Opportunities and challenges for mesenchymal stem cell-mediated heart repair[J]. Current opinion in lipidology, 2007, 18(6):645-649.
[20] Tang XL, Rokosh G, Sanganalmath SK,etal. Intracoronary administration of cardiac progenitor cells alleviates left ventricular dysfunction in rats with a 30-day-old infarction[J]. Circulation, 2010, 121(2):293-305.
[21] Kreke M, Smith RR, Marban L,etal. Cardiospheres and cardiosphere-derived cells as therapeutic agents following myocardial infarction[J]. Expert review of cardiovascular therapy, 2012, 10(9):1185-1194.
[22] Sousonis V, Nanas J, Terrovitis J. Cardiosphere-derived progenitor cells for myocardial repair following myocardial infarction[J]. Current pharmaceutical design, 2014, 20(12):2003-2011.
Cardiosphere-derived cell therapy for treatment of acute myocardial infarction
YUE Rongchuan, LIAO Xiang,WANG wei,etal
(1.DepartmentofCardiology,NorthSichuanMedicalCollegeAffiliatedHospital,Nanchong637000,Sichuan,China;2.DepartmentofCardiology,DapingHospital,TheThirdMilitaryMedicalUniversity,Chongqing400042,China)
Objective To investigate the protective role and mechanism of cardiosphere-derived cells (CDCs) in acute myocardial infarction. Methods CDCs were got from rat heart tissue. Adult male SD rats were divided into control group, MI group (LAD was permanently ligated and CDCs+MI group (CDCs were injected into 4 regions within ischemic border zone after LAD was permanently ligated). Then, the protein level of activated caspse-3, the apoptosis rate of myocardial cells, and the infarct area of the heart were determined in these groups. Results Compared with control, the protein level of activated caspse-3, the apoptosis rate of myocardial cells, and the infarct area of the heart were significantly increased in the MI groups (P<0.05). However, these effects were abolished by CDCs treatment(P<0.05). Conclusion CDCs were suggested to be a promising cell source to repair acute myocardial infarction through inhibiting apoptosis.
Cardiosphere-derived cells; Acute myocardial infarction; Apoptosis
国家自然科学基金(81100111)
王伟,E-mail: 13883117310@163.com
R -33;R 542.2+2
A
10.3969/j.issn.1672-3511.2016.03.008
2015-12-01; 编辑: 母存培)
