上调Cx43对心肌细胞间通讯及离子通道的影响*
2016-05-07唐良虎李德杨大春王强马双陶张彦
唐良虎 李德 杨大春 王强 马双陶 张彦
上调Cx43对心肌细胞间通讯及离子通道的影响*
唐良虎1李德2杨大春2王强2马双陶2张彦2
(1.四川医科大学, 四川 泸州 646000;2.成都军区总医院心内科, 四川 成都 610083)
目的 通过重组腺病毒介导缝隙连接蛋白Cx43在体外培养的心肌细胞中过度表达,观察心肌细胞间通讯及细胞离子通道变化。 方法 通过RT-PCR法克隆SD大鼠缝隙连接蛋白Cx43基因的全长cDNA,用基因重组的方法构建腺病毒pAdEasy-1-Cx43。行心肌细胞基因转染后,分别用RT-PCR和蛋白质免疫印迹技术检测Cx43在心肌细胞中的mRNA和蛋白表达,用免疫荧光技术分析Cx43在心肌细胞膜上的分布。采用划痕标记荧光染料示踪(SLDT)技术观察培养心肌细胞群之间的罗氏黄(lucifer yellow, LY)染色传输,检测上调Cx43对心肌细胞间通讯的影响;采用单细胞膜片钳技术分析各离子通道电流的变化,观察上调Cx43对心肌细胞膜离子通道表达的影响。 结果 腺病毒重组质粒pAdEasy-1-Cx43构建成功;转染心肌细胞后,pAdEasy-1-CX43转染组Cx43 mRNA及蛋白表达上调,且心肌细胞膜上分布较多;细胞划痕荧光染料示踪提示转染后,心肌细胞间通讯增强;膜片钳全细胞膜电流提示转染后钙内流降低,钾离子电流未发现有明显改变。 结论 成功构建腺病毒重组质粒pAdEasy-1-Cx43载体,隙连接蛋白Cx43表达上调增强了心肌细胞间通讯以及钙内流,为Cx43改善心室肌电重构,减少或预防室性心律失常发生的进一步研究打下了基础。
重组腺病毒转染; 缝隙连接蛋白Cx43; 细胞划痕荧光染料示踪; 细胞间通讯; 膜片钳
缝隙连接是心肌细胞间唯一具有电连接作用的细胞间连接形式,其位于心肌细胞的闰盘处, 由两侧细胞膜上的连接蛋白(connexin, Cx)构成的连接子以非共价键对接而成。在人类心脏组织中,连接蛋白的亚型主要有:Cx43、 Cx40、 Cx45、Cx46和Cx37等,其中前3种是主要亚型。Cx43是心室工作肌细胞的主要连接蛋白[1,2]。相邻细胞间通过缝隙连接进行着信息和能量物质的交换,参与细胞间物质交换的代谢偶联和电信号传递的电偶联,对细胞的新陈代谢、内环境稳定、增殖和分化等生理过程起着重要的调控作用[3]。
随着急性心肌梗死近期救治水平的提高和人群年龄结构老龄化,慢性心力衰竭的患病率正在逐年升高,严重威胁国人生命健康。目前室性心律失常的发病机制尚不完全明确。学者们逐渐认识到心力衰竭患者的高死亡率与恶性室性心律失常的发生密切相关[2]。近十余年来的研究提示,心室肌细胞间电耦联的改变可能与心律失常的发生关系紧密[1,4~6]。在各种心力衰竭动物模型及心力衰竭患者的衰竭心肌中均发现心室肌细胞缝隙连接蛋白-43(connexin-43, Cx43)的表达显著下调。缝隙连接数量减少可导致心室肌细胞间通讯及电传导异常,从而引发室性心律失常[4]。Cx43的减少及异质性分布增加了心室肌传导的不均一性和改变了细胞膜离子通道特性,使心律失常更容易发生。心力衰竭时缝隙连接重构导致心室肌细胞间电耦联的改变可能与室性心律失常的发生有密切关系[7,8]。然而Cx43表达异常导致心律失常的具体机制尚不清楚。Cx43表达异常除了改变心室肌细胞间电耦联外,是否对心室肌细胞离子通道、细胞内钙调节产生影响?逆转Cx43下调是否能改善其异质性分布从而改善心肌细胞的电传导及细胞离子通道重构?这些问题目前均不清楚,国内外也未见相关研究报道。据此,我们采用基因转导技术,上调缝隙连接蛋白Cx43的表达,检测重建心肌细胞间缝隙连接通讯,同时观察心室肌细胞离子通道、细胞内钙离子电流的变化调节同时,以期改善心力衰竭时心室肌的电重构,从而减少或预防室性心律失常的发生。
1 材料和方法
1.1 主要试剂 cDNA Synthesis Kit、Ex Taq、5kb DNA Marker、λ-hind III Marker、SYBR®Premix Ex Taq购自TAKARA 公司;pShuttle-CMV、pAdEasy-1购自Strategene公司;DH10b 为实验室保存;BJ5183购自上海北诺生物科技有限公司;293 cell 购自上海细胞库;Pme I、Pac I、BglII、XhoI 购自 fermentas公司;Lipo2000、Trizol 购自invitrogen公司;Qiagen Plasmid Mini Kit 购自Qiagen公司;Kan、Amp sigma购自公司;琼脂糖胶和PCR产物纯化系统购自 promega公司;Lucifer Yellow 购自sigma公司;DMEM 培养基、PBS、胰蛋白酶购自hyclone公司;6孔细胞培养板 购自corning 公司; Anti-Connexin 43 / GJA1 antibody 购自abcam (ab11369);SD大鼠购自成都达硕公司;iPatch 购自Flyion公司。
1.2 携带Cx43基因重组腺病毒的构建、扩增及纯化 大鼠眼总RNA提取后根据已报道的Cx43序列设计合成引物,设计引物时引入需要的Bgl-II和Xhol酶切位点,采用RT-PCR法制备Cx43基因全长cDNA。采用Bgl-II和Xhol双酶切Cx43 cDNA和pAdTrackCMV,然后用T4DNA连接酶将Cx43 cDNA连接到pAdTrackCMV上,构建pAdTrackCMV/Cx43重组子,并进行酶切鉴定及外源基因测序。将重组穿梭质粒pAdTrackCMV/Cx43转化Adeasier-1细菌即可获得重组腺病毒质粒pAdEasy-1/Cx43。采用限制性内切酶Pac-I酶切pAdEasy-1/Cx43,经脂质体介导转染293细胞,即可包装产生以CMV为启动子带有目的基因Cx43及绿色荧光蛋白(GFP)基因的重组腺病毒Ad-Cx43-GFP。以抽提的重组腺病毒DNA作模板,用Cx43引物进行PCR鉴定。用经鉴定正确的重组腺病毒Ad-Cx43-GFP感染293细胞进行大量扩增,采用氯化铯梯度离心获得高滴度的纯化重组腺病毒。
1.3 乳鼠心肌细胞的培养及重组腺病毒转染心肌细胞 取新生3天以内的SD乳鼠(成都达硕实验动物公司),心肌细胞的培养按Simpson等[6]的方法进行,分别培养于35mm2培养皿和24孔培养板中,培养3天待生长融合至80%后用于实验。取纯化好的重组腺病毒50μl,加入培养有乳鼠心肌细胞的6孔板中,在37℃、5%CO2条件下继续培养36~48小时。
1.4 RT-PCR检测Cx43的mRNA表达 取两瓶细胞铺满瓶底90%的培养瓶,一瓶转染腺病毒,一瓶为空白对照组,按照 Trizol试剂盒说明提取总RNA。荧光定量PCR检测Cx43 :引物设计序列如下(5′ to 3′):GAPDH 上游引物:GGACCTCATGGCCTACATGG ,GAPDH 下游引物:GGACCTCATGGCCTACATGG; CX43 上游引物:TTTCATTGGGGGAAAGGCGT CX43,下游引物:GCAGACTGTTCATCACCCCA ; mRNA反转录合成cDNA:在 Microtube 中配制下列混合液:Oligo dT Primer (50μM) 1μl,dNTP Mixture 1μl,模板 RNA 5mg以下,Rnase Free dH2O 加至10μl,65℃保温 5 min 后,冰上迅速冷却;在上述 Microtube 管中配制反转录反应液,5×PrimeScriptTMbuffer (for real time) 4μl,Rnase Inhibitor (40U/μl) 0.5μl,PrimeScript Ⅱ RTase (200U/μl) 1μl,Rnase Free dH2O 加至20μl,缓慢混匀,30℃(10 min),-20℃保存cDNA进行反转录反应;RT-PCR反应体系:10× PCR Buffer 2.5μl,25mM Mg2+1.5μl,dNTP Mixture 0.5μl,Sense primer1μl,Anti-sense primer1μl,Taq 0.2μl,cDNA1.5μl, dH2O 16.8μl; PCR反应参数: Cycle 1:(1×) 94℃,3~4min ,Cycle 2:(30×)94℃ 30s ,60℃ 30s,72℃ 30s;Cycle 3:(1×) 72℃ 10min,16℃ ∞。
1.5 Western-blot法检测心肌细胞中Cx43的蛋白表达 取两瓶细胞铺满瓶底90%的培养瓶,一瓶转染腺病毒,一瓶为空白对照组,提取蛋白后根据样品浓度上样,进行SDS聚丙烯酞胺凝胶电泳后转PVDF膜,将PVDF膜放入5% TBST脱脂牛奶中在室温下封闭2小时,滴加Cx43单克隆抗体(一抗浓度为1∶2000)后置于4°C冰箱内过夜,然后加入辣根过氧化物酶标记的二抗(二抗浓度为1∶1500)并继续在室温下孵育2小时,采用增强化学发光的方法将PVDF膜显色后显影于X线胶片上。用凝胶图像分析系统获取蛋白质信号条带图像后,测定目的蛋白Cx43和内参蛋白GAPDH的光密度值,计算两者的比值作为Cx43蛋白的表达水平。
1.6 免疫荧光检测Cx43蛋白在心肌细胞中的表达分布情况。
1.7 划痕荧光染料示踪(SLDT)技术观察培养的心肌细胞群之间的LY染色传输 将处于对数生长期的细胞用0.25%胰蛋白酶消化后接种细胞在6 孔板内,保证细胞在次日为单层细胞密度饱和,设3 个重复孔。24小时后弃培养液,以PBS 洗4 次,弃净液体。将细胞浸泡在含0.05% Lucifer Yellow的PBS 液内,每孔2ml。用锐利刀刃轻轻划痕,放置3min。弃净液体,并以PBS 洗4 次,立即用倒置荧光显微镜观察摄像,KP490 滤光片观察黄色荧光,同一视野取黄色荧光和普通光2种图像进行对照。计数荧光染料从划痕边沿细胞向邻近细胞传递的列数,数目大小表征通讯功能强弱。
1.8 膜片钳实验 采用全细胞膜片钳技术分析各离子通道电流的变化。
2 结果

图1 pShuttle-CMV-Cx43的构建
Fig 1 Construction of pShuttle-CMV-Cx43
注:A.Cx43 RT-PCR产物的鉴定;B.Cx43及pShuttle-CMV双切酶;C.重组腺病毒pAdEasy-1-Cx43 pac I酶切鉴定
2.1 腺病毒重组质粒pAdEasy-1-Cx43的构建 图1A示Cx43基因的全长cDNA(1149bp)克隆成功;图1B示重组质粒pShuttle-CMV经限制性内切酶BglII和XhoI双酶切,得到Cx43 1149bp、pShuttle-CMV (7.5kbp) 线状质粒,提示目的基因及pShuttle-CMV 质粒酶切成功;图1C示腺病毒重组质粒pAdEasy-1-Cx43 用pac I酶切成功。
2.2 腺病毒重组质粒pAdEasy-1-Cx43转染心肌细胞后Cx43的表达 与对照组相比,图2A示pAdEasy-1-Cx43转染组Cx43的mRNA表达明显增加;图2B、2C示pAdEasy-1-Cx43转染组的Cx43蛋白表达明显增加;图2D示pAdEasy-1-Cx43转染组Cx43蛋白表达明显上调,且多表达于胞质中,差异均有统计学意义(均P<0.05)。
2.3 Cx43对心肌细胞细胞间通讯的影响 图3示空白对照组荧光传至划痕邻近第4列细胞以外,而pAdEasy-1-Cx43转染组荧光传至划痕邻近第11或第12列细胞,提示Cx43过表达后心肌细胞细胞间通讯增强,差异有统计学意义(P<0.05)。
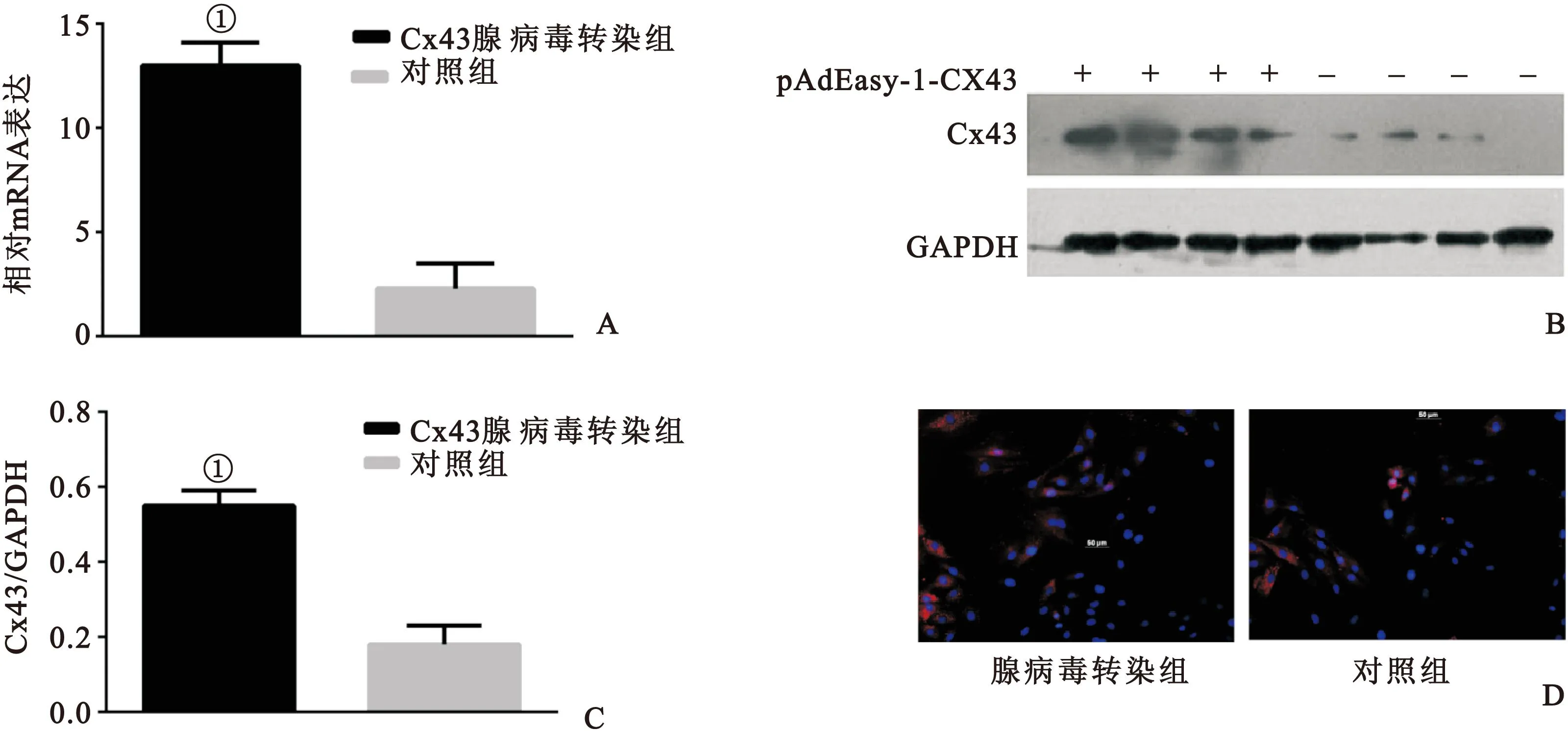
图2 腺病毒的鉴定
Fig.2 Identification of adenovirus
注:A.心肌细胞腺病毒转染组与对照组Cx43mRNA表达;B和C.腺病毒转染组与对照组Cx43蛋白表达;D.免疫荧光检测Cx43蛋白(n=4,与对照组比较,①P<0.01)
2.4 膜片钳记录全细胞膜电流 与对照组相比,图4示pAdEasy-1-Cx43转染组的钙内流有所降低,钾离子电流未发现有明显改变。
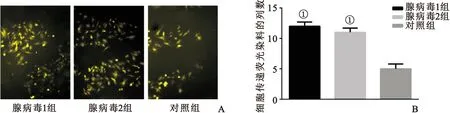
图3 A和B.细胞划痕荧光染料示踪(SLDT)检测细胞间通讯情况(n=4,与对照组比较,①P<0.05)
Fig 3 A and B.Inter-cellular communication was observed by Scrape-Loading and Dye Transfer Technique
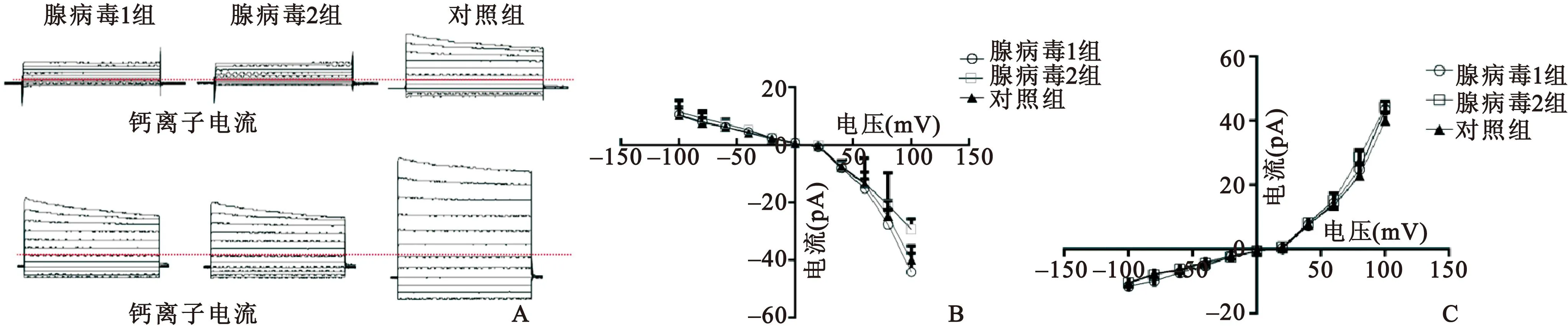
图4 转染Cx43对细胞钙离子及钾离子电流的影响注
Fig 4 The changes of Ca+and K+after Cx43 transfection
注:A.膜片钳全细胞膜电流的检测;B.钙离子及钾离子Ⅰ~Ⅴ曲线图
3 讨论
既往对Cx43的研究均采用基因敲除和基因沉默的方法,而本实验采用基因转导和过表达技术逆转缝隙连接蛋白Cx43的表达,重建心肌细胞间缝隙连接通讯,在研究策略的选择和应用上有一定创新性。腺病毒载体具有体内外转染效率高,感染细胞范围广,可感染静止期和分裂期细胞,同时又不整合到宿主细胞基因组中,病毒滴度高,易于浓缩和贮存等优点,而成为基因治疗和临床实验的重要载体[9,10]。本实验应用的pAdEasyXL腺病毒载体包装系统大大提高了质粒pAdEasy-1与重组穿梭质粒pShuttle-CMV-Cx43的同源重组成功率。HEK293细胞中缺乏核酸内切酶和重组酶,重组腺病毒质粒在其中扩增就大大提高了提取质粒的量和确保外源基因插入的稳定性,所以此包装系统方法简便,同源重组效率高,并且快速,实验周期短,能够得到高滴度的重组腺病毒,为Cx43的腺病毒重组质粒构建打下了基础。
目前室性心律失常的发病机制尚不完全明确。既往认为心力衰竭时心室肌细胞膜离子通道的紊乱及Ca2+循环异常是引发室性心律失常的直接原因[11~13]。但近十余年来的研究提示,心室肌细胞间电耦联的改变可能与心律失常的发生关系更为紧密。现有实验证据表明,心力衰竭时心室肌细胞间缝隙连接(gap junction, GJ)会发生重构,从而导致心肌细胞电生理特性发生改变,进一步促进室性心律失常的发生[14,15]。在各种心力衰竭动物模型及心力衰竭患者的衰竭心肌中均发现心室肌细胞缝隙连接蛋白-43(connexin-43, Cx43)的表达显著下调。缝隙连接数量减少可导致心室肌细胞间通讯及电传导异常,从而引发室性心律失常[16]。本研究通过上调缝隙连接蛋白Cx43的表达,发现心肌细胞间缝隙连接通讯增强,其是否能减少或预防室性心律失常的发生,为心力衰竭患者发生室性心律失常及猝死的预防另辟蹊径。
然而Cx43表达异常导致心律失常的机制尚不清楚。缝隙连接对于以合胞体方式工作的心肌细胞而言,不仅是细胞间连接的一种形式, 还是电信号快速传导的低电阻通道, 它确保了心肌电机械活动的同步有序进行[17,18]。因而推测心肌细胞缝隙连接分布和数量的改变都对心律失常的发生有着重要影响。有学者认为,心肌细胞缝隙连接通道在决定传导速度方面可能比离子流的作用更大[19~23]。因此,我们通过全细胞膜电流技术观察心肌细胞膜离子流,发现通过上调缝隙连接蛋白Cx43的表达,心肌细胞钙离子电流减低,钾离子电流没有明显变化,所以我们认为Cx43表达异常除了改变心室肌细胞间电耦联外,可能对心室肌细胞离子通道、细胞内钙调节产生了影响,从而进一步导致室性心律失常的发生。
4 结论
通过基因转导技术,利用重组腺病毒构建pAdEasy-1-Cx43载体转染心肌细胞后,缝隙连接蛋白Cx43表达上调增强了心肌细胞的细胞间通讯以及钙内流,钙离子电流降低,而对钾离子电流的影响不明显。为Cx43改善心室肌电重构,减少或预防室性心律失常发生的进一步研究打下基础。而Cx43的上下游分子及信号通路仍不是太清楚,需要进一步深入研究探讨。
[1]Zhang Y, Wang, HT, Kovacs A,etal. Reduced expression of Cx43 attenuates ventricular remodeling after myocardial infarction via impaire- d TGF-β signaling[J]. Am J Physiol Heart Circ Physiol, 2010, 298:H477 -H487.
[2]Sepp R, Severs NJ, Gourdie RG. Altered patterns of cardiac interce llular junction distribution in hypertrophic cardiomyopathy[J]. Heart,1996,76: 412-417.
[3]Salameh A, Krautblatter S, Karl S,etal.The signal transduction cascade regulating the expression of the gap junction protein connexin43 by β-adrenoceptors[J]. Br J Pharmacol, 2009,158: 198-208.
[4]Wen HZ, Jiang H, Lu ZB,etal. Carvedilol Ameliorates the Decreases in Connexin 43 and Ventricular Fibrillation Threshold in Rats with Myocardial Infarction[J]. The Tohoku Journal of Expe rimental Medicine,2009, 218: 121-127.
[5]Delmar M and Makita N. Cardiac connexins mutations and arrhyth mias[J]. Curr Opin Cardiol, 2012,27: 236-241.
[6]Palatinus JA, Rhett JM and Gourdie RG.The connexin43 carboxylterminus and cardiac gap junction organization[J].Biochim Biophys Acta,2012,1818: 1831-1843.
[7]Kostin S, Dammer S, Hein S,etal. Connexin 43 expression and distribution in compensated and decompensated cardiac hypertro phy in patients with aortic stenosis[J]. Cardiovascular Research, 2004, 62: 426- 436.
[8]Simpson P,Savion S. Differentiatron of rat myoeytes in single ce11 cultures with and without proliferating nonmyoeardlal cells.Cross-striations, ultrastrueture,and chronotropic response to isoprotoronol [J].CirRes,1982, 50(1):101-126.
[9]李德,伍卫,周淑娴.FKBP12.6重组腺病毒载体的构建及其心肌细胞感染效率测定[J].中山大学学报(医学科学版), 2006,27:271-275.
[10] Noguchin,Xu G,Matsumotos,etal.Induction of pancreatic stem/progenitor cells into insulin-producing cells by adenoviralmedi ated gene transfer technology[J]. Cell Transplant, 2006,15(10): 929-938.
[11] Moffitt JA, Henry MK, Welliver KC,etal. Hind limb unloading results in increased predisposition to cardiac arrhyth mias and alters left ventricular connexin 43 expression[J]. Am J Physiol Regul Integr Comp Physiol, 2013,304:R362-R373.
[12] Yi SL, Zhong JQ, Zhang J,etal. ZP123 reduces energy required for defibrillation by preventing connexin43 remodeling during prolonged ventricular fibrillation in swine[J]. Tex Heart Inst J,2012,39:784-791.
[13] Liu HZ, Zhong JQ, Li JS,etal. Changes in myocardial connexin 43 during ventricular fibrillation[J]. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue, 2010,22:595-598.
[14] Wayakanon P, Bhattacharjee R, Nakahama K,etal.The role of the Cx43 Cterminus in GJ plaque formation and in ternalization[J]. Bioc hem Biophys Res Commun, 2012,420: 456-461.
[15] Axelsen LN, Lademann JB, Petersen JS,etal. Cardiac and metabolic changes in long-term high fruct osefat fed rats with severe obesity and extensive intramyocardial lipid accumulation[J]. Am J Physiol Regul Integr Comp Physiol, 2010,298:R1 560-R1570.
[16] Ai X, Pogwizd SM. Connexin 43 downregulation and dephosphorylation in nonischemic heart failure is associated with enhanced colocalized p rotein phosphatase type 2A[J]. Circ Res, 2005, 96: 54-63.
[17] Akar FG, Spragg DD, Tunin RS,etal. Mechanisms underlying con du ction slowing and arrhythmogenesis in nonischemic dilated car diomyopathy[J]. Circulation Research, 2004, 95: 717-725.
[18] Li JS, Zhong JQ, Zeng QX,etal. Effect of ZP123, a gap junction m odifier, on prolonged ventricular fibrillation in swine[J]. Cardiology, 2011, 118:147-152.
[19] 李德,伍卫,黄至斌,等.FK506结合蛋白12.6基因转染对心力衰竭心 肌细胞钙通道和钠钙交换电流的影响[J]. 中国心脏起搏与心电生理杂志,2009, 23:237-240.
[20] Wit AL and Peters NS.The role of gap junctions in the arrhythm ias of ischemia and infarction[J]. Heart Rhythm, 2012,9: 308-311.
[21] Roell W, Lewalter T, Sasse P,etal. Engraftment of connexin 43 expr- essing cells prevents post-infarct arrhythmia[J]. Nature, 2007, 450: 819-824.
[22] Chkourko HS, Guerrero-Serna G, Lin X,etal. Remodeling of mechanical junctions and of microtubule-associated proteins accompany cardiac connexin43 lateralization[J]. Heart Rhythm, 2012,9:1133-1140.
[23] Cheng J, Niwa R, Kamiya,etal. Carvedilol blocks the repolarizing K+currents and the L-typeCa2+current in rabbit ventricular myocytes[J]. Eur J Pharma-col,1999,376:189-201.
Changes of inter-cellular communications and cell ion channels after over-expression Cx43
TANG Lianghu1,LI De2,YANG Dachun2,etal
(1.SichuanMedicalUniversity,Luzhou646000,Sichuan,China;2.DepartmentofCardiology,ChengduMilitaryGeneralHospital,Chengdu610083,China)
Objective In order to observe the changes of inter-cellular communications and cell ion channels,over-expression gap junction protein connexin 43(Cx43) was transfected in cardiomyocytes by recombinant adenovirus-mediated in vitro. Methods The full-length cDNA of Cx43 gene was cloned by RT-PCR in SD rats, and adenovirus pAdEasy-1-Cx43 was constructed through gene recombination. The expression of Cx43 mRNA was determined by RT-PCR. The protein was determined by Western blot after transfection in cardiomyocytes. The Cx43’s distribution on myocardial cell membrane was observed by immunofluorescence. The changes of inter-cellular communication was observed by Scrape-Loading and Dye Transfer Technique (SLDT),which was contributed to analysis lucifer yellow(LY) in cultured cardiomyocytes after over-expression Cx43;the changes of ion channel currents was observed by single-cell patch-clamp technique to analysis the expression of myocardial cell membrane ion channels after upregulation the expression of Cx43. Results The recombinant adenovirus pAdEasy-1-Cx43 was successfully constructed. Cx43 mRNA and protein expression upregulated in pAdEasy-1-CX43 group and the distribution of Cx43 was increased on myocardial cell membrane after transfection. The inter-cellular communication enhanced after transfection by Scrape-Loading and Dye Transfer Technique;whole-cell patch-clamp current calcium influx prompted after transfection. The potassium ion currents had not a similar change. Conclusion The recombinant adenovirus pAdEasy-1-Cx43 vectors were successfully constructed. The inter-cellular communication and calcium influx were enhanced after upregulation Cx43 in cardiomyocytes. These will contribute to the further study of Cx43 in improving of ventricular electrical remodeling and reducing or preventing ventricular arrhythmias.
Adenovirus transfection; Gap junction protein connexin 43; Scrape-Loading and Dye Transfer Technique; Inter-cellular communications; Cell patch-clamp
四川省科技厅应用基础计划(2011JY0029),四川省科技创新苗子工程培育项目(2015016)
李德,教授,主任医师,E-mail:lide660809@qq.com;杨大春,教授,主任医师,E-mail:yangdc71@126.com
R-33
A
10.3969/j.issn.1672-3511.2016.03.005
2015-12-01; 编辑: 母存培)
