黄瓜生殖细胞分离及其线粒体DNA的观察与拷贝数定量分析
2016-05-06王丹阳
唐 绮,蔺 祯,高 龙,郭 雪,王丹阳
(西北大学 生命科学学院,西部资源生物与现代生物技术教育部重点实验室,西安 710069)
黄瓜生殖细胞分离及其线粒体DNA的观察与拷贝数定量分析
唐绮,蔺祯,高龙,郭雪,王丹阳*
(西北大学 生命科学学院,西部资源生物与现代生物技术教育部重点实验室,西安 710069)
摘要:该研究以6~8月上午10点左右摘取的新鲜黄瓜花朵为材料,采用渗透压冲击的方法分离黄瓜生殖细胞,并应用竞争型定量PCR技术测定其线粒体DNA数量,分析生殖细胞在发育过程中线粒体DNA的变化,以明确高丰度线粒体DNA的来源,为进一步研究被子植物调控线粒体DNA扩增的分子机制奠定基础。结果显示:(1)DAPI染色观察发现,黄瓜生殖细胞的细胞核周围存在大量的细胞器DNA荧光点,表明黄瓜生殖细胞的细胞质中存在大量的线粒体DNA。(2)成熟黄瓜生殖细胞平均包含(1 037±126)个线粒体DNA拷贝。(3)成熟生殖细胞内线粒体DNA含量为早期生殖细胞的14.5倍,表明成熟生殖细胞中的线粒体DNA主要来自于生殖细胞形成后其内活跃的线粒体DNA扩增。研究认为,黄瓜生殖细胞内活跃的线粒体DNA是黄瓜线粒体父系遗传的基础。
关键词:线粒体DNA;拷贝数;父系遗传;黄瓜;生殖细胞
植物细胞3个携带DNA的细胞器——细胞核、质体及线粒体以不同的方式传递DNA到下一代。不同于细胞核的双亲遗传,叶绿体与线粒体普遍呈现母系遗传,尤其是线粒体,显现出更为严格的母系遗传[1-2]。在迄今所研究过的植物中,只有甜瓜、天竺葵、香蕉及黄瓜等少数物种呈现双亲或者父系线粒体遗传的特征[3-5]。由于线粒体是携带DNA的细胞器,因此,线粒体遗传的本质是线粒体DNA的遗传。细胞学研究结果表明:对于线粒体双亲或者父系遗传的物种,其生殖细胞或精细胞总是携带丰富的线粒体DNA;而对于母系遗传的物种,则几乎不携带DNA[6]。因此,线粒体DNA含量与线粒体遗传模式呈现出高度的相关性。
对于那些双亲或者父系遗传的物种,其生殖细胞或精细胞都包含线粒体DNA,细胞学方法难以对线粒体DNA含量进行准确的测量。以前的研究运用定量PCR技术测量了天竺葵精细胞及甜瓜生殖细胞中线粒体DNA含量[7]。结果显示:对于双亲遗传的天竺葵,其精细胞所携带的线粒体DNA数量为(256.7±71.2)个;而对于父系遗传的甜瓜,其生殖细胞所携带的则为(1 296.3±310.6)个。这些定量结果与这两个物种的线粒体遗传模式呈现出高度的一致性,即父系遗传的甜瓜在生殖细胞中线粒体DNA含量远高于双亲遗传的天竺葵在精细胞中的线粒体DNA含量。因此,定量研究结果能为我们理解线粒体的遗传模式提供更为精细的实验数据。
黄瓜,作为少数几个线粒体父系遗传的物种之一,对其生殖细胞中线粒体DNA含量的测定还未见报道。本研究通过分离黄瓜生殖细胞,应用竞争型定量PCR技术测量了其内线粒体DNA含量,分析生殖细胞在发育过程中线粒体DNA的变化,以明确高丰度线粒体DNA的来源,为进一步研究被子植物调控线粒体DNA扩增的分子机制奠定基础。
1材料和方法
1.1实验材料
实验材料黄瓜(C.sativus)在自然条件下于4~8月种植于西北大学果园。新鲜的黄瓜花朵取自上午10:00左右,摘取后立即进行后续的实验。
1.2方法
1.2.1花粉DAPI压片在载玻片上,将新鲜花粉置于1滴DAPI(0.1 μg/mL)与固定液(4%多聚甲醛,2%戊二醛,0.1 mol/L二甲砷酸钠)的混合液中静置30 s。盖上盖玻片后,轻轻用力向一个方向挤压。花粉内容物因受力而被挤压出花粉。用莱卡倒置显微镜DMI3100观察压片,用彩色CCD获取图像。
1.2.2生殖细胞的分离生殖细胞的分离采用渗透压冲击的方法[8]。将新鲜成熟花粉富集于35%蔗糖溶液中,经过1 min离心后(100×g),将上清换成15%蔗糖溶液以进行渗透压冲击。在渗透压变化的冲击下,花粉将从萌发孔处释放包含生殖细胞的内容物。将生殖细胞在倒置显微镜下用玻璃毛细管于15%蔗糖溶液中清洗3遍后进行富集。生殖细胞的活力用FDA染色方法进行检测。细胞于0.01% FDA溶液中进行5 min染色后,置于倒置荧光显微镜下观察。
1.2.3生殖细胞的消化处理将富集的黄瓜生殖细胞转移至PCR管中进行消化处理。在消化前,细胞首先经过快速冻融处理以破裂细胞膜。消化液的组成为0.2×Taq酶缓冲液(天根),50 μg/mL蛋白酶K(Merck)。消化条件:56 ℃过夜处理。消化液的用量为每个生殖细胞添加2 μL。
1.2.4定量PCR消化液经过95 ℃变性处理5 min以灭活其中的蛋白酶K。竞争型定量PCR用于定量实验[7,9]。定量PCR包括2轮PCR扩增。在第1轮PCR扩增中,首先,按普通PCR反应配制5个反应,组分包括1×Taq酶缓冲液、0.2 mmol/L dNTPs、0.6 UTaq酶、双蒸水及0.4 mmol/L引物对(CmQan1F/CmQan1R)[7];其次,向每个PCR反应液中加入2 μL消化液作为模板,其对应于单个生殖细胞中的线粒体DNA数量;最后,向每个PCR管中加入不同数量的竞争模板cmmatR-(竞争模板cmmatR-来自甜瓜线粒体DNA上的基因matR。由于甜瓜的matR在序列上与黄瓜的matR完全一致,所以cmmatR-也可以用于黄瓜的定量实验。与matR片段相比,cmmatR-缺失了其内部的113 bp。在定量PCR反应中,由cmmatR-与matR所扩增出的PCR产物大小不同,由此可以在凝胶上进行区分)[7]。PCR反应条件为95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共20个循环。该反应结束后,进行第2轮PCR扩增。以第1轮的反应液1 μL做为第2轮PCR模板,反应循环数为22个循环。其它反应条件如上,仅将引物对换成CmQan2F/CmQan2R[7]。
拷贝数的计算根据2次PCR扩增条带的灰度值比进行。首先,计算5个PCR反应中2条带的灰度值比;其次,找出灰度值比接近修正系数0.64的PCR反应(修正系数为当定量模板与竞争模板为1∶1时,其扩增的两PCR产物的灰度值比)[7];最后,用该PCR反应来计算线粒体DNA的拷贝数,方法为该PCR反应的竞争模板的数量乘以“灰度值比与修正系数”之比。
1.2.5DiOC7/DAPI染色早期的两核花粉及成熟花粉于固定液中室温固定4 h。固定液组成为:4%多聚甲醛,2%戊二醛,0.1 mol/L 二甲砷酸钠。固定的样品经乙醇脱水后,于Technovit3040树脂中进行渗透、聚合。实验流程按产品厂家建议进行。
500 nm厚的切片先于1 μg/mL DiOC7溶液中染色3 min,用蒸馏水清洗2 min后,再于0.1 μg/mL DAPI溶液中染色6 min[6]。所有图像均在同等条件下拍照获取,以方便后续DNA含量变化的分析。
为了比较早期生殖细胞与成熟生殖细胞中线粒体DNA变化,统计了这两个发育时期单个线粒体中的DNA含量变化以及整个生殖细胞中的线粒体数目变化。单个线粒体内的DNA含量变化对应于切片上这两个时期单个DAPI点的平均灰度值之比(灰度值在Photoshop中进行计算);而线粒体数目的变化则对应于相同细胞质面积内DAPI点的数量之比,细胞质面积在Photoshop中可以用总像素点来表示。总的线粒体DNA含量变化则用单个线粒体的DNA含量变化与线粒体数目变化之积来表示。
2结果与分析
2.1黄瓜生殖细胞内的细胞器DNA
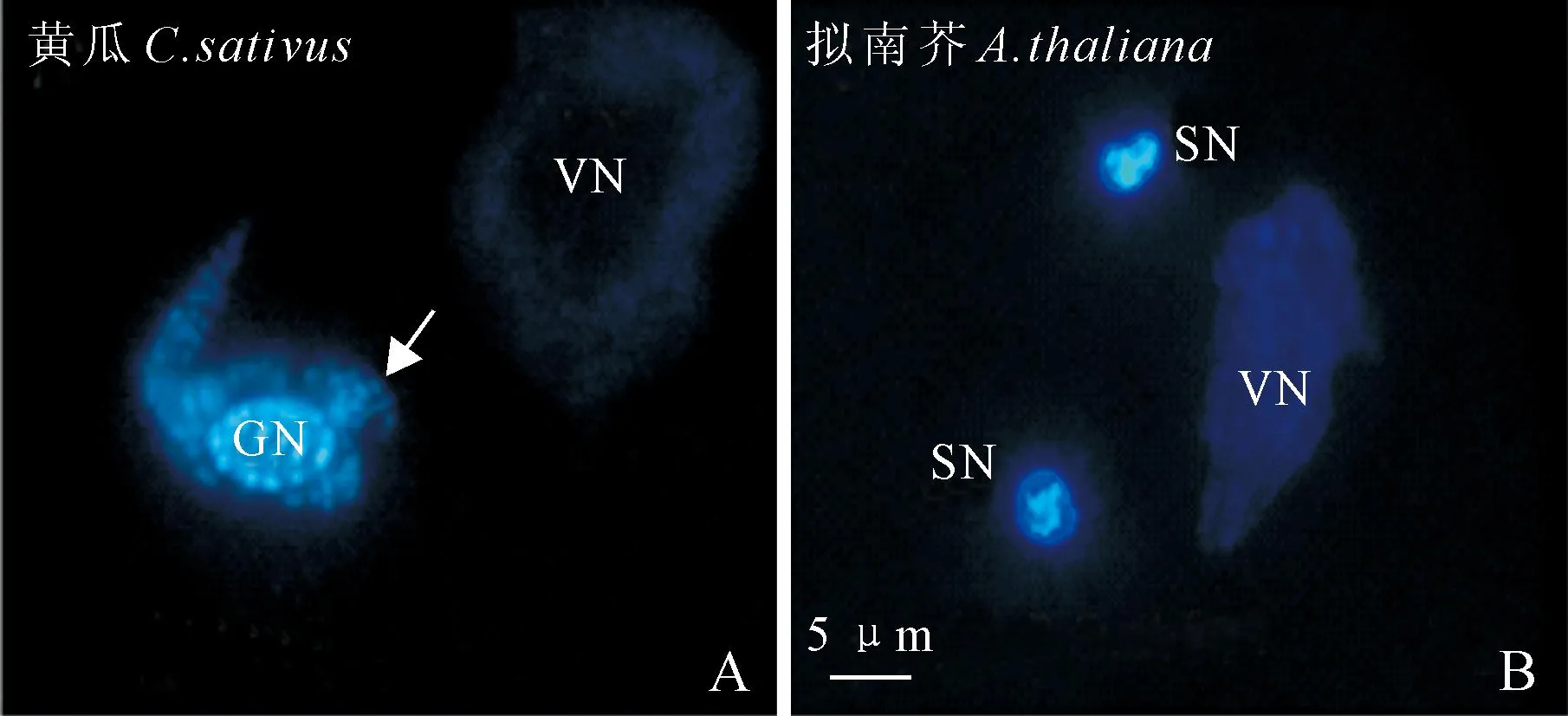
用花粉压片结合DAPI染色技术检测结果显示,黄瓜生殖细胞的细胞核周围存在大量的荧光点(图1,A,箭标所示),这些核外的荧光点暗示了细胞器DNA的存在。而对照拟南芥精细胞的细胞核周围并无明显的点状荧光信号(图1,B)。由于遗传学证据已经显示黄瓜为线粒体父系遗传物种[3],因此,这些点状的荧光信号暗示了线粒体DNA的存在。
尽管黄瓜生殖细胞与拟南芥精细胞在核外细胞器DNA上的DAPI染色结果不同,但是,它们在花粉营养细胞中的染色结果却是相似的,即都不包含可见的细胞器DNA(图1,A、B)。这暗示这2个物种的花粉营养细胞仅携带少量的细胞器DNA,其含量已经低于DAPI染色所能观察到的范围。这与前期的观察结果是一致的[6]。
2.2黄瓜生殖细胞的分离
为了对成熟黄瓜生殖细胞中的线粒体DNA含量进行准确的测量,我们首先分离、纯化了该细胞。在渗透压变化的冲击下,生殖细胞会伴随营养细胞的细胞质从花粉萌发孔处释放到花粉外(图2,A箭头所示)。这些游离的生殖细胞可以通过玻璃毛细管进行小规模富集,图2,B显示了富集的29个生殖细胞。FDA染色显示,分离的生殖细胞在2 h后仍具细胞活力(图2,C、D)。
A.箭头所示黄瓜生殖细胞(GC)的细胞质中存在大量的

A.刚从花粉释放的生殖细胞;B.富集的29个生殖细胞;C、D.FDA染色以指示
2.3黄瓜生殖细胞中线粒体DNA拷贝数的定量
分离得到的29个生殖细胞,在经过快速的冻融处理后,于58 μL消化液中进行消化处理以释放模板DNA。2 μL消化产物(平均对应于1个生殖细胞)被用来作为单个定量PCR反应的模板。在每次的定量实验中,设置5个定量PCR反应。每个PCR反应除了包含相同数量的线粒体DNA模板(数量未知)外,还包含不同数量的竞争模板cmmatR-(竞争模板的数量是已知的)。从PCR产物的凝胶电泳结果可以看见,随着竞争型模板的逐渐增加,由其扩增而来的PCR产物的条带亮度逐渐递增(339 bp条带),同时,由线粒体DNA扩增而来的条带亮度逐渐减弱(452 bp)。这表明两扩增产物在PCR反应中表现出明显的竞争关系,暗示了定量结果是可靠的。选取了两PCR条带灰度值比接近参考系数(0.64)的PCR反应来计算线粒体DNA的拷贝数(图3,A~C)。3次实验结果分别为1 093个、893个及1 125个。因此,单个黄瓜生殖细胞平均携带的线粒体DNA拷贝数为(1 037±126)个。
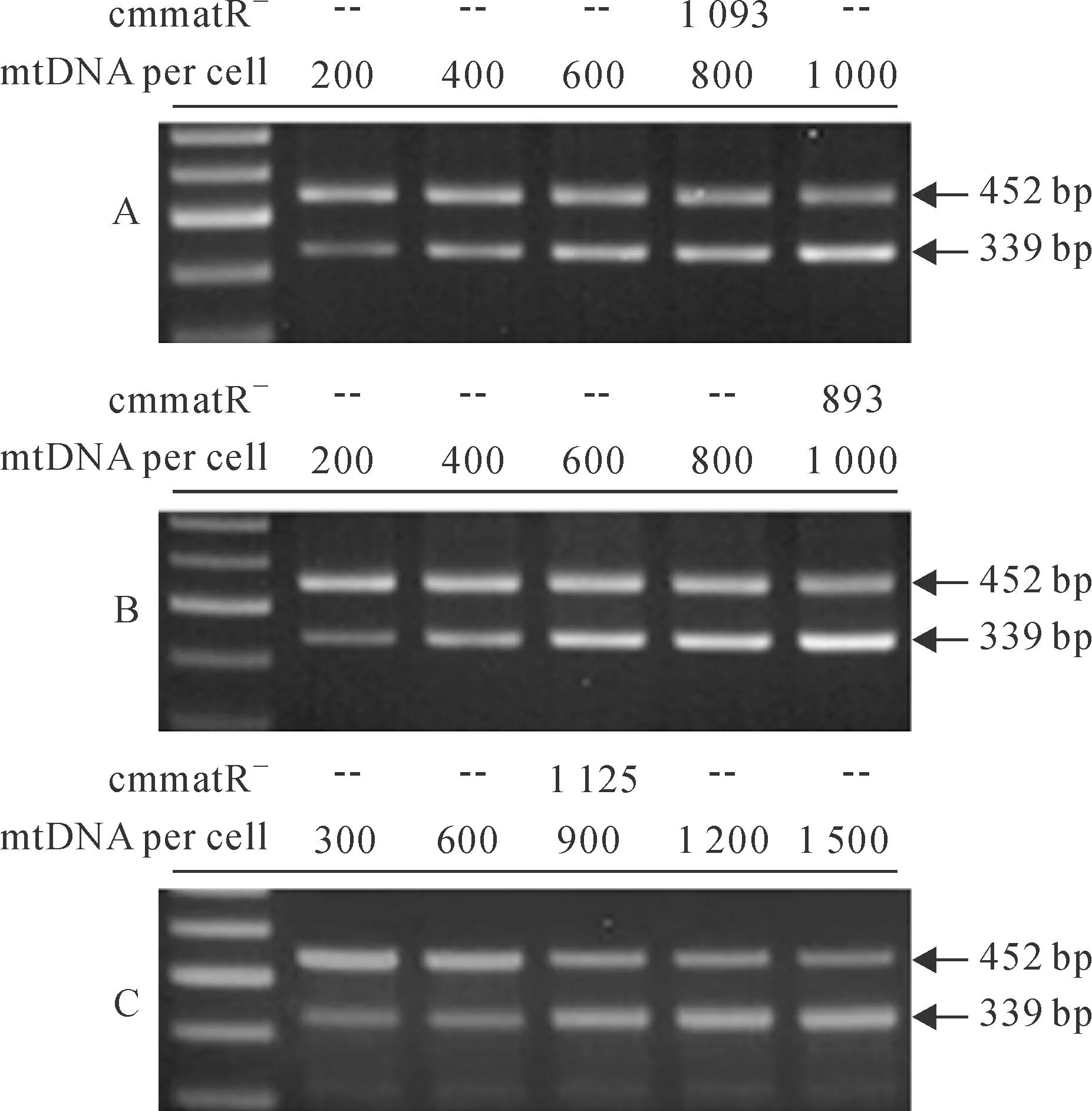
图3 黄瓜生殖细胞线粒体DNA拷贝数的定量分析

A、B.显示早期生殖细胞的DiOC7(A)及DAPI(B)染色;C、D.显示成熟生殖细胞的DiOC7(C)及DAPI(D)染色;
2.4生殖细胞中线粒体DNA的扩增
为了调查成熟生殖细胞产生如此高丰度线粒体DNA的原因,比较了早期生殖细胞与成熟生殖细胞中的线粒体DNA含量。生殖细胞最早出现于小孢子第一次不对称有丝分裂,这次分裂产生了1个体积较大的营养细胞和1个体积较小的生殖细胞(早期生殖细胞)。鉴于早期生殖细胞难以分离,运用切片技术与DiOC7/DAPI染色来研究线粒体DNA的变化。在切片上,DiOC7染色能够显示生殖细胞中的线粒体(图4,A和C中M所示),其相对应的DAPI点能指示线粒体DNA的含量(图4,B、D箭头所示)。结果显示:成熟生殖细胞中的DAPI染色点在荧光信号上是早期生殖细胞的4.4倍(图4,E),同时,成熟生殖细胞中的荧光点在单位面积上出现的频率是早期生殖细胞的3.3倍,暗示总的线粒体数目增加了3.3倍(图4,F)。因此,在发育过程中,成熟生殖细胞中的线粒体DNA含量增加为早期生殖细胞的14.5倍。这表明成熟生殖细胞中的线粒体DNA主要来自于生殖细胞形成后其内活跃的线粒体DNA扩增。
3讨论
在本研究中,我们定量分析了黄瓜生殖细胞中的线粒体DNA数量。黄瓜生殖细胞平均携带(1 037±126)个线粒体DNA拷贝。这与同属植物甜瓜生殖细胞的线粒体DNA含量相似(1 296±310)[7]。如此高丰度的线粒体DNA主要来自于生殖细胞内活跃的线粒体DNA扩增。这包括两方面的原因:单个线粒体内DNA含量的增加以及生殖细胞内总线粒体数量的增加。这可能是黄瓜线粒体父系遗传的主要原因。
基因组测序结果表明,黄瓜核基因组和线粒体基因组的大小分别为243.5 Mb与1 568 kb[10-11]。在成熟生殖细胞中(核基因组的复制已经完成),其核DNA的含量为487 Mb,而线粒体DNA的含量为1 626.0 Mb(1 037×1 568 kb)。因此,黄瓜生殖细胞所携带的线粒体DNA含量是其核DNA含量的3.3倍。这种核外线粒体DNA含量大于核DNA含量的现象在植物细胞中并不常见。目前,仅在天竺葵卵细胞中报道过[12]。考虑到核基因组与线粒体基因组共用了一些与DNA复制相关的原料,这提示生殖细胞中可能存在某种机制使得线粒体能高效地利用DNA复制所需要的各种物质。
在被子植物中,体细胞平均携带约50个线粒体DNA拷贝[7,13]。在体细胞的分裂过程中,线粒体DNA仅复制1倍后平均分配到2个子细胞中。目前,我们并不清楚是什么机制维持了体细胞中的线粒体DNA仅发生1倍的增加?但是,与体细胞不同,黄瓜生殖细胞却发生了14.5倍的线粒体DNA扩增。这表明体细胞中维持线粒体DNA数量的机制在黄瓜生殖细胞中并不能正常行使功能。因此,在黄瓜生殖细胞中,可能存在或者缺失了某些因子,使得线粒体DNA发生了超量复制。解析这些因子,有助于我们理解线粒体DNA数量控制的基本生命科学问题。近来,研究者们已用RT-PCR方法从分离的百花丹与烟草精细胞构建了各自的cDNA文库[14-15],进而解析了大量精细胞表达的基因。利用该方法并结合黄瓜生殖细胞的分离技术,使得我们可以获得黄瓜生殖细胞的转录组;同时,鉴于黄瓜基因组的测序已经完成,这使得我们可以利用黄瓜生殖细胞作为实验材料来研究被子植物调控线粒体DNA扩增的分子机制。
参考文献:
[1]MOGENSEN H L.The hows and whys of cytoplasmic inheritance in seed plants[J].AmericanJournalofBotany,1996,83(3):383-404.
[2]ZHANG Q,LIU Y,SODMERGEN.Examination of the cytoplasmic DNA in male reproductive cells to determine the potential for cytoplasmic inheritance in 295 angiosperm species[J].PlantCellandPhysiology,2003,44(9):941-951.
[3]HAVEY M J,MCCREIGHT J D,RHODES B,etal.Differential transmission of theCucumisorganellar genomes[J].TheoreticalandAppliedGenetics,1998,97(1):122-128.
[4]FAURE S,NOYER J L,CARREEL F,etal.Maternal inheritance of chloroplast genome and paternal inheritance of mitochondrial genome in bananas (Musaacuminata)[J].CurrentGenetics,1994,25(3):265-269.
[5]ANDREAS W,JANINA A,FRANK P,etal.Biparental inheritance of plastidial and mitochondrial DNA and hybrid variegation inPelargonium[J].MolecularGeneticsandGenomics,2009,282(6):587-593.
[6]NAGATA N,SAITO C,SAKAI A,etal.The selective increase or decrease of organellar DNA in generative cells just after pollen mitosis one controls cytoplasmic inheritance[J].Planta,1999,209(1):53-65.
[7]WANG D Y,ZHANG Q,LIU Y,etal.The levels of male gametic mitochondrial DNA are highly regulated in angiosperms with regard to mitochondrial inheritance[J].ThePlantCell,2010,22(7):2 402-2 416.
[8]鲁云龙,魏丽勤,戴绍军,等.被子植物生殖细胞与精细胞的分离方法[J].植物学报,2014,49(3):229-245.
LU Y L,WEI L Q,DAI S J,etal.Current methods used to isolate and purify generative and sperm cells from pollen grains and tubes of flowering plants[J].ChineseBulletinofBotany,2014,49(3):229-245.
[9]GILLILAND G,PERRIN S,BLANCHARD K,etal.Analysis of cytokine mRNA and DNA:detection and quantitation by competitive polymerase chain reaction[J].ProceedingsoftheNationalAcademyofSciences,1990,87(7):2 725-2 729.
[10]HUANG S,LI R,ZHANG Z,etal.The genome of the cucumber,CucumissativusL[J].NatureGenetics,2009,41(12):1 275-1 281.
[11]ALVERSON A J,RICE D W,DICKINSON S,etal.Origins and recombination of the bacterial-sized multichromosomal mitochondrial genome of cucumber[J].ThePlantCell,2011,23(7):2 499-2 513.
[12]KUROIWA H,NISHIMURA Y,HIGASHIYAMA T,etal.Pelargoniumembryogenesis:cytological investigations of organelles in early embryogenesis from the egg to the two-celled embryo[J].SexualPlantReproduction,2002,15(1):1-12.
[13]PREUTEN T,CINCU E,FUCHS J,etal.Fewer genes than organelles:extremely low and variable gene copy numbers in mitochondria of somatic plant cells[J].ThePlantJournal,2010,64(6):948-959.
[14]XIN H P,PENG X B,NING J,etal.Expressed sequence-tag analysis of tobacco sperm cells reveals a unique transcriptional profile and selective persistence of paternal transcripts after fertilization[J].SexualPlantReproduction,2011,24(1):37-46.
[15]GOU X P,YUAN T,WEI X P,etal.Gene expression in the dimorphic sperm cells ofPlumbagozeylanica:transcript profiling,diversity,and relationship to cell type[J].ThePlantJournal,2009,60(1):33-47.
(编辑:宋亚珍)
Isolation of Generative Cell ofCucumissativusand Mitochondrial DNA Observation and Copy-number Quantification Analysis
TANG Qi,LIN Zhen,GAO Long,GUO Xue,WANG Danyang*
(Key Laboratory of Resource Biology and Biotechnology in Western China,Ministry of Education,College of Life Science,Northwest University,Xi’an 710069,China)
Abstract:In this study,we collected fresh flowers from Cucumis sativus around 10:00(am) from June to August,isolated the generative cells (GC) of C.sativus with the method of osmotic shock,quantified its mitochondrial DNA (mtDNA) contents through employing the competitive quantitative PCR technology,and analyzed the change of mtDNA contents in GC during its development,in order to investigate the origin of the abundant mtDNA,and lay the foundation for further study on the molecular mechanism of regulation of mitochondrial DNA amplification in angiosperm.The results showed that:(1)DAPI staining represents abundant fluorescence points of organellar DNA around the nucleus of GC of C.sativus,indicating the presence of a large number of mtDNA in cytoplasm of cucumber GC.(2)The single mature GC of C.sativus averagely owns (1 037±126) mtDNA copies.(3)Compared with early GC,the mature GC up-regulates the mtDNA by 14.5 times,suggesting that mtDNA in mature GC is mainly from its active amplification after GC formation.The study suggests that the active increase of mtDNA in GC is the basis of the paternal mitochondrial inheritance of C.sativus.
Key words:mtDNA;copies;paternal inheritance;Cucumis sativus;generative cell(GC)
中图分类号:Q349+.51;Q753
文献标志码:A
作者简介:唐绮(1991-),女,硕士,主要从事被子植物生殖生物学研究。E-mail:583208677@qq.com*通信作者:王丹阳,副教授,硕士生导师,主要从事被子植物生殖生物学研究。E-mail:wangdy@nwu.edu.cn
基金项目:国家自然科学基金(31200234);陕西省教育厅科研计划(14JS089)
收稿日期:2015-10-12;修改稿收到日期:2016-01-17
文章编号:1000-4025(2016)03-0429-06
doi:10.7606/j.issn.1000-4025.2016.03.0429
