黑沙蒿的化学成分及其生物活性研究
2016-04-25冯雪松刘雅茹
钟 阳,冯雪松,刘雅茹
(1.中国医科大学公共基础学院化学教研室,辽宁 沈阳 110122;
2.中国医科大学药学院药物分析教研室,辽宁 沈阳 110122)
黑沙蒿的化学成分及其生物活性研究
钟阳1,冯雪松2,刘雅茹1
(1.中国医科大学公共基础学院化学教研室,辽宁 沈阳 110122;
2.中国医科大学药学院药物分析教研室,辽宁 沈阳 110122)
摘要:采用硅胶柱色谱法和高效液相色谱法从黑沙蒿中提取分离出6种黄酮类化合物,通过EIMS、1HNMR、(13)CNMR对化合物的结构进行了鉴定,并测定了6种化合物体外抑制大鼠巨噬细胞生成NO的活性。结果表明,6种化合物分别为:3,5,3′,4′-四羟基-6,7-二甲氧基黄酮(Ⅰ)、5,3′,4′-三羟基-7-甲氧基二氢黄酮(Ⅱ)、5,7,4′-三羟基-6-甲氧基黄酮(Ⅲ)、5,7,4′-三羟基二氢黄酮(Ⅳ)、3,5,4′-三羟基-7-甲氧基二氢黄酮(Ⅴ)、3,5,7 -三羟基-4′-甲氧基二氢黄酮(Ⅵ);其中,化合物Ⅲ~Ⅵ为首次从黑沙蒿中分离得到,化合物Ⅰ~Ⅲ对大鼠巨噬细胞生成NO具有较强的抑制活性。
关键词:黑沙蒿;黄酮;生物活性;大鼠巨噬细胞
黑沙蒿(Artemisia ordosicaKrasch)是菊科植物,又名沙蒿、油蒿、鄂尔多斯蒿、籽蒿。黑沙蒿性味辛苦微温,具有祛风湿的功效,可以治疗风湿性关节炎、感冒、咽痛、疮疖痈肿[1]。文献报道,黑沙蒿中含有微量元素[2]、挥发性成分及黄酮类化学成分[3]。
NO是由一氧化氮合成酶(NOS)催化L-精氨酸产生的,是一种结构简单、性质活泼且半衰期极短的自由基。NO因参与介导免疫、消灭微生物等众多生理及病理过程而备受瞩目。如:在IL-1、IL-2、TNF、IFN等细胞因子和LPS等内毒素的刺激下巨噬细胞可产生大量NO,而NO含量的上调又可使巨噬细胞释放TNF-α、IL-1α和γ-IFN等炎症性细胞因子,这些因子对机体既起到介导炎症的作用,又起到调节细胞生长分化的作用。所以,在免疫系统中,巨噬细胞在细胞内、外环境变化时可通过与NO间的作用与反作用产生免疫保护、免疫损伤和免疫调节效果[9],有调节并维持机体稳定的作用。
作者提取分离了黑沙蒿所含的6种主要化学成分,并对其进行了结构表征,通过活性筛选法,即体外测定NO在大鼠巨噬细胞中的生成量,测定6种化合物的生物活性,确定黑沙蒿中抑制NO生成的活性成分,拟为黑沙蒿的合理开发利用奠定基础。
1实验
1.1材料与仪器
黑沙蒿药材,购自内蒙古,经深圳清华大学研究院深圳创新中药及天然药物研究重点实验室王乃利教授鉴定为菊科植物Artemisia ordosicaKrasch的全草;硅胶,日本关东化学。试剂为分析纯或化学纯。
LC-6A型高效液相色谱仪、SPD-6A型紫外可见光检测仪、UV-160型紫外可见分光光度计,岛津;FTIR-300型红外光谱仪,JASCO;Mercury-300型核磁共振仪,Varian;M-200型质谱仪,日立;SG80型硅胶制备柱(10mm×2.5mm),资生堂;Model-3550型酶标仪,Bio-Rad。
1.2提取与分离
取黑沙蒿3kg阴干后粉碎,用80%甲醇浸泡提取4次,减压回收溶剂后得浸膏611g,上DiaionHP-20 色谱柱,分别用40%甲醇、70%甲醇、100%甲醇、1∶1的醋酸乙酯-甲醇溶液洗脱, 得到6组分,6组分再反复经过硅胶柱色谱及制备高效液相色谱纯化得到化合物Ⅰ~Ⅵ。
1.3抑制大鼠巨噬细胞生成NO的活性测试
6种化合物抑制大鼠巨噬细胞生成NO的活性测试参照文献[10]进行。空白组为未加样品、LPS、INF-γ的细胞培养液,阴性对照组为未加样品的细胞培养液,阳性对照组为槲皮素。
2结果与讨论
2.1结构鉴定
化合物Ⅰ:黄色粉末,盐酸-镁粉反应阳性。C17H14O8,EIMS,m/z:346[M+];1HNMR(300 MHz,DMSO-d6),δ:12.43(1H,s,C5-OH),9.46(3H,brs,C3,C3′,C4′-OH),7.73(1H,d,J=2.1 Hz,H-2′),7.57(1H,dd,J=8.4 Hz、2.1 Hz,H-6′),6.89(1H,d,J=8.4 Hz,H-5′),6.83(1H,s,H-8),3.92(3H,s,C6-OCH3),3.74(3H,s,C7-OCH3);13CNMR(300 MHz,DMSO-d6)数据见表1。化合物Ⅰ的上述光谱学数据同文献[4]中所提供的3,5,3′,4′-四羟基-6,7-二甲氧基黄酮的光谱学数据基本一致。
化合物Ⅱ:白色粉末,盐酸-镁粉反应阳性。C16H14O6,EIMS,m/z:167[M]+;1HNMR(300 MHz,DMSO-d6),δ:12.08(1H,s,C5-OH),9.03(2H,brs,C3′,C4′-OH),6.87(1H,s,H-2′),6.73(2H,d,J=0.9 Hz,H-6′,5′), 6.08(1H,d,J=2.1 Hz,H-8),6.06(1H,d,J=2.1 Hz,H-6),5.41(1H,dd,J=3.0 Hz、12.3 Hz,H-2),2.70(1H,dd,J=3.0 Hz、17.1 Hz,H-3b),3.23(1H,dd,J=12.6 Hz、17.1 Hz,H-3a),3.78(3H,s,C7-OCH3);13CNMR(300 MHz,DMSO-d6)数据见表1。化合物Ⅱ的上述光谱学数据同文献[5]中所提供的5,3′,4′-三羟基-7-甲氧基二氢黄酮的光谱学数据基本一致。
化合物Ⅲ:黄色粉末,盐酸-镁粉反应阳性。C16H12O6,HREIMS:[M]+,300.0633(requires 300.0634);EIMS,m/z(rel int):301[M+1]+(18.6),300[M]+(100),285[M-Me]+(85),284(11),283(17),282[M-H2O]+(75),258(14),257[M-43]+(82),254(20),153(13),139(32),121(12),119(35),118(14)。化合物Ⅲ的上述质谱数据同文献[6]中所提供的5,7,4,-三羟基-6-甲氧基黄酮的光谱学数据基本一致。
化合物Ⅳ:褐色结晶,盐酸-镁粉反应阳性。1HNMR(300 MHz,DMSO-d6),δ:12.13(1H,s,C5-OH),7.30(2H,d,J=8.7 Hz,H-2′,6′),6.78(2H,d,J=8.7 Hz,H-3′,5′),5.87(1H,s,H-6),5.87(1H,s,H-8),2.67(1H,dd,J=3.0 Hz、17.4 Hz,H-3b),3.27(1H,dd,J=12.9 Hz、17.4 Hz,H-3a),5.42(1H,dd,J=12.9 Hz、3.0 Hz,H-2);13CNMR(300 MHz,DMSO-d6)数据见表1。化合物Ⅳ的上述光谱学数据同文献[5]中所提供的5,7,4′-三羟基二氢黄酮的光谱学数据基本一致。
化合物Ⅴ:黄色粉末,盐酸-镁粉反应阳性。1HNMR(300 MHz,acetone-d6),δ:7.34(2H,d,J=8.4 Hz,H-2′,6′),6.82(2H,d,J=8.4 Hz,H-3′,5′),6.06(1H,d,J=2.1 Hz,H-6),6.01(1H,d,J=2.1 Hz,H-8),4.55(1H,d,J=11.7 Hz,H-3),4.99(1H,d,J=12.9 Hz,H-2);13CNMR(300 MHz,acetone-d6)数据见表1。化合物Ⅴ的上述光谱学数据同文献[7]中所提供的3,5,4′-三羟基-7-甲氧基二氢黄酮的光谱学数据基本一致。
化合物Ⅵ:黄色粉末,盐酸-镁粉反应阳性。1HNMR(300 MHz,acetone-d6),δ:7.44(2H,d,J=8.7 Hz,H-2′,6′),6.96(2H,d,J=8.4 Hz,H-3′,5′),5.93(1H,d,J=2.1 Hz,H-6),5.88(1H,d,J=2.1 Hz,H-8),4.54(1H,d,J=11.4 Hz,H-3),5.01(1H,d,J=11.4 Hz,H-2);13CNMR(300 MHz,acetone-d6)数据见表1。化合物Ⅵ的上述光谱学数据同文献[8]中所提供的3,5,7-三羟基-4′-甲氧基二氢黄酮的光谱学数据基本一致。
表1
化合物Ⅰ~Ⅵ的13CNMR数据
Tab.1
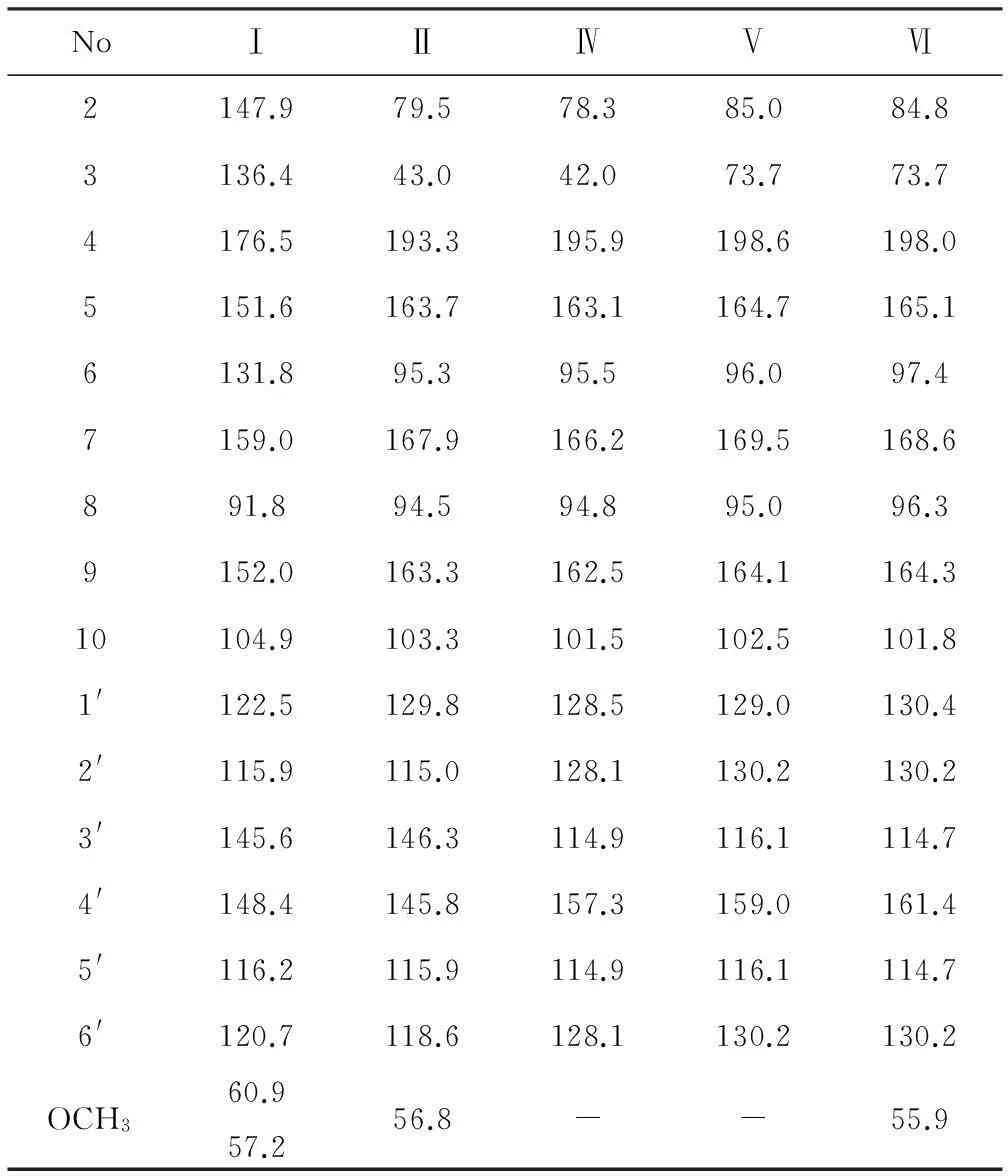
13CNMR Data of compounds Ⅰ~Ⅵ
化合物Ⅲ~Ⅵ为首次从黑沙蒿中分离得到。
2.2抑制大鼠巨噬细胞生成NO的活性测试结果(表2)
表2
6种化合物体外抑制大鼠巨噬细胞
生成NO的实验结果
Tab.2
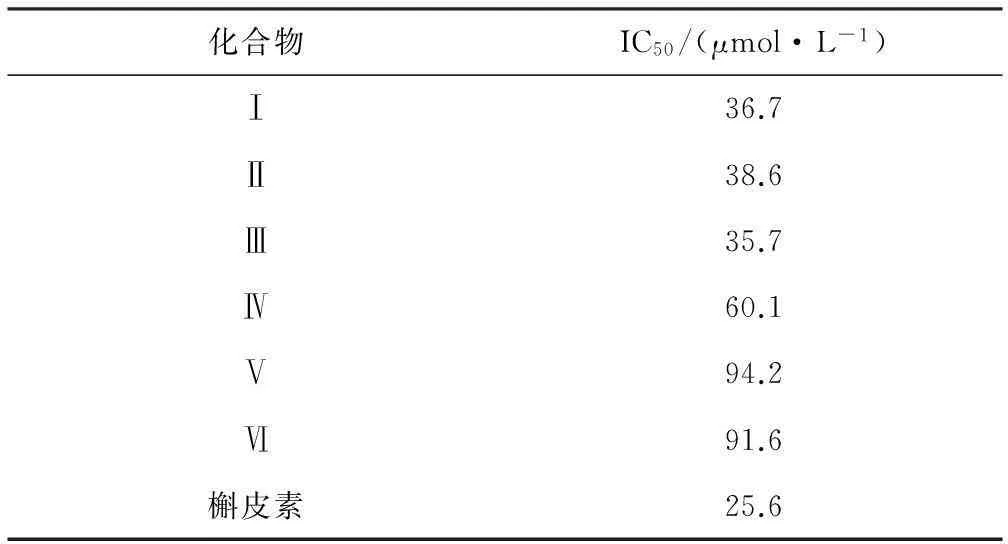
Results of inhibitory effect of 6 compounds on
由表2可知,化合物Ⅰ~Ⅲ对大鼠巨噬细胞中NO的生成具有较强的抑制活性,IC50分别为36.7 μmol·L-1、38.6 μmol·L-1、35.7 μmol·L-1,三者的活性均较槲皮素(IC50为25.6 μmol·L-1)稍弱。
3结论
采用硅胶柱色谱法和高效液相色谱法从黑沙蒿中提取分离出6种黄酮类化合物,通过EIMS、1HNMR、13CNMR对化合物的结构进行了鉴定,并测定了6种化合物体外抑制大鼠巨噬细胞生成NO的活性。结果表明,6种化合物分别为:3,5,3′,4′-四羟基-6,7-二甲氧基黄酮(Ⅰ)、5,3′,4′-三羟基-7-甲氧基二氢黄酮(Ⅱ)、5,7,4′-三羟基-6-甲氧基黄酮(Ⅲ)、5,7,4′-三羟基二氢黄酮(Ⅳ)、3,5,4′-三羟基-7-甲氧基二氢黄酮(Ⅴ)、3,5,7 -三羟基-4′-甲氧基二氢黄酮(Ⅵ);其中,化合物Ⅲ~Ⅵ为首次从黑沙蒿中分离得到,化合物Ⅰ~Ⅲ对大鼠巨噬细胞生成NO具有较强的抑制活性。
参考文献:
[1]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:685.
[2]颜世芬,梁冰,李菊白.黑沙蒿微量元素及精油的化学成分研究[J].分析试验室,1994,13(3):82-84,94.
[3]赵东保,杨玉霞,张卫,等.黑沙蒿黄酮类化学成分研究[J].中国中药杂志,2005,30(18):1430-1432.
[4]KISO Y,SASAKI K,OSHIMA Y,et al.Structure of arcapillin,an antihepatotoxic principle ofArtemisiacapillariesherbs[J].Heterocycles,1982,19(9):1615.
[5]IBRAHIM A R,GALAL A M,AHMED M S,et al.O-Demethylation and sulfation of 7-methoxylated flavanones byCunninghamellaelegans[J].Chem Pharm Bull,2003,51(2):203-206.
[6]HANAWA F,TAHARA S,MIZUTANI J.Flavonoids produced byIrispseudacorusleaves treated with cupric chloride[J].Phytochemistry,1991,30(7):2197-2198.
[7]ROSSI M H,YOSHIDA M,MAIA J G S.Neolignans,styrylpyrones and flavonoids from anAnibaspecies[J].Phytochemistry,1997,45(6):1263-1269.
[8]MALTERUD K,BREMNES T E,FAEGRI A,et al.Flavonoids from the wood of salix caprea as inhibitors of wood-destroying fungi[J].Journal of Natural Products,1985,48(4):559-563.
[9]ZHENG Y C.Nitric oxide and immunoloregulation of macrophag[J].Foreign Med Sci:Immunol,1995,15(4):204-206.
[10]郭晓宇,王珏,王乃利,等.云南石仙桃的化学成分及其抑制NO生成的作用[J].中草药,2006,37(4):17-21.
Chemical Constituents fromArtemisiaOrdosicaKrasch and Their Bioactivities
ZHONG Yang1,FENG Xue-song2,LIU Ya-ru1
(1.DepartmentofChemistry,SchoolofFundamentalSciences,ChinaMedicalUniversity,Shenyang110122,China;2.DepartmentofPharmaceuticalAnalysis,SchoolofPharmacy,ChinaMedicalUniversity,Shenyang110122,China)
Abstract:Six kinds of flavonoids were extracted and isolated from Artemisia ordosica Krasch by silica gel column chromatography and high performance liquid chromatography(HPLC).Their structures were identified by EIMS,1HNMR and (13)CNMR,and their activities of inhibiting the formation of NO in rat macrophages in vitro were determined.Results showed that six kinds of flavonoids were 3,5,3′,4′-tetrahydroxy-6,7-dimethoxyflavone(Ⅰ),5,3′,4′-trihydroxy-7-methoxyflavanone(Ⅱ),5,7,4′-trihydroxy-6-methoxyflavone(Ⅲ),5,7,4′-trihydroxyflavanone(Ⅳ),3,5,4′-trihydroxy-7-methoxyflavanone(Ⅴ) and 3,5,7-trihydroxy-4′-methoxyflavanone(Ⅵ).Among them,compounds Ⅲ~Ⅵ were firstly isolated from Artemisia ordosica Krasch,and compounds Ⅰ~Ⅲ exhibited strong inhibitory activities for the formation of NO in rat macrophages.
Keywords:Artemisia ordosica Krasch;flavonoid;bioactivity;rat macrophage
中图分类号:R 284.2
文献标识码:A
文章编号:1672-5425(2016)03-0036-03
作者简介:钟阳(1987-),女,辽宁沈阳人,助教,研究方向:药物化学;通讯作者:刘雅茹,教授,E-mail:704544116@qq.com。
收稿日期:2015-11-20
