杏蔗糖转运蛋白基因PaSUC4的获得及其生物信息学分析
2016-04-21贺红霞
康 爽, 贺红霞, 王 铭, 郭 嘉, 薛 晶
1.吉林农业大学园艺学院, 长春 130118;
2.吉林省农业科学院农业生物技术研究所, 吉林省农业生物技术重点实验室, 长春 130033
杏蔗糖转运蛋白基因PaSUC4的获得及其生物信息学分析
康爽1,2,贺红霞2*,王铭1*,郭嘉2,薛晶1
1.吉林农业大学园艺学院, 长春 130118;
2.吉林省农业科学院农业生物技术研究所, 吉林省农业生物技术重点实验室, 长春 130033
摘要:果树通过蔗糖转运蛋白转运蔗糖进入果实细胞中,蔗糖转运蛋白的转运效率直接影响着果实的糖含量和果实的品质。利用RT-PCR方法,从吉农红杏中获得蔗糖转运蛋白基因PaSUC4,测序结果表明序列全长2 480 bp,其中完整开放阅读框1 500 bp,编码499个氨基酸。预测编码的蛋白质分子量为53.58 kDa,等电点为9.31。相似性及系统进化分析发现,所得蔗糖转运蛋白与蔷薇科李属植物中同类蛋白序列相似性很高,推测其功能也具有保守性。对其表达分析结果显示PaSUC4在杏树各部位中的表达具有组织特异性,其中成熟叶片中表达量最高,雌蕊中表达量最低。为进一步研究其生物学功能,构建了适合植物遗传转化的植物表达载体并进行了烟草遗传转化。研究结果为普通杏优良品种培育提供了参考。
关键词:杏;蔗糖转运蛋白基因;生物信息学
杏是蔷薇科(Rosaceae)李亚科(Prunoideae)杏属(Armeniaca)植物,其果肉、果仁均可食用。它原产于中国,野生种和栽培品种资源都非常丰富。杏属植物在全世界共有10个种,除法国杏(Prunusbrigantiaca)外其他9个种均原产于我国,分别为普通杏、西伯利亚杏、辽杏、紫杏、志丹杏、政和杏、李梅杏、藏杏、梅。栽培品种近3 000个,普通杏种(P.armeniacavulgaris)分布最广[1~3]。
果实品质的形成和改良直接影响着果树行业的发展,因此,果实的品质是果树研究领域中最重要的课题之一。果实的糖分积累是影响果实品质的重要因素[4]。在果实中,糖分常以果糖、葡萄糖和蔗糖这三种形式存在。由于蔗糖是由一分子果糖和一分子葡萄糖组成的双糖,相对于果糖和葡萄糖等碳形式可以运输大量的碳,性质稳定且渗透势高,所以蔗糖是几乎所有果树长距离转运碳的主要形式,也是光合产物的主要形态[5,6]。蔗糖不仅可以通过韧皮部长距离运输到果实中积累糖分,提高果实糖含量,还可以长距离运输到果树其他部位,提供营养生长所需的能量。而蔗糖的主要运输途径是质外体途径[7],在质外体途径中蔗糖需要进行跨膜运输,所以在完成蔗糖韧皮部装载和卸载的过程中,需要一种存在于质膜上的载体蛋白的帮助,该载体蛋白利用ATP在质膜H+/ATPase所建立的质子动力势作用下产生跨膜质子梯度,使蔗糖与H+以1∶1的比例跨膜共转运。这种载体蛋白叫做蔗糖-质子共转运蛋白,也叫做蔗糖转运蛋白(sucrose transporter, SUT)[8~10]。
蔗糖转运蛋白(SUT)属于MFS超家族(major facilitator super family)中的一员,是存在于质膜上的一类高疏水性蛋白,帮助蔗糖等碳水化合物进行跨膜运转,含有12个保守的跨膜结构域,其中间有一个大的面向细胞质的胞质环,将该蛋白划分为各含6个跨膜结构域的2个半区,即前半区和后半区[11]。该跨膜结构域高度保守,只有N端和C端为高变异区,最保守的跨膜区域为第1、2和第11跨膜区,因此不同植物中的蔗糖转运蛋白都存在相似的结构域[12]。
杏树具有突出的抗旱性和耐寒性,杏产品具有良好的产业化前景,由此可见杏在我国民众生活和园艺产业中占据非常重要的地位,虽然在杏资源评价、研究和利用方面做了大量工作并取得了很大进展[13],但在杏育种及优质基因功能挖掘方面的研究甚少,与国外相比差距很大,因此挖掘杏中的蔗糖转运蛋白新基因并阐明其生物功能对研究杏果实形成及抗旱耐寒等机理都具有重要意义[14],本工作所选取的“吉农红杏”具有果大整齐、质优丰产、抗寒性强及早熟等优点[15],本研究试图从中获得蔗糖转运蛋白基因,并进行相关的生物信息学分析和功能鉴定,以期为杏的品质育种和生理机制挖掘提供参考。
1材料与方法
1.1植物材料
吉农红杏属于杏属普通杏种(Prunusarmeniaca),由吉林农业大学园艺学院王铭教授提供,采于吉林农业大学果园,在结果期取成熟叶片,用于总RNA的提取并进行基因克隆。基因表达分析材料取自花期、展叶期和座果期。
1.2菌株、试剂和质粒
总RNA提取试剂盒、LATaq酶和rTaq酶、PCR产物回收试剂盒购自TaKaRa公司,反转录试剂盒购自ROCHE公司,质粒提取试剂盒购自Axygen公司,克隆载体pEASY-T1 Simple和荧光定量试剂盒TransScript Green Two-step qRT-PCR SuperMix购自北京全式金生物技术有限公司,植物表达载体pCAM-UPN为本实验室发明专利载体。
1.3方法
1.3.1引物设计将NCBI(www.ncbi.nlm.nih.gov/)上已注册的日本杏蔗糖转运蛋白基因序列和其他李亚科果树中蔗糖转运蛋白基因序列进行同源性比对,选择同源性高的保守区作为模板,使用Primer Premier 5.0设计简并引物,最后通过BLAST比对引物特异性,筛选出高成功率的引物PaS4(1)和PaS4(2),根据所得序列拼接后的序列设计PaS4(3)引物,亚克隆引物根据PaSUC4基因编码区设计,为便于构建载体在PaS4(4)的上、下游引物上分别添加了BamHⅠ和SpeⅠ酶切位点。荧光定量引物利用Primer 3(http://bioinfo.ut.ee/primer3-0.4.0/)在线设计,所有引物均由上海捷瑞生物工程有限公司合成,序列信息及扩增条件见表1。
1.3.2杏总RNA的获得选取杏结果期成熟叶片100 mg,参照TaKaRa试剂盒说明书提取杏总RNA,利用NanoDrop 2000(Pittsburgh, USA)测定所提取RNA的浓度,利用琼脂糖凝胶电泳检测总RNA的质量,确定总RNA的完整性且无降解后于-80℃保存备用。用Transcriptor High Fidelity cDNA Synthesis Kit(ROCHE公司)将杏总RNA(1 μg)反转录成第一链的cDNA来扩增目的基因(参考ROCHE试剂盒说明书)。
1.3.3RT-PCR克隆与序列分析以杏总RNA反转录成的第一链cDNA为模板,分别用3组引物(RT-PCR引物见表1)进行RT-PCR扩增,用PaS4(1)引物和PaS4(2)两组引物分别扩增得到与预期片段大小一致的特异性产物,回收PCR产物后连接入克隆载体pEASY-T1 Simple,经菌落PCR鉴定,挑取含重组质粒的阳性克隆测序,两组重组质粒分别命名为:pEASY-T1-X1XY1 4-1和pEASY-T1-X1XY1 E9。将两组质粒DNA混合作为PCR模板,用第3组引物扩增得到PCR产物,然后连接到克隆载体pEASY-T1 Simple上,所得重组质粒命名为pEASY-T1-PaSUC4,经菌落PCR鉴定后将符合条件的阳性克隆送至北京鼎国昌盛生物技术有限公司进行测序分析。
1.3.4杏蔗糖转运蛋白基因PaSUC4的表达分析用1 μg的不同组织(幼果、新叶、成熟叶、雌蕊、花瓣、新梢)提取的总RNA为模版,参照TransScript Green Two-step qRT-PCR SuperMix Kit操作步骤合成cDNA,稀释5倍后作为模板,采用荧光定量PCR(qRT-PCR)检测PaSUC4表达水平,以杏的管家基因actin为内参。实时定量PCR扩增在荧光定量PCR仪(ABI7900)上完成,反应总体积为20 μL,所用引物及反应条件如表1所示,数据分析采用2-△△Ct法[16]。
1.3.5杏蔗糖转运蛋白基因PaSUC4的生物信息学分析序列拼接结果在瑞士生物信息学研究所网站(http:/us.expasy.org/)用Translate软件预测编码氨基酸序列,用ProtScale软件对编码蛋白疏水性进行分析,用ProtParam对编码蛋白质的等电点、分子量进行预测, 用在线工具TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)预测PaSUC4蛋白跨膜结构;用TargetP1.1 Server (http://www.cbs.dtu.dk/services/TargetP/)进行跨膜区域的信号肽分析,采用PSORT II蛋白质亚细胞定位服务器(http://psort.hgc.jp/form.html)定位[17,18]。在NCBI数据库中对PaSUC4蛋白进行Blastp序列比对,将得到来源于不同植物的蔗糖转运蛋白序列,利用BioEdit软件中的ClustalW和MEGA6.0软件进行比对和聚类分析,采用邻近法构建进化树[19~21]。
1.3.6植物表达载体的构建将所得的PaSUC4基因进行亚克隆,在扩增引物上、下游分别填加BamHⅠ和SpeⅠ位点,经测序分析后将准确无误的目的基因插入到植物表达载体pCAM-UPN中,得到重组载体pCAM-UPN-PaSUC4(图1),利用冻融法转入农杆菌感受态EHA105中(自制),利用农杆菌介导的叶盘法转化模式植物烟草进行功能验证。
2结果与分析
2.1杏总RNA的获得和PaSUC4全长序列的获得
从吉农红杏成熟叶片中提取的杏总RNA取3 μL进行电泳检测,图2中可以看出所提取RNA的28S和18S条带清楚,未发生降解,说明提取RNA的完整性,可以用来扩增目的基因。

图1 pCAM-UPN-PaSUC4载体图谱Fig.1 The construct map of pCAM-UPN-PaSUC4.

图2 杏茎总RNA提取Fig.2 Total RNA isolated from apricot stem.注:M: DL10 000分子量标准, 泳道1~4:从杏树样本1~4的茎提取的总RNA
为了检测反转录成第一链的cDNA,用内参actin引物对cDNA进行PCR扩增,PCR结果证明cDNA反转录效果很好,没有基因组DNA的污染(图3)。
pEASY-T1-4-1和pEASY-T1-E9测序结果表明,这两组阳性克隆为杏蔗糖转运蛋白基因全长序列的一部分,前者缺少起始子,后者缺少终止子。以上述两种质粒DNA为混合模板进行扩增,所得的pEASY-T1-PaSUC4的测序结果表明:获得了含有杏蔗糖转运蛋白的基因全序列2 480 bp,其中开放阅读框(ORF)为1 500 bp,预测编码499个氨基酸的蔗糖转运蛋白,将其命名为PaSUC4,GenBank登记序列号为KT223003。与梅中的PmSUC4(XP_008219162)有98%的同源性。
图3 cDNA内参actin的PCR扩增Fig.3 PCR amplification of actin.注: M:100 bp分子量标准,1:阴性对照,2:RNA,3:cDNA

图4 PaSUC4基因PCR扩增Fig.4 PCR amplification of PaSUC4.注:M:DL10 000,1:PaSUC4,2:阴性对照
2.2PaSUC4基因编码蛋白的理化性质
PaSUC4基因所编码的蛋白质由499个氨基酸组成,等电点为9.33,预测其相对分子量为53.58 kDa。根据CDS(conserved domain search)分析发现,它具有典型的糖转运蛋白结构域,属于GPH_Sucrose即Sucrose/H+Symporter。蛋白结构域预测结果显示,PaSUC4含有一个由168个氨基酸(26~193)组成的MFS功能域,一个373氨基酸组成的MFS-2结构域(50~422)。信号肽分析预测结果显示,叶绿体转运肽17.8%、线粒体靶向肽32.1%、分泌通路信号肽0.6%、其他定位60.8%,推测该蛋白无信号肽,存在跨膜区域[17],亚细胞定位预测显示,该蛋白定位于叶绿体类囊体膜、质膜、内质网膜和高尔基体的可能性分别是61.7%、60%、51.9%和40%[18,21]。应用在线工具(http://www.cbs.dtu.dk/services/TMHMM/)预测PaSUC4蛋白含有12次跨膜区(图5)。

图5 杏PaSUC4蛋白跨膜结构预测Fig.5 The prediction of trans-membrane structure of PaSUC4.
2.3PaSUC4基因编码蛋白的系统进化分析
将PaSUC4基因编码的蛋白序列在NCBI-BLAST进行序列比对,选取31种相似度大于70%的蔗糖转运蛋白利用ClustalW进行多序列聚类分析,根据比对结果构建系统进化树(图6)。
结果表明:PaSUC4与其他序列氨基酸同源性非常高,与梅(Prunusmume)的PmSUC4和碧桃(Prunuspersica)的PpSUC4同源性最高,分别为98.6%和97.8%,与蔷薇科野草莓的蔗糖转运蛋白FvSUC4的同源性为79.2%。在草莓中的研究表明蔗糖是一个调控果实成熟的重要信号,其中栽培草莓的FaSUT1过表达引起蔗糖和ABA含量增加从而加速果实成熟[22]。根据系统发生树分支,PaSUC4与蔷薇科李属的相关树种中的蔗糖转运蛋白同源性较高,其功能也必定具有相似性。
2.4不同组织中PaSUC4的表达量分析
荧光定量qRT-PCR结果如图7显示,PaSUC4在杏树的幼果、新叶、成熟叶、花瓣和新梢中均有表达,雌蕊中表达量很少,表达水平具有组织特异性。在成熟叶(源组织)中表达量最高,花瓣、新梢、幼果、新叶中表达量依次减少,雌蕊中表达量最低。这说明PaSUC4基因在源组织中发挥着重要作用,主要负责从源到库的蔗糖转运。
2.5PaSUC4基因过表达载体的构建及烟草的遗传转化
为了验证所克隆的PaSUC4基因功能,利用酶切连接的方法将目的基因插入pCAM-UPN中,得到重组的pCAM-UPN-PaSUC4。
利用农杆菌介导的叶盘转化法转化本生烟草,经过除草剂双丙胺磷筛选,得到抗性植株3批共30株,经PCR检测有6株为阳性转化苗(图8A)。进一步利用提取阳性烟草叶片总RNA进行反转录RT-PCR检测PaSUC4是否转录(TEF作为内参对照),从中共检出PaSUC4阳性植株4株。图8B结果显示1、2、3、5号植株为PaSUC4表达植株,证明目的基因已经在受体植物中表达,为后续基因的生物功能鉴定工作提供了重要实验材料。

图6 吉农红杏蔗糖转运蛋白PaSUC4系统发生树Fig.6 Phylogenetic tree of homolog sucrose transporters of PaSUC4.注:所选的SUTs的蛋白序列经过ClustalW比对,利用相邻连接(Neighbor-joining,NJ)分析构建系统进化树(MEGA6.0.6)。构建进化树所选用的蔗糖转运蛋白登录号(NCBI)如下:图标长度代表0.05个氨基酸差别。缩写(物种来源):序列号:PaSUC4(杏):KT223003;PmSUC4(梅):XP_008219162.1;PpSUC4(碧桃):XP_007223388.1;PbSUC4-like(白梨):XP_009335489.1;MdSUC4(苹果):XP_008339011.1;FvSUC4(草莓):XP_011464770.1;DgSUT4(北美假大麻):CAG70682.1;CmSUT4(甜瓜):NP_001284446.1;EgSUC4(巨桉):XP_010060140.1;ThSUC4-like(醉蝶花):XP_01055367.1.1;BnSUC4(欧洲油菜):XP_013698453.1;PeSUC4(胡杨):XP_011016949.1;JcSUC4-like(麻风树):XP_012068110.1;HbSUT4(橡胶树):ABK60191.1;MeSUT4(木薯):ABA08443.1;TcSUT4(可可):XP_007018362.1;GaSUC4-like(木本棉):KHG28870.1;CsSUC4(甜橙):XP_006472375.1;PsSUF4(豌豆):AFS33111.1;MtSUT2(苜蓿):XP_013462077.1;GmSUC4(黄豆):XP_003523764.1;VrSUC4-like(绿豆):XP_014521848.1;PvSUC4(菜豆):XP_007141313.1;LjSUT4(百脉根):CAD61275.1;CcSUC-like(中果咖啡):CDP00966.1;CaSUC4(鹰嘴豆):XP_004490500.1;SlSUT4(番茄):NP_001234344.1;StSUT4(马铃薯):NP_001275070.1; NtSUT4(烟草):BAI60050.1;VvSUC-like(葡萄):XP_010664062.1;NnSUC4(荷花):XP_010271544.1;BvSUC4(甜菜):XP_010695439.1
3讨论
绝大多数果树的光合产物为蔗糖,并以蔗糖为主要形式,通过质膜上的蔗糖转运蛋白经韧皮部卸载到发育的果实内,进行代谢和糖分的积累[23]。柴叶茂等[24]在对草莓果实发育过程中糖代谢相关基因的表达分析研究中发现,草莓的成熟只需要短短的一个月时间,在这期间果实需要完成褪绿和着色过程,曾出现两次蔗糖含量的高峰,两次的高峰都与蔗糖转运蛋白高水平表达相关,说明草莓的蔗糖转运蛋白的表达会影响果实的成熟进程[24]。在葡萄中共发现4种蔗糖转运蛋白基因序列:VvSUT1[25]、VvSUC11、VvSUC12、VvSUC27[26],它们均在果实中表达,且具有转运蔗糖的功能。其中VvSUC11属于SUT4亚群,VvSUC12属于SUT2亚群[27]。Chun等[28]研究不同糖对柑橘蔗糖转运蛋白CitSUT1和CitSUT1的表达影响,其结果表明CitSUT2的表达不受外源糖的影响,且在库中表达;而CitSUT1在源叶中表达,被外源的蔗糖、葡萄糖、甘露糖和2-脱氧葡萄糖所抑制。彭昌操[29]从新红星果实cDNA文库中克隆到蔗糖转运蛋白基因MdSUT1,并研究发现,MdSUT1不仅在苹果果实中表达,同样也在花瓣、枝条皮层、叶片、种子中表达。随果实的发育,MdSUT1的表达在花后60 d和花后110 d达到高峰,而在花后30 d和花后80 d则表达量下降。
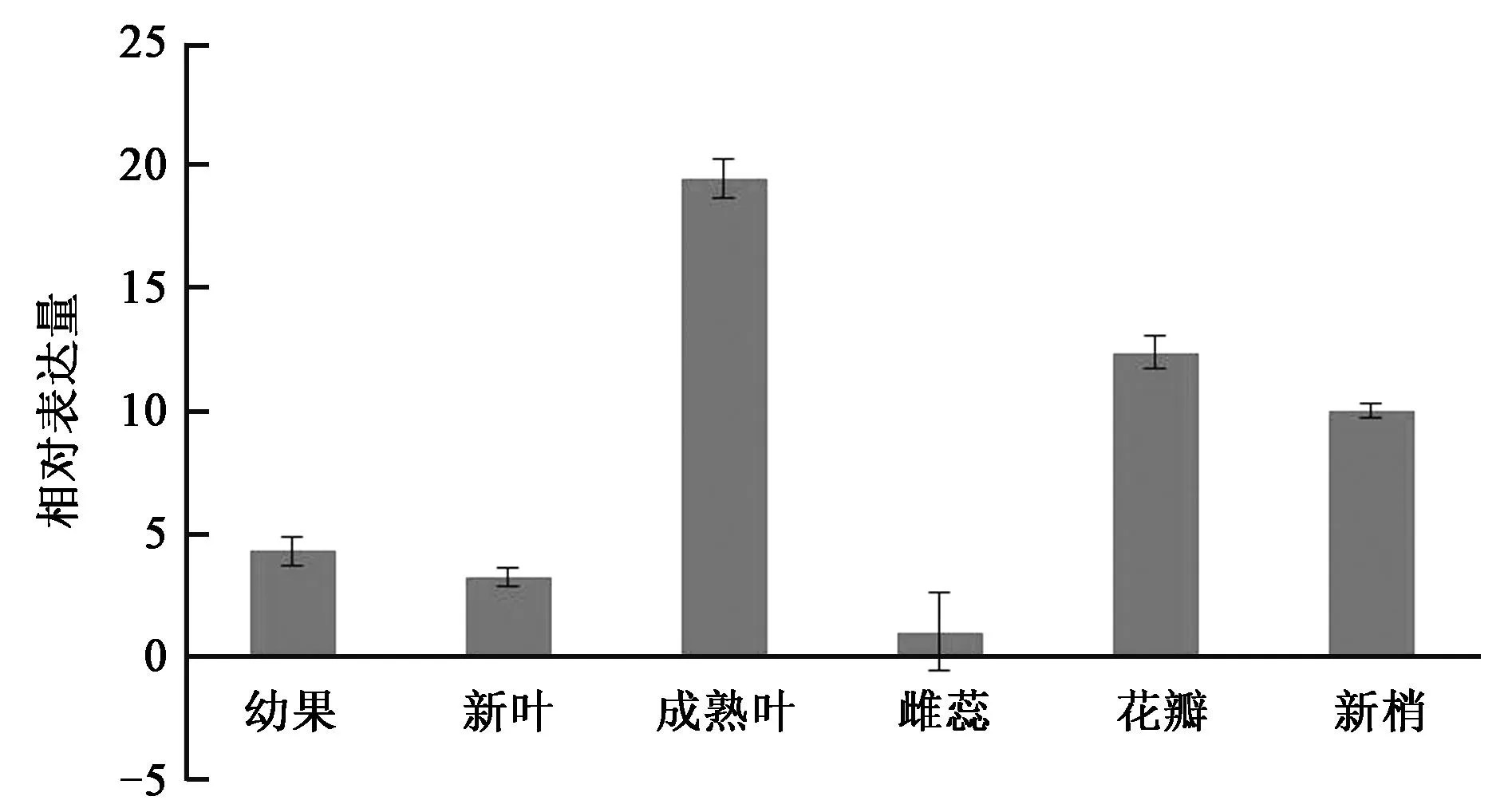
图7 吉农红杏不同组织中蔗糖转运蛋白基因PaSUC4的相对表达量Fig.7 Relative expression level of PaSUC4 in different apricot tissues.

图8 转PaSUC4烟草植株的RT-PCR检测Fig.8 RT-PCR amplification of PaSUC4 transgenic tobacco plants.注:A. M:DL2000, -:水对照,+:阳性质粒DNA,1~6:转基因植株, WT:野生型烟草;B. M:DL1000, -:水对照,+:阳性质粒DNA,1~6:转基因烟草,WT:野生型烟草
在苹果、樱桃、桃和梨等蔷薇科木本果树中,其光合产物山梨醇虽然作为韧皮部主要运输形态[29, 30],但是其果实内的蔗糖含量仍然不可忽略。如在成熟期的桃叶片中,山梨醇∶蔗糖(w/w)为1.3∶1~4.2∶1,在苹果韧皮部中为3∶1[31]。蔗糖的含量虽低于山梨醇的含量,但是依然占据相当的比例。
目前已经在草莓、梨、苹果、葡萄和柑橘等果树中发现并获得了相关的蔗糖转运蛋白。而且蔗糖转运蛋白不仅在蔗糖的长距离运输上起重要作用,也影响着光合作用同化的碳水化合物的分配,与果实品质有直接关系。因此发现并获得果树新的蔗糖转运蛋白基因,并对其进行深度的功能分析,对提高果实内在品质有很大帮助。本实验获得了杏的蔗糖转运蛋白基因PaSUC4,对其进行了生物信息学和表达分析,证明该基因符合MFS超家族的高度保守特点,是MFS超家族中的一员,具有组织表达特异性。
参考文献
[1]吕增仁. 试论我国杏品种改良的方向与途径[J].河北果树, 2002, 3:1-3.
[2]赵宏勇, 赵 锋.我国杏资源及遗传育种研究进展[J].北方果树, 2008, 2:1-3.
[3]赵海娟,刘威生,刘 宁,等. 普通杏(Prunusarmeniaca)种质资源数量形状的遗传多样性分析[J].果树学报, 2014, 31(1):20-29.
[4]赵智慧, 周俊义.果树果实内在品质形成及评价方法研究进展[J].河北农业大学学报, 2002, 25(S):111-114.
[5]张立军,李晓宇,阮燕晔,等.双子叶与单子叶植物蔗糖转运蛋白的研究进展[J].沈阳农业大学学报,2008,39(3):259-264.
[6]白雪梅,张立军,吴晓丹,等.植物蔗糖转运蛋白[J].植物生理学通讯,2006,42(6):1195-1202.
[7]吴 楚,朱能斌.植物中糖转运途径、糖转运蛋白及其生理功能[J].湖北农学院学报,2004,24(4):294-301.
[8]Barth I, Meyer S, Sauer N. PmSUC3: characterization of a SUT2/SUC3-type sucrose transporter fromPlantagomajor[J]. Plant Cell,2003,15(6):1375-85.
[9]戚继艳,阳江华,唐朝荣,等.植物蔗糖转运蛋白的基因与功能[J].植物学通报,2007,24(4):532-543.
[10]Kühn C, Barker L, Bürkle L,etal.. Update on sucrose transport in higher plants[J]. J. Exp. Bot., 1999, 50(335):935-953.
[11]彭昌操,赵小兰. 植物体内蔗糖转运蛋白的功能和调控[J].植物生理学通讯,2010,46(4):317-323.
[12]王利芬, 张虎平, 张绍铃.植物蔗糖转运蛋白及其功能调节研究进展[J].植物研究, 2012, 32(4):501-507.
[13]张艳敏,何天明,冯建荣,等.杏种质资源评价、创新与利用研究新进展[J].园艺学报,2009,36(5):755-762.
[14]刘晓华,丁宁,牛洪斌,等.桃蔗糖转运蛋白基因的克隆及序列分析[J].园艺学报, 2012,39(S):2596.
[15]郭连柱,贺喜春,孙玉书. “吉农红杏“新品种[J].北方园艺,1991,2(S):49.
[16]唐永凯,贾永义.荧光定量PCR数据处理方法的探讨[J].生物技术,2008,18(3):89-91.
[17]Emanuelsson O, Brunak S, von Heijne G.etal.. Locating proteins in the cell using TargetP, SignalP, and related tools[J]. Nat. Protocols, 2007, 4(2):953-971.
[18]贺红霞,陈 亮,康 爽,等.玉米ZmSUT4-J基因的克隆与植物表达载体构建[J].吉林农业科学,2015,40(3):18-22,72.
[19]李俊,王学敏,董 洁,等.东方山羊豆蔗糖转运蛋白基因克隆及表达载体构建[J].中国草地学报,2011,33(3):39-46.
[20]李浩戈,刘晓宇,郭致富,等.ZmG1基因在玉米小穗发育中作用的初步探析[J].辽宁农业科学,2012,3:1-6.
[21]闫 倩,闫苗章,王保莉,等.梭菌氢酶基因部分片段的同源克隆及敲除载体的构建[J].西北农业学报,2012,21(7):61-66.
[22]Jia H F, Wang Y H, Sun M Z,etal.. Sucrose functions as a signal involved in the regulation of strawberry fruit development and ripening[J]. New Phytol., 2013, 198:453-465.
[23]陈发兴, 祁芳斌. 蔷薇科果树果实糖的形成与调控机理研究进展[J].福建果树,2009,4: 46-51.
[24]柴叶茂, 贾海锋, 李春丽,等.草莓果实发育过程中糖代谢相关基因的表达分析[J]. 园艺学报, 2011, 38(4): 637-643.
[25]Ageorges A, Issaly N, Picaud S,etal.. Identification and functional expression in yeast of a grape berry sucrose carrier[J]. Plant Physiol. Biochem., 2000, 38: 177-185.
[26]于 菲, 卢 江, 张雅丽. 葡萄中蔗糖转运蛋白家族的序列分析及功能推测[J].生物信息学, 2011, 9(1):35-38.
[27]Chun Y L, Jian X, Weiss D,etal.. Sugars regulate sucrose transporter gene expression in citrus[J]. Biochem. Biophys. Res. Commun.,2003,306(2): 402-407.
[28]彭昌操. 苹果蔗糖转运蛋白基因MdSUT1克隆及其互作因子筛选[D]. 北京:中国农业大学, 博士学位论文, 2006.
[29]陈俊伟, 张上隆, 张良诚.果实中糖的运输、代谢与积累及其调控[J].植物生理与分子生物学学报, 2004, 30(1):1-10.
[30]王永章, 蒋家慧, 李培环,等.肉质果实碳水化合物代谢及调控研究进展[J].莱阳农学院学报, 2001, 18(4):288-296.
[31]李嘉瑞, 马锋旺.蔷薇科果树山梨醇的研究[J].果树学报, 1991, 8(2):111-115.
The Acquisition and Bioinformatic Analysis of Sucrose Transporter Protein GenePaSUC4 from Apricot
KANG Shuang1,2, HE Hong-xia2*, WANG Ming1*, GUO Jia2, XUE Jing1
1.CollegeofHorticulture,JilinAgriculturalUniversity,Changchun130118,China;
2.JilinProvincialKeyLaboratoryofAgriculturalBiotechnology,InstituteofAgriculturalBiotechnology,JilinAcademyofAgriculturalSciences,Changchun130033,China;
Abstract:Sucrose is transported into fruit cells by sucrose transporters in fruit trees. The transport efficiency of sucrose transporters affects the sugar content and quality of fruits. Reverse transcript PCR technology was used in this study. Prunus armeniaca sucrose transport protein gene SUC4 (PaSUC4) was obtained from Jinong red apricot. The full cDNA was 2 480 bp according to the sequencing result. The codon region was 1 500 bp, encoding 499 amino acids. The protein molecular weight was 53.58 kDa, the soelectric point was 9.31. Results of similarity and phylogenetic analysis showed that the sucrose transporters we got had high similarity with that in Prunus (Rosaceae), speculating the function was also conserved. The expression level of PaSUC4 was highest in mature leaves and lowest in pistils. The characteristics of predicted protein had been analyzed by bioinformatics software. For further verification of the gene biological function, the expression vector had been constructed and transformed into tobacco plants. The research results was expected to provide reference for apricot breeding.
Key words:apricot; sucrose transporter protein gene; bioinformatics
DOI:10.3969/j.issn.2095-2341.2016.02.05
作者简介:康爽,硕士研究生,主要从事果树生物技术与功能基因挖掘研究。E-mail:kangshuang0000@sina.com。*通信作者:贺红霞,副研究员,主要从事植物功能基因挖掘与生物技术研究。E-mail:hehx35@cjaas.com;王铭,教授,主要从事果树育种研究。E-mail:wmingaa@sina.com
基金项目:吉林省科技发展计划项目(20130102043JC)资助。
收稿日期:2015-11-30; 接受日期:2016-01-04
