禽类多瘤病毒APV-1晚期基因多顺反子的EGFP标记载体构建和表达
2016-04-21李劲,刘琳
李 劲,刘 琳
(中南民族大学 生命科学学院,武汉 430074)
禽类多瘤病毒APV-1晚期基因多顺反子的EGFP标记载体构建和表达
李劲,刘琳
(中南民族大学 生命科学学院,武汉 430074)
摘要为研究禽类多瘤病毒晚期基因多顺反子翻译起始调控的机制,设计和构建了以增强绿色荧光蛋白(EGFP)报告基因替代病毒APV-1野生型的晚期结构蛋白VPs基因的真核双顺反子表达载体,并观察其在转染进入禽类原代成纤维细胞中的表达翻译状态.以APV-1 的cDNA克隆(pHL1003)为模板, 运用PCR技术扩增出与野生型病毒APV-1相同的Ori区、早期编码区和晚期Agno-1a区序列作为载体片段;从质粒pEGFP-N1中扩增出编码绿色荧光的EGFP DNA片段;经连接构成重组质粒pHL1003-GFP,通过脂质体细胞转染方法将质粒DNA转染到鸡胚胎和鹌鹑胚胎成纤维细胞中,通过细胞培养观察荧光表达状况. DNA序列分析证实了重组克隆中的EGFP序列与已知的质粒pEGFP-N1中EGFP序列一致.转染72 h后观察鸡和鹌鹑胚胎成纤维细胞,转染成功胚胎细胞明显表达较强的荧光,说明 GFP可以在构建的双顺反子重组质粒的下游中正常表达并产生荧光.pHL1003-GFP 重组质粒的构建及其在禽类原代成纤维细胞中的高效表达,为我们研究多顺反子翻译起始调控中Agno-1a基因的表达对下游病毒结构蛋白基因的翻译调控机制提供了简洁易用的系统和模型.
关键词禽类多瘤病毒;增强绿色荧光蛋白;重组质粒;转染;表达
Construction and Expression of the Polycistronic Vector of Avian Polyomavirus 1 Late Genes Tagged withEGFP
LiJin,LiuLin
(College of Life Science,South-Central University for Nationalities,Wuhan 430074, China)
AbstractTo study the mechanism of translational initiation regulation of the polycistronic mRNA of the Avain Polyomavirus late genes, the eukaryotic expression vector with bi-cistronic mRNA was designed and constructed, in which the downstream late structural proteins of wild-typeAPV-1 were replaced by EGFP reporter gene. By transfection of the recombinant DNA into the bird primary fibroblast cells, the expression of EGFP was observed. UsingAPV-1 cDNA plasmid as template, the early and Ori regions includingAgno-1agene of the viral genome were amplified by PCR. TheEGFPcoding sequence was amplified from plasmid pEGFP-N1. After ligation of the above two kinds of DNA fragments, the recombinant plasmid pHL1003-GFP was identified by restriction enzyme digestions, PCR and DNA sequencing. The viral recombinant DNA was transfected into chicken embryo and quail embryo fibroblasts by lipofection respectively. TheEGFPDNA sequence of the recombinant pHL1003-GFP was consistent with theEGFPsequence in the pEGFP-N1 plasmid by DNA sequencing analysis. After 72 h transfection , theGFPgene at downstream of the bi-cistronic mRNA was able to be expressed effectively, and the strong fluorescence of the GFP was excited in chicken embryo and quail embryo fibroblast cells. The construction of pHL1003-GFP recombinant plasmid and its highly expressed GFP with strong capability of fluorescence excitation in avian primary fibroblast cells provide a simple and easy testing system and an experimental model to explore the translational regulation mechanism in poly-cistronic mRNA of theAgno-1agene for its downstream genes expression, which codingAPV-1 late structural proteins.
Keywordsavian polyomavirus; EGFP; recombinant plasmid; transfection; expression
禽类多瘤病毒(APV-1),也称鹦鹉幼雏病病毒(BFDV),能引起多种鹦鹉幼雏死亡的急性病毒性传染病[1-2].APV-1基因组分为早期基因编码区、晚期基因编码区及非编码调控区(Ori)[3],Ori区位于早期编码区和晚期编码区之间,分别调控早晚期基因表达(见图1).Ori区包含DNA复制起始位点,早期基因启动子(PE)、晚期基因启动子(PL1和PL2)和增强子序列.早期基因编码区包含大T抗原、小t抗原的开放阅读框(ORF),这两种蛋白在病毒DNA开始复制前合成.晚期基因启动子PL1调控晚期基因转录并通过选择性拼接(intron-1/-2a/-3)可产生两种多顺反子mRNAs Agno-1a + VP1(大量)和Agno-1a + VP2/3 + VP1 (少量),分别编码Agno-1a(大量)、VP2、VP3和VP1蛋白(大量)[4].对APV-1的晚期基因编码的前导蛋白Agno-1(1a和1b)和Agno-2(2a和2b)的结构和功能的研究发现,依其mRNA不同的选择性剪切(intron-1a/1b和intron-2a/2b),APV-1的晚期基因PL1、PL2两个启动子可驱动转录并随后加工形成6种成熟的多顺反子mRNAs,分别合成4种前导蛋白(和VP1/2/3)大量的Agno-1a蛋白、少量的Agno-1b、蛋白Agno-2a蛋白和Agno-2b蛋白[5].Agno-1a是一种外壳蛋白VP4并与Agno-1b一起导致鸡胚成纤维细胞的凋亡[6 ].在研究APV-1感染CEF细胞的病毒蛋白质表达的动力学实验中,APV-1感染早期(24 hpi前)以Agno-1a合成占优,其后改变为以VP-1合成为主,形成一种基因表达从Agno-1a到VP-1的switch现象,引发针对Agno-1a在多顺反子翻译调控中作用的研究.
本文构建以增强型绿色荧光蛋白GFP氨基酸编码序列替代APV-1晚期结构蛋白下游VPs氨基酸编码序列(VP2/3和VP1)为报告基因的APV-1 cDNA多顺反子表达质粒,位于多顺反子下游的EGFP报告基因可以在禽类成纤维细胞中高效表达荧光蛋白,从而为研究多顺反子翻译起始调控中上游的Agno-1a基因对下游病毒结构蛋白基因的调控作用提供了简洁易用的系统和模型.
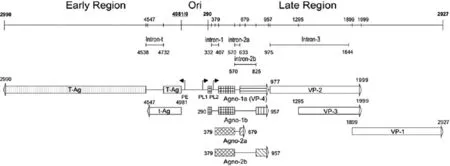
图1 禽类多瘤病毒全基因组线性图Fig.1 The linear map of Avian Polyomavirus-1 genome
1材料与方法
1.1材料和试剂
pHL1003,APV-1 cDNA克隆[见图2(C),ango区域只含有agno-1a,除去intron-4而缺失小t基因,德国Giessen大学Gerd Hobom教授提供],新生小牛血清和DMEM(Gibco-BRL公司),各种限制性内切酶及修饰酶(Takara公司,Biolab公司),DNA Marker(Takara公司). 凝胶回收试剂盒(Axygen公司),PCR引物合成和DNA 测序(上海桑尼生物科技有限公司),脂质体Lipofectamine2000(美国Invitrogen公司).
1.2方法
1.2.1pHL1003的制备
挑取-70℃超低温冰箱保存的含有pHL1003质粒DNA的DH5α菌液接种于1 mL含amp的LB液体培养基,在37℃, 220 r/min 条件下培养12 h,采取SDS碱裂解法提取DNA,1%琼脂糖凝胶电泳检测,质粒DNA保存于-20℃冰箱.
1.2.2表达绿色荧光的EGFPDNA片段
从质粒pEGFP-N1中扩增出编码绿色荧光的EGFP-DNA片段,在GFP多克隆位点处设计一条上游引物,GFP-sense636 (5′TCGAGCTCAAGCTTCGAATTC T3′),在EGFP序列下游设计一条下游引物,GFP-Antisense1535 (5′TATTAAGCTTTGTAACCATTATAAG CT3′)(引入HindIII酶切位点,下划线部分).PCR体系总体积50 μL,含无菌水39 μL,10 × buffer 5 μL,10 μmol/L正反引物各1 μL,1 mmol/L dNTP 2 μL,2.5 U/μL Tag聚合酶1 μL,模板DNA 1 μL. PCR程序:94℃ 5 min;94℃ 30 s;58℃ 30 s;72℃ 1 min;30个循环;72℃ 5 min.所得PCR片段经试剂盒洗盐后,用HindIII,BamHI双酶切,胶回收试剂盒回收约894 bp的小片段.
1.2.3pHL1003-GFP载体片段构建

(a) pEGFP-N1质粒; (b) PCR扩增EGFP目的片段; (c) pHL1003:与野生型APV-1类同的cDNA重组克隆; (d) pHL1003-1: 删除VP1,VP2,VP3的重组cDNA克隆; (e) pHL1003-GFP:构建的GFP荧光标记重组克隆 图2 重组质粒的构建 Fig.2 Construction of the recombinant plasmide
运用PCR技术扩增出与野生型病毒APV-1相同的Ori区、早期编码区和晚期Agno-1a区序列作为载体片段, 在VP-1下游设计一条引物,1003-sense2757(5′TTATAAGCTTCTCCCGAGATTGACA 3′)(引入HindIII酶切位点,下划线部分),VP-2上游设计一条引物,1003-Antisense850(5′TATTGGATCCACCTTAGTGCAGCT AC 3′)(引入BamHI酶切位点,下划线部分).PCR体系总体积50 μL,含无菌水37.5 μL,10×buffer 5 μL,10 umol/L正反引物各1.5 μL,1mmol/L dNTP 1.5 μL,1 U/μL Tag聚合酶1 μL,25 mM MgCl21 μL,模板DNA 1 μL. PCR程序:95℃ 3 min;98℃ 20 s;60℃ 15 s;72℃ 3 min;30个循环;72℃ 6 min. 所得PCR片段经洗盐试剂盒洗盐后,用HindIII,BamHI双酶切,胶回收试剂盒回收约5.6×103的大片段.
1.2.4禽类多瘤病毒荧光标记克隆pHL1003-GFP的构建
将上述获得的目的片段与载体片段按5∶1 的比例混合,T4 DNA连接酶16℃连接过夜, 再转化大肠杆菌DH5α,SDS碱裂解法提取质粒DNA后做酶切鉴定,筛选出正确插入荧光标记的重组克隆pHL1003-GFP.
1.2.5细胞培养及D N A 转染
原代鸡胚和鹌鹑胚成纤维细胞在含10%小牛血清、青霉素和链霉素的DMEM培养基中培养,并于37℃、体积分数5% C02饱和湿度条件下生长.用质粒纯化试剂盒提取pHL1003-GFP和pHL1003质粒DNA,并对含量和纯度进行测定.转染前,各株细胞均以2×105/孔接种于35 mm的培养皿中,每孔加入2 mL DMEM培养液,37℃培养细胞密度达到80%;将3 μg 质粒DNA稀释于无血清无抗生素的DMEM至终体积50 μL,取5 μL Lipofectamine2000稀释于45 μL无血清无抗生素DMEM,轻轻振摇5 min,二者混合,室温静置20 min 后逐滴加入禽类胚胎成纤维细胞上,混匀,培养72 h.
1.2.6转染后倒置荧光显微镜观察细胞
转染DNA 36、48、60、72 h后采用荧光显微镜在488 nm波长紫外光激发条件下观察细胞中EGFP的表达情况.
2结果与分析
2.1重组载体的酶切鉴定
制备的载体和目的DNA片段经1%琼脂糖凝胶电泳检测,条带大小分别为5.6 kb和0.9 kb(见图5),将目的片段和载体片段连接、转化和细菌培养,挑取阳性克隆,SDS碱裂解法提取质粒DNA后,用BamHI单酶切和HindIII,BamHI双酶切检测(见图3),选择有插入目的DNA片段的克隆测序.

(1) 载体片段5.6 kb;(2) 目的片段894 bp;(3) 1kb Marker Fig.3 Preparation of the vector and the target DNA图3 制备载体和目的片段DNA
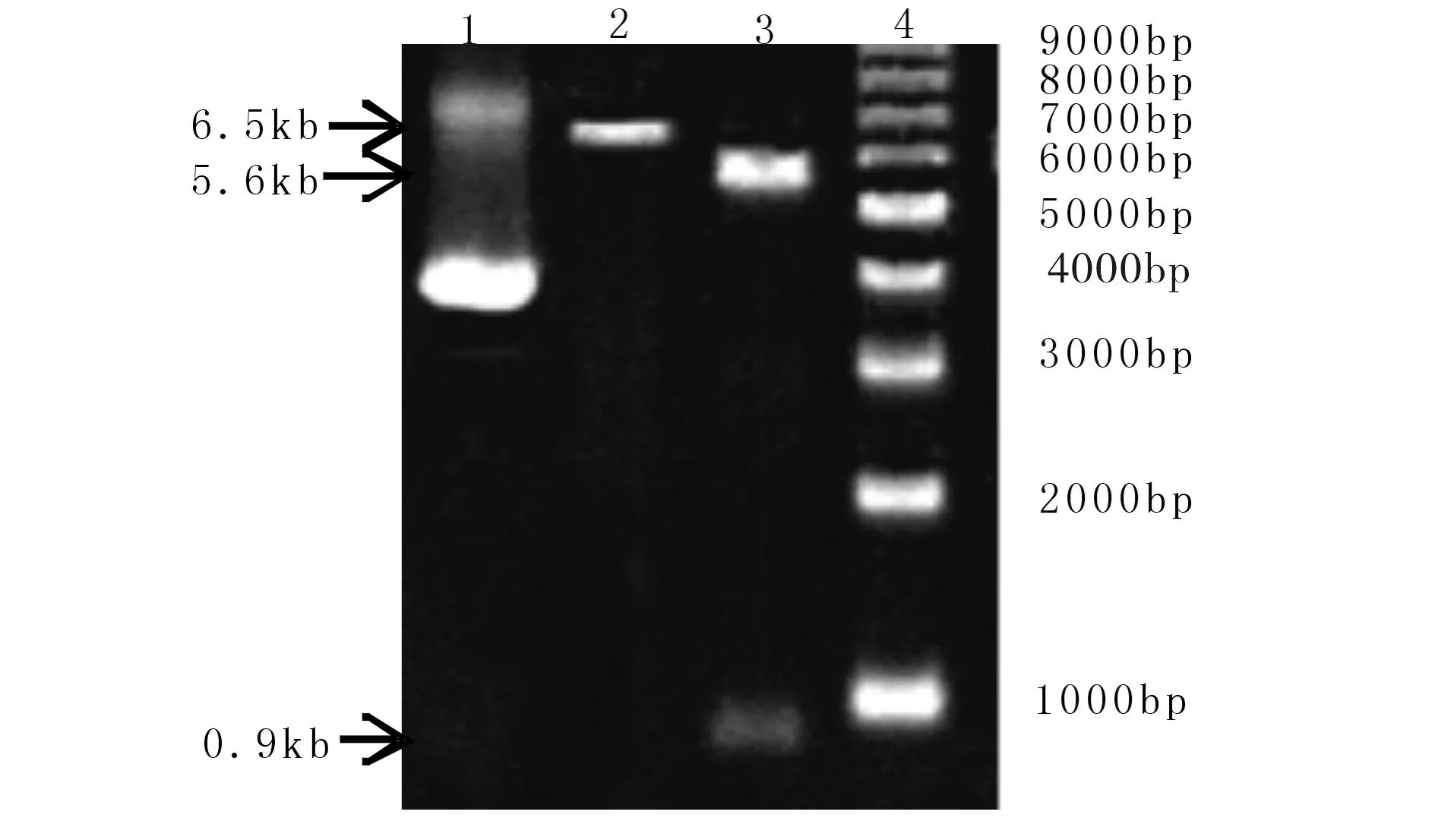
(1) 阳性克隆的质粒DNA;(2) 阳性克隆BamH I酶切,(3)阳性克隆Hind III + BamH I双酶切;4)1kb Marker 图4 阳性克隆酶切鉴定 Fig.4 Identification of the positive clone
2.2重组克隆的测序鉴定:
双向测序表明,重组克隆中插入了相应的EGFP目的片段. Blast比对分析表明pEGFP-N1质粒DNA中EGFP序列与重组克隆中的插入序列一致,证明APV-1cDNA重组EGFP克隆构建成功.
2.3细胞中重组质粒GFP的表达
重组克隆pHL1003-GFP质粒DNA转入鸡胚成纤维细胞后,在48 hpt可观察到部分细胞表达EGFP; 72h后,表达EGFP的细胞数量逐渐增多,细胞中有较强的荧光蛋白表达 (见图5).

a)72 h细胞表达GFP (b)72 h 可见光下细胞图5 荧光显微镜观察鸡胚细胞荧光蛋白表达Fig.5 The GFP expression of CEF under fluorescence microscope

(a) 72 h细胞表达GFP (b) 72 h 可见光下细胞图6 荧光显微镜观察鹌鹑胚胎成纤维细胞荧光蛋白表达Fig.6 The GFP expression of QEF under fluorescence

图7 激光扫描共焦显微镜观察鸡胚细胞荧光蛋白表达Fig.7 The GFP expression of CEF under confocal laserscanning microscopy
3讨论
研究表明一些缺乏5′帽子结构的非典型病毒如小核糖核酸病毒和丙型肝炎病毒的翻译合成起始,是依赖其5′端非翻译区翻译调控的顺式作用元件(包括RNA的高级结构),在一些关键的反式作用因子ITAFs(IRES trans-acting factors)的辅助下,直接招募核糖体小亚基到病毒mRNA的翻译起始位点[7].能够特异性引导核糖体识别mRNA内部序列和结构并与mRNA 结合从而起始翻译的序列称为内部核糖体进入位点序列(internal ribosome entry site,IRES) .
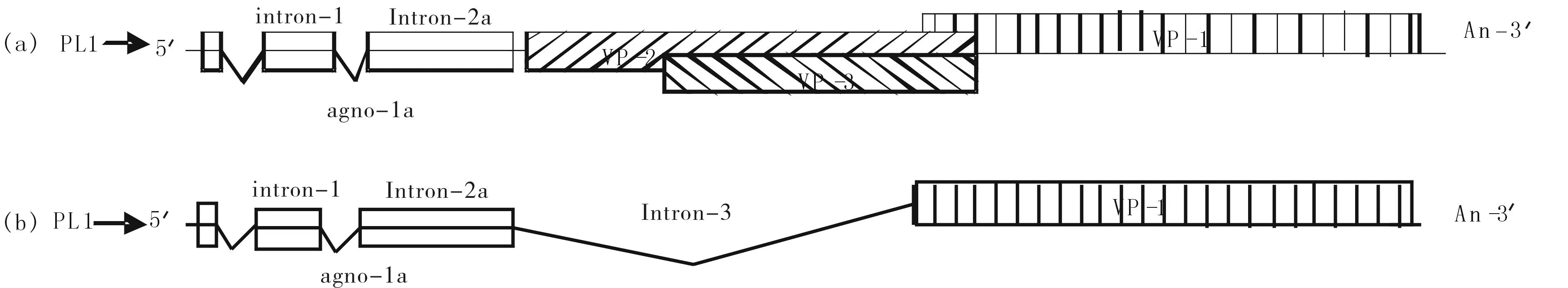
图8 pL1下2顺反子(Agno-1a+VP1)和3顺反子(Agno-1a+VP2/3)线形图 Fig.8 Under pL1 2 cistron (Agno-1a + VP1) and 3 cistron (Agno-1a + VP2 / 3) Line Chart
禽多瘤病毒APV-1与猴空泡病毒(SV40)和其他哺乳动物的多瘤病毒都是通过启动子上游的起始位点序列和大T抗原蛋白的先相互作用进行晚期mRNA转录调控. 在APV-1中,两个启动子PL1和PL2,相隔89 bp,晚期基因启动子PL1调控的晚期基因转录通过选择性拼接(intron-1/-2a(2b)/-3)可产生两组四种多顺反子mRNAs:Agno-1a+VP1(大量)和Agno-1a+VP2/3+VP1(少量);Agno-1a+VP1(少量)和Agno-1b + VP2/3 + VP1(少量).分别翻译出Agno-1a(大量)、Agno-1b、Agno-2a、Agno-2b、VP1(大量)、VP2、VP3蛋白(见图8).内含子1,2a,3剪切后,产生最主要和占多数的多顺反子Agno-1a+VP1的mRNA,翻译出Agno-1a、VP1蛋白(见图8-b)[4,5,6].内含子1和2a被剪切后,产生多顺反子Agno-1a+VP2/3+VP1,翻译出Agno-1a、VP2、VP3蛋白(见图8-a)[ 4].对 APV 的晚期基因编码的前导蛋白 Agno-1( 1a和 1b) 和 Agno-2( 2a 和 2b) 的结构和功能的深入研究,发现这些Agno蛋白与禽类多瘤病毒的晚期蛋白的表达调控有关[5].依据对APV-1的一系列研究结果的分析,推测在最主要的agno-1a+VP1双顺反子中Agno-1a蛋白可能作为ITAF辅助VP1的IRES调控VP1的翻译,而该双顺反子的5′-UTR和agno-1a mRNA区域可形成特异的IRES,从而导致开始以依赖帽子结构的方式进行上游Agno-1a的翻译switch到后期的由ITAF(Agno-1a)结合IRES介导的下游VP1的翻译.为研究多顺反子中上游Agno基因,特别是占主要数量的Agno-1a基因的表达对下游病毒结构蛋白基因表达的调控作用,设计和构建出与野生型病毒APV-1基因组结构相同的但在Agno-1a翻译起始AUG区域插入含AUG起始码的编码7个氨基酸的具有最佳翻译起始信号核苷酸的两种APV-1 cDNA克隆突变体,转染到鸡胚细胞内观察其对Agno-1amRNA下游VP蛋白翻译的影响[8].用Western blot方法特异性显示目标蛋白,通过条带的位置(MW)和密度判断蛋白的种类和表达数量,以此分析和研究多顺反子翻译起始调控机制.但此法也有其局限性,如过程较长,操作繁琐,无法实时定位,定量困难等.
本研究设计用pEGFP-N1的GFP氨基酸编码序列代替APV-1晚期结构蛋白下游VPs氨基酸编码序列(VP2/3和VP1),构建出带有下游EGFP荧光标记报告基因的双顺反子重组克隆,可通过在荧光显微镜下定性和相对定量地观察重组病毒基因表达荧光量的异同,结合Agno-1a的多种不同突变体可反映上游Agno-1a基因对GFP表达的影响. 转染24 h后观察鸡胚和鹌鹑胚胎成纤维细胞,部分细胞(细胞核)表达了荧光. 转染48 h后观察,转染成功的细胞(细胞核,细胞质)表达明显的荧光.转染72 h后观察,发现较多胚胎细胞明显表达较强的荧光. 转染的阴性对照质粒pHL1003,细胞不表达荧光.表达有较强的荧光的样本可采用ELISA绿色荧光蛋白酶联免疫分析测定不同样本中绿色荧光蛋白水平. 此方法较Western blot更加简便易用,同批细胞可在不同转染时间下持续地定性和相对定量地观察的GFP的表达情况. 所构建的APV-1绿色荧光蛋白报告基因标记克隆均能较好地表达GFP并在488 nm下正常地激发出较强的荧光信号.在后续研究多顺反子中的上游基因(如Agno-1a)对下游基因(如VPs)蛋白质翻译的调控机制打下了良好的基础.
参考文献
[1]冯锋,夏苇,赵林,等. 我国一种鹦鹉新病毒的分离[J].中国病毒学,1996,11(4):384-386.
[2]夏苇,冯锋,李天宪,等. 我国一株鹦鹉病毒的鉴定及其生化特性[J]. 中国病毒学,1999,3(14):265-272.
[3]寇铮. 鹦鹉幼雏病毒结构蛋白VP1 基因的克隆及原核表达[J].华中农业大学学报,2004,23(6):593-596.
[4]Li J, Liu Q, Müller H, et al. Avian polyomavirus expression patterns of bicistronic late mRNAs[J].Virology,2009,388(1): 42-48.
[5]Li J. Molecular analysis of late gene expression and characterization in BFDV (budgerigar fledgling disease virus)[D]. Giessen:Justus-liebig-Universitat Giessen,1996.
[6]Shen P S.Enderlein D,Nelson C D,et al. The structure of avian polyomavirus reveals variably sized capsids,non-conserved inter-capsomere interactions,and a possible location of the minor capsid protein VP4 [J]. Virology,2011,411(1):142-152.
[7]Jang S K. Internal initiation: IRES elements of picornaviruses and hepatitis c virus [J]. Virus Research, 2006, (119): 2-15.
[8]李劲,高奎,李可可,等. 禽类多瘤病毒APV-1的cDNA病毒突变体构建[J].中南民族大学学报(自然科学版),2013,32(3):22-25.
中图分类号Q291
文献标识码A
文章编号1672-4321(2016)01-0039-05
基金项目教育部留学回国人员科研启动基金[教外司留(2007)1108号]
作者简介李劲(1962-),男,副教授,博士,研究方向:分子病毒学,E-mail:jinli62@126.com
收稿日期2015-12-06
