苯基乙酰对小鼠移植性肺癌的抑制作用及其机制
2016-04-18权文强吴军录姚懿雯万海英李冬上海市同济医院上海200065
权文强,吴军录,姚懿雯,万海英,李冬(上海市同济医院,上海200065)
苯基乙酰对小鼠移植性肺癌的抑制作用及其机制
权文强,吴军录,姚懿雯,万海英,李冬(上海市同济医院,上海200065)
摘要:目的观察苯基乙酰(PG)对肺癌的抑制作用,并探讨其作用机制。方法选择C57BL/6小鼠40只,尾静脉注射肺癌LLC细胞建立肺癌模型。随机将成模小鼠分为PG组、PBS组各20只,PG组腹腔内注射800 mg/kg PG,PBS组腹腔内注射等量PBS,连续10天。两组各随机取5只,计数肺肿瘤个数、测量肿瘤最大直径;各随机取5只,采用Western blotting法观察肺癌组织Bcl-2、Bcl-XL、细胞凋亡抑制蛋白1(cIAP1)、Survivin、增殖细胞核抗原(PCNA)表达。剩余小鼠收集支气管肺泡灌洗液(BALF),取5只小鼠的BALF,检测炎症细胞(包括WBC总数及分类)及炎症因子(TNF-α、IL-6、趋化因子);剩余小鼠的BALF,采用电泳迁移位移试验观察NF-κB DNA结合活力。结果与PBS组比较,PG组肺肿瘤个数和肿瘤最大直径明显减少或降低(P均<0.05)。Western blotting结果显示,PG组Bcl-2、Bcl-XL、cIAP1、Survivin及PCNA表达均明显下调,BALF中巨噬细胞中NF-κB与靶DNA结合活性明显被抑制。与PBS组比较,PG组可显著降低BALF中各种炎性细胞数量及炎症因子水平(P均<0.05)。结论PG能明显抑制小鼠肺癌的生长,其机制与诱导肿瘤细胞凋亡、抑制巨噬细胞中NF-κB活性、减轻肺部炎症反应有关。
关键词:肺癌;苯基乙酰;巨噬细胞;核因子-κB;炎症反应;小鼠
炎症免疫细胞在肿瘤的发展中扮演重要角色,如巨噬细胞,其数量与肿瘤预后有关[1];侵入肿瘤的巨噬细胞及其释放的大量可溶性炎症介质(如TNF-α、IL-6),可促进肿瘤细胞增殖、浸润和转移[2]。研究发现,NF-κB能够调节肿瘤细胞增殖和生存时间,促进血管形成、细胞侵袭和肿瘤转移,在多种肿瘤形成中具有重要作用,如肺癌、结肠癌等[3,4]。尿多酸肽(CDA-2)是从健康人尿液中分离、提取的一种抗肿瘤新药[5],对白血病、肝癌、肺癌等均有抑制作用[6~8]。苯基乙酰(PG)是CDA-2的主要成分,但其是否为CDA-2的主要作用成分尚不清楚。2014年2~9月,我们观察了PG对小鼠移植性肺癌的抑制作用,并对其作用机制进行初步探讨。
1材料与方法
1.1材料雌性C57BL/6小鼠40只,6~8周龄,体质量18~24 g,由国家啮齿类实验动物中心上海分院提供,饲养于同济大学附属同济医院SPF级无菌实验室。LLC细胞,美国标准细胞培养所;细胞培养用青霉素、链霉素、DMEM培养基,美国Hyclone公司;FBS,美国Invitrogen公司;PG,美国Sigma公司。鼠抗Bcl-XL、Bcl-2,美国Santa Cruz公司;鼠抗增殖细胞核抗原(PCNA)、兔抗细胞凋亡抑制蛋白1(cIAP1)、兔抗Survivin,英国Abcam公司;鼠抗β-actin,美国Sigma公司。HRP结合的羊抗兔,美国Santa Cruz公司;HRP结合的兔抗鼠,丹麦Dako公司。
1.2模型制备及动物处理传代培养LLC细胞,取对数生长期细胞用于实验。随机将小鼠分为PG组、PBS组各20只。两组均尾静脉注射LLC细胞2×105个。注射第14天开始,PG组腹腔内注射PG 800 mg/kg,PBS组腹腔内注射等体积PBS;均连续10天。
1.3相关指标观察
1.3.1肺肿瘤情况观察腹腔内注射药物第10天,随机各取5只处死,取出荷瘤肺,4%多聚甲醛固定。固定24 h,石蜡包埋,350 μm厚连续切片,HE染色,计数肺肿瘤个数,并测量肿瘤最大直径。
1.3.2抗凋亡及增殖相关因子检测采用Western blotting法。随机各取5只,显微镜下用18G针头分离肺肿瘤组织,取10 mg置于500 μL含有PMSF及Cocktail蛋白酶抑制剂的RIPA裂解液中,用组织匀浆器充分匀浆后置冰上30 min,4 ℃ 12 000 r/min离心15 min,取上清;采用BCA试剂盒测定BCA蛋白浓度,调整浓度一致后加入5×loading煮沸10 min。取30 μg样本上样于10%十二烷基硫酸钠-聚丙烯酰胺凝胶,电泳,冰浴转膜。5%脱脂奶粉封闭1 h,加一抗孵育过夜,相应二抗杂交。采用ECL化学发光剂显影,压片,观察Bcl-XL、Bcl-2、cIAP1、Survivin、PCNA表达。
1.3.3炎症细胞及炎症因子检测剩余小鼠,经气管对荷瘤肺进行PBS灌注,收集支气管肺泡灌洗液(BALF)。各取5只检测炎症细胞及炎症因子。采用血细胞计数仪计数WBC总数,计数细胞后,离心涂片,选择任意视野计数100个白细胞,对白细胞进行分类。采用双抗体夹心ELISA法检测TNF-α、IL-6、趋化因子(KC),所有操作严格按试剂盒说明书进行。
1.3.4NF-κB DNA结合活力检测采用电泳迁移位移试验。取剩余5只小鼠的BALF,置于含DMEM的细胞培养皿中,37 ℃ 5% CO2培养箱中孵育1 h,培养皿用PBS洗3次,收集贴壁细胞,主要为巨噬细胞。按核蛋白抽提试剂盒说明对肺泡巨噬细胞进行核浆蛋白分离。核蛋白用带32p标记的双链NF-κB序列探针在室温孵育30 min,DNA-蛋白混合物上样于4%聚丙烯酰胺凝胶,0.5×TBE电泳缓冲液,300 V电压电泳。凝胶干燥,-80 ℃ ECL显影。

2结果
2.1两组肿瘤形成情况比较PBS组及PG组肿瘤个数分别为(45.2±10.5)、(9.6±3.0)个,肿瘤最大直径分别为(5.4±0.8)、(1.7±0.6)mm。两组比较,P均<0.05。
2.2两组抗凋亡及增殖相关因子表达情况Western blotting结果显示,Bcl-XL、Bcl-2、cIAP1相对灰度值分别下降至0.53±0.05、0.42±0.03、0.27±0.04;凋亡抑制因子Survivin含量亦明显减少,相对灰度值下降至0.39±0.03。同时发现,PCNA表达亦明显下降,相对灰度值下降至0.29±0.02。见插页Ⅱ图4。
2.3两组BALF中炎性细胞及炎性因子水平比较见表1、2。
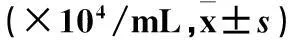
表1 两组BALF中白细胞总数及分类比较
注:与PBS组比较,*P<0.05。
2.4两组NF-κB DNA结合活力情况见插页Ⅱ图5。与PBS组比较,PG处理显著抑制BALF中巨噬细胞NF-κB与靶DNA结合活性,同时对肿瘤细胞的NF-κB活性也有显著抑制作用, 相对灰度值下降至0.13±0.02。
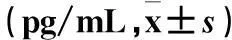
表2 两组BALF中TNF-α、IL-6、KC
注:与PBS组比较,*P<0.05。
3讨论
CDA-2有多个活性部分,如PG、苯甲酰-乙二醇、4-羟基-苯基酸等。有研究认为,PG可能在其抗癌中起主要作用[6]。PG在体外的抑癌作用可能是通过上调过氧化物酶激活受体和抑制PI3/Akt信号传导通路来实现[8]。
肿瘤细胞微环境包括免疫细胞[如肿瘤相关巨噬细胞(TAM)]和结缔组织(如成纤维细胞、内皮细胞等),对肿瘤的发生、发展具有重要作用[2]。TAMs通过释放炎性细胞和趋化因子形成新生血管,促进肿瘤侵袭和转移,导致肺癌患者预后较差[1~4]。本研究结果显示,PG组BALF中炎症细胞数明显少于PBS组。推测PG可能是通过抑制炎性免疫细胞数量、减轻炎性反应来抑制肺癌细胞增殖。
活化的NF-κB是诱导多种肿瘤发生的重要靶基因[9,10]。在炎性细胞中,活化的NF-κB控制着炎性因子的产生,如TNF、IL-6和KC等。这些因子能够诱导肿瘤发生和促进肿瘤细胞增殖。活化的NF-κB在肿瘤细胞中亦有同样作用,能够促进肿瘤血管形成、细胞侵袭和转移。而敲除髓系细胞和肺癌上皮细胞的NF-κB能降低肺癌发生风险[11~14]。近年来,通过体外培养人类白血病和MDS细胞系发现,PG能够通过影响IkBa磷酸化和降解阻止NF-κB核易位而抑制NF-κB活性[6]。由此推测,PG抑制肺癌生长可能涉及NF-κB的调控。本研究发现,PG能够显著降低肺泡巨噬细胞中NF-κB与靶DNA结合活性,提示PG能够通过抑制肺泡巨噬细胞中NF-κB激活来抑制肺癌细胞增殖。
Toll样受体(TLR)通常在髓系细胞表面表达,通过激活NF-κB诱导炎症因子的产生和释放,在机体的先天免疫中行使重要功能。近年研究发现,在肺癌微环境中,TAM表面的TLR2介导NF-κB激活,增强TNF-α、IL-6等因子的释放,促进肺肿瘤生长[15]。因此,PG抑制NF-κB激活过程可能涉及TLR,特别是TLR2;通过抑制TLR2、阻断NF-κB激活可能是PG的抗炎作用机制。有研究报道,抑制肿瘤细胞中NF-κB活性可使肺癌、乳腺癌、结肠癌等细胞增殖停滞,并促使其凋亡[16]。因此不排除PG对肺癌细胞具有直接抑制增殖、促进凋亡的作用。
综上所述,PG能抑制小鼠肺癌的生长,其机制与诱导肿瘤细胞凋亡、抑制巨噬细胞中NF-κB激活、减轻肺部炎性反应有关。
参考文献:
[1] Lievense LA, Bezemer K, Aerts JG, et al. Tumor-associated macrophages in thoracic malignancies[J]. Lung Cancer, 2013,80(3):256-262.
[2] Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013,19(11):1423-1437.
[3] Takahashi H, Ogata H, Nishigaki R, et al. Tobacco smoke promotes lung tumorigenesis by triggering IKKbeta- and JNK1-dependent inflammation[J]. Cancer Cell, 2010,17(1):89-97.
[4] Karin M, Greten FR. NF-kappaB: linking inflammation and immunity to cancer development and progression[J]. Nat Rev Immunol, 2005,5(10):749-759.
[5] Yao CJ, Lai GM, Chan CF, et al. Differentiation of pheochromocytoma PC12 cells induced by human urine extract and the involvement of the extracellular signal-regulated kinase signaling pathway[J]. J Altern Complement Med, 2005,11(5):903-908.
[6] Huang J, Yang M, Liu H, et al. CDA-Ⅱ, a urinary preparation, induces growth arrest and apoptosis of human leukemia cells through inactivation of nuclear factor-kappaB in a caspase-dependent manner[J]. Food Chem Toxicol, 2009,47(1):40-49.
[7] Lin WC, Liao YC, Liau MC, et al. Inhibitory effect of CDA-Ⅱ, a urinary preparation, on aflatoxin B(1)-induced oxidative stress and DNA damage in primary cultured rat hepatocytes[J]. Food Chem Toxicol, 2006,44(4):546-551.
[8] Huang J, Yang M, Liu H, et al. Human urine extract CDA-2 induces apoptosis of myelodysplastic syndrome-derived MUTZ-1 cells through the PI3K/Akt signaling pathway in a caspase-3-dependent manner[J]. Acta Pharmacol Sin, 2008,29(8):951-964.
[9] 雷梅先,王云开,殷然,等.肝X受体通过NF-κB信号通路减轻高糖诱导的H9C2细胞凋亡[J].中国药理学通报,2014,30(12):1698-1704.
[10] 孟兰,程民,沈国栋,等.5-氮杂-2-脱氧胞苷联合曲古抑菌素A对胃癌细胞SGC-7901MGMT表达及NF-κB活性的影响[J].中国药理学通报,2014,30(2):244-250.
[11] Grivennikov SI, Karin M. Inflammation and oncogenesis: a vicious connection[J]. Curr Opin Genet Dev, 2010,20(1):65-71.
[12] Grivennikov SI, Karin M. Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer[J]. Cytokine Growth Factor Rev, 2010,21(1):11-19.
[13] Luo JL, Maeda S, Hsu LC, et al. Inhibition of NF-kappaB in cancer cells converts inflammation- induced tumor growth mediated by TNFalpha to TRAIL-mediated tumor regression[J]. Cancer Cell, 2004,6(3):297-305.
[14] Naugler WE, Karin M. NF-kappaB and cancer-identifying targets and mechanisms[J]. Curr Opin Genet Dev, 2008,18(1):19-26.
[15] Kim S, Takahashi H, Lin WW, et al. Carcinoma-produced factors activate myeloid cells through TLR2 to stimulate metastasis[J]. Nature, 2009,457(7225):102-106.
[16] Aggarwal BB. Nuclear factor-kappaB: the enemy within[J]. Cancer Cell, 2004,6(3):203-208.
Inhibitory effect of phenylacetylglutamine on metastatic lung caner of mice
QUANWenqiang,WUJunlu,YAOYiwen,WANHaiying,LIDong
(TongjiHospitalofTongjiUniversity,Shanghai200065,China)
Abstract:ObjectiveTo observe the inhibitory effect of phenylacetylglutamine (PG) on lung caner and to investigate the mechanism. MethodsThe lung cancer metastasis models in C57BL/6 mice was generated by intravenous injection of Lewis lung carcinoma (LLC) cells. Then the model mice were randomly divided into PG group (n=20) which was injected with 800 mg/kg PG and PBS group (n=20) which was injected with the same amount of PBS, both for 10 days. We randomly took 5 mice in each group to calculate the tumor count and measure the size of tumor. We randomly took 5 mice in each group to detect the expression of Bcl-2, Bcl-XL, cIAP1, Survivin and PCNA proteins by Western blotting. The broncho alveolar lavage fluid (BALF) from 5 mice were collected to detect inflammatory cells and inflammatory factors (TNF-α, IL-6, KC). The electrophoretic mobility shift assay (EMSA) was used to detect the NF-κB DNA binding ability. ResultsCompared with the PBS group, the growth of lung tumors in mice was inhibited, and tumor number and tumor size decreased significantly in the PG group (P<0.05). The expression of Bcl-2, Bcl-XL, cIAP1, Survivin and PCNA was significantly decreased in the PG group. In BALF of the PG group, binding activity between NF-κB and target DNA was strongly suppressed. Compared with the PBS group, the number of BALF of various inflammatory cells and inflammatory cytokines were significantly reduced in the PG group (all P<0.05). ConclusionPG can inhibit the development of lung tumor, and the mechanism may be related with inducing lung tumor cell apoptosis, inhibiting the activation of NF- κB, and reducing the inflammatory reaction.
Key words:lung cancer; phenylacetylglutamine; macrophage; nuclear factor-kappa B; inflammation reaction; mice
(收稿日期:2015-09-29)
中图分类号:R734.2
文献标志码:A
文章编号:1002-266X(2016)08-0020-03
doi:10.3969/j.issn.1002-266X.2016.08.007
通信作者简介:李冬(1974-),男,副教授,研究方向为肿瘤的分子诊断。E-mail: 186ld@163.com
作者简介:第一权文强(1985-),男,硕士研究生,研究方向为炎症与肿瘤的关系。E-mail: qwq1985@126.com
基金项目:国家自然科学基金资助项目(81272603,81472179);上海市浦江人才计划(13PJ1407300);上海申康医院发展中心市级医院临床辅助科室能力建设项目(SHDC22014008)。
