玉烛散水煎液对血虚型结肠慢传输型便秘小鼠胃肠功能的影响及其作用机制
2016-04-18吕艳锋王建新李志文崔振华王贤仁禹化龙喻苗金镭刘贞吉山东大学第二医院济南250033
吕艳锋,王建新,李志文,崔振华,王贤仁,禹化龙,喻苗,金镭,刘贞吉(山东大学第二医院,济南250033)
玉烛散水煎液对血虚型结肠慢传输型便秘小鼠胃肠功能的影响及其作用机制
吕艳锋,王建新,李志文,崔振华,王贤仁,禹化龙,喻苗,金镭,刘贞吉(山东大学第二医院,济南250033)
摘要:目的探讨不同浓度玉烛散水煎液对血虚型结肠慢传输型便秘(STC)小鼠胃肠功能的影响及其可能的作用机制。方法制备含生药0.8、0.4、0.2 g/mL的玉烛散水煎液(分别为高、中、低浓度)。建立小鼠血虚型STC模型60只,随机分为模型对照组、莫沙必利组,高、中、低浓度玉烛散组,每组12只;莫沙必利组予莫沙必利灌胃,高、中、低浓度玉烛散组分别予高、中、低浓度玉烛散水煎液20 mL/kg灌胃;另选正常小鼠12只作为空白对照组,空白对照组、模型对照组均予等体积生理盐水灌胃。各组均连续灌胃7天。比较各组第1次排黑便时间、排便粒数、排便重量及血清5-羟色胺(5-HT)、胃动素(MTL)、NO水平。结果与空白对照组比较,模型对照组第1次排黑便时间明显增加,排便粒数、排便质量显著降低(P均<0.05);与模型对照组比较,高、中浓度玉烛散组第1次排黑便时间明显缩短,粪便粒数和重量显著增加(P均<0.05);与莫沙必利组比较,高、中浓度玉烛散组第1次排黑便时间亦显著缩短,粪便粒数和重量亦显著增加(P均<0.05);并且高、中浓度玉烛散组效果优于低浓度玉烛散组(P均<0.05)。与空白对照组比较,模型对照组血清5-HT水平明显降低(P<0.05);与模型对照组比较,高、中、低浓度玉烛散组及莫沙必利组血清5-HT水平明显升高(P均<0.05)。与空白对照组比较,模型对照组血清MTL水平明显降低(P<0.05);与模型对照组比较,中浓度玉烛散组血清MTL水平明显升高(P<0.05)。与空白对照组比较,模型对照组血清NO水平明显升高(P<0.05);与模型对照组比较,中浓度玉烛散组、莫沙必利组血清NO水平明显降低(P均<0.05)。结论0.8、0.4、0.2 g/mL的玉烛散水煎液均能促进血虚型STC小鼠肠蠕动,改善其胃肠功能,呈一定的量效关系;其机制可能与升高血清5-HT、MTL水平,降低血清NO水平有关。
关键词:结肠慢传输型便秘;血虚型便秘;玉烛散;小鼠
结肠慢传输型便秘(STC)又称结肠无力,属肠道动力障碍性疾病[1,2]。中医认为,STC大多属中医虚秘范畴,多以虚证为主,临床以气虚、血虚便秘居多,且虚实夹杂,多伴血瘀,临证以养血润肠、化瘀通便为治法,常能获得满意疗效。玉烛散出自中医古籍《儒门事亲》,具有调养气血、通瘀润肠之功效,多用于治疗虚型便秘。本课题组自2008年开展关于便秘胃肠道动力方面的中医药研究,前期研究发现,玉烛散中部分单味药物在药理上有促进排便作用,但其成方功效具体机理鲜见报道。2012年12月~2013年10月,我们观察了玉烛散水煎液对血虚型STC小鼠胃肠功能的影响,现分析结果,并探讨其可能的作用机制。
1材料与方法
1.1材料健康ICR小鼠100只,4周龄,雌雄各半,体质量18~22 g,由山东鲁抗医药集团提供,许可证号:SCXK(鲁)20080002。所有小鼠于山东大学第二医院实验动物中心适应性饲养,温度20~22 ℃,相对湿度50%~60%。复方苯乙哌啶(批号:20110703,长春长红制药有限公司);枸橼酸莫沙必利片(批号:110511,鲁南贝特制药有限公司);纳米碳混悬液(规格:50 mg/支,批号:20100022,重庆莱美药业股份有限公司);电子天平(型号:DS-425P,上海寺岗电子有限公司);恒温鼓风干燥箱(型号:DHG-9030A,上海精宏仪器厂)。 玉烛散水煎液(主要成分为当归、川芎、熟地、白芍、大黄、芒硝、甘草)制备:取同一批次各药材饮片(除芒硝)10 g,用蒸馏水浸泡30 min,煎煮30 min收集煎液,煎液中加入芒硝10 g,搅拌充分溶解。原渣再加水煎20 min,过滤取煎液,两液合并后加热蒸发,制成含生药0.8、0.4、0.2 g/mL的水煎液(分别为高、中、低浓度),4 ℃冰箱保存备用。
1.2动物分组及处理所有小鼠适应性饲养48 h。随机取12只作为空白对照组。其余小鼠制作血虚型STC模型[3,4]:复方苯乙哌啶(1.875 mg/kg)连续灌胃30天。灌胃首日下午,用75%乙醇棉球擦拭小鼠尾部,使血管扩张充血,剪去鼠尾尖端(0.25~0.30 cm),将鼠尾伤口浸入37 ℃温水中,直至小鼠失血0.15~0.20 mL。每5天同法放血1次,共6次。共制成血虚型STC模型小鼠60只。
将成模小鼠随机均分为模型对照组、莫沙必利组及高、中、低浓度玉烛散组,每组12只。按人和动物比例折算药物用量[5],莫沙必利组给予枸橼酸莫沙必利片1.875 mg/kg,用生理盐水稀释至0.05 mg/mL灌胃,2次/d;高、中、低浓度玉烛散组分别予高、中、低浓度玉烛散水煎液20 mL/kg灌胃,2次/d。空白对照组、模型对照组给予等体积生理盐水灌胃。各组均连续灌胃7天。末次灌胃前禁食12 h,灌胃液加入纳米碳混悬液1 mL,混匀后灌胃。
1.3相关指标观察
1.3.1排便情况观察灌胃后第1次排黑便时间,连续观察12 h,计数排便粒数,并称取粪便重量。
1.3.2血清5-羟色胺(5-HT)、胃动素(MTL)、NO各组收集完粪便后,腹腔注射4%水合氯醛麻醉,下腔静脉取血,4 ℃ 2 500 r/min离心10 min,取上清,检测血清5-HT、MTL、NO。所有操作严格按试剂盒说明进行。

2结果
2.1各组排便情况比较见表1。

表1 各组排便情况比较±s)
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与莫沙必利组比较,△P<0.05;与低浓度玉烛散组比较,▲P<0.05。
2.2各组血清5-HT、MTL、NO水平比较见表2。
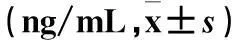
表2 各组血清5-HT、MTL、NO水平比较
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与莫沙必利组比较,△P<0.05;与中浓度玉烛散组比较,▲P<0.05。
3讨论
STC是由结肠传输功能障碍引起的一种常见疾病,表现为排便次数减少、排便困难、腹胀等,其确切发病机制尚不清楚[6~8]。目前西医治疗以各类泻药为主,多数患者治疗早期病情有所缓解,但长期服用泻药易产生耐药,部分患者产生药物依赖性,表现为服药即便、停药即秘,出现滥用泻药综合征、泻剂结肠等,部分长期服药者出现水电解质紊乱、心律失常等。
近年来,中药单方及组方治疗便秘多有报道,如单味中药枳实、木香、养血润肠方等[9,10],均可增加胃肠道推进率。玉烛散来自《儒门事亲》卷十二,由当归、川芎、熟地、白芍、大黄、芒硝、甘草组成,主要功用是养血清热、泄积通便,主治血虚秘结。《成方切用》谓:取《尔雅》“四时和气,谓之玉烛”之义。古籍中对其颇为推崇,《血证论》释:取四物以补调其血,而芒硝、大黄逐瘀去闭。
5-HT是参与调节胃肠道运动和分泌功能的重要神经递质和旁分泌信号分子,与慢性便秘、肠易激综合征、腹泻等胃肠道功能性疾病密切相关[11~13]。结肠体外实验证明,5-HT类似物能够加速结肠运动,而其拮抗剂则明显抑制结肠运动[14]。MTL是一种含有22个氨基酸的活性直链多肽,分泌MTL的细胞分布于十二指肠和近端空肠黏膜隐窝及绒毛中,在胃底、胃窦及小肠下部黏膜有少量分布,通过血液循环以内分泌的方式调节胃肠运动,其主要生理作用是促进消化间期的胃肠运动,是参与胃肠动力的一种兴奋性肽[15]。NO在肠道的生理活动中具有重要作用,通过扩散方式进入胃肠平滑肌细胞,激活可溶性鸟苷酸环化酶,引起cGMP升高,可减少细胞内钙离子浓度,使结肠平滑肌松弛导致胃肠蠕动减弱[16]。
莫沙必利作为第四代促胃肠动力药物,是一种强效5-HT受体激动剂,通过兴奋肌间神经丛5-HT受体,刺激乙酰胆碱释放,增强胃肠运动,已得到广泛认可。本研究结果显示,与莫沙必利组比较,高、中浓度玉烛散组第1次排黑便时间明显缩短,排便粒数及重量明显增加。表明玉烛散水煎液可用于STC的治疗。本研究还发现,与空白对照组比较,模型对照组血清5-HT水平明显降低;与模型对照组比较,高、中、低浓度玉烛散组及莫沙必利组血清5-HT水平明显升高。与空白对照组比较,模型对照组血清MTL水平明显降低;与模型对照组比较,中浓度玉烛散组血清MTL水平明显升高。与空白对照组比较,模型对照组血清NO水平明显升高;与模型对照组比较,中浓度玉烛散组、莫沙必利组血清NO水平明显降低。表明玉烛散可能通过升高血清5-HT、MTL水平,降低血清NO水平而发挥治疗作用。
综上所述,0.8、0.4、0.2 g/mL的玉烛散水煎液均能促进血虚型STC小鼠肠蠕动,改善其胃肠功能,呈一定的量效关系;其机制可能与升高血清5-HT、MTL水平,降低血清NO水平有关。
参考文献:
[1] Lyford GL, He CL, Soffer E, et al. Pan-colonic decrease in interstitial cells of Cajal in patients with slow transit constipation[J]. Gut, 2002,51(4):496-501.
[2] Sanders KM, Ordog T, Ward SM. Physiology and pathophysiology of the interstitial cells of Cajal: from bench to bedside. Ⅳ. Genetic and animal models of GI motility disorders caused by loss of interstitial cells of Cajal[J]. Am J Physiol Gastrointest Liver Physiol, 2002,282(5):G747-G756.
[3] 卢文丽,方肇勤,潘志强,等.四种不同品系小鼠气虚血虚证候的比较与评价[J].辽宁中医杂志,2007,34(4):519-522.
[4] 刘丽莎,张微,赵敏,等.功能性便秘动物造模方法研究概况[J].实用中医内科杂志,2015,29(2):169-172.
[5] Kobayashi A, Yokota H, Kobayashi H, et al. Mucosal neuroendocrine cell abnormalities in patients with chronic constipation[J]. Asian J Surg, 2004,27(3):197-201.
[6] Bassotti G, Villanacci V. Slow transit constipation: a functional disorder becomes an enteric neuropathy[J]. World J Gastroenterol, 2006,12(29):4609-4613.
[7] Chan AO, Cheng C, Hui WM, et al. Differing coping mechanisms, stress level and anorectal physiology in patients with functional constipation[J]. World J Gastroenterol, 2005, 11(34):5362-5366.
[8] Benatar A, Feenstra A, Decraene T, et al. Effects of cisapride on corrected QT interval, heart rate, and rhythm in infants undergoing polysomnography[J]. Pediatrics, 2000,106(6):E85.
[9] 吴承艳,李振彬,石建喜.木香、丁香和威灵仙镇痛及胃肠动力作用的实验研究[J].江苏中医药,2005,26(12):61-63.
[10] 邱剑锋,李国栋,肖诚,等.养血润肠方对小鼠血虚型慢性功能性便秘结肠组织匀浆及血清中 NO的影响[J].江西中医药大学学报,2007,19(3):68-69.
[11] Prasansuklab A, Poovorawan Y, Tencomnao T. Modulation of human serotonin transporter expression by 5-HTTLPR incColon cells[J]. Int J Mol Sci, 2011,12(10):6619-6634.
[12] Priem EK, De Maeyer JH, Vandewoestyne M, et al. Predominant mucosal expression of 5-HT4(+h) receptor splice variants in pig stomach and colon[J]. World J Gastroenterol, 2013,19(24):3747-3760.
[13] Chua AS, Keeling PW, Dinan TG. Role of cholecystokinin and central serotonergic receptors in functional dyspepsia[J]. World J Gastroenterol, 2006,12(9):1329-1335.
[14] Lacy BE, Yu S. Tegaserod: a new 5-HT4 agonist[J]. J Clin Gastroenterol, 2002,34(1):27-33.
[15] He Y, Wang H, Yang DY, et al. Differential expression of motilin receptor in various parts of gastrointestinal tract in dogs[J]. Gastroenterol Res Pract, 2015,2015:970940.
[16] Francis SH, Busch JL, Corbin JD, et al. cGMP-dependent protein kinases and cGMP phosphodiesterases in nitric oxide and cGMP action[J]. Pharmacol Rev, 2010,62(3):525-563.
(收稿日期:2015-12-08)
中图分类号:R574.62
文献标志码:A
文章编号:1002-266X(2016)08-0025-03
doi:10.3969/j.issn.1002-266X.2016.08.009
通信作者:王建新(E-mail: youtow@sina.com)
基金项目:山东省自然科学基金资助项目(ZR2011HQ049);济南市青年科技明星计划项目(201004055,20090208)。
