小鼠骨髓来源调节性树突状细胞的体外诱导分化及鉴定
2016-04-15王进京袁晶华乔磊刘义张晓宁李克秋李光
王进京,袁晶华,乔磊,刘义,张晓宁,李克秋,李光
(天津医科大学基础医学院,天津300070)
小鼠骨髓来源调节性树突状细胞的体外诱导分化及鉴定
王进京,袁晶华,乔磊,刘义,张晓宁,李克秋,李光
(天津医科大学基础医学院,天津300070)
摘要:目的建立小鼠骨髓来源调节性树突状细胞(DCreg)体外诱导培养和扩增的方法,并进行生物学及功能鉴定。方法取小鼠骨髓单个核细胞(BM-MNCs),用重组小鼠白细胞介素4(rmIL-4)及重组小鼠粒-巨噬细胞集落刺激因子(rmGM-CSF)诱导分化,第6天细胞中含大量DCreg;取部分细胞加脂多糖(LPS),继续培养2 d(第8天)分化为成熟DC(mDC)。观察培养过程中细胞形态变化,流式细胞术检测DCreg特异性表面分子CD11b和共刺激分子CD40、CD86。取小鼠脾脏分离的CD8+ T细胞,随机分为3组;A、B组将细胞分别与DCreg、mDC以5∶1、10∶1、20∶1混合培养4 d,C组细胞不处理。采用CFSE标记法检测CD8+ T细胞增殖情况,Real-time PCR检测CD8+ T细胞免疫功能分子穿孔素(Prf1)和颗粒酶B(GzmB)mRNA。结果新分离的BM-MNCs呈圆形,体积较小;诱导第6天细胞集落数量增多,体积增大,细胞表面突起增多,CD11b阳性细胞比例达96.1%±2.7%。与mDC相比,DCreg中CD40、CD86表达阳性率降低(P均<0.05)。与B组比较,A组细胞增殖率降低(P均<0.05);与B、C组比较,A组Prf1、GzmB mRNA表达量降低(P均<0.05),与C组比较,B组GzmB mRNA表达量升高(P均<0.05)。结论rmGM-CSF联合rmIL-4可成功诱导小鼠BM-MNCs向DCreg分化,且纯度高,并具有免疫抑制功能。
关键词:调节性树突状细胞;器官移植;免疫耐受;细胞培养;穿孔素;颗粒酶B
肝移植是治疗终末期肝衰竭最有效的手段,寻找诱导肝移植免疫耐受的有效方法是研究的热点之一[1]。调节性树突状细胞(DCreg)又称耐受性树突细胞(DC),多为未成熟状态的树突状细胞(imDC),表达低水平的MHC-Ⅱ类分子及共刺激分子(CD40、CD86等),抗原吞噬能力极强,但活化T细胞的能力较弱,还能抑制免疫活化分子的分泌,促进调节性T细胞(Treg)增殖以诱导免疫耐受[2~4]。肝脏内含有大量DCreg[5],探索其具体作用可为肝移植基础研究与临床应用提供新思路[6,7]。由于DCreg在体内含量低,且直接从体内分离既操作复杂又难以纯化[8],2014年12月~2015年6月,我们应用重组小鼠白细胞介素4(rmIL-4)联合重组小鼠粒-巨噬细胞集落刺激因子(rmGM-CSF)成功诱导小鼠骨髓来源单个核细胞(BM-MNCs)向DCreg分化和扩增,为进一步研究DCreg在肝移植免疫耐受中的作用奠定了基础。
1材料与方法
1.1材料BM-MNCs分离自SPF级健康雄性C57BL/6小鼠(北京军事医学科学院实验动物中心,6~8周龄,体质量18~20 g),用含10% FBS的RPMI 1640培养基调整细胞密度为(1~2)×107/mL。主要试剂:RPMI 1640培养基及细胞培养板(美国Corning公司);胎牛血清(FBS,以色列BI公司);rmGM-CSF、rmIL-4(美国BD公司);抗小鼠CD11b、CD40、CD86抗体及其同型对照抗体(美国eBioscience公司);小鼠CD8磁珠及分选柱(德国Miltenyi公司);免疫功能分子穿孔素(Prf1)和颗粒酶B(GzmB)基因引物由上海生工合成。
1.2方法
1.2.1小鼠BM-MNCs向DCreg的诱导分化与扩增将细胞以2×105/孔接种于12孔培养板,加入终浓度10 ng/mL的rmIL-4、20 ng/mL的rmGSM-CSF,置于37 ℃、5% CO2培养箱中培养。第3、5天半量换液并补足细胞因子。培养第6天,轻轻吹洗细胞培养孔,收集半悬浮细胞及疏松贴壁细胞即为imDC(含大量DCreg)。取部分细胞加入1 μg/mL的脂多糖(LPS),继续培养2 d(第8天)即可分化为成熟DC(mDC)。
1.2.2细胞形态学观察培养过程中,每天用倒置显微镜观察所诱导培养DC的形态特点。
1.2.3DCreg细胞表型分析采用流式细胞术。分别收集培养第3、6、8 天的细胞,洗涤悬浮后标记荧光抗体:PE标记CD11b,FITC标记CD40和CD86(仅测第6、8 天的细胞)。流式细胞术检测各表面标记物,以DCreg特异性分子CD11b阳性细胞所占比例表示其纯度。
1.2.4DCreg免疫调节功能观察采用混合淋巴细胞反应。①CD8+T淋巴细胞增殖观察:采用羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)法。参考文献[9]分离正常C57BL/6小鼠脾脏淋巴细胞,免疫磁珠法分选CD8+T细胞。CFSE标记CD8+T细胞,将细胞分为3组。A、B组将细胞分别与DCreg、mDC以不同比例(5∶1、10∶1、20∶1)加入96孔板混合培养,调整每孔培养液至200 μL;37 ℃、5% CO2共培养4 d;C组不处理。收集悬浮细胞,流式细胞术检测CD8+T细胞的荧光值,以CFSE荧光强度减弱比率代表各组的增殖率。各组均设3个复孔,取平均值。②免疫功能分子Prf1和GzmB mRNA检测:采用Real-time PCR法。收集混合淋巴细胞培养体系中的各组细胞,TRIzol法提取总RNA,经cDNA第一链合成试剂盒反转录为cDNA;Real-time PCR检测细胞免疫功能分子Prf1和GzmB mRNA表达水平。Prf1基因引物上游为5′-CGGTGTCGTGTGGAACAATA-3′、下游为5′-TCATCATCCCAGCCGTAGTC-3′,产物长度为126 bp ;GzmB基因引物上游为5′-GACCCAGCAAGTCATCCCTA-3′、下游为5′-CCAGCCACATAGCACACATC-3′,产物长度为186 bp。并以GAPDH基因为内参照,以2-ΔΔCT法分析基因相对表达量。

2结果
2.1细胞形态学变化小鼠BM-MNCs经rmIL-4和rmGM-CSF联合诱导24 h后,显微镜下可见多数细胞贴壁生长,体积较小,多为圆形,少部分悬浮生长;培养3 d后大量细胞集落形成,细胞数量显著增多,细胞体积增大,形状不规则,细胞表面出现短的毛刺样突起,贴壁细胞减少,可见有突起的悬浮细胞;培养6 d时可见大部分为悬浮细胞,集落数增多,集落体积明显增大,可见悬浮细胞表面有较多的短毛刺样突起。加入LPS继续培养2 d后,细胞集落呈分散状态,细胞分布比较均匀,细胞表面突起明显伸长,可见典型的较长的树枝样突起。
2.2DCreg细胞CD11b表达变化小鼠BM-MNCs培养第6、8天CD11b阳性表达率分别为96.1%±2.7%、90.5%±0.4%,高于培养第3天的69.1%±2.50%(P均<0.05);第6、8天CD11b阳性表达率比较,P>0.05。
2.3DCreg细胞CD40和CD86表达变化小鼠BM-MNCs诱导培养第6天细胞CD40、CD86阳性表达率分别为21.2%±3.2%和18.7%±3.5%,第8天分别为66.9%±3.4%和70.9%±1.7%,P均<0.05。
2.4DCreg对CD8+T细胞增殖的影响见表1。

表1 DCreg对CD8+ T细胞增殖的影响
注:与A组同浓度比较,*P<0.05。
2.5DCreg对CD8+T细胞GzmB和Prf1 基因表达的影响见表2。
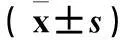
表2 各组CD8+ T细胞GzmB及Prf1 mRNA相对
注:与A组同浓度比较,*P<0.05;与C组比较,#P<0.05。
3讨论
肝移植排斥反应和免疫抑制剂不良反应严重影响移植物的长期存活,有效诱导肝移植免疫耐受是治疗关键[10]。DC作为体内最强大的专职抗原提呈细胞,处于免疫反应的中心环节,不仅参与抗原特异性免疫反应的活化,还参与免疫耐受的建立和维持[11]。DC主要来源于CD34+造血干细胞,不同来源和不同分化阶段的DC功能有一定差异[6]。目前研究表明,mDC可被炎症信号激活,进而促进T细胞活化与增殖,诱导特异性T细胞反应;DCreg虽具有很强的抗原处理能力,但低表达CD40、CD80、CD86和MHC-Ⅱ类分子,可抑制T细胞活化,具有促免疫耐受性调节功能[7,12]。有研究表明,骨髓来源的DCreg在同种异基因皮肤移植、肾移植和角膜移植中具有诱导免疫耐受和预防免疫排斥发生的作用[13~15]。
研究表明,骨髓来源的CD34+造血干细胞数量多且纯度高,更适合体外诱导培养DCreg[16]。培养体系中细胞因子的种类和浓度决定了干细胞向不同谱系定向分化。本研究中的rmGM-CSF主要促进造血干细胞向DC定向分化,但还会向中性粒细胞和巨噬细胞分化,所以DC纯度较低。由于rmIL-4能抑制造血干细胞向中性粒细胞和巨噬细胞分化,故联合rmIL-4后可获得数量较多、纯度较高的DC[17]。
DC表面的共刺激分子不仅参与了细胞发育过程,还可以为免疫效应细胞的活化提供必需的共刺激信号,对免疫效应细胞的激活具有极其重要的作用[18]。本研究中,DCreg刺激同种异基因CD8+T细胞增殖的能力显著低于mDC,可能是由于DCreg低表达共刺激分子CD86和CD40,导致CD8+T细胞增殖活化信号通路受阻[19]。进一步研究发现,与DCreg共培养的CD8+T细胞GzmB和Prf1 mRNA表达降低,而与mDC共培养的CD8+T细胞GzmB和Prf1 mRNA表达升高。表明共培养体系中DCreg能通过抑制GzmB和Prf1基因表达进而抑制CD8+T细胞的杀伤作用,其机制有待深入研究。
综上所述,本研究联合应用细胞因子rmGM-CSF和rmIL-4诱导小鼠BM-MNCs向DC定向分化和增殖,第6天即可获得数量较多、纯度较高、具有免疫调节功能的DCreg,实验过程操作简单,培养周期短,为进一步研究DCreg在肝移植免疫耐受诱导中的作用奠定了基础。
参考文献:
[1] Chung CY, Ysebaert D, Berneman ZN, et al. Dendritic cells: cellular mediators for immunological tolerance[J]. Clin Dev Immunol, 2013,2013:972865.
[2] Tisch R. Immunogenic Versus tolerogenic dendritic cells: a matter of maturation[J]. Int Rev Immunol, 2010,29(2):111-118.
[3] Li HB, Shi BY. Tolerogenic dendritic cells and their applications in transplantation[J]. Cell Mol Immunol, 2015,12(1):24-30.
[4] Raǐch-Regué D, Glancy M, Thomson AW. Regulatory dendritic cell therapy: from rodents to clinical application[J]. Immunol Lett, 2014,161(2):216-221.
[5] Natarajan S, Thomson AW. Tolerogenic dendritic cells and myeloid-derived suppressor cells: potential for regulation and therapy of liver auto- and alloimmunity[J]. Immunobiology, 2010,215(9-10):698-703.
[6] Mosayebi G, Moazzeni SM. Spleen and Liver dendritic cells differ in their tolerogenic and cytokine induction potential[J]. Iran J Allergy Asthm, 2011,10(3):163-170.
[7] Morel PA, Turner MS. Dendritic cells and the maintenance of self-tolerance[J]. Immunol Res, 2011,50(2-3):124-129.
[8] Volchenkov R, Hovden AO, Karlsen M, et al. Generation of tolerogenic monocyte-derived dendritic cells[J]. Scand J Immunol, 2011,73(4):378-379.
[9] 荆小伟,裴国献,张大伟,等.BALB/C小鼠脾淋巴细胞活性Alamarblue测定法[J].山东医药,2010,50(12):7-8.
[10] Beriou G, Moreau A, Cuturi MC. Tolerogenic dendritic cells: applications for solid organ transplantation[J]. Curr Opin Organ Tran, 2012,17(1):42-47.
[11] Steinman RM, Nussenzweig MC. Avoiding horror autotoxicus: the importance of dendritic cells in peripheral T cell tolerance[J]. Proc Natl Acad Sci USA, 2002,99(1):351-358.
[12] Carreno LJ, Gonzalez PA, Bueno SM, et al. Modulation of the dendritic cell-T-cell synapse to promote pathogen immunity and prevent autoimmunity[J]. Immunotherapy, 2011,3(Suppl 4):6-11.
[13] Xin H, Yang W, Wang Q, et al. Immune tolerance of skin allograft transplantation induced by immature dendritic cells of a third party carrying donor antigens in mice[J]. Transplant Proc, 2013,45(2):552-557.
[14] Wang T, Xu L, Li H, et al. Immature CD4(+) dendritic cells conditioned with donor kidney antigen prolong renal allograft survival in rats[J]. Chin Med J (Engl), 2012,125(14):2530-2537.
[15] Gao XW, Fu Y, Li WJ, et al. Mechanism of immune tolerance induced by donor derived immature dendritic cells in rat high-risk corneal transplantation[J]. Int J Ophthalmol, 2013,6(3):269-275.
[16] Fu JJ, Song SS, Li PP, et al. Bone marrow tolerogenic dendritic cell modulate the balance of Tregs and Th17 cells in vitro[J]. Acta Pharmacologica Sinica, 2013,34(Suppl): 83-83.
[17] Holla S, Sharma M, Vani J, et al. GM-CSF along with IL-4 but not alone is indispensable for the differentiation of human dendritic cells from monocytes[J]. J Allergy Clin Immunol, 2014,133(5):1500-1502.
[18] Lutz MB, Kurts C. Induction of peripheral CD4+ T-cell tolerance and CD8+T-cell cross-tolerance by dendritic cells[J]. Eur J Immunol, 2009,39(9): 2325-2330.
[19] Hubo M, Trinschek B, Kryczanowsky F, et al. Costimulatory molecules on immunogenic versus tolerogenic human dendritic cells[J]. Front Immunol, 2013(4):82.
Induced differentiation and identification of mouse bone marrow-derived regulatory dendritic cells in vitro
WANGJinjing,YUANJinghua,QIAOLei,LIUYi,ZHANGXiaoning,LIKeqiu,LIGuang
(TianjinMedicalUniversity,Tianjin300070,China)
Abstract:ObjectiveTo establish a method for the induction and amplification of regulatory dendritic cells (DCreg) derived from mouse bone marrow in vitro, and to identify their biological and functional characteristics. MethodsThe bone marrow mononuclear cells (BM-MNCs) were induced to differentiate into DCreg by recombinant mouse IL-4 and recombinant murine granulocyte-macrophage colony-stimulating factor (rmGM-CSF). The cells collected on the sixth day contained a large number of DCreg. A portion of cells were cultured with lipopolysaccharide (LPS) for another 2 days to achieve the mature DC (mDC). The morphology of DCreg was observed by inverted microscope. The expression of CD40, CD11b and CD86 were detected by flow cytometry. The splenic CD8+ T cells were randomly divided into three groups: groups A, B and C. The cells in the group A and group B were incubated with DCreg or mDC at different ratios (5∶1, 10∶1, 20∶1) of mixture to culture for 4 days, and cells in the group C were not treated. We detected the proliferation of CD8+ T cells by the CFSE labeling. The expression of perforin (Prf1) and GzmB mRNA in CD8+ T cells was detected by real-time PCR. ResultsFreshly isolated MSCs were round with small volume. When induced for 6 days, much more cell colonies were found, and cells became larger with the increased cell surface projections. The positive cell percentage of CD11b was (96.1±2.7)%. Compared with mDC, the positive expression rates of CD40 and CD86 in DCreg were lower (all P<0.05). Compared with group B, the proliferation rate of group A was significantly decreased (all P<0.05). Compared with group C and group B, the expression of Prf1, GzmB mRNA of group A was reduced (all P<0.05). Compared with group C, the expression of GzmB mRNA in the group B was increased (all P<0.05).ConclusionsrmGM-CSF combined with rmIL-4 can induce the differentiation of BM-MNCs into DCreg successfully, which can obtain a large number of highly purified DCreg with immune suppressive function.
Key words:regulatory dendritic cells; organ transplantation; immune tolerance; cell culture; perforin; granzyme B
(收稿日期:2015-09-18)
中图分类号:R392.4
文献标志码:A
文章编号:1002-266X(2016)10-0013-04
doi:10.3969/j.issn.1002-266X.2016.10.005
通信作者简介:李光(1959-),女,教授,主要研究方向为器官移植与免疫耐受。E-mail: lig@tmu.edu.cn
作者简介:第一王进京(1975-),男,讲师,主要研究方向为移植免疫。E-mail: wangjinjingxml@163.com
基金项目:国家高技术研究发展计划项目(2012AA021003)。
