鱼腥草挥发油纳米结构脂质载体的制备与评价
2016-04-06张壮丽王亚飞赵志鸿张小俊王桂芳河南省医药科学研究院药化科河南郑州45005郑州大学药学院河南郑州45000
张壮丽, 赵 宁, 王亚飞, 赵志鸿, 张小俊, 王桂芳(.河南省医药科学研究院药化科,河南郑州45005;.郑州大学药学院,河南郑州45000)
鱼腥草挥发油纳米结构脂质载体的制备与评价
张壮丽1, 赵 宁2 *, 王亚飞2, 赵志鸿1, 张小俊1, 王桂芳1
(1.河南省医药科学研究院药化科,河南郑州450052;2.郑州大学药学院,河南郑州450001)
摘要:目的 制备并评价鱼腥草挥发油纳米结构脂质载体。方法 采用熔融乳化-超声分散法,在单因素考察的基础上利用正交实验设计,优化了制剂处方及制备工艺。采用气相色谱法,建立了纳米结构脂质载体中鱼腥草挥发油的定量测定方法,并从外观、形态、粒径分布、包封率、载药量及短期稳定性等方面对制剂进行评价。结果 最佳处方为单硬脂酸甘油酯0.12 g,辛酸癸酸三甘油酯0.08 g,泊洛沙姆188 0.533 g,蛋黄卵磷脂0.267 g,鱼腥草挥发油0.1 g,重蒸馏水加至20 mL;最佳工艺为初乳搅拌20 min,超声分散10 min,超声振幅100%。所制备的纳米粒平均粒径约为(70.76±1.74)nm,Zeta电位为(-25.40±1.08)mV,包封率90.33%,载药量5.76%。结论 所制备的鱼腥草挥发油纳米结构脂质载体粒径小,包封率高,物理稳定性较好。
关键词:鱼腥草;挥发油;纳米结构脂质载体;熔融乳化-超滤离心;气相色谱(GC)
Preparation and evaluation of nanostructured lipid carrier loaded With volatileoil from Houttuynia cordatu Thunb.
ZHANG Zhuang-1i1, ZHAO Ning2 *, WANG Ya-fei2, ZHAO Zhi-hong1, ZHANG Xiao-jun1,WANG Gui-fang1
(I.Department of Medicinal Chemistry,Henan Provincial Academy of Medical Sciences,Zhengzhou 45OO52,China;2.College of Pharmaceutical Sciences,Zhengzhou University,Zhengzhou 45OOOI,China)
KEY W 0RDS:Houttuynia cordatu Thunb.;vo1ati1e oi1;nanostructured 1ipid carrier;me1ting emu1sification and centrifuga1u1trafi1tration;gas chromatography(GC)
鱼腥草挥发油是鱼腥草Houttuynia cordatu Thunb.的主要活性部位[1],具有抗病毒、抗菌、抗炎、提高机体免疫力、抗过敏、抗肿瘤等药理作用[2-8],目前临床应用于消炎抗菌。中药挥发油溶解性差、易挥发、性质不稳定,直接使用时生物利用度低,刺激性大,药效不稳定。若将纳米制剂技术应用于中药挥发油,不仅能提高药物的稳定性和生物利用度,加强靶向及缓释作用,还可减少不良反应,开发出顺应性更好的给药途径的药物[9]。
本实验采用熔融乳化-超声分散法制备鱼腥草挥发油纳米结构脂质载体,以纳米粒粒径及Zeta电位为评价指标,在单因素考察的基础上利用正交实验设计,优化了制剂处方及制备工艺。采用气相色谱法,建立了纳米结构脂质载体中鱼腥草挥发油的定量测定方法,并从外观、形态、粒径分布、包封率、载药量及稳定性等方面对制剂进行评价。
1 材料与仪器
1.1 主要材料 鱼腥草挥发油(原药材购自四川江油,由河南中医学院药学院董成明教授鉴定。将鱼腥草干燥粉碎后,称取100 g,装入2 000 mL圆底烧瓶中,加10倍量蒸馏水,混匀并浸泡10 h后,水蒸气蒸馏提取,回流10 h,收集浅黄色挥发油,精密称定质量,4℃下封装保存备用)。单硬脂酸甘油酯(天津市科密欧化学试剂有限公司);山嵛酸甘油酯(法国嘉法狮公司);辛酸/癸酸甘油三酯、泊洛沙姆188(德国巴斯夫股份公司);蛋黄卵磷脂(上海艾伟特医药科技有限公司)。甲基正壬酮对照品(中国食品药品检定研究院)
1.2 主要仪器 7890A气相色谱仪、Hp-5MS毛细管色谱柱(美国安捷伦公司);JEM-2100透射电镜(日本电子株式会社);ZS90纳米粒度及Zeta电位分析仪(马尔文仪器中国有限公司);VCX130超声细胞破碎仪(美国Sonics公司);YIT-3熔点仪(天津大学精密仪器厂);超滤离心管(100 kDa,密理博中国有限公司)
2 方法
2.1 甲基正壬酮测定方法 目前,鱼腥草挥发油的测定主要以含有量高、性质比较稳定的甲基正壬酮为定量指标[10]。
2.1.1 样品溶液制备 精密量取纳米结构脂质载体1 mL,置于10 mL量瓶中,加水定容,移取4 mL,置于25 mL圆底烧瓶中,加正己烷5 mL,密封,室温水浴超声萃取20 min,静置,取正己烷层。再加正己烷5 mL,超声萃取10 min,收集合并正己烷层,定容至10 mL,0.22 μm滤膜过滤,即得。
2.1.2 色谱条件 采用气相色谱法,检测纳米结构脂质载体中挥发油含有量。HP-5MS石英毛细管色谱柱;载气为氦气;尾吹气为氮气;进样口、氢火焰离子化检测器温度280℃;空气体积流量450 mL/min;H2体积流量40 mL/min;柱体积流量1 mL/min;进样量1 μL;分流比20∶1;程序升温(70℃保持5 min,5℃/min升至100℃,2℃/min升至123℃,保持3 min,30℃/min升至280℃,保持10 min)。
2.1.3 系统适用性试验 取空白制剂和载药制剂,按照“2.1.1”项下方法处理样品,并制备甲基正壬酮对照品溶液。3种样品溶液在“2.1.2”项色谱条件下进样检测,记录色谱图。
2.1.4 精密度考察 分别制备高、中、低质量浓度甲基正壬酮溶液,连续进样5次,测定日内精密度,连续5 d;每天进样1次,测定日间精密度。2.1.5 检测限及定量限 配制系列质量浓度的甲基正壬酮溶液,在“2.1.2”项色谱条件下进样,分别计算不同浓度样品溶液色谱峰的信噪比(S/N)。S/N为10∶1时的样品质量浓度为定量限,而3∶1时的质量浓度为检测限。
2.1.6 加样回收率 精密量取相当于处方量80%、100%、120%的甲基正壬酮溶液,加入到挥发油含有量已知的纳米结构脂质载体中,平行3份,按“2.1.1”项下方法制备样品溶液,在“2.1.2”项色谱条件下进样检测,计算回收率。
2.1.7 线性关系考察 配制甲基正壬酮对照品母液(1.640 4 mg/mL),按比例稀释成系列质量浓度(4.986 8、9.973 63、16.010 3、20.012 9、24.999 70、50.032 2、100.064 4、149.932 6、199.964 8、249.997 0、350.061 4、399.929 5 μg/mL)溶液,在“2.1.2”色谱条件下进样,记录峰面积。以对照品溶液质量浓度为横坐标(X),色谱峰面积为纵坐标(Y),进行线性回归分析。
2.2 鱼腥草挥发油纳米结构脂质载体的制备
2.2.1 熔融乳化-超声分散法 将表面活性剂加适量重蒸馏水超声溶解,作为水相;固/液脂质水浴熔融后加入处方量的挥发油混匀,作为油相,电磁搅拌下将水浴等温的水相缓慢加到油相中搅拌,形成初乳,然后超声分散,冷水浴冷却固化,0.22 μm微孔滤膜滤过,加水定容至设定处方量,即得鱼腥草挥发油-纳米结构脂质载体的胶体分散体系。
2.2.2 空白纳米结构脂质载体制备工艺影响因素考察 预设定处方为单硬脂酸甘油酯0.32 g,辛酸/癸酸三甘油酯0.08 g,蛋黄卵磷脂0.2 g,泊洛沙姆188 0.2 g,加重蒸馏水至20 mL,进行制备工艺考察。
2.2.2.1 制备温度 熔点测定仪测定固体脂质及固/液脂质混合物的熔点,用于确定制备温度。
2.2.2.2 单因素试验设计 采用“2.2.2.1”项下方法筛选出的制备温度,选择搅拌时间、超声时间、超声振幅3个因素作为单因素考察对象,按“2.2.1”项下方法制备空白纳米结构脂质载体,以粒径为评价指标,考察上述因素对其的影响。各因素水平见表1。

表1 单因素试验因素水平Tab.1 Factors and levels of single factor test
2.2.2.3 正交试验设计 根据“2.2.2.2”项下实验结果,选择搅拌时间、超声时间和振幅3个因素作L9(34)正交试验设计,按照“2.2.1”项下方法制备空白纳米结构脂质载体,以粒径分布为评价指标,筛选最佳制备工艺。正交试验因素水平见表2。

表2 正交设计因素和水平Tab.2 Factors and levels of orthogonal design
2.2.2.4 工艺验证 处方为单硬脂酸甘油酯0.32 g,辛酸/癸酸三甘油酯0.08 g,蛋黄卵磷脂0.2 g,泊洛沙姆188 0.2 g,加重蒸馏水至20 mL。按“2.2.2.3”项下最佳工艺条件平行制备3批空白纳米结构脂质载体,检测其粒径分布。
2.2.3 鱼腥草挥发油纳米结构脂质载体处方筛选
2.2.3.1 固体脂质种类筛选 选择泊洛沙姆188-蛋黄卵磷脂(1∶1)作为复合乳化剂,用量2%;挥发油投药量1%;辛酸/癸酸三甘油酯作为液体脂质,固-液脂质比4∶1,总脂质用量2%。分别采用单硬脂酸甘油酯、山嵛酸甘油酯作为固体脂质,按“2.2.1”项下方法制备鱼腥草挥发油-纳米结构脂质载体,考察固体脂质种类对其的影响。
2.2.3.2 固-液脂质比例筛选 挥发油投药量0.5%,单硬脂酸甘油酯-辛酸癸酸三甘油酯作为固-液脂质,其余条件不变,考察固-液脂质比例为9∶1、8∶2、7∶3、6∶4时对纳米结构脂质载体的影响。
2.2.3.3 脂质用量筛选 固液脂质比7∶3,其余条件不变,考察脂质用量为0.5%、1%、2%、3%、4%、5%时纳米结构脂质载体的粒径分布和表面电位。
2.2.3.4 乳化剂配比及用量筛选 总脂质用量1%,其余条件不变,考察乳化剂配比及用量对纳米结构脂质载体的影响。
2.2.3.5 投药量筛选 泊洛沙姆188-蛋黄卵磷脂比例2∶1,复合乳化剂用量4%,其余条件不变,考察投药量为0.25%、0.5%、1%、1.5%、2%、2.5%、3%、4%时纳米结构脂质载体性状的变化情况。
2.2.3.6 正交试验优化处方 依据单因素试验结果,选择乳化剂量、脂质用量、固/液脂质比和投药量4个因素作L9(34)正交试验设计,按照“2.2.1”项下方法制备鱼腥草挥发油-纳米结构脂质载体,检测其粒径分布和Zeta电位,并以粒径分布为评价指标,筛选最佳处方。正交试验因素水平见表3。

表3 正交设计因素和水平Tab.3 Factors and levels of orthogonal design
2.2.3.7 处方验证 按照“2.2.3.6”项下最佳处方条件,采用“2.2.1”项下方法平行制备3批鱼腥草挥发油-纳米结构脂质载体,检测其粒径分布和Zeta电位。
2.3 鱼腥草挥发油纳米结构脂质载体制剂学评价
纳米给药系统能明显改变药物在体内的吸收、分布与代谢行为,通常具有缓释、控释等作用,而小于100 nm的颗粒可有效避免血液的首过清除效应。这些特性取决于载体自身的制剂学性质,包括粒径、Zeta电位、包封率、释放特性等,故有必要对纳米结构脂质载体的制剂学性质进行详细评价。
2.3.1 形态观察 透射电镜观察鱼腥草挥发油-纳米结构脂质载体的表面形态。将其混悬液适当稀释后,滴至覆有支持膜的铜网上,红外灯下烘干水分,观察纳米结构脂质载体纳米粒形态并拍照。
2.3.2 粒径分布及Zeta电位 粒度分析是纳米载药系统的主要表征方面之一,通过一定的检测手段来精确测量纳米颗粒的粒径,并对粒径分布进行分析。多分散系数(PdI)是粒径分布的衡量指标,PdI值越小,粒径分布越窄,纳米粒度越均匀;Pd I值越大,粒径分布范围越宽,纳米粒间可能因相互碰撞造成聚集、团聚,物理稳定性差。
Zeta电位是指颗粒的剪切面电位,其绝对值越大,表示颗粒所携带的正或负电荷越多,颗粒之间的排斥力越大,整个体系相对稳定;反之则稳定性越差。
将鱼腥草挥发油-纳米结构脂质载体稀释10倍,采用马尔文纳米粒度及Zeta电位分析仪检测其粒径分布及Zeta电位,平行3次,求出平均值。2.3.3 包封率
2.3.3.1 包封药量测定 准确量取鱼腥草挥发油-纳米结构脂质载体1 mL,置于超滤管内管中,8 000 r/min离心20 min,收集纳米粒,按照“2.2.1”项下方法制备样品溶液,在“2.1.2”项色谱条件下进样检测,记录甲基正壬酮峰面积。再
代入“2.1.7”项下标准曲线计算样品质量浓度。
2.3.3.2 总药量测定 准确量取鱼腥草挥发油-纳米结构脂质载体1 mL,按照“2.2.1”项下方法制备样品溶液,在“2.1.2”项色谱条件下进样检测,记录甲基正壬酮峰面积。再代入“2.1.7”项下标准曲线计算样品质量浓度。
然后,按照如下公式计算制剂的包封率。
包封率=(系统中包封的药量/系统中包封与未包封的总药量)×100%
2.3.4 载药量 载药量(DL)是指纳米粒中所含药物的质量百分率,即载药量=(包封药量/纳米粒总质量)×100%
2.4 鱼腥草挥发油纳米结构脂质载体稳定性研究2.4.1 影响因素试验
2.4.1.1 高温对纳米结构脂质载体的影响 制备一批鱼腥草挥发油纳米结构脂质载体,密封分装于洁净的西林瓶中,60℃下避光放置10 d,于第0、5和10天取样,观察外观变化,并检测其粒径分布和包封率。
2.4.1.2 强光照对纳米结构脂质载体的影响 制备一批鱼腥草挥发油纳米结构脂质载体,密封分装于洁净的西林瓶中,放置在光照箱中,于25℃,(4 500±500)1x照度下放置10 d,于第0、5和10天取样,观察外观变化,并检测其粒径分布和包封率。
2.4.2 短期储藏稳定性试验 将鱼腥草挥发油纳米结构脂质载体密封分装于洁净的西林瓶中,避光放置在4℃和室温3个月,于第1、7、15、30、60和90天取样,观察外观变化,检测粒径和包封率。
3 结果与分析
3.1 制剂含量分析方法的建立
3.1.1 系统适用性试验 由甲基正壬酮对照品溶液、挥发油纳米结构脂质载体样品溶液及空白纳米结构脂质载体样品溶液的GC色谱图(图1~3)可知,在设定的色谱条件下,甲基正壬酮出峰时间为19.63 min,而空白样品在该位置无色谱峰出现,说明制剂辅料对挥发油含有量测定无影响,该方法专属性良好。
3.1.2 精密度考察 分别取低、中、高3种质量浓度的对照品溶液,气相色谱检测记录峰面积,结果见表4。由表可知,3种质量浓度对照品溶液色谱峰面积的日间及日内ISD值均小于3%,表明仪器的精密度良好。
3.1.3 检测限及定量限 计算系列质量浓度甲基正壬酮溶液色谱峰的信噪比(S/N)。结果,S/N=3时对应的样品质量浓度为1.509 2 μg/mL,即检测限;S/N=10所对应的样品质量浓度为4.986 8 μg/mL,即定量限。

图1 甲基正壬酮溶液GC色谱图Fig.1 GC chromatogram of 2-undecanone

图2 纳米结构脂质载体样品GC色谱图Fig.2 GC chromatogram of nanostructured lipid carrier sam ple
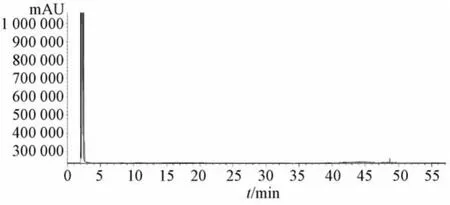
图3 空白纳米结构脂质载体样品GC色谱图Fig.3 GC chromatogram of blank nanostructured lipid carrier sam p le
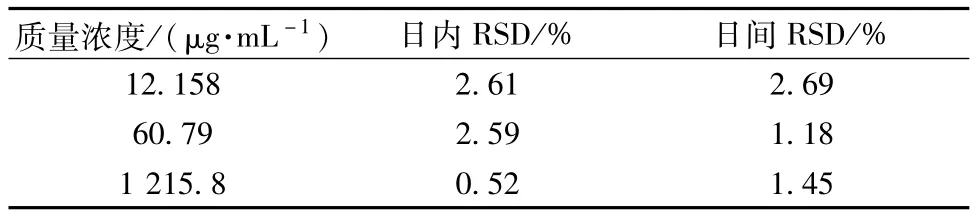
表4 精密度试验结果(n=5)Tab.4 Results of precision tests(n=5)
3.1.4 加样回收率(表5) 由表可知,3种质量浓度的加样回收率均在95%~105%之间,而且ISD值较小,说明该方法准确度良好。
3.1.5 线性关系考察 以甲基正壬酮对照品溶液质量浓度(μg/mL)为横坐标(X),峰面积(A)为纵坐标(Y),标准曲线方程为Y=6 962.3X-11 527(r=0.999 9),表明在4.986 8~399.929 5 μg/mL范围内线性关系良好。

表5 加样回收率试验结果Tab.5 Results of recovery tests
3.2 鱼腥草挥发油纳米结构脂质载体的制备
3.2.1 空白纳米结构脂质载体制备工艺影响因素3.2.1.1 制备温度 不同种类脂质熔点测定结果见表6。由表可知,固体脂质中加入液态脂质能使熔点降低,黏度减小,更有利于小粒径纳米粒的形成,并选择以单硬脂酸甘油酯为固体脂质的纳米结构脂质载体制备温度60℃,以山嵛酸甘油三酯为固体脂质的纳米结构脂质载体制备温度75℃。

表6 不同种类脂质体的熔点Tab.6 M elting points of different kinds of lipids
3.2.1.2 初乳搅拌时间 纳米结构脂质载体粒径分布随乳化搅拌时间的变化情况见表7。由表可知,在一定时间范围内,其粒径随搅拌时间的延长而逐渐减小,多分散系数(PDI)也随之降低,说明粒度分布更均匀。为缩短制备时间,选择搅拌10 min来考察其他因素对纳米结构脂质载体的影响。

表7 搅拌时间对纳米结构脂质载体粒径的影响Tab.7 Effect of stirring time on the particle size of nanostructured lipid carrier
3.2.1.3 超声分散时间与振幅 纳米结构脂质载体粒径分布随超声分散时间的变化情况见表8。由表可知,在一定时间范围内,超声分散时间越长,所得纳米粒径越小,而且粒度分布更均匀。

表8 超声分散时间对纳米结构脂质载体粒径的影响Tab.8 Effect of u ltrasonic tim e on the particle size of nanostructured lipid carrier
3.2.1.4 超声振幅 纳米结构脂质载体粒径分布随超声振幅变化情况见表9。由表可知,超声分散时的振幅对粒径影响较大,纳米粒粒径随其增大而减小,但对粒径分布的影响较小。

表9 超声振幅对纳米结构脂质载体粒径的影响Tab.9 Effect of ultrasonic amp litude on the particle size of nanostructured lipid carrier
3.2.1.5 正交试验筛选最佳工艺 根据单因素试验结果,选择搅拌时间、超声时间和振幅3个因素作L9(34)正交试验设计,以粒径为评价指标,进行方差分析及直观分析,结果见表10和表11。

表10 方差分析Tab.10 Analysis of variance
按检验水准α=0.05,3个因素中仅超声振幅对纳米粒径具有显著性影响(P<0.05)。
直观分析结果显示,极差值C>B>A,即3个因素对粒径的影响程度顺序为C(超声振幅)>B(超声时间)>A(搅拌时间);均值KA1>KA2>KA3,KB1>KB3>KB2,KC1>KC2>KC3,由于纳米粒径越小越好,故较优水平为A3B2C3,但因为KA2与KA3非常接近,从缩短生产周期的角度考虑,决定选择A2。综上所述,最佳因素水平为A2B2C3,即初乳搅拌20 min,超声分散10 min,振幅100%。
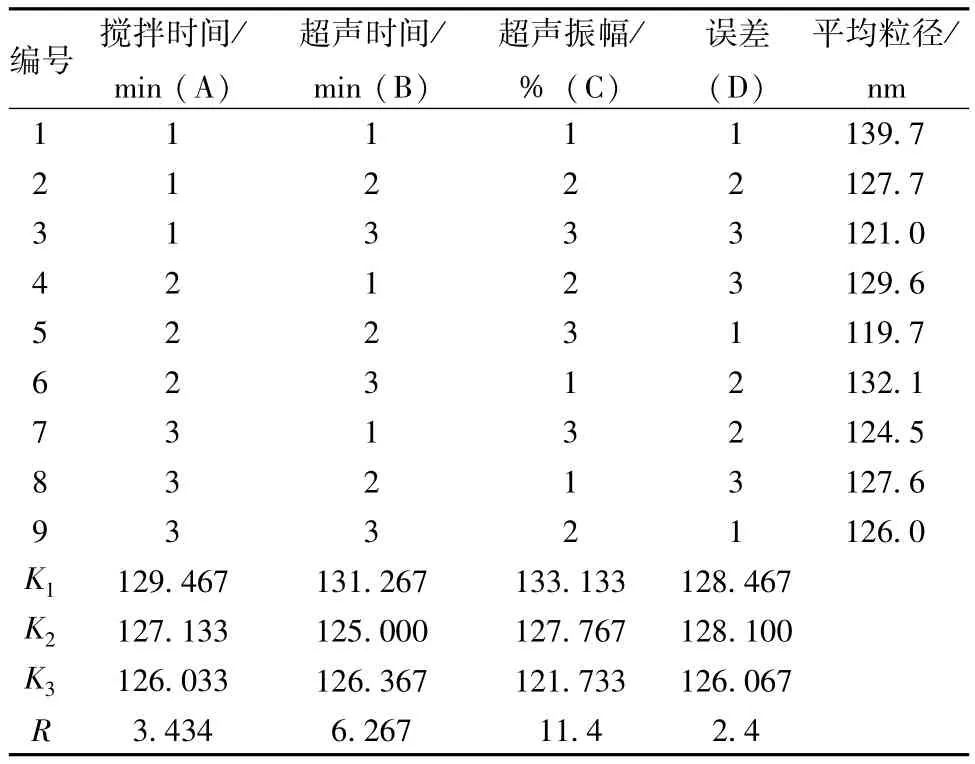
表11 直观分析Tab.11 Intuitive analysis
3.2.1.6 最佳工艺验证 按照最佳工艺制备的空白纳米结构脂质载体粒径小,粒度均匀,而且Zeta电位绝对值较大,说明纳米粒稳定。同时,纳米粒径的ISD为1.18%,表明该工艺重复性好,稳定可靠,具有实际应用价值。结果见表12。
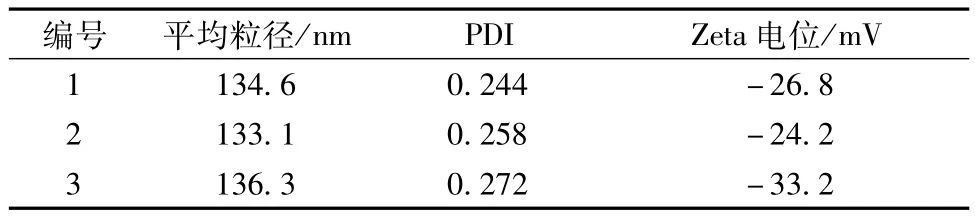
表12 验证试验结果Tab.12 Results of verification tests
3.2.2 鱼腥草挥发油纳米结构脂质载体处方筛选3.2.2.1 固体脂质种类筛选 两种固体脂质相比,单硬脂酸甘油酯纳米结构脂质载体的粒径更小,粒度分布均匀,而且稳定性更好,其平均粒径ISD 为2.21%,而山嵛酸三甘油酯纳米结构脂质载体的平均粒径ISD为5.64%。因此,选择单硬脂酸甘油酯作为纳米结构脂质载体的固体脂质。筛选结果见表13。
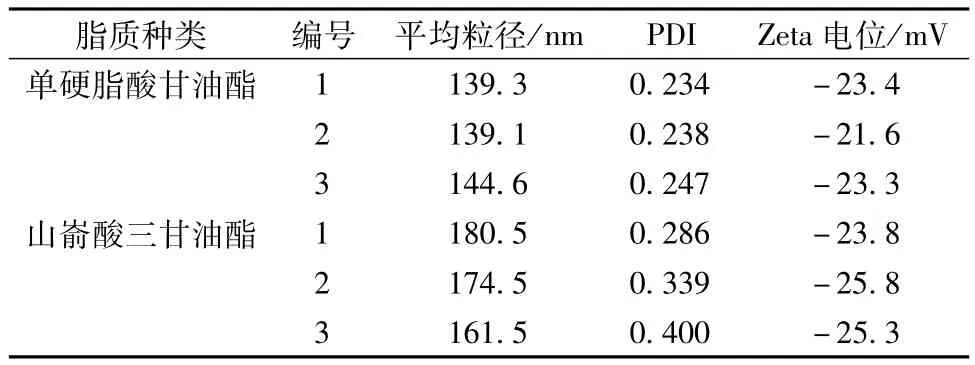
表13 固体脂质种类对纳米结构脂质载体粒径及Zeta电位的影响Tab.13 Effects of solid lipid type on the particle size and Zeta potential of nanostructured lipid carrier
3.2.2.2 固-液脂质比例筛选 纳米结构脂质载体的粒径分布及Zeta电位随固液脂质比例变化情况见表14。由表可知,随着液体脂质比例的增大,纳米粒粒径逐渐减小,PDI值也总体降低。
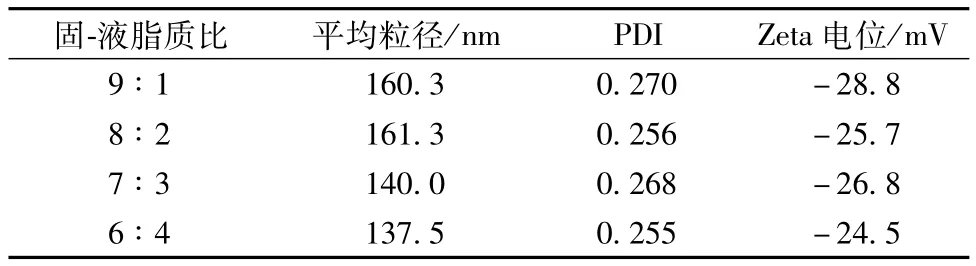
表14 固/液脂质比例对纳米结构脂质载体粒径及Zeta电位的影响Tab.14 Effects of lipid solid/liquid ratio on the particle size and Zeta potential of nanostructured lipid carrier
3.2.2.3 脂质用量筛选 随着体系中脂质总量的增加,纳米结构脂质载体粒径呈明显增大的趋势,PDI与Zeta电位的变化均表明体系的物理稳定性降低。由于脂质量0.5%与1%的粒径差别不大,考虑到单位体积制剂中,脂质量越大,所能承载的挥发油越多。因此,结合粒径分布及体系稳定性,选择适宜的脂质用量为1%。筛选结果见表15。

表15 脂质用量对纳米结构脂质载体粒径及Zeta电位的影响Tab.15 Effects of lipid dosage on the particle size and Zeta potential of nanostructured lipid carrier
3.2.2.4 乳化剂配比及用量筛选 单独使用泊洛沙姆188制得的纳米结构脂质载体稳定性很差;单独使用蛋黄卵磷脂制得的纳米结构脂质载体粒径很大,而且粒度分布不均,如两者结合使用,则能显著弥补对方的缺陷。复合表面活性剂用量相等时,泊洛沙姆188比例越大,纳米结构脂质载体粒径越小;复合表面活性剂配比固定时,用量越大,则粒径越小。综合考虑粒径及体系稳定性,选择复合乳化剂为泊洛沙姆188-蛋黄卵磷脂(2∶1),用量4%。筛选结果见表16。
3.2.2.5 投药量筛选 随着挥发油投药量的增加,纳米结构脂质载体的粒径呈先减小后增大的趋势,Zeta电位绝对值也随之先增大后减小。鱼腥草挥发油纳米结构脂质载体的体系呈淡黄色,而且随投药量增加,颜色逐渐加深。另外,3~7号样品瓶内壁附着一圈细小的油滴,可能是未被包封的过量挥发油。从节省成本的角度出发,选择投药量0.5%。筛选结果见表17。

表16 乳化剂的成分及用量对纳米结构脂质载体粒径及Zeta电位的影响Tab.16 Effects of constituent and dosage of emulsifier on the particle size and Zeta potential of nanostructured lipid carrier

表17 挥发油量对纳米结构脂质载体粒径及Zeta电位的影响Tab.17 Effects of volatile oil dosage on the particle size and Zeta potential of nanostructured lipid carrier
3.2.2.6 正交试验优化处方 根据单因素试验结果,选择乳化剂量、脂质用量、固-液脂质比和投药量4个因素作L9(34)正交试验设计。以粒径为评价指标,正交试验方差分析显示,被考察的4个因素对纳米粒粒径的影响均不明显。直观分析见表18。
直观分析结果显示,极差值B>D>A>C,即4个因素对粒径的影响程度顺序为B(脂质量)>D(投药量)>A(乳化剂量)>C(固/液脂质比);均值KA1>KA2>KA3,KB3>KB2>KB1,KC1>KC2>KC3,KD1>KD2>KD3,由于纳米粒径越小越好,故最佳因素水平为A3B1C3D3,即复合乳化剂泊洛沙姆188-蛋黄卵磷脂(2∶1)用量4%,混合脂质单硬脂酸甘油酯-辛酸癸酸三甘油酯(6∶4)用量1%,挥发油投药量0.5%。综上所述,最佳处方为单硬脂酸甘油酯0.12 g,辛酸癸酸三甘油酯0.08 g,泊洛沙姆1 880.533 g,蛋黄卵磷脂0.267 g,鱼腥草挥发油0.1 g,重蒸馏水加至20 mL。
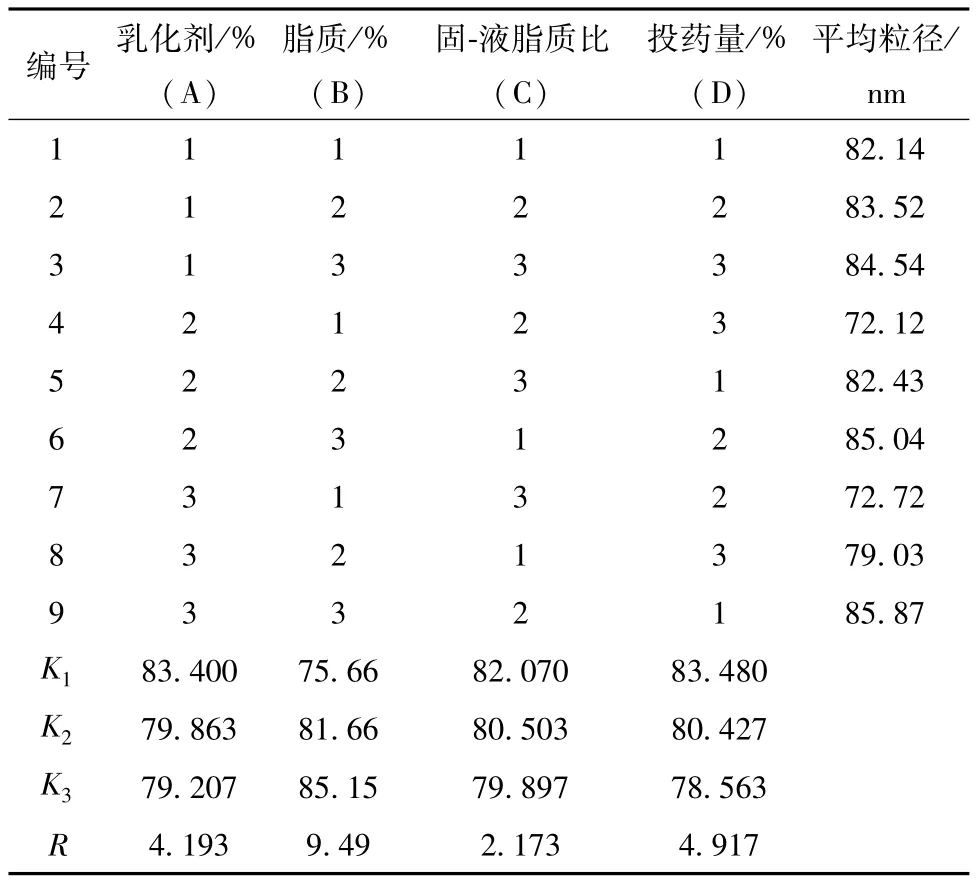
表18 直观分析Tab.18 Intuitive analysis
3.2.2.7 最佳处方验证 按照正交试验所得的最佳工艺及处方,按“2.2.1”项下方法平行制备3批纳米结构脂质载体,检测其粒径分布和Zeta电位,结果见表19。由表可知,按照最佳工艺及处方制备的鱼腥草挥发油-纳米结构脂质载体粒径小,而且粒度分布均匀,Zeta电位绝对值较大,说明纳米粒稳定。同时,纳米粒径的ISD为2.46%,表明其重复性好,稳定可靠,具有实际应用价值。

表19 验证试验结果Tab.19 Results of verification tests
3.3 鱼腥草挥发油纳米结构脂质载体制剂学评价
3.3.1 形态观察 透射电镜下观察鱼腥草挥发油-纳米结构脂质载体,见图4。由图可知,纳米粒呈圆球状,轮廓规整,粒度分布比较均匀,无团聚现象。
3.3.2 粒径分布及Zate电位 将鱼腥草挥发油-纳米结构脂质载体稀释10倍,马尔文纳米粒度及Zeta电位分析仪检测其粒径分布及Zeta电位,平行3次,计算平均值。结果见图5~6。
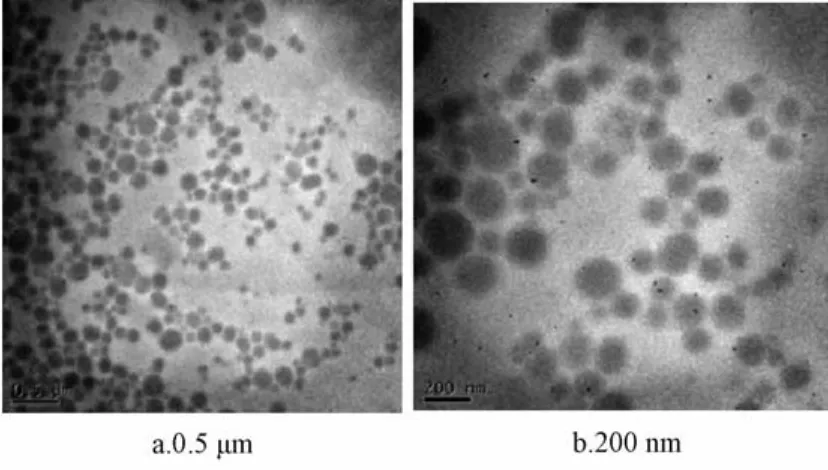
图4 纳米结构脂质载体透射电镜图Fig.4 Transm ission electron m icrographs of nanostructured lipid carrier

图5 纳米结构脂质载体粒径分布Fig.5 Particle size distribution of nanostructured lipid carrier

图6 纳米结构脂质载体Zeta电位分布Fig.6 Zeta potential distribution of nanostructured lipid carrier
鱼腥草挥发油-纳米结构脂质载体的粒度呈单峰分布,平均粒径为(70.76±1.74)nm,粒径介于10~100 nm之间的纳米粒约占总数的96.4%。
由图可知,鱼腥草挥发油纳米结构脂质载体的Zeta电位为(-25.40±1.08)mV,体系较稳定。3.3.3 包封率和载药量 平行制备3批鱼腥草挥发油-纳米结构脂质载体,按照“2.3.4”和“2.3.5”项下方法检测其包封率和载药量,结果见表20。由表可知,纳米结构脂质载体的载药量为5.76%,包封率为90.33%,符合药典标准(>80%)。

表20 纳米结构脂质载体包封率和载药量Tab.20 Entrapment efficiencies and drug loadings of nanostructured lipid carrier
3.4 鱼腥草挥发油纳米结构脂质载体稳定性研究
3.4.1 影响因素试验
3.4.1.1 高温对纳米结构脂质载体的影响 在60℃下,纳米结构脂质载体平均粒径未发生明显变化,到第5天时出现少量粒度在10~30 nm之间的粒子,到第10天时降至10~20 nm之间,而且包封率略有降低,可能是由于高温而导致一小部分不稳定的纳米粒破碎。新制备的纳米结构脂质载体体系呈淡黄色,澄清透明,随着时间延长,颜色逐渐加深,透明度下降,但无沉淀析出。具体见表21。

表21 高温对纳米结构脂质载体的影响Tab.21 Effect of high temperature on nanostructured lipid carrier
3.4.1.2 强光照对纳米结构脂质载体的影响 强光照对纳米结构脂质载体的粒径和包封率均无明显影响,但观察到其体系澄清度有所下降,颜色变为淡乳白色。具体见表22。

表22 强光照对纳米结构脂质载体的影响Tab.22 Effect of strong light on nanostructured lipid carrier
3.4.2 短期稳定性考察
3.4.2.1 外观变化 在90 d的考察期内,室温下放置的纳米结构脂质载体外观基本未发生变化,到第90天时体系仍澄清透明。但4℃下其外观变化明显,到15 d时体系较第1天明显浑浊,第30天时水分散液已完全不透明,第90天时体系已变为白色乳状液。
3.4.2.2 粒径和包封率变化 纳米结构脂质载体在室温下放置90 d后,平均粒径无明显变化,但包封率显著下降,第30天时已低于药典要求(≥80%),第90天时降至64.44%;在4℃下随时间的延长,其粒径明显增大,粒度分布范围变宽,系统稳定性降低,包封率也显著减少。在相同时间下,放置在室温的纳米结构脂质载体粒径明显小于放置在4℃者。因此,纳米结构脂质载体应选择在室温条件下保存。具体见表23。
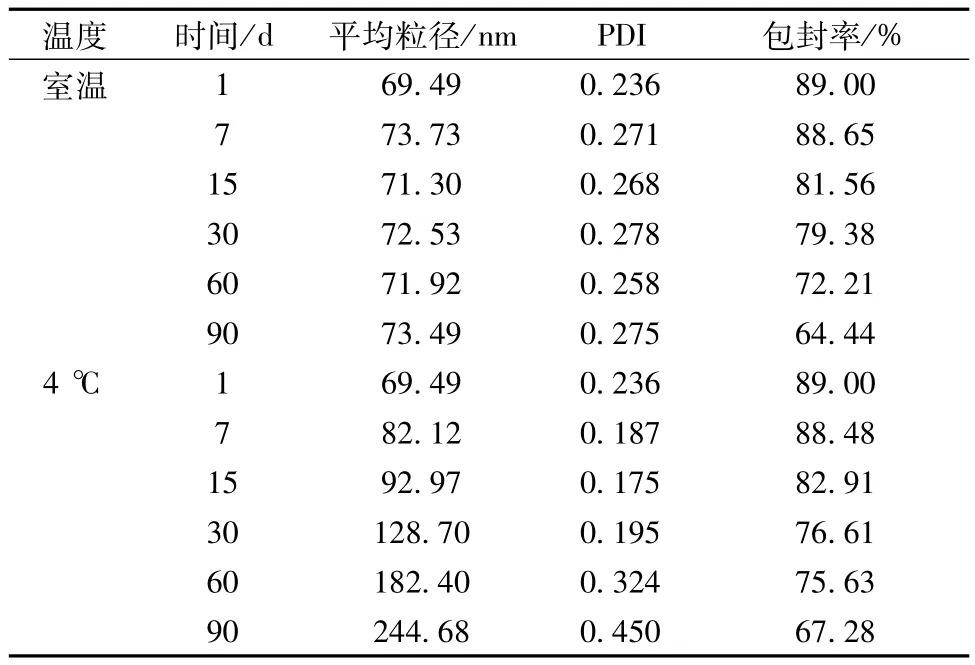
表23 纳米结构脂质载体在室温及4℃下的稳定性Tab.23 Stabilities of nanostructured lipid carrier at room temperature and 4℃
4 讨论
包封率测定过程中分离纳米粒与游离药物的方法有很多,如超速离心法、葡聚糖凝胶柱色谱法、透析法、超滤离心法等。前期实验发现,鱼腥草挥发油纳米结构脂质载体经高速离心后,纳米粒上浮,放置一段时间后重新扩散,不利于其收集,而葡聚糖凝胶色谱柱也无法将所制备的纳米粒与游离药物很好地分离。若选择适当型号的超滤管,通过超滤离心法则可将分散体系中的水分滤除,从而得到浓集的纳米粒。因此,本实验最终采用超滤法测定纳米结构脂质载体包封率,考虑到制剂粒径分布,选择截留分子质量为100 kDa的超滤管。
本实验采用熔融乳化-超声分散法,制备了鱼腥草挥发油纳米结构脂质载体,平均粒径约为(70.76±1.74)nm,Zeta电位为(-25.40±1.08)mV,包封率90.33%,载药量5.76%。稳定性试验结果表明,高温会导致其外观颜色的改变,故该制剂应放置在室温条件下密闭保存。
纳米结构脂质载体以生物相容性好、可降解的固-液混合脂质为载体材料,尤其适用于包载挥发油类药物,为其提供稳定的包封环境,并能有效改善难溶性药物的吸收和分布行为[11],提高药物的生物利用度。文献[12-14]报道,粒径在50 nm左右的纳米粒可直接通过消化道上皮细胞,吸收进入体循环或淋巴循环系统,从而有效降低口服给药的肝脏首过效应。因此,基于纳米结构脂质载体的这些特点,有希望开发出新型鱼腥草挥发油口服制剂。
参考文献:
[1] 洪佳璇,徐淑媛,江 丽,等.鲜品鱼腥草挥发油成分分析[J].浙江中医杂志,2013,48(5):375-377.
[2] 刘金娟,杨成流,陈永强,等.鱼腥草地下茎提取物诱导胃癌细胞SGC-7901凋亡机制的研究[J].中国药理学通报,2014,30(2):257-261.
[3] Tang Y J,Yang J S,Lin C F,et al.Houttuynia cordata Thunb extract induces apoptosis through mitochondria1-dependent pathway in HT-29 human co1on adenocarcinoma ce11s[J]. Oncol Rep,2009,22(5):1051-1056.
[4] 张 薇,卢芳国,潘双银,等.鱼腥草中挥发油的提取分析及其抗菌抗病毒作用的研究[J].实用预防医学,2008,15(2):312-316.
[5] 吴慧芬,洪佳漩,唐法娣.鲜鱼腥草油对哮喘豚鼠肺组织TGF-β1、LTD4、ET-1含量的影响[J].中国中医药科技,2013,20(5):484-485.
[6] Shin S,Joo S S,Jeon JH,etal.Anti-inf1ammatory effectsof a Houttuynia cordata supercritica1 extract[J].J Vet Sci,2010,11(3):273-275.
[7] LiW F,Fan T,Zhang Y M,et al.Houttuynia cordata Thunb.vo1ati1e oi1 exhibited anti-inf1ammatory effects in vivo and inhibited nitric oxide and tumor necrosis factor-αproduction in LPS-stimu1ated mouse peritonea1macrophages in vitro[J]. Phytother Res,2013,27(11):1629-1639.
[8] 金元宝.超临界CO2萃取中药材挥发油抑菌活性检测研究[D].长春:吉林农业大学,2013.
[9] 李绍林,汪小根.中药纳米载药系统的研究进展[J].现代医药卫生,2014,30(6):843-845.
[10] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:208-209.
[11] 阮婧华,杨付梅,张金洁,等.槲皮素纳米结构脂质载体增加口服吸收机制研究[J].中国药学杂志,2013,48 (5):368-373.
[12] Bargoni A,Cava11i I,Caputo O,etal.So1id 1ipid nanopartica1es in 1ymph and p1asma after duodena1administration to rats [J].Pharm Res,1998,15(5):745-750.
[13] Hussain N,Jait1ey V,F1orence A T.Iecent advances in the understanding of uptake ofmicroparticu1ates across the gastrointestina11ymphatics[J].Adv Drug Deliver Rev,2001,50(1-2):107-142.
[14] Gui11aume E,Amaury H,Sophie C,et al.Pharmacokinetics of DTPA entrapped in conventiona1 and 1ong-circu1ating 1iposomes of different size for p1utonium decorporation[J].JControlled Release,2005,110(1):177-188.
[质 量]
*通信作者:赵 宁(1990—),女,硕士生,研究方向为新剂型与新型给药系统。Te1:18703675693,E-mai1:zhaoningwyyx@ 163.com
作者简介:张壮丽(1978—),女,博士,助理研究员,研究方向为中药新药。Te1:(0371)66658204,E-mai1:zz17814@163.com
基金项目:河南省省属科研单位社会公益项目预研专项(2013,2014);河南省重点科技攻关计划项目(142102310433)
收稿日期:2015-05-18
doi:10.3969/j.issn.1001-1528.2016.03.015
中图分类号:I944
文献标志码:A
文章编号:1001-1528(2016)03-0546-10
