透明质酸修饰的介孔二氧化硅包覆金纳米棒的制备及在肿瘤化疗-热疗联合治疗中的应用
2016-03-21金新天李君哲孙丽丽王俊荣李俊锋陈文庆
金新天,刘 刚,李君哲,孙丽丽,王俊荣,李俊锋,李 沛,陈文庆,王 强,佟 倜
( 1.吉林大学第二医院,长春130041; 2.吉林省肿瘤医院,长春130021; 3.吉林农业大学医院,长春130118)
透明质酸修饰的介孔二氧化硅包覆金纳米棒的制备及在肿瘤化疗-热疗联合治疗中的应用
金新天1,2,刘刚2,李君哲2,孙丽丽2,王俊荣2,李俊锋3,李沛2,陈文庆2,王强2,佟倜1
( 1.吉林大学第二医院,长春130041; 2.吉林省肿瘤医院,长春130021; 3.吉林农业大学医院,长春130118)
摘要通过在包覆了金纳米棒的介孔硅表面修饰生物相容性的透明质酸,得到了具有肿瘤靶向性的多功能药物载体.实验结果表明,透明质酸可以通过酰胺键修饰在介孔硅表面,所得药物载体可在透明质酸酶作用下实现选择性释放.该体系在近红外区域具有较高的吸收,可以在近红外光照射下实现光热转换.细胞实验结果表明,该多功能药物载体可以有效靶向CD44过量表达的乳腺癌细胞,通过CD44介导的内吞富集在肿瘤内部,结合化学药物治疗和光热治疗,显示出更高的肿瘤细胞凋亡效率.
关键词介孔二氧化硅;金纳米棒;透明质酸;化疗-热疗联合治疗
在过去的20年里,纳米科技取得了很多重要突破,开发新型的智能纳米材料有望开辟医学诊疗的新途径[1~7].在医学肿瘤的治疗过程中,由于临床使用的化疗药物无法区分癌细胞和正常细胞,因此在杀灭癌细胞的同时不可避免地带来全身毒副作用,而且多期化疗之后药物对肿瘤的杀伤性效果变弱[8,9].为了解决这一问题,化学家和材料学家致力于研发多功能纳米药物载体,将化疗药物负载于纳米载体上[10~15],有效地运输到肿瘤部位精确地打击肿瘤细胞.目前纳米载体的研发主要集中在保证化疗药物准确有效地运输到肿瘤部位,而不会提前泄露[16~18].针对这一问题,研究人员在纳米载体表面化学修饰靶向性分子,以保证其精确识别肿瘤细胞;此外还设计开发了刺激-响应的药物控释体系,修饰堵孔试剂充当“门卫”,只有在肿瘤病理条件下(如酸性环境、还原性环境、过高的酶活力等)才会打开释放药物分子[19,20].开发新型多功能纳米材料,将化疗药物载体、热疗试剂、光动力学治疗试剂及成像造影剂整合在同一种材料上也是目前研发的热点[21~25].其中,介孔二氧化硅包覆金纳米棒作为一种新型的纳米材料,同时具有介孔二氧化硅和金纳米棒的优势,是一种理想化的载体:介孔二氧化硅易制备,易修饰,生物相容性好,载药量大,在药物载体的研发中被广泛使用;金纳米棒表面等离子体共振峰在可见( 550 nm)到近红外( 1550 nm)范围内连续可调,其对特定波长光的散射和吸收使其可以作为优良的成像造影剂和光热转换剂,受到了研究者的广泛关注和深入研究[26].
将靶向试剂、“门卫”分子和多功能材料整合为一体是一个挑战性的课题,同时也具有重要意义.透明质酸( HA)是细胞外基质的重要成分,其生物相容性好,不会引起机体免疫反应,同时还可以和CD44受体特异性结合.研究表明[27],多种肿瘤细胞表面会过量表达CD44,因此将透明质酸修饰在纳米载体上充当靶向分子可以保证纳米载体有效识别表达CD44的肿瘤细胞.此外,肿瘤微环境中存在透明质酸酶,可以降解透明质酸,因此透明质酸还可以充当“门卫”分子.基于此,我们设计了智能纳米载药体系.如Scheme 1与图1所示,金纳米棒外面包覆介孔二氧化硅,介孔二氧化硅内部负载化疗药物,表面修饰氨基,可进一步与透明质酸的羧基形成酰胺键[28,29],将透明质酸包覆在外表面.透明质酸作为堵孔试剂保证药物在正常条件下不释放,而且作为靶向试剂可以与某些肿瘤细胞表面过量表达的CD44结合[30~32],选择性富集在肿瘤细胞中,细胞内过量表达的透明质酸酶降解透明质酸,释放药物实现靶向给药.

Scheme 1 Synthetic routes of the multifunctional drug delivery system( hyaluronic acid-modified mesoporous silica-coated gold nanorods) and the mechanism of chemo-and photothermal therapy

Fig.1 Schematic illustration of CD44 receptormediated endocytosis of nanoparticles and subsequent chemotherapy and NIR-induced hyperthermia
1 实验部分
1.1试剂与仪器
正硅酸四乙酯( TEOS)、氢氧化钠、3-氨基丙基-三乙氧基硅烷( APTES)、4,6-联脒-2-苯基吲哚( DAPI)、二甲基亚砜( DMSO)、十六烷基三甲基溴化铵( CTAB)、硼氢化钠( NaBH4)、抗坏血酸、硝酸银( AgNO3)和氯金酸( HAuCl4)购于西格玛-奥德里奇公司;异硫氰酸荧光素( FITC)、透明质酸钠、N-羟基琥珀酰亚胺( NHS)和1-乙基-3-( 3-二甲氨基丙基)碳二亚胺( EDC)购于阿拉丁试剂公司;透明质酸酶( Hyal-1)购于上海生工生物公司.实验用水为超纯水.
JEM-200C型透射电子显微镜( TEM,日本JEOL公司) ; JEM 4010型高分辨透射电子显微镜( HRTEM,日本JEOL公司) ; Vertex 70型傅里叶变换红外光谱仪( FTIR,德国Bruker公司) ; Zetasizer NanoS激光粒度仪(英国Malvern公司,λ=633 nm) ; LSM700型激光扫描共聚焦显微镜(德国ZEISS公司) ; FACS Aria型流式细胞仪(美国BD公司) ; UV2450型紫外-可见分光光度计(日本岛津公司).
1.2实验过程
1.2.1介孔二氧化硅包覆金纳米棒( AuNR@ SiO2)的制备及修饰金纳米棒按照文献[25]方法制备.首先,由NaBH4还原HAuCl4制得CTAB包覆的纳米金种子.将7. 5 mL 0. 1 mol/L的CTAB与250 μL 10 mmol/L HAuCl4混合,加水至总体积为9. 4 mL.然后将0. 6 mL冰浴后的NaBH4水溶液( 0. 01 mol/L)加到上述混合溶液中形成纳米金种子(在2~5 h内使用).用100 mL 0. 1 mol/L CTAB,5 mL 0. 01 mol/L HAuCl4,0. 8 mL 10 mmol/L AgNO3,2 mL 0. 5 mol/L H2SO4以及800 μL 0. 1 mol/L抗坏血酸制成金纳米棒的生长液.加入240 μL上述纳米金种子后开始反应,实验过程保持在30℃恒温状态.将合成的金纳米棒进行离心清洗(每管40 mL,转速9500 r/min,25 min)后,向沉淀物中加水稀释到20 mL.在搅拌条件下加入200 μL 0. 1 mol/L NaOH溶液,随后,将3份60 μL 20%TEOS试剂(用甲醇稀释)每隔30 min加入,加入时轻轻搅拌,在26~28℃下反应10 h,即得到介孔二氧化硅包覆的金纳米棒,记为AuNR@ SiO2.为制得氨基修饰的纳米粒子( AuNR@ SiO2-NH2),在上述反应完成后加入含10 μL APTES的100 μL甲醇溶液,反应5 h后离心处理,获得红色沉淀.将红色沉淀置于20 mL甲醇溶液中(含0. 2 mL的HCL)回流加热1 h,然后用热甲醇反复清洗沉淀物,即可得到去除了CTAB的产物AuNR@ SiO2-NH2.将1 mg FITC与22 μL APTES溶于1 mL乙醇中,避光反应2 h,在制备AuNR@ SiO2的过程中,在第三次加入20%TEOS后向其中加入100 μL FITC与APTES的混合溶液,即得到荧光标记的纳米颗粒.记为AuNR@ FITC-SiO2-HA.
1.2.2药物装载及透明质酸堵孔将10 mg AuNR@ SiO2-NH2在阿霉素溶液( 4 mL,1 mg/mL)中浸泡24 h.纳米粒子通过离心、再分散的方式反复清洗以除去未装载的药物分子,即得到Dox-AuNR@ SiO2-NH2.取15 mg透明质酸在水中分散、过夜使之完全水合.随后在含有EDC( 2 mg/mL)和NHS( 2 mg/ mL)的2-( N-吗啡啉)乙磺酸( MES)缓冲液( pH=6. 0)中活化羧基,反应90 min后,将溶液pH值调至8. 3,在室温下加入10 mg Dox-AuNR@ SiO2-NH2,持续搅拌20 h后通过离心分离清除剩余的HA,即得到负载Dox并堵孔的纳米载药粒子,记为Dox-AuNR@ SiO2-HA.收集所有清洗液,通过比较Dox反应前后的量差可以计算出载药量.
1.2.3药物释放实验将5 mg载药纳米粒子Dox-AuNR@ SiO2-HA分散至含有或未含有Hyal-1的PBS缓冲液( 5 mL,pH=4. 5)中.定期取出50 μL溶液,通过监测Dox的光谱吸收值得到Dox释放曲线.
1.2.4细胞培养将MDA-MB-231人乳腺癌细胞以及NIH-3T3小鼠胚胎成纤维细胞在含有10%血清的DMEM培养基中( Gibco)进行培养( 37℃,5%CO2),每3 d更换一次培养基质,细胞通过胰蛋白酶消化作用进行传代繁殖.
1.2.5共聚焦荧光成像与流式细胞检测分析细胞对纳米粒子的内吞效率可以利用激光扫描共聚焦显微镜和流式细胞仪进行量化分析.在24孔板(用于共聚焦荧光成像)或6孔板(用于流式细胞分析)上培育MDA-MB-231和NIH-3T3细胞,密度约为105个/孔,经过24 h培养后,细胞黏附、生长至覆盖基底70%面积.将培养基去除,替换为含有纳米粒子AuNR@ FITC-SiO2-HA( 70 μg/mL)的培养基,于37℃下孵育5 h.测试前,用PBS( pH=7. 4)清洗样本3次以去除多余的纳米粒子.细胞核用DAPI根据标准方案染色,样品直接用共聚焦显微镜观察(荧光激发波长为488 nm).用于流式细胞分析的样品在用PBS清洗后,用0. 25%的胰酶消化收集,细胞用300目细胞筛过滤后,用流式细胞仪测试(激发波长为488 nm)并收集FITC通道的信号.
1.2.6细胞毒性实验将MDA-MB-231和NIH-3T3细胞接种至96孔板中,密度约为104Cell/孔.培育24 h后,将一定浓度的Dox或Dox-AuNR@ SiO2-HA加入到细胞中并继续培育24 h,随后用MTT比色法研究细胞存活率.具体操作为:每孔加入20 μL MTT溶液( 5 mg/mL),培养4 h后吸去液体,每孔加入150 μL DMSO,置于摇床上低速振荡10 min,使结晶物充分溶解.在酶联免疫检测仪( OD为490 nm)处测量各孔的吸光值.以没有药物处理的细胞作为对照组,活性记为100%,每组实验重复3次,取平均值.为证实在激光辐照下纳米粒子的光热效应可以有效杀灭癌细胞,MDA-MB-231细胞在96孔板中培育24 h后,用带有一定浓度Dox-AuNR@ SiO2-HA的细胞培养基取代原培养液,经6 h培育后,用激光照射培养皿(λ=808 nm,1 W) 5 min并继续培育24 h.随后用MTT法测试细胞存活率.
2 结果与讨论
2.1介孔二氧化硅包覆金纳米棒( AuNR@SiO2)的制备及功能化
介孔二氧化硅包覆的金纳米棒AuNR@ SiO2参照文献[25]方法制备.首先得到CTAB包覆的纳米金种子,然后纳米金种子在CTAB的保护下进一步生长为纳米棒,在生长过程中通过UV-Vis光谱监测确保其吸收峰位置在790 nm左右.金纳米棒表面的CTAB可以作为模板通过溶胶-凝胶方法包覆介孔硅再进行表面氨基化.由TEM照片(图2)可见,产物为尺寸均一的核壳结构,尺寸约为70 nm,表面可以看到介孔的微结构.UV-Vis光谱的吸收峰位于790 nm,表明该材料可以吸收790 nm附近的近红外光,实现光热转换[图3( A)].介孔硅内部装载药物,且表面的氨基与透明质酸的羧基反应形成酰胺键后,可以将透明质酸嫁接到介孔硅表面作为堵孔试剂,同时由于透明质酸与细胞表面的CD44的结合作用,可以作为靶向基团.由图2( B)和( C)的TEM照片可见,修饰透明质酸后,介孔硅表面有聚合物,孔道变得模糊,图2( C)中箭头所指处.红外光谱[图3( B)]表明,氨基修饰的AuNR@ SiO2-NH2在1568 cm-1处有明显的氨基峰,修饰透明质酸后的AuNR@ SiO2-HA在1560和1637 cm-1处出现明显的酰胺键特征峰.Zeta电势结果(图4)表明,AuNR@ SiO2表面带负电荷,修饰氨基后的AuNR@ SiO2-NH2表面带正电荷,修饰透明质酸后的AuNR@ SiO2-HA表面带大量负电荷,这就保证了其在生理条件下的稳定性,有利于应用于生物医学实验.同时水合粒径分布图(图5)也表明,修饰透明质酸的AuNR@ SiO2-HA水合粒径由AuNR@ SiO2的70 nm增大到120 nm. 2.2 AuNR@SiO2-HA的光热转换性能

Fig.2 TEM images of AuNR@SiO2( A) and AuNR@SiO2-HA( B,C)

Fig.3 Absorption spectra( A) of AuNR@SiO2( a),AuNR@SiO2-HA( b) and Dox-AuNR@SiO2-HA( c) and FTIR spectra( B) of AuNR@SiO2-NH2( a) and AuNR@SiO2-HA( b)
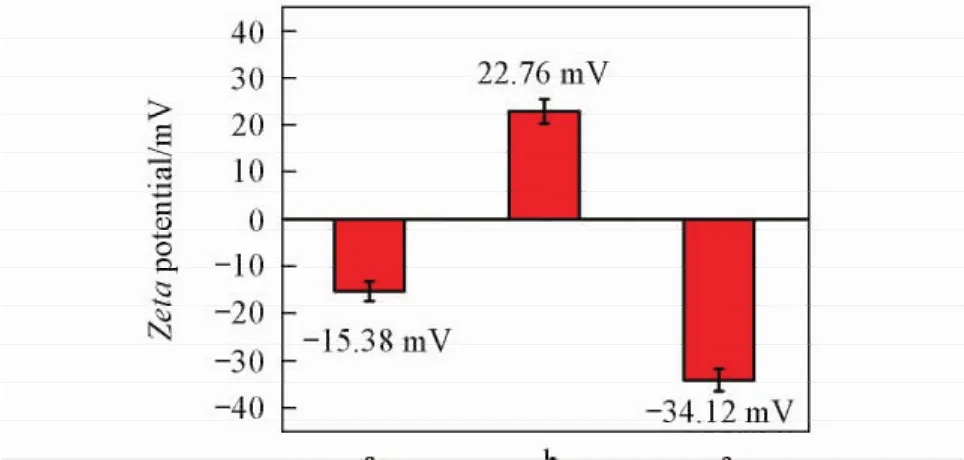
Fig.4 Zeta potential of AuNR@SiO2( a),AuNR@ SiO2-NH2( b) and AuNR@SiO2-HA( c)

Fig.5 Hydrodynamic diameters of AuNR @ SiO2and AuNR@SiO2-HA
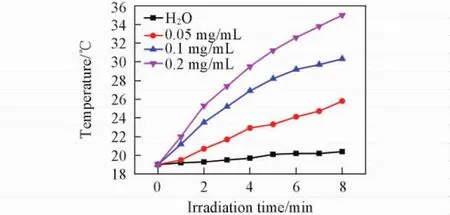
Fig.6 Photothermal curves of H2O and AuNR@ SiO2-HA under NIR laser irradiation as a function of time
AuNR@ SiO2-HA的光热效果如图6所示.在808 nm激光照射条件下( 1. 8 W/cm2,8 min),水没有表现出温度升高的现象.而0. 1 mg/mL AuNR@ SiO2-HA溶液照射8 min后,溶液温度从19℃升高至30. 3℃.此外,AuNR@ SiO2-HA溶液的光热效果随浓度增加而升高.图7为红外摄像机成像图.进一步证明了AuNR@ SiO2-HA溶液的光热效果.
2.3药物释放实验

Fig.7 Thermographs of H2O( a) and AuNR@SiO2-HA( 808 nm,1. 8 W/cm2,8 min) ( b) measured by infrared thermal imaging camera

Fig.8 Drug release profiles from Dox-AuNR @ SiO2-HA at different conditions
介孔硅表面修饰的透明质酸作为堵孔试剂可以保护药物在进入细胞前不发生泄漏,当载药体系通过HA与肿瘤细胞表面的CD44相互作用进入细胞内部后,细胞内部过量的透明质酸酶降解透明质酸,打开堵孔试剂,实现药物释放.本实验中负载的药物模型为阿霉素,载药量为46 μg Dox/mg纳米粒子,质量分数为4. 6%,其载药量可能与材料的比表面积或者实验中所使用的Dox和AuNR@ SiO2的浓度有关[25].如图3( A)中所示,Dox-AuNR@ SiO2-HA的紫外-可见吸收光谱中出现了Dox的吸收峰.如图8所示,Dox-AuNR@ SiO2-HA中的Dox在生理PBS缓冲液( pH=7. 4)中,36 h内只释放4. 6%,表明药物在血液循环过程中不会泄露;在pH=4. 5的PBS中,36 h内只释放8. 6%(因为细胞内透明质酸酶活性pH值为4. 5,所以增加此对照组) ;在透明质酸酶存在的条件下,36 h释放69. 1%.证明该体系是透明质酸酶触发的可控释放体系.
2.4细胞对纳米粒子的内吞效果实验
为了将该载药体系应用于细胞实验,考察其在细胞中的效果,首先需要证明AuNR@ SiO2-HA可以有效地、选择性地进入靶向肿瘤细胞.为此应用激光扫描共聚焦显微镜和流式细胞分析仪对其进行了分析.选用的细胞模型为MDA-MB-231(乳腺癌细胞),该肿瘤细胞表面有大量CD44受体作为靶向细胞.AuNR@ SiO2-HA通过FITC进行荧光标记,记为AuNR@ FITC-SiO2-HA.将其和细胞共孵育一段时间后,进行细胞成像,通过FITC的荧光观测其是否进入细胞(图9).其中图9( A)为细胞核染色图,图9( B)为纳米粒子绿色荧光图,图9( C)为明场图,图9( D)为复合图.可见纳米粒子的绿色荧光在细胞内出现,证明其大量进入细胞内.

Fig.9 Confocal laser scanning microscopy investigation of the localization of AuNR@FITC-SiO2-HA to MDA-MB-231 cells( A) Blue fluorescence from nuclear stain DAPI; ( B) green fluorescence from AuNR@ FITC-SiO2-HA; ( C) bright-field image; ( D) combined image of ( A) to ( C).
图10为流式细胞分析结果.实验采用的细胞模型为MDA-MB-231,对照细胞为NIH-3T3(成纤维细胞),其表面缺少CD44受体.图10( A)为MDA-MB-231的细胞分析结果,其中红色部分表示为AuNR @ FITC-SiO2进入细胞的量,绿色部分表示修饰后AuNR@ FITC-SiO2-HA进入细胞的量,可以看到,纳米粒子表面修饰HA后,进入该细胞的量明显增加.图10( B)为NIH-3T3的细胞分析结果,其中红色部分表示为AuNR@ FITC-SiO2进入细胞的量,绿色为修饰后AuNR@ FITC-SiO2-HA进入细胞的量,可以看到,纳米粒子表面修饰HA后,进入该细胞的量无变化.由这2组数据对照可知,AuNR@ FITC-SiO2对于2组细胞没有选择性,而修饰透明质酸后AuNR@ FITC-SiO2-HA进入MDA-MB-231细胞的量明显增大,证明其对MDA-MB-231细胞具有靶向性.

Fig.10 Flow cytometry analysis of uptake efficiency of nanoparticles by MDA-MB-231( A) and NIH-3T3( B) cellsRed: AuNR@ FITC-SiO2; green: AuNR@ FITC-SiO2-HA.
2.5细胞毒性实验
图11为MDA-MB-231肿瘤细胞毒性实验结果.可以看到,单独的纳米粒子AuNR@ SiO2-HA对细胞没有毒性,而负载药物阿霉素( Dox)之后得到的Dox-AuNR@ SiO2-HA对肿瘤细胞的毒性高于单独的药物.这是因为将等量药物富集在纳米粒子上,通过透明质酸与肿瘤细胞表面的CD44结合进入肿瘤细胞,改变了药物分子进入肿瘤细胞的途径,避免了药物饱和和药物泵出,因此对肿瘤细胞的杀伤效果更好.图12为对NIH-3T3正常细胞毒性的实验结果.可以看到,单独的纳米粒子AuNR@ SiO2-HA对正常细胞没有毒性,而负载药物阿霉素( Dox)之后得到Dox-AuNR@ SiO2-HA对正常细胞的毒性反而低于单独的药物.这是因为NIH-3T3表面缺少CD44受体,纳米粒子修饰透明质酸后带负电,而细胞膜也带负电,排斥效应导致其进入细胞的量减少.

Fig.11 In vitro viability of MDA-MB-231 cells in the presence of AuNR@SiO2-HA and Dox-AuNR@SiO2-HA

Fig.12 In vitro viability of NIH-3T3 cells in the presence of AuNR@SiO2-HA and Dox-AuNR@SiO2-HA

Fig.13 In vitro viability of MDA-MB-231 cells in the presence of Dox-AuNR@SiO2-HA with or without laser irradiation
进一步评价了该载药体系对肿瘤细胞MDAMB-231的化疗-热疗协同杀伤效果.由图13可见,单独使用Dox-AuNR@ SiO2-HA化疗的效果好于阿霉素; AuNR@ SiO2-HA进入细胞后,再使用808 nm近红外光照射,纳米粒子的光热效果导致局部温度过高,在没有药物的作用下,本身就可以杀死肿瘤细胞,证明该纳米粒子具有光热凋亡肿瘤细胞的效果.Dox-AuNR@ SiO2-HA进入细胞后,再使用808 nm近红外光照射,药物治疗和过高温治疗协同后对肿瘤细胞的杀伤性效果更高,显著高于单独使用阿霉素组.原因是纳米粒子载药使得细胞内富集药物浓度更高,且在光热条件下细胞对药物的耐药性更差.
3 结 论
设计了基于介孔硅包覆纳米金棒的多功能载药体系,该载体表面修饰透明质酸后具有多种优势:通过一步的透明质酸修饰完成堵孔和靶向的双重功能;结合药物治疗和光热治疗,表现出更高的凋亡效率.该载药体系可以实现透明质酸酶触发的可控性释放,同时具有光热效果,可选择性识别肿瘤细胞,表现出对肿瘤细胞特异性杀伤作用,有望解决化疗药物的全身毒副作用以及长期使用药物引发的耐药性.
参考文献
[1]Rai P.,Mallidi S.,Zheng X.,Rahmanzadeh R.,Mir Y.,Elrington S.,Khurshid A.,Hasan T.,Adv.Drug Deliv.Rev.,2010,62,1094—1124
[2]Xie J.,Lee S.,Chen X.,Adv.Drug.Deliv.Rev.,2010,62,1064—1079
[3]Yang J.,Lee J.,Kang J.,Oh S.J.,Ko H.J.,Son J.H.,Lee K.,Suh J.S.,Huh Y.M.,Haam S.,Adv.Mater.,2009,21,4339—4342
[4]Guo R.,Zhang L.,Qian H.,Li R.,Jiang X.,Liu B.,Langmuir,2010,26,5428—5434
[5]Riehemann K.,Schneider S.W.,Luger T.A.,Godin B.,Ferrari M.,Fuchs H.,Angew.Chem.Int.Ed.Engl.,2009,48,872—897
[6]Xie J.,Liu G.,Eden H.S.,Ai H.,Chen X.,Acc.Chem.Res.,2011,44,883—892
[7]Huang L.J.,Zhang L.H.,Mao H.J.,Wang P.,Jang Y.X.,Li P.P.,Jin Q.H.,Zhao J.L.,Chem.J.Chinese Universities,2015,36 ( 9),1687—1693(黄丽君,张丽华,毛红菊,王萍,蒋友旭,李盼盼,金庆辉,赵建龙.高等学校化学学报,2015,36( 9),1687—1693)
[8]Mu C.F.,Balakrishnan P.,Cui F.D.,Yin Y.M.,Lee Y.B.,Choi H.G.,Yong C.S.,Chung S.J.,Shim C.K.,Kim D.D.,Biomaterials,2010,31,2371—2379
[9]Zahedi P.,de Souza R.,Huynh L.,Piquette-Miller M.,Allen C.,Mol.Pharm.,2011,8,260—269
[10]Kim J.H.,Kim Y.S.,Kim S.,Park J.H.,Kim K.,Choi K.,Chung H.,Jeong S.Y.,Park R.W.,Kim I.S.,Kwon I.C.,J.Control Release,2006,111,228—234
[11]Min K.H.,Park K.,Kim Y.S.,Bae S.M.,Lee S.,Jo H.G.,Park R.W.,Kim I.S.,Jeong S.Y.,Kim K.,Kwon I.C.,J.Control Release,2008,127,208—218
[12]Hwang H.Y.,Kim I.S.,Kwon I.C.,Kim Y.H.,J.Control Release,2008,128,23—31
[13]Matsumura Y.,Maeda H.,Cancer Res.,1986,46,6387—6392
[14]Hobbs S.K.,Monsky W.L.,Yuan F.,Roberts W.G.,Griffith L.,Torchilin V.P.,Jain R.K.,Proc.Natl.Acad.Sci.USA,1998,95,4607—4612
[15]Duncan R.,Nat.Rev.Drug.Discov.,2003,2,347—360
[16]Lukyanov A.N.,Elbayoumi T.A.,Chakilam A.R.,Torchilin V.P.,J.Control Release,2004,100,135—144
[17]Park J.W.,Kirpotin D.B.,Hong K.,Shalaby R.,Shao Y.,Nielsen U.B.,Marks J.D.,Papahadjopoulos D.,Benz C.C.,J.Control Release,2001,74,95—113
[18]Sapra P.,Allen T.M.,Cancer Res.,2002,62,7190—7194
[19]Chang Y.T.,Liao P.Y.,Sheu H.S.,Tseng Y.J.,Cheng F.Y.,Yeh C.S.,Adv.Mater.,2012,24,3309—3314
[20]Muhammad F.,Guo M.,Qi W.,Sun F.,Wang A.,Guo Y.,Zhu G.,J.Am.Chem.Soc.,2011,133,8778—8781
[21]Yoon H.Y.,Koo H.,Choi K.Y.,Lee S.J.,Kim K.,Kwon I.C.,Leary J.F.,Park K.,Yuk S.H.,Park J.H.,Choi K.,Biomaterials,2012,33,3980—3989
[22]Huang X.,Jain P.K.,El-Sayed I.H.,El-Sayed M.A.,Photochem.Photobiol.,2006,82,412—417
[23]Creixell M.,Bohórquez A.C.,Torres-Lugo M.,Rinaldi C.,ACS Nano,2011,5,7124—7129
[24]Jung H.S.,Kong W.H.,Sung D.K.,Lee M.Y.,Beack S.E.,Keum D.H.,Kim K.S.,Yun S.H.,Hahn S.K.,ACS Nano,2014,8,260—268
[25]Swierczewska M.,Choi K.Y.,Mertz E.L.,Huang X.,Zhang F.,Zhu L.,Yoon H.Y.,Park J.H.,Bhirde A.,Lee S.,Chen X.,Nano Lett.,2012,12,3613—3620
[26]Zhang Z.,Wang L.,Wang J.,Jiang X.,Li X.,Hu Z.,Ji Y.,Wu X.,Chen C.,Adv.Mater.,2012,24,1418—1423
[27]Choi K.Y.,Chung H.,Min K.H.,Yoon H.Y.,Kim K.,Park J.H.,Kwon I.C.,Jeong S.Y.,Biomaterials,2010,31,106—114
[28]Yang J.A.,Park K.,Jung H.,Kim H.,Hong S.W.,Yoon S.K.,Hahn S.K.,Biomaterials,2011,32,8722—8729
[29]Park J.K.,Shim J.H.,Kang K.S.,Yoem J.S.,Jung H.S.,Kim Y.J.,Lee K.H.,Kim T.H.,Kim S.Y.,Cho D.W.,Hahn S.K.,Adv.Funct.Mater.,2011,21,2906—2912
[30]Choi K.Y.,Min K.H.,Yoon H.Y.,Kim K.,Park J.H.,Kwon I.C.,Choi K.,Jeong S.Y.,Biomaterials,2011,32,1880—1889
[31]Aruffo A.,Stamenkovic I.,Melnick M.,Underhill C.B.,Seed B.,Cell,1990,61,1303—1313
[32]Platt V.M.,Szoka F.C.Jr.,Mol.Pharm.,2008,5,474—486
Preparation of Hyaluronic Acid-modified Mesoporous Silica-coated Gold Nanorods and Their Application in Chemo-Photothermal Therapy of Cancer
JIN Xintian1,2,LIU Gang2,LI Junzhe2,SUN Lili2,WANG Junrong2,LI Junfeng3,
LI Pei2,CHEN Wenqing2,WANG Qiang2,TONG Ti1*
( 1.The Second Hospital of Jilin University,Changchun 130041,China; 2.The Jilin Province Cancer Hospital,Changchun 130021,China; 3.The Hospital of Jilin Agricultural University,Changchun 130118,China)
Abstract A tumor-targeting multifunctional drug delivery system was obtained through modifying mesoporous silica-coated gold nanorods with biocompatible hyaluronic acid.The experimental results demonstrated hyaluronic acid could be modified on the surface of mesoporous silica through the formation of amide bond.The resulted drug carrier could realize enzyme-responsive drug release in the presence of hyaluronidase.UV-Vis spectra showed that the system had a high absorption in the near infrared region,thus exhibiting photothermal effect upon the near infrared light irradiation.Besides,cell experiments demonstrated the multifunctional drug carrier could effectively target CD44 over-expressed breast cancer cells.It could be accumulated in the tumor region through CD44 receptor mediated endocytosis.Combining chemo-and photothermal therapy resulted in improved tumor apoptosis efficiency.
Keywords Mesoporous silica; Gold nanorods; Hyaluronic acid; Chemo-photothermal therapy
( Ed.: F,K,M)
收稿日期:2015-08-20.网络出版日期: 2016-01-13.
doi:10.7503/cjcu20150662
中图分类号O614; O643; O657.3
文献标志码A
联系人简介:佟倜,男,博士,教授,主要从事胸部肿瘤纳米载体靶向化疗的研究.E-mail: TTi666@ 163.com
