聚合物在荧光检测领域的应用
2016-03-21宋春霞羊小海王柯敏刘剑波李文山黄海花
宋春霞,羊小海,王柯敏,王 青,刘剑波,黄 晋,李文山,黄海花,刘 卫
(湖南大学化学生物传感与计量学国家重点实验室,化学化工学院,生物纳米与分子工程湖南省重点实验室,长沙410082)
聚合物在荧光检测领域的应用
宋春霞,羊小海,王柯敏,王青,刘剑波,黄晋,李文山,黄海花,刘卫
(湖南大学化学生物传感与计量学国家重点实验室,化学化工学院,生物纳米与分子工程湖南省重点实验室,长沙410082)
摘要聚合物是由一种或几种重复单体以共价键连接形成的大分子化合物,它不仅能够保持单体的性质,而且由于聚合后单体间的协同作用,使其表现出独特的性能.聚合物作为基础材料在荧光检测领域得到广泛应用.聚合物通过氢键作用、亲疏水作用及范德华力等分子间相互作用,实现了对特定目标物的选择性识别;通过信号转换和放大功能,可以将分子识别作用转化为荧光信号;可以作为骨架连接多个识别单元,通过多价结合作用等提高识别目标物的能力,或连接不同的功能单元,构建多功能的分子器件.本文对聚合物在荧光检测领域的应用进行了概述.
关键词聚合物;荧光检测;分子识别;信号转换;探针骨架
E-mail: yangxiaohai@ hnu.edu.cn
王柯敏,男,博士,教授,博士生导师,主要从事纳米及分子水平上的生物分析化学研究.
E-mail: kmwang@ hnu.edu.cn
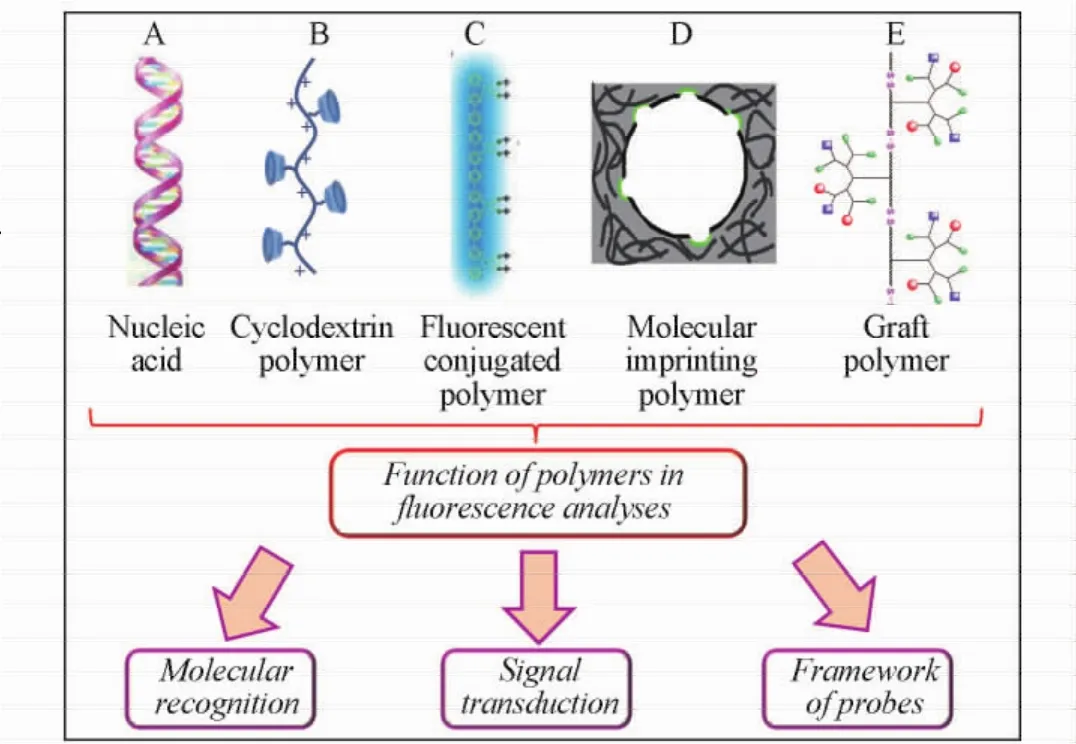
Fig.1 Application of polymers in fluorescence analyses[10—12]( C) Copyright( 2010) from American Chemical Society;( D) Copyright( 2014) from American Chemical Society;( E) Copyright( 2013) from American Chemical Society.
聚合物是由一种或几种重复单体以共价键连接形成的大分子化合物[1,2].它不仅能够保持单体的性质,而且由于聚合后单体彼此间的协同作用,表现出某些独特的性能,其作为基础材料已经在荧光检测领域得到了广泛关注和应用.其中最为经典的例子是分子印迹聚合物.基于抗原-抗体的检测体系是多种环境、食品和临床荧光分析方法的基础,然而抗体的应用在稳定性和成本等方面受到诸多限制[3].1940年,Pauling[4]提出了以抗原作为模板合成“化学抗体”的理论.基于此,1973年Wulff研究组[5]首次报道了人工合成分子印迹聚合物.1993年Mosbach等[6]以甲基丙烯酸为单体,合成了可以模拟生物抗体识别作用的分子印迹聚合物并用于胆碱的检测后,分子印迹聚合物成为当时的研究热点.除了用于目标物的识别外,聚合物也常被用于荧光信号的转换和放大.Swager等[7,8]利用荧光共轭聚合物中荧光信号的超猝灭作用实现了百草枯等的高灵敏检测.近年来,以聚合物为骨架,结合其它功能单元来构建多功能的荧光纳米探针备受关注.Li等[9]利用两亲型嵌段聚合物作为探针骨架,通过自组装方法构建了一种集多种成像和治疗功能于一体的纳米颗粒,其具有近红外荧光成像、磁共振成像、正电子放射成像、光热治疗和光动力学治疗等功能.本文根据聚合物在荧光检测中的作用,分别对其在分子识别、信号转换和作为探针骨架等方面的应用进行概述(图1).
1 聚合物的分子识别功能及其在荧光检测领域的应用
一个荧光检测方法至少包括分子识别和信号转换2个单元.分子识别是指识别单元通过共价键、范德华力、亲疏水作用、氢键或离子键等与目标物特异性结合,这种识别需要较高的亲和力和专一性[13],是能够特异性检测目标物的基础.信号转换是将目标物与分子识别单元的识别作用转换为荧光信号输出,从而给出目标物的相关信息.
聚合物通过多个单体之间的协同作用以及结构的改变,与目标分子高特异性、高选择性结合,在荧光检测领域应用非常广泛,发挥着重要作用.分子印迹聚合物是其中最为典型的应用.自1993年Mosbach等[6]利用分子印迹聚合物实现血液中痕量胆碱的检测以来,分子印迹聚合物的研究引起广泛关注并取得重要进展.其它聚合物如核酸适配体通过独特的碱基序列或者构象改变实现对目标分子的高效识别.这些聚合物具有性能稳定、成本低廉及可重复使用等优点,作为抗体的有效补充在分析检测领域得到广泛应用[10,14].我们以分子印迹聚合物和核酸适配体为例,对聚合物的分子识别机制及其应用进行概述.
1.1基于分子印迹聚合物的分子识别机制及其应用
分子印迹技术被称为制造“人工钥匙”的人工锁技术,即模拟生物体内抗原与抗体、酶与底物等分子之间的识别过程,利用单体聚合制备对目标分子具有特异性识别能力的聚合物[15].分子印迹聚合物具有抗恶劣环境能力强、稳定性好、使用寿命长和应用范围广等优点,因此在催化、生物分析、色谱分离、药物开发、细胞培养甚至分子结晶等领域都得到了应用[10].
分子印迹聚合物的识别机制如图2所示[16].首先,使模板分子尽可能地与具有适当功能基团的单体形成多重作用位点,得到单体-模板分子复合物;然后,单体与过量的交联剂在致孔剂的存在下形成聚合物,从而在模板分子周围形成一个交联度很高的刚性聚合物骨架,单体上的功能基团在特定的空间取向上固定下来;最后,通过物理或化学方法将模板分子脱除,即在聚合物中留下一个与模板分子在空间结构上完全匹配,并含有与模板分子特异性结合的功能基团的三维空穴[17,18].所得空穴对模板分子的作用与生物体内抗原-抗体或酶-底物作用相似,通过多个作用位点非共价键(氢键、范德华力及离子键等)或共价键的协同作用,与模板分子形成稳定的复合物,并且具有良好的选择性.
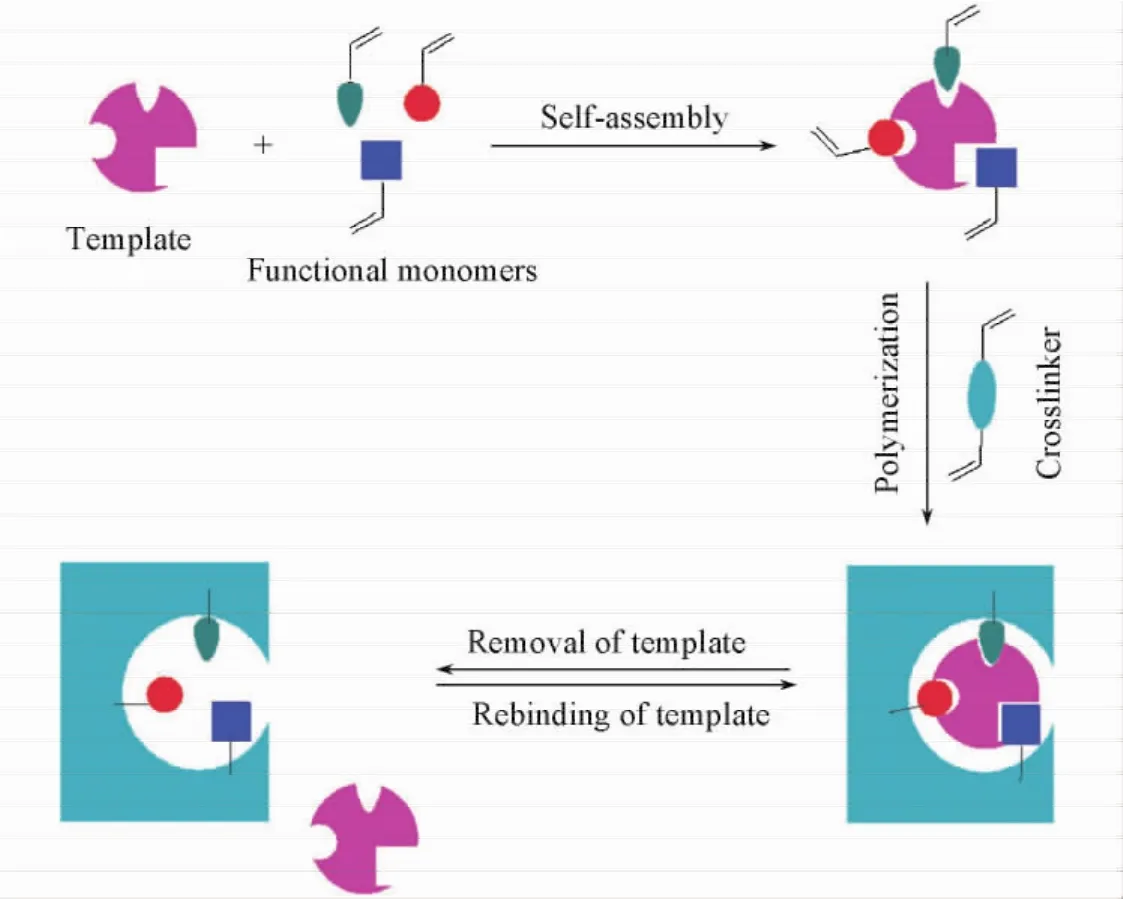
Fig.2 Schematic diagram of recognition mechanism of the molecular imprinting process[16]Copyright( 2011) from the Royal Society of Chemistry.
目前,基于分子印迹聚合物的荧光分析方法已经得到了广泛研究和应用,例如Xu等[19]以目标物三硝基甲苯( TNT)为模板,以CdTe量子点为种子合成了分子印迹聚合物(图3),利用分子印迹聚合物识别TNT过程中量子点的荧光被猝灭的现象,实现了TNT的检测.在此基础上,Liu等[20]利用受样品本体荧光影响小的上转换纳米颗粒YVO4∶Eu3+为种子合成分子印迹聚合物,实现了复杂样品中λ-氯氟氰菊酯的检测.此外,Cheng等[21]和Liu等[22]利用与目标物分子有选择性作用力的环糊精为单体构建了分子印迹聚合物,显著提高了方法的选择性.

Fig.3 Dummy molecularly imprinted polymers-capped CdTe quantum dots for the fluorescent sensing of 2,4,6-trinitrotoluene[19]Copyright( 2013) from American Chemical Society.
为了进一步提高分子印迹聚合物与目标分子的结合能力,可以选择与目标分子有选择性作用的单体来合成分子印迹聚合物.如Cheng等[21]利用与亚精胺之间有超分子作用力的环糊精作为单体合成分子印迹聚合物,并结合疏水环境下荧光分子的荧光增强实现了亚精胺的灵敏检测;利用喹啉修饰的β-环糊精作为功能单体,以亚精胺作为模板合成分子印迹聚合物膜.去除模板后分子印迹聚合物可以识别亚精胺,疏水性的亚精胺进入环糊精的空腔,导致喹啉所在微环境的疏水性提高、荧光增强,从而实现亚精胺的灵敏检测.由于环糊精对亚精胺的选择性识别能力增强了分子印迹聚合物与目标物之间的结合常数,所以本方法对同系物有良好的选择性.Liu等[22]也利用环糊精为单体构建分子印迹聚合物,环糊精与氨基酸的选择性结合大大提高了分子印迹聚合物与氨基酸的结合常数,使该方法的选择性显著提高.
1.2基于核酸适配体的分子识别机制及其应用
核酸适配体是从人工合成的DNA/RNA文库中通过指数富集配基系统进化技术( Systematic evolution of ligands by exponential enrichment,SELEX)[23,24]筛选获得的能够高亲和力、高特异性结合目标物的寡核苷酸链.核酸适配体具有易于合成与修饰、无免疫原性且目标物范围广等优点[3,14].核酸适配体作为识别单元在生物传感、分析检测和生物成像等方面得到广泛应用,是当前分析化学领域的研究热点之一[3].
SELEX技术是体外筛选核酸适配体的基本方法.筛选原理是首先合成一个大容量的单链寡核苷酸文库,将其与目标物混合后,通过一定的分离技术从中筛选出与目标物特异性结合的核酸,并以此核酸分子为模板进行PCR扩增,使其得到指数级富集,用于下一轮的筛选过程.经过多次循环,最终获得与目标物高特异性、高亲和力结合的核酸适配体[25].SELEX技术通常包括以下步骤: ( 1)文库与目标物孵育; ( 2)除去未结合的核酸; ( 3)分离与目标物结合的核酸; ( 4)扩增得到的核酸.此外,还要通过反筛步骤以提高核酸适配体的特异性识别能力[25].
核酸适配体与目标物的相互作用需要2个条件:一是通过折叠形成特定结构,使彼此空间结构相互匹配;二是需要多种“作用力”如氢键、静电作用等稳定彼此的相互作用.核酸适配体与目标物结合时,往往通过碱基配对形成稳定二级结构与目标物结合,或者在配体的诱导下形成稳定的二级结构,如发夹( Hairpin)、假结( Pseudoknot)和G-四聚体( G-quartet)等,其中的碱基通常是结合目标物的关键位点.核酸适配体与目标物的作用通常不是单独一种作用力,而是“假碱基对”堆积作用、氢键作用、静电作用和形状匹配效应等多种作用力协同作用的结果.例如,凝血酶的核酸适配体可形成含有2个G-四聚体结构的特殊三维结构,与凝血酶通过范德华力、氢键作用、静电作用和形状匹配等相互作用实现高特异性识别(图4)[26].
核酸适配体作为一类新型的识别分子,目前已被广泛用于无机离子、有机分子、生物大分子(蛋白质、酶和受体)乃至细菌、病毒、细胞及组织等的检测[14].经过合理设计和修饰后的核酸适配体首先与目标物特异性识别,再输出易于检测的物理信号.荧光法具有灵敏度高、易于读取、样品体积量少及定量方便等优势[14,27].在荧光方法中通常是利用荧光基团标记核酸适配体,目标物与核酸适配体作用后荧光性质发生改变,从而实现对目标分子的检测;或者同时将荧光基团和猝灭基团共同标记在核酸适配体的不同位置上,通过目标物特异性诱导核酸适配体空间结构发生变化,从而使荧光信号发生改变来实现目标物的检测.本课题组[28]基于细胞膜蛋白触发核酸适配体探针构型变化的信号激活原理,实现了小鼠体内肿瘤靶向定位和成像(图5) ; Tang等[29]设计了一种可激活式荧光探针,实现了凝血酶等目标物的检测.为了增强核酸适配体对目标物的识别能力,还可利用能识别目标物不同位置的2个核酸适配体进行荧光检测[30].
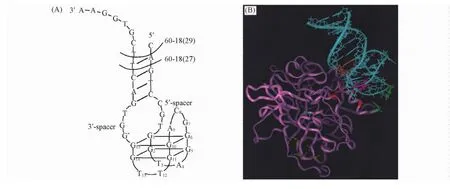
Fig.4 Proposed secondary structure of the thrombin aptamer( A) and the interaction of the aptamer with human thrombin( B)[26]Copyright( 1997) from Academic Press.
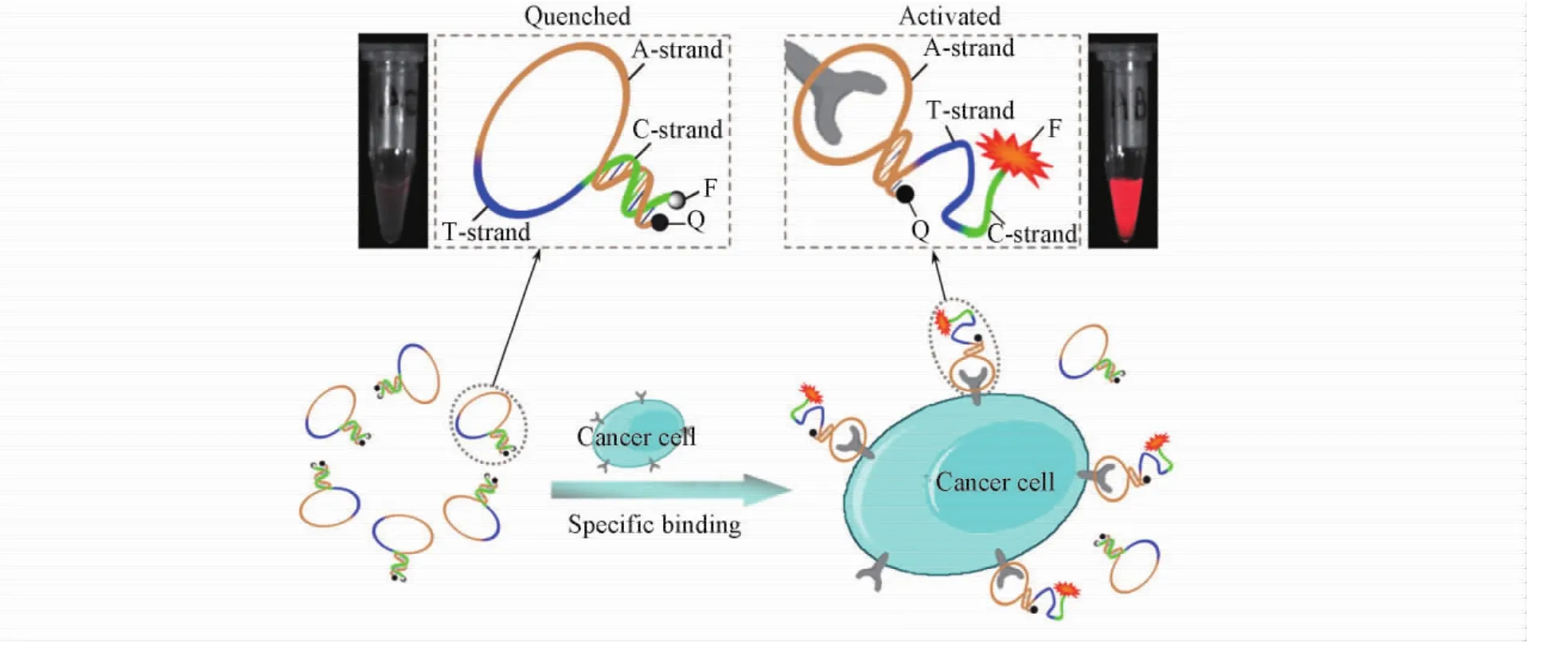
Fig.5 Activatable aptamer probe for contrast-enhanced in vivo cancer imaging based on cell membrane protein-triggered conformation alteration[28]Copyright( 2011) from National Academy of Sciences.
2 聚合物的信号转换功能及其在荧光检测领域的应用
在荧光检测方法中,通过信号转换将分子识别作用转换为荧光信号输出是荧光检测方法的必要组成部分.聚合物在荧光信号转换中的应用非常广泛,例如荧光共轭聚合物因具有导电性而使荧光信号超猝灭,可实现对目标物的高灵敏检测[12,31,32].根据聚合物在荧光信号转换中的作用模式,可将其分为可自发荧光的聚合物、可诱导生成荧光物质的聚合物以及可增强或减弱荧光的聚合物.
2.1可自发荧光的聚合物及其在信号转换中的应用
可自发荧光的聚合物在与目标物的相互作用过程中,其荧光性质发生变化,从而实现信号的转换输出.本文以荧光共轭聚合物为例进行介绍.荧光共轭聚合物的主链具有单键、双键或叁键交替结构[12,31,32],主链结构中的π电子共轭体系提供了电子和空穴迁移的路径,被称为“分子导线”,只要共轭聚合物上的一个荧光单元被猝灭,则整条聚合物链的荧光都会沿着共轭聚合物链以电子能量转移的形式被猝灭,从而引起荧光信号的超猝灭[33](图6).研究表明,电子能量转换可以传递130个单体甚至更多[33],有些荧光共轭聚合物还可以作为超灵敏的激光材料[34].所以荧光共轭聚合物具有良好的信号放大能力,作为一种高灵敏的荧光信号转换元件已被用于离子[35~38]、小分子[39]、生物大分子( DNA,RNA和蛋白质等)[40~44]和细胞[45~48]的灵敏检测.

Fig.6 Schematic diagram of signal transformation mechanism of the conjugated polymers[33]Copyright( 2013) from American Chemical Society.
对空气中爆炸物的检测在反恐和军事等领域具有非常重要的意义,利用线性荧光共轭聚合物已经实现了三硝基甲苯( TNT)等爆炸物的检测[33],是荧光共轭聚合物应用于分析检测领域最成功的例子.三亚甲基三硝胺( RDX,也称黑索金)是一种高能炸药,挥发性能比TNT低1000倍,应用经典的线性荧光共轭聚合物无法检测.Gopalakrishnan等[49]通过交联聚乙炔得到网状荧光共轭聚合物,发现其信号放大能力优于线性共轭聚合物,通过RDX对其荧光的超猝灭作用实现了空气中RDX的高灵敏检测(图7).

Fig.7 Direct detection of RDX vapor using a conjugated polymer network[49]Copyright( 2013) from American Chemical Society.
阳离子荧光共轭聚合物是一种带正电荷的共轭聚合物,因其可以通过静电作用与带负电荷的DNA探针相互作用而得到广泛应用.2002年,Bazan等[50]首次基于聚芴与中性的肽核酸( PNA)之间的荧光共振能量转移( FRET)发展了DNA的检测方法,通过FRET可导致荧光素的发光强度达到直接激发时的25倍以上,从而使对目标DNA的检出限达到10 pmol/L.Nilsson等[51]在静电力的基础上引入氢键力,利用两性聚噻吩与单链、双链DNA相互作用时静电作用力和氢键力的不同使聚噻吩构型发生变化,引起其荧光强度和最大发射波长变化,从而实现DNA的检测.王树等[52]利用聚芴与荧光基团之间以及荧光基团与DNA链嵌入性荧光染料之间的2次FRET,实现了DNA的高特异性和高灵敏检测.此外,王树等[12]还利用聚芴结合核酸工具酶,实现了DNA单碱基错配、DNA甲基化和DNA损伤的检测.Liu等[53]通过点击化学反应在红色荧光共轭聚合物的侧链上引入聚乙二醇( PEG)以增加其水溶性和荧光量子产率,降低非特异性团聚以及消除与细胞的非特异性结合,并进一步通过在侧链上引入叶酸得到可与肿瘤细胞特异性结合的荧光探针.
2.2可诱导产生荧光的聚合物及其在信号转换中的应用
可诱导产生荧光的聚合物本身不发射荧光,但是可以作为模板诱导生成荧光纳米颗粒,从而实现信号的转换,利用这类聚合物作为信号转换单元避免了探针的标记,降低了分析成本[54~72].以核酸和含胺基等的聚合物为例对其信号转换机制及应用进行概述.
核酸可以作为模板诱导荧光纳米材料的生成,从而实现信号转换.研究较多的主要有DNA稳定的荧光银纳米簇和由单/双链DNA为模板制备的荧光铜纳米颗粒.2004年,Dickson等[58]首次以DNA为模板合成了银纳米簇.银纳米簇具有高达30%的量子产率,为其用于细胞成像提供了有力支持.本课题组[73]设计了银纳米簇-核酸适配体探针用于肿瘤细胞的检测和成像.Rotaru等[74]首次以双链DNA为模板合成了荧光铜纳米颗粒( CuNPs),而单链DNA以及三链DNA不能有效地合成荧光CuNPs.2013年,本课题组[75]发现富T核酸单链可以作为模板合成荧光CuNPs(图8).通过将富T核酸链固定在琼脂糖凝胶中,做成“水凝胶试纸”,实现了水样中铜离子的检测( LOD=20 μmol/L).该方法可以避免水样中酶的影响,能够满足国际组织对饮用水中铜离子安全上限的检测要求[76].因具有易合成、分散性好以及优良的光谱性质等特点,使得CuNPs受到了广泛关注,已应用于离子、核酸酶和核酸等的检测[77~84].

Fig.8 Poly( thymine) -templated selective formation of fluorescent copper nanoparticles[75]Copyright( 2013) from Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim.
胺基等基团对许多贵金属离子如铂离子、银离子有很强的配位能力,所以含胺基等基团的聚合物常用于贵金属纳米簇的合成[54,56,57,65,85].由于具有易合成、分散性好以及优良的光谱性质等特点,以含胺基等基团的聚合物为模板的贵金属纳米簇已经用于硫化物等的检测[86].
2.3可增强或猝灭荧光的聚合物及其在信号转换中的应用
虽然鲜腐竹、鲜豆皮的口感美味,但易腐烂变坏并招蝇虫,有些商家会用甲醛浸泡以保持新鲜,颜色鲜亮。生蔬菜品要细查,在涮食前,应仔细检查蔬菜的色泽和新鲜程度,并确保已清洗干净再放入锅内。
有些聚合物本身没有荧光,也不能诱导荧光物质的合成,但是其存在会影响其它分子的荧光性质(荧光强度和荧光光谱等),这类聚合物在荧光分析方法中也有一些应用.
环糊精聚合物是含有多个环糊精单体的高分子聚合物,不仅保持了环糊精单体的包络识别功能,还具有溶解度增大、稳定性增强、交联剂效应及多价结合效应等优点,并且具有显著的荧光增强能力[87,88].最近,本课题组[27,88~90]利用环糊精聚合物的增敏作用开展了一系列工作,发现β-环糊精聚合物可使标记在单链DNA上芘的荧光增强10倍以上,并将此现象用于DNA的检测[88].其原理如图9所示.DNA探针( Py3-probe)上的芘与β-环糊精聚合物发生相互作用,导致荧光显著增强,当有互补序列的目标DNA存在时,Py3-probe与目标DNA互补形成双链,由于DNA双链结构的刚性和空间位阻使标记在碱基上的芘脱离β-环糊精聚合物的空腔,致使探针荧光信号降低,从而实现了目标DNA的灵敏检测.
其它聚合物(如核酸)与核酸嵌入型染料如溴化乙锭( EB)[91~93],SYBR Gold和SYBR GreenⅡ[60,71]等结合后,可以增强染料的荧光.Zheng等[91]利用SYBR Gold嵌入核酸,结合目标物对核酸适配体的酶切保护作用,发展了一种免标记的通用型荧光分析方法用于离子、蛋白质和小分子的检测.带负电荷的聚合物可使苝聚集,导致其荧光猝灭[94~96].Liao等[94]利用此现象发展了乙酰胆碱脂酶的荧光检测方法; Wang等[95]利用带负电荷的核酸存在下苝的聚集猝灭现象实现了溶菌酶的检测.
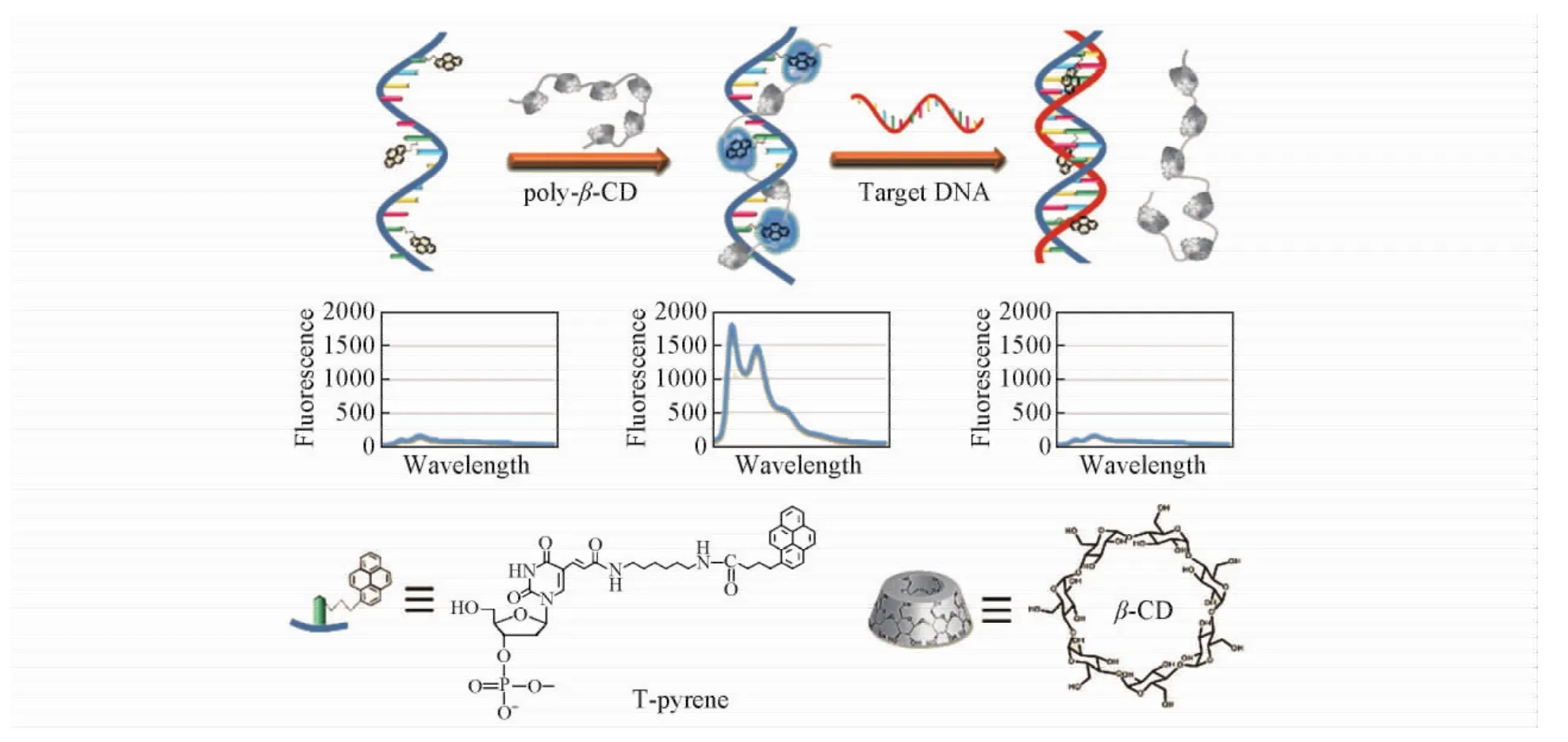
Fig.9 Competitive host-guest interaction( CHGI) between β-cyclodextrin polymer and pyrene-labeled probes for fluorescence analyses[88]Copyright( 2015) from American Chemical Society.
3 聚合物作为骨架构建的荧光传感探针
近年来,聚合物作为荧光传感探针骨架的研究是生物分析领域一个非常值得关注的课题.Li等[9]利用聚合物两亲型嵌段聚合物作为骨架,构建了一种集多种成像和治疗功能于一体的纳米颗粒.以聚合物为骨架构建的荧光传感探针克服了单独染料分子在应用中存在的易聚集、光散射干扰及光漂白等缺点[97,98],体现出如下优点: ( 1)多价结合[11,99],以聚合物作为骨架的传感探针具有多个结合位点,提高了与目标分子的结合常数和检测灵敏度; ( 2)信号放大作用[11,99],以聚合物为骨架的荧光传感探针包含大量荧光基团,灵敏度比传统方法有显著提高; ( 3)光学稳定性好[97,98],以聚合物为骨架构建的传感探针的光学稳定性比单独染料分子明显提高; ( 4)易于修饰[97,98],聚合物上可以引入不同的活性基团,如氨基、羧基或者巯基等,以满足不同的生物功能化需求; ( 5)生物相容性得到改善[97,98],因为聚合物作为骨架可以在一定程度上隔绝染料分子与细胞的直接接触; ( 6)实现多目标物检测[100],其原因是可以在聚合物上修饰多个识别单元.
目前,以聚合物作为骨架的聚合物荧光传感探针的构建主要有2种方式:一种是通过化学接枝法将染料分子和功能基团修饰在聚合物的侧链上;另一种是通过超分子自组装形成荧光传感探针.
3.1通过接枝法构建的聚合物荧光传感探针
通过接枝法可以将多个功能基团和识别单元通过共价键连接在聚合物的侧链上.如Yang等[99](图10)通过丙烯酰胺聚合的方法构建了侧链上连接有多个sgc8( CEM细胞的核酸适配体)和荧光基团的聚丙烯酰胺聚合物.此探针对CEM细胞及其耐药细胞具有非常好的识别能力,能通过聚合物本身的毒性杀伤目标细胞,并且侧链上的多个荧光基团可以将识别信号转换为荧光信号.该工作通过聚合物接枝法实现了人急性淋巴细胞白血病的诊疗一体化,是以聚合物作为传感探针骨架的典型应用.
此外,通过接枝法还可在聚合物侧链上连接多个功能基团以实现多种功能的一体化,提高荧光传感探针的生物相容性等.如Zeng等[11]通过胱氨酸与赖氨酸聚合得到多肽聚合物骨架,然后在侧链上连接有疏水基团和亲水基团以及pH敏感基团,得到一种树枝状聚合物传感探针,并用于miRNA的传输.此聚合物传感探针是由天然氨基酸聚合而成,具有良好的生物相容性和可降解性.研究[11]还发现疏水基团和亲水基团的引入有利于细胞的吞噬,通过pH敏感基团还可以进行细胞内pH传感.
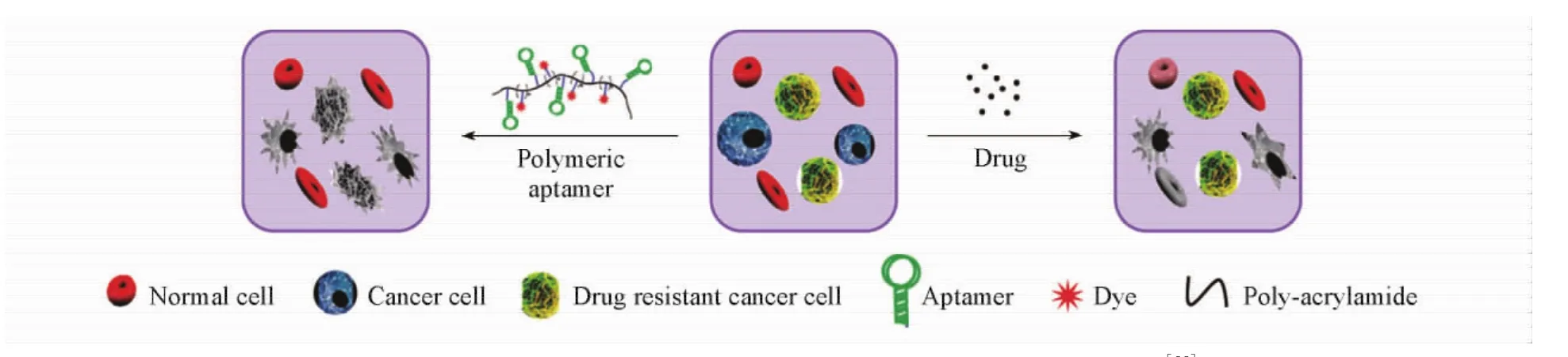
Fig.10 Engineering polymeric aptamers for selective cytotoxicity[99]Copyright( 2011) from American Chemical Society.
3.2通过超分子自组装构建的聚合物荧光传感探针
共价接枝法构建聚合物荧光传感探针通常反应条件苛刻,需要多步化学合成及复杂的后续纯化处理.通过超分子自组装来构建传感探针可以克服上述缺点,因为聚合物和功能团之间一般通过弱相互作用力(如氢键、范德华力,固体中的紧密堆积、疏水效应及π-π堆积)结合.超分子聚合物荧光传感探针还具有刺激响应性和可逆性等优势,在荧光传感、药物输送和治疗等领域具有一定的优势.
Li等[9]利用两亲型嵌段聚合物的自组装,构建了基于卟啉的诊疗一体化的多功能纳米颗粒(图11).该两亲型嵌段聚合物的亲水端为聚乙二醇( PEG),疏水端以赖氨酸为树枝状骨架,焦脱镁叶绿酸a和胆酸为端点.该聚合物在水溶液中形成约20 nm的纳米颗粒,可以吸收红外区的光,具有光热治疗( PTT)和光动力学治疗( PDT)的能力.由于此纳米颗粒为自组装形成,在细胞内两亲型嵌段聚合物分散开,使原本聚集猝灭的近红外荧光恢复,因此不仅可以在低背景下进行肿瘤的近红外荧光成像( NIRFI),而且分散开后用于化疗的药物可以更好地作用于细胞.此外,焦脱镁叶绿酸a的卟啉基团还可与Cu2+,Pd2+,Gd3+和Ga3+络合,使得这种纳米颗粒具有磁共振成像( MRI)和正电子放射成像( PET)的功能.此方法充分利用了可逆自组装的优势,获得了具有多种模式的诊疗一体化纳米颗粒.
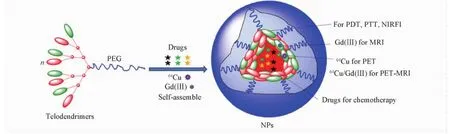
Fig.11 A smart and versatile theranostic nanomedicine platform based on nanoporphyrin[9]Copyright( 2014) from Nature Publishing Group.
本课题组[101]利用β-环糊精聚合物与2种荧光染料金刚烷-罗丹明B/金刚烷-荧光素之间的主-客体相互作用,构建了一种粒径为30 nm的比率型荧光纳米探针,并用于细胞内pH的检测(图12).此纳米探针由环糊精构成,具有良好的水溶性和生物相容性,易于被细胞吞噬;并且金刚烷-罗丹明B对pH不敏感,而金刚烷-荧光素的荧光受pH影响,通过2种染料荧光强度的比率可以实现细胞内pH的检测.Yan等[102,103]则利用β-环糊精聚合物与双光子荧光染料DEASPI自组装构建了粒径约为50 nm的胶束,该胶束结合了环糊精聚合物和双光子荧光染料的优点,可以避免体系自发荧光的干扰,已用于肿瘤组织染色和细胞内Caspase-3的检测.
综上所述,与单独染料相比,利用聚合物作为骨架构建的荧光传感探针具有多价结合、信号放大、光学稳定性好、易修饰、生物相容性好、多目标物同时检测以及多功能一体化等优势;并且通过自组装构建的聚合物荧光传感探针具有刺激响应性和可逆性,可用于生物体内的刺激响应、靶向传输及可控释放,在分析检测和生物医学等领域有望得到广泛应用.
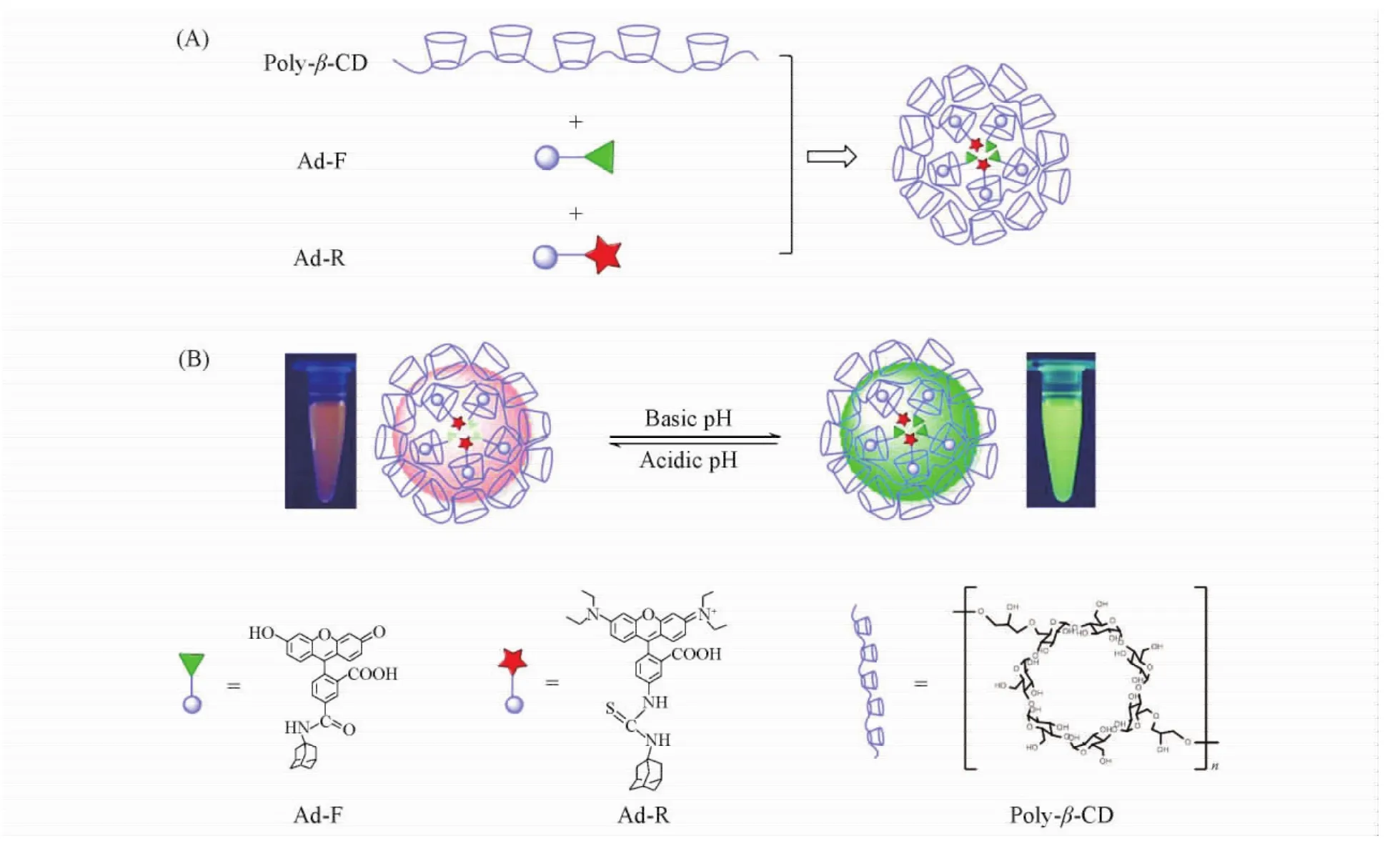
Fig.12 Self-assembled supramolecular nanoprobes for ratiometric fluorescence measurement of intracellular pH values[101]Copyright( 2015) from American Chemical Society.
4 结论与展望
虽然聚合物在保持单体性质的同时,还因聚合后单体之间的协同作用,在分子识别、信号转换及多功能探针构建等方面表现出特有的优势,是荧光检测领域广泛应用的基础材料,但是目前仍然存在一些问题和挑战,需要在未来的研究工作中加以重视: ( 1)目前获得可识别目标物的聚合物(如分子印迹聚合物和核酸适配体)的过程繁琐、费时,为了更方便快捷地得到可识别相应目标物的聚合物,需要在分子水平上深入解析聚合物相关的分子识别机制和信号转换机制; ( 2)将某些聚合物如分子印迹聚合物由有机相转移至水相,提高水溶性,使其识别能力与抗体相当; ( 3)发展生物相容性好、易于合成修饰的新型聚合物材料,为荧光检测领域的发展提供更多的材料基础; ( 4)拓展聚合物荧光分析的目标物范围,从小分子、蛋白甚至到活细胞,使聚合物在荧光检测领域的应用越来越广泛,成为实际的通用方法[12,14,16,53].
参考文献
[1]Nicholson J.W.,The Chemistry of Polymers,Translated by Fu Z.Y.,China Textile Press,Beijing,2005,1—2(付中玉[译].聚合物化学,北京:中国纺织出版社,2005,1—2)
[2]Ma D.Z.,He P.S.,Xu Z.D.,Structure and Performance of High Polymer,Science Press,Beijing,1981,551—552(马德柱,何平笙,徐仲德.高聚物的结构和性能,北京:科学出版社,1981,551—552)
[3]Mascini M.,Aptamers in Bioanalysis,Translated by Qu F.et al.,Chemical Industry Press,Beijing,2010,1—5(屈锋等[译].生物分析中的核酸适配体,北京:化学工业出版社,2010,1—5)
[4]Pauling L.,J.Am.Chem.Soc.,1940,62,2643—2657
[5]Wulff G.,Sarhan A.,Zabrocki K.,Tetrahedron Lett.,1973,14,4329—4332
[6]Vlatakis G.,Andersson L.I.,Muller R.,Mosbach K.,Nature,1993,361,645—647
[7]Zhou Q.,Swager T.M.,J.Am.Chem.Soc.,1995,117,7017—7018
[8]Zhou Q.,Swager T.M.,J.Am.Chem.Soc.,1995,117,12593—12602
[9]Li Y.,Lin T.Y.,Luo Y.,Liu Q.,Xiao W.,Guo W.,Lac D.,Zhang H.,Feng C.,Wachsmann-Hogiu S.,Walton J.H.,Cherry S.R.,Rowland D.J.,Kukis D.,Pan C.,Lam K.S.,Nat.Commun.,2014,5,5712—5718
[10]Schirhagl R.,Anal.Chem.,2014,86,250—261
[11]Zeng H.X.,Little H.,Tiambeng T.,Williams G.,Guan Z.B.,J.Am.Chem.Soc.,2013,135,4962—4965
[12]Duan X.,Liu L.,Feng F.,Wang S.,Acc.Chem.Res.,2010,43,260—270
[13]Hermann T.,Patel D.J.,Science,2000,287,820—825
[14]Liu J.,Cao Z.,Lu Y.,Chem.Rev.,2009,109,1948—1998
[15]Yan H.,Yu H.W.,Wei W.,Functional Polymer,Chemical Industry Press,Beijing,2013,92—100(晏欣,余红伟,魏徵.功能聚合物,北京:化学工业出版社,2013,92—100)
[16]Chen L.,Xu S.,Li J.,Chem.Soc.Rev.,2011,40,2922—2942
[17]Jiang Z.Y.,Wu H.,Molecular Imprinting Technology,Chemical Industry Press,Beijing,2003,1—40(姜忠义,吴洪.分子印迹技术,北京:化学工业出版社,,2003,1—40)
[18]Komiyama M.,Takecuchi T.,Mukawa T.,Asanuma H.,Molecular Imprinting from Fundamentals to Applications,Translated by Wu S.K.,Wang P.F.,Science Press,Beijing,2006,1—29(吴世康,汪鹏飞[译].分子印迹学从基础到应用,北京:科学出版社,2006,1—29)
[19]Xu S.F.,Lu H.Z.,Li J.H.,Song X.L.,Wang A.X.,Chen L.X.,Han S.B.,ACS Appl.Mater.Interfaces,2013,5,8146—8154
[20]Liu C.B.,Song Z.L.,Pan J.M.,Yan Y.S.,Cao Z.J.,Wei X.,Gao L.,Wang J.,Dai J.D.,Meng M.J.,Yu P.,Talanta,2014,125,14—23
[21]Cheng Y.,Jiang P.,Dong X.,RSC Adv.,2015,5,55066—55074
[22]Liu X.Y.,Fang H.X.,Yu L.P.,Talanta,2013,116,283—289
[23]Fang X.,Tan W.,Acc.Chem.Res.,2010,43,48—57
[24]Ellington A.D.,Szostak J.W.,Nature,1990,346,818—822
[25]Proske D.,Blank M.,Buhmann R.,Resch A.,Appl.Microbiol.Biotechnol.,2005,69,367—374
[26]Tasset D.M.,Kubik M.F.,Steiner W.,J.Mol.Biol.,1997,272,688—698
[27]Song C.,Yang X.,Wang K.,Wang Q.,Liu J.,Huang J.,He L.,Liu P.,Qing Z.,Liu W.,Chem.Commun.,2015,51,1815—1818
[28]Shi H.,He X.X.,Wang K.M.,Wu X.,Ye X.S.,Guo Q.P.,Tan W.H.,Qing Z.H.,Yang X.H.,Zhou B.,Proc.Nalt.Acad.Sci.USA,2011,108,3900—3905
[29]Tang Z.W.,Mallikaratchy P.,Yang R.H.,Kim Y.M.,Zhu Z.,Wang H.,Tan W.H.,J.Am.Chem.Soc.,2008,130,11268—11269
[30]Tan Y.,Guo Q.,Zhao X.,Yang X.,Wang K.,Huang J.,Zhou Y.,Biosens.Bioelectron.,2014,51,255—260
[31]Ahn D.J.,Kim J.M.,Acc.Chem.Res.,2008,41,805—816
[32]Ho H.A.,Najari A.,Leclerc M.,Acc.Chem.Res.,2008,41,168—178
[33]Rochat S.,Swager T.M.,ACS Appl.Mater.Interfaces,2013,5,4488—4502
[34]Rose A.,Zhu Z.,Madigan C.F.,Swager T.M.,Bulovic V.,Nature,2005,434,876—879
[35]Rochat S.,Swager T.M.,Angew.Chem.Int.Ed.,2014,53,9792—9796
[36]Huang H.,Shi F.P.,Li Y.N.,Niu L.,Gao Y.,Shah S.M.,Su X.G.,Sens.Act.B,Chem.,2013,178,532—540
[37]Hong T.,Wang T.,Guo P.,Xing X.,Ding F.,Chen Y.,Wu J.,Ma J.,Wu F.,Zhou X.,Anal.Chem.,2013,85,10797—10802
[38]Huang H.,Wang K.,Tan W.,An D.,Yang X.,Huang S.,Zhai Q.,Zhou L.,Jin Y.,Angew.Chem.Int.Ed.,2004,43,5635—5638
[39]Dedeoglu B.,Monari A.,Etienne T.,Aviyente V.,özen A.S.,J.Phys.Chem.C,2014,118,23946—23953
[40]Wang C.,Tang Y.,Liu Y.,Guo Y.,Anal.Chem.,2014,86,6433—6438
[41]Wang C.,Tang Y.,Guo Y.,ACS Appl.Mater.Interfaces,2014,6,21686—21691
[42]Seo S.,Kim J.,Jang G.,Kim D.,Lee T.S.,ACS Appl.Mater.Interfaces,2014,6,918—924
[43]Rush A.M.,Nelles D.A.,Blum A.P.,Barnhill S.A.,Tatro E.T.,Yeo G.W.,Gianneschi N.C.,J.Am.Chem.Soc.,2014,136,7615—7618
[44]Xie Y.,Zhao R.,Tan Y.,Zhang X.,Liu F.,Jiang Y.,Tan C.,ACS Appl.Mater.Interfaces,2012,4,405—410
[45]Huang Y.,Yao X.,Zhang R.,Ouyang L.,Jiang R.,Liu X.,Song C.,Zhang G.,Fan Q.,Wang L.,Huang W.,ACS Appl.Mater.Interfaces,2014,6,19144—19153
[46]Nie C.,Zhu C.,Feng L.,Lv F.,Liu L.,Wang S.,ACS Appl.Mater.Interfaces,2013,5,4549—4554
[47]Li J.,Tian C.,Yuan Y.,Yang Z.,Yin C.,Jiang R.,Song W.,Li X.,Lu X.,Zhang L.,Fan Q.,Huang W.,Macromolecules,2015,48,1017—1025
[48]Bao Y.,de Keersmaecker H.,Corneillie S.,Yu F.,Mizuno H.,Zhang G.,Hofkens J.,Mendrek B.,Kowalczuk A.,Smet M.,Chem.Mater.,2015,27,3450—3455
[49]Gopalakrishnan D.,Dichtel W.R.,J.Am.Chem.Soc.,2013,135,8357—8362
[50]Gaylord B.S.,Heeger A.J.,Bazan G.C.,Proc.Nalt.Acad.Sci.USA,2002,99,10954—10957
[51]Nilsson K.P.R.,Inganas O.,Nat.Mater.,2003,2,419—424
[52]Wang S.,Gaylord B.S.,Bazan G.C.,J.Am.Chem.Soc.,2004,126,5446—5451
[53]Pu K.Y.,Li K.,Liu B.,Adv.Funct.Mater.,2010,20,2770—2777
[54]Zheng J.,Zhang C.,Dickson R.M.,Phys.Rev.Lett.,2004,93,077402
[55]Yeh H.C.,Sharma J.,Han J.J.,Martinez J.S.,Werner J.H.,Nano Lett.,2010,10,3106—3110
[56]Zheng J.,Petty J.T.,Dickson R.M.,J.Am.Chem.Soc.,2003,125,7780—7781
[57]Zheng J.,Dickson R.M.,J.Am.Chem.Soc.,2002,124,13982—13983
[58]Petty J.T.,Zheng J.,Hud N.V.,Dickson R.M.,J.Am.Chem.Soc.,2004,126,5207—5212
[59]Guo W.,Yuan J.,Dong Q.,Wang E.,J.Am.Chem.Soc.,2010,132,932—934
[60]Xiao S.J.,Hu P.P.,Xiao G.F.,Wang Y.,Liu Y.,Huang C.Z.,J.Phys.Chem.B,2012,116,9565—9569
[61]Seidel C.A.M.,Schulz A.,Sauer M.H.M.,J.Phys.Chem.,1996,100,5541—5553
[62]Lee J.,Park J.,Lee H.H.,Kim H.I.,Kim W.J.,J.Mater.Chem.B,2014,2,2616—2621
[63]Shang L.,Dong S.,J.Mater.Chem.,2008,18,4636—4640
[64]Shang L.,Dong S.,Chem.Commun.,2008,7,1088—1090
[65]Tanaka S.,Miyazaki J.,Tiwari D.K.,Jin T.,Inouye Y.,Angew.Chem.Int.Ed.,2011,50,431—435
[66]Torimura M.,Kurata S.,Yamada K.,Yokomaku T.,Kamagata Y.,Kanagawa T.,Kurane R.,Anal.Sci.,2001,17,155—160
[67]Yang X.,Zhu Y.,Liu P.,He L.,Li Q.,Wang Q.,Wang K.,Huang J.,Liu J.,Anal.Methods,UK,2012,4,895—897
[68]Hu Y.,Wu Y.,Chen T.,Chu X.,Yu R.,Anal.Methods,UK,2013,5,3577—3581
[69]Zhang Z.,Sharon E.,Freeman R.,Liu X.,Willner I.,Anal.Chem.,2012,84,4789—4797
[70]Yin J.,He X.,Wang K.,Xu F.,Shangguan J.,He D.,Shi H.,Anal.Chem.,2013,85,12011—12019
[71]Cao A.P.,Zhang C.Y.,Anal.Chem.,2012,84,6199—6205
[72]Wang L.,Tian J.Q.,Li H.L.,Zhang Y.W.,Sun X.P.,Analyst,2011,136,891—893
[73]Yin J.,He X.,Wang K.,Qing Z.,Wu X.,Shi H.,Yang X.,Nanoscale,2012,4,110—112
[74]Rotaru A.,Dutta S.,Jentzsch E.,Gothelf K.,Mokhir A.,Angew.Chem.Int.Ed.,2010,49,5665—5667
[75]Qing Z.,He X.,He D.,Wang K.,Xu F.,Qing T.,Yang X.,Angew.Chem.Int.Ed.,2013,52,9719—9722
[76]Qing Z.,Mao Z.,Qing T.,He X.,Zou Z.,He D.,Shi H.,Huang J.,Liu J.,Wang K.,Anal.Chem.,2014,86,11263—11268
[77]Xu F.,Shi H.,He X.,Wang K.,He D.,Guo Q.,Qing Z.,Yan L.A.,Ye X.,Li D.,Tang J.,Anal.Chem.,2014,86,6976—6982
[78]Zhang L.,Zhao J.,Duan M.,Zhang H.,Jiang J.,Yu R.,Anal.Chem.,2013,85,3797—3801
[79]Zhou Z.,Du Y.,Dong S.,Anal.Chem.,2011,83,5122—5127
[80]Hu R.,Liu Y.,Kong R.,Donovan M.J.,Zhang X.,Tan W.,Shen G.,Yu R.,Biosens.Bioelectron.,2013,42,31—35
[81]Chen J.,Liu J.,Fang Z.,Zeng L.,Chem.Commun.,2012,48,1057—1059
[82]Wang X.P.,Yin B.C.,Ye B.C.,RSC Adv.,2013,3,8633—8636
[83]Qing Z.H.,He X.X.,Qing T.P.,Wang K.M.,Shi H.,He D.G.,Zou Z.,Yan L.,Xu F.Z.,Ye X.S.,Mao Z.G.,Anal.Chem.,2013,85,12138—12143
[84]Jia X.,Li J.,Han L.,Ren J.,Yang X.,Wang E.,ACS Nano,2012,6,3311—3317
[85]Yuan Z.Q.,Polyethyleneimine Assisted Synthesis of Fluorescent Gold/Silver Nanomaterials and Their Applications,Hunan University,Changsha,2013,70—85(袁智勤.聚乙烯亚胺辅助的荧光金、银纳米材料的合成及应用研究,长沙:湖南大学,2013,70—85)
[86]Yuan Z.,Peng M.,Shi L.,Du Y.,Cai N.,He Y.,Chang H.T.,Yeung E.S.,Nanoscale,2013,5,4683—4686
[87]Hollas M.,Chung M.A.,Adams J.,J.Phys.Chem.B,1998,102,2947—2953
[88]Liu P.,Sun S.,Guo X.,Yang X.,Huang J.,Wang K.,Wang Q.,Liu J.,He L.,Anal.Chem.,2015,87,2665—2671
[89]Guo X.,Liu P.,Yang X.,Wang K.,Wang Q.,Guo Q.,Huang J.,Liu J.,Song C.,Li W.,Analyst,2015,140,2016—2022
[90]Guo X.,Yang X.,Liu P.,Wang K.,Wang Q.,Guo Q.,Huang J.,Li W.,Xu F.,Song C.,Analyst,2015,140,4291—4297
[91]Zheng D.,Zou R.,Lou X.,Anal.Chem.,2012,84,3554—3560
[92]Pomerantz A.K.,Moerner W.E.,Kool E.T.,J.Phys.Chem.B,2008,112,13184—13187
[93]Oba S.,Hatakeyama M.,Handa H.,Kawaguchi H.,Bioconjugate Chem.,2005,16,551—558
[94]Liao D.L.,Chen J.,Zhou H.P.,Wang Y.,Li Y.X.,Yu C.,Anal.Chem.,2013,85,2667—2672
[95]Wang B.,Yu C.,Angew.Chem.Int.Ed.,2010,49,1485—1488
[96]Wurthner F.,Chen Z.,Dehm V.,Stepanenko V.,Chem.Commun.,2006,37,1188—1190
[97]Zhu G.,Zhang S.,Song E.,Zheng J.,Hu R.,Fang X.,Tan W.,Angew.Chem.Int.Ed.,2013,52,5490—5496
[98]Zhu G.,Zheng J.,Song E.,Donovan M.,Zhang K.,Liu C.,Tan W.,Proc.Nalt.Acad.Sci.USA,2013,110,7998—8003
[99]Yang L.,Meng L.,Zhang X.,Chen Y.,Zhu G.,Liu H.,Xiong X.,Sefah K.,Tan W.,J.Am.Chem.Soc.,2011,133,13380—13386
[100]Balamurugan A.,Lee H.I.,Macromolecules,2015,48,3934—3940
[101]He L.,Yang X.,Zhao F.,Wang K.,Wang Q.,Liu J.,Huang J.,Li W.,Yang M.,Anal.Chem.,2015,87,2459—2465
[102]Yan H.,He L.,Ma C.,Li J.,Yang J.,Yang R.,Tan W.,Chem.Commun.,2014,50,8398—8401
[103]Yan H.,He L.,Zhao W.,Li J.,Xiao Y.,Yang R.,Tan W.,Anal.Chem.,2014,86,11440—11450
Application of Polymers in Fluorescence Analysis†
SONG Chunxia,YANG Xiaohai*,WANG Kemin*,WANG Qing,LIU Jianbo,
HUANG Jin,LI Wenshan,HUANG Haihua,LIU Wei
( State Key Laboratory of Chemo/Biosensing and Chemometrics,College of Chemistry and Chemical Engineering,Key Laboratory for Bio-Nanotechnology and Molecular Engineering of Hunan Province,Hunan University,Changsha 410082,China)
Abstract Polymers are macromolecular compounds built up from single or numerous kinds of monomers.The common materials in production and living( for example protein,nucleic acid,starch,fiber,plastic and rubber,etc.) are included in this category.Owing to the unique properties after polymerization and their monomers,polymers have been extensively used in fluorescence analysis as fundamental materials: target recognition can be realized through polymers interact with target molecules through intermolecular forces ( hydrogen bond,hydrophilic and hydrophobic function,and van der Waals’force,etc.) ; certein polymers can transform the molecular recognition event to easily recognizable fluorescence signal,and then fluorescence signal transformation and amplification could be realized; certein polymers have been used as framework of flourescence probes,therefore the recognition capacity of fluorescence probes are improved due to multivalency effect,and multifunction devices are constructed based on the conjugation of different functional units.In this paper,the research and application of polymers in molecular recognition,signal transformation and as framework of probes were reviewed.
KeywordsPolymer; Fluorescence analysis; Molecular recognition; Signal transduction; Framework of fluorescence probe
( Ed.: N,K)
†Supported by the National Natural Science Foundation of China( Nos.21190044,21175035) and the National Basic Research Program of China( No.2011CB911002).
基金项目:国家自然科学基金(批准号: 21190040,21175035)和国家“九七三”计划项目(批准号: 2011CB911002)资助.
收稿日期:2015-10-15.网络出版日期: 2016-01-14.
doi:10.7503/cjcu20150796
中图分类号O652
文献标志码A
联系人简介:羊小海,男,博士,教授,博士生导师,主要从事核酸分子探针及生物传感器的研究.
