牛乳κ-酪蛋白活性多肽及其改造肽的合成和生物活性
2016-02-25王小青赵红玲宫闻婧尹志峰王良友
王小青,赵红玲,高 杨,宫闻婧,尹志峰,王良友
(1.承德医学院 河北省中药研究与开发重点实验室,河北 承德 067000;
2.承德天创生物制品有限公司,河北 承德 067000)
牛乳κ-酪蛋白活性多肽及其改造肽的合成和生物活性
王小青1,赵红玲1,高杨1,宫闻婧2,尹志峰1,王良友1
(1.承德医学院 河北省中药研究与开发重点实验室,河北 承德 067000;
2.承德天创生物制品有限公司,河北 承德 067000)
摘要:为获得抗凝血活性更强的多肽,对牛乳κ-酪蛋白(κ-CN)的十一肽(f106-116)进行设计合成并改造,采用Fmoc固相合成策略,以Wang树脂为载体,Fmoc保护氨基酸为原料,HOBT/DIC为缩合剂,TFA/苯甲硫醚/EDT/苯甲醚裂解体系脱除保护基,经RP-HPLC纯化后得到了纯度>95%的9种多肽,经ESI-MS确证其结构。将所有的合成肽进行凝血酶时间(TT)、活化部分凝血活酶时间(APTT)以及凝血酶原时间(PT)活性测定,结果表明,各改造肽抗凝活性皆低于十一肽,增强牛乳κ-CN的十一肽片段的疏水性,其TT活性增强。
关键词:牛乳κ-酪蛋白活性多肽;固相合成;抗凝活性
近年来研究发现,食源性抗血栓肽主要来源于牛乳κ-酪蛋白(κ-CN)的水解产物[1],其中κ-CN十一肽MAIPPKKNQDK(f106-116)可抑制ADP诱导的血小板凝集及人血纤维蛋白原与血小板表面上特异受体的结合而具有抗血栓活性[2]。ditSollier等[3]发现五肽KNQDK(f112-116)对ADP诱导的血小板凝集的抑制作用较强,而MAIPPKK(f106-112)和NQDK(f113-116)抑制血小板功能的作用较弱,可能是由于其缺少N端的Lys残基。在激光损伤引发的动脉粥样硬化模型中检测到κ-CN十一肽和五肽在体内都具有潜在的抗血栓活性。Jolles等[4]从牛乳κ-CN的胰蛋白酶水解液中分离出短肽MAIPP(f106-110),可抑制人血纤维蛋白原结合到血小板表面的特异受体位点。Teschemacher等[5]证实片段KDQDK在豚鼠体内具有显著的抗血栓活性。
作者采用Fmoc固相合成策略合成了十一肽、五肽(KDQDK、KNQDK)、PKKNQDK、PPKKNQDK、IPPKKNQDK等6条短肽,并将Pro4替换成Phe4,设计合成了FPKKNQDK、IFPKKNQDK等2条改造肽。同时,D残基取代的肽可以有效地耐受蛋白酶降解作用[6],合成了(D)FPKKNQDK。对合成的十一肽及各改造肽进行凝血酶时间(TT)、活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)活性检测,拟为生物活性多肽药物的研发提供参考。
1实验
1.1 材料、试剂与仪器
固相合成载体Wang树脂(替代度为1.17mmol·g-1),天津南开合成科技有限公司;肽链中所有保护氨基酸,成都诚诺新技术有限公司;羟基苯并三氮唑(HOBT)、N,N′-二异丙基碳二亚胺(DIC),苏州中科天马肽工程中心有限公司;冰乙醚、三氟乙酸(TFA),天津风船化学试剂科技有限公司;哌啶、苯甲硫醚、间甲酚、苯甲醚,上海晶纯试剂有限公司;1,2-乙二硫醇(EDT),Sigma-Aldrich;N,N′-二甲基甲酰胺(DMF)、乙腈,天津科密欧化学试剂有限公司;二氯甲烷(DCM),天津博迪化工股份有限公司;超纯水,自制;雄性昆明小鼠[体重(20±2g),SCXK(京)2009-0004],北京华阜康生物科技有限公司;APTT、PT、TT试剂盒,美德太平洋科技有限公司。
XMTD-6000型恒温水浴锅,余姚上通温控仪器厂;Newstyle型反相高效半制备液相色谱仪,苏州汉邦科技有限公司;Ultimate3000/MSQ型戴安液相色谱-质谱联用仪,美国戴安公司;CHRIST型冻干机,北京博励行仪器有限公司;高速大容量离心机,上海安亭科学仪器厂;Agilent1200型高效液相色谱仪,安捷伦科技有限公司。
1.2 方法
1.2.1牛乳κ-CN活性肽及其改造肽的合成、纯化及鉴定
在洗净并干燥的反应柱中加入Wang树脂,加DMF通氮气溶胀30min,充分溶胀后抽掉DMF。称取4倍于树脂量的Fmoc-Lys(Boc)-OH、4倍于树脂量的DMAP∶HOBT∶DIC(0.1∶1.2∶1.2,物质的量比),溶于DMF,冰浴活化5min,加入反应柱中反应2h,茚三酮检测合格后,抽干,分别用DMF与DCM洗涤树脂,并进行替代度检测,加入20~40倍的醋酸酐与吡啶1∶1(物质的量比)混合液封闭14h。加入适量的DBLK溶液(20%哌啶DMF溶液)脱Fmoc保护基2次,时间分别为5min和7min,茚三酮检测合格后,用DMF和DCM分别洗涤树脂,抽干溶剂。按照上述方法延伸肽链直至连接完整条肽链。冲洗树脂,加甲醇收缩2次(5min·次-1),减压干燥至恒重,得干燥肽树脂。
称取干燥至恒重的肽树脂200.0mg,置于PE管中,加入裂解液TFA∶苯甲硫醚∶EDT∶苯甲醚(9∶0.5∶0.3∶0.2,体积比)2mL,冰浴反应30min,逐渐升至室温,于室温下反应1h。过滤,用少许TFA洗涤树脂,将滤液倾入20mL无水冰乙醚中,析出白色固体,0 ℃静置沉降20min。4 000r·min-1离心4min,弃去上清液,重复5次,真空干燥至恒重,得粗肽。
将粗肽用无氧水溶解,经半制备型RP-HPLC纯化得到纯度大于95%的多肽:半制备柱HederaODS-2反相硅胶柱(10mm×250mm,10 μm);检测波长215nm;采用乙腈/0.1%TFA水分离体系,流速8mL·min-1,乙腈25%~55%,洗脱时间30min。纯化后多肽经高效液相色谱分析,色谱柱KromasilC18(4.6mm×250mm,5 μm),以乙腈/水为分析体系(0.1%TFA), 乙腈5%~95%,流速1mL·min-1,20min梯度洗脱。纯化后多肽的分子量经ESI-MS分析确证。
牛乳κ-CN十一肽改造肽的合成、纯化及鉴定方法同上。
1.2.2TT、APTT及PT活性测定
1)空白血浆制备
小鼠眼眶静脉丛取血,按体积比9∶1加入含0.109 mol·L-1的枸橼酸钠抗凝剂,轻轻混合均匀。3 000 r·min-1离心15 min,制备乏血小板血浆(即空白血浆),备用。
2)待测样品制备
精密称取纯化后的多肽样品,超纯水溶解成2 mg·mL-1溶液,(37±0.1) ℃水浴中预温,备用。
3)TT活性测定
按照试剂盒说明,TT试剂加入复溶液复溶,用前颠倒混匀。取200μL空白血浆,加入预温的10μL多肽样品在37 ℃下预温3 min,加入200μL TT试剂并记录凝固时间,重复2次取平均值。
4)APTT活性测定
按照试剂盒说明,取100μL空白血浆,加入10μL多肽样品、100μL APTT试剂,37 ℃下预温5 min,再加入已预温至37 ℃的CaCl2溶液100μL,记录凝固时间,重复2次取平均值。
5)PT活性测定
按照试剂盒说明,取100μL空白血浆,加入10μL多肽样品在37 ℃下预温3 min,再加入已预温至37 ℃的PT试剂200μL,记录凝固时间,重复2次取平均值。
2结果与讨论
2.1 合成肽的氨基酸顺序及相对分子质量(表1)
表1合成肽的氨基酸顺序及相对分子质量
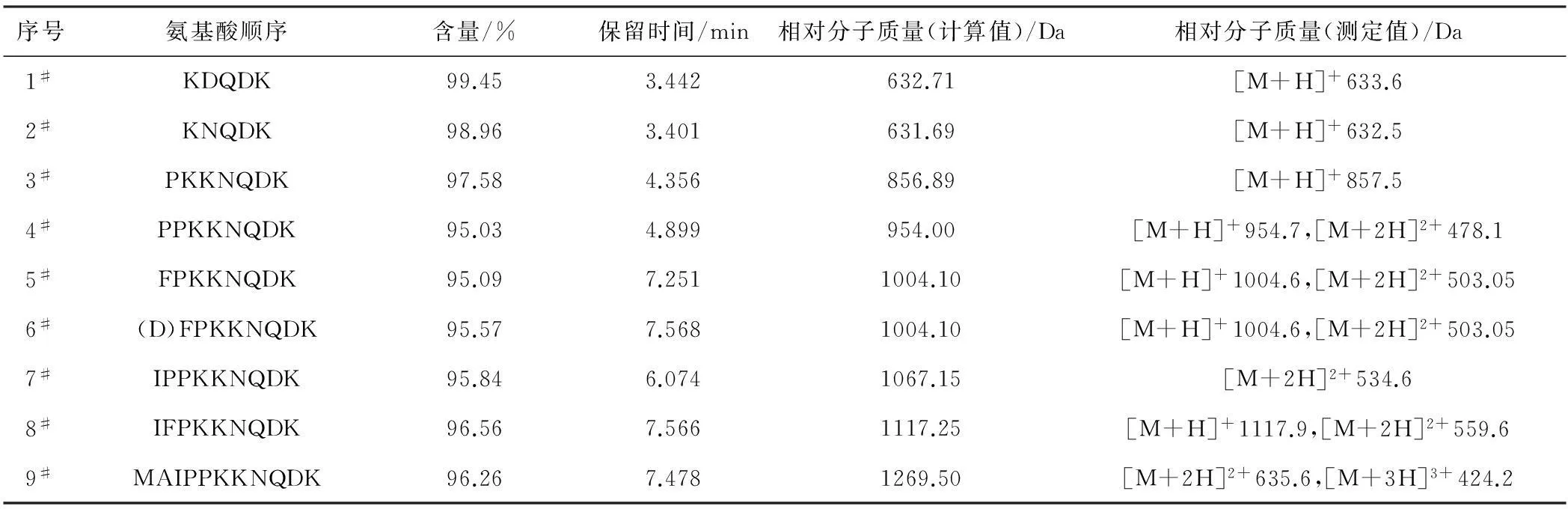
Tab.1 Amino acid sequence and relative molecular mass of the synthetic peptide
由表1可知,所合成的9个多肽化合物经RP-HPLC纯化后,各产物的HPLC纯度均大于95%。由ESI-MS结果可知,各多肽的[M+H]+峰测定值与计算值一致,[M+2H]2+与多肽带两个单位正电荷保持一致,确证了各个化合物的分子结构。
2.2 TT、APTT及PT活性的测定结果(表2)
表2TT、APTT 及PT活性的测定结果

Tab.2 The results of TT, APTT and PT activities
注:n=3;**P<0.05;***P<0.01。
由表2可知,短肽1#、2#和9#三条合成肽的TT活性与水相比有极显著性差异;短肽3#的TT活性与水相比有极显著性差异;短肽4#和7#的TT活性与水相比有显著性差异;而由疏水性强的Phe4代替疏水性次之的Pro4的短肽5#和8#的TT活性增强,与水相比有极显著性差异。同时各改造肽的TT活性皆低于十一肽及五肽。
短肽1#、2#、5#和6#的APTT活性与水相比有极显著性差异;短肽7#的APTT活性与水相比有显著性差异;田垒等[7]分别以Leu、Phe、Tyr及Ser改造多肽,增强整个分子的疏水性,从而提高了GⅢb/Ⅲa受体与该分子的疏水键强度,使得APTT活性增强。短肽5#、6#为Phe或D-Phe替换Pro的改造肽,增强了整个分子的疏水性,因而APTT活性增强。
十一肽、五肽以及其各改造肽与水相比,PT活性在统计学上没有显著性差异。
3结论
牛乳κ-酪蛋白五肽具有明显的TT活性和APTT活性,十一肽具有明显的TT活性,改造肽的抗凝活性皆低于十一肽,改造肽分子疏水性增强,其APTT活性增强。PT活性测定结果表明,牛乳κ-酪蛋白十一肽及其改造肽不是通过外源性途径抗血液凝聚。
参考文献:
[1]BEUCHER S,LEVENEZ F,YVON M,et al.Effects of gastric digestive products from casein on CCK release by intestinal cells in rat[J].The Journal of Nutritional Biochemistry,1994,5(12):578-584.
[2]JOLLES P,CAEN J P.Parallels between milk clotting and blood clotting:Opportunities for milk-derived products[J].Trends in Food Science & Technology,1991,2(1):42-43.
[3]dit SOLLIER C B,DROUET L,PIGNAUD G,et al.Effect ofκ-casein split peptides on platelet aggregation and on thrombus formation in the guinea-pig[J].Thrombosis Research,1996,81(4):427-437.
[4]JOLLES P,LOUCHEUX-LEFEBVRE M H,HENSCHEN A.Structural relatedness ofκ-casein and fibrinogenγ-chain[J].Journal of Molecular Evolution,1978,11(4):271-277.
[5]TESCHEMACHER H,KOCH G,BRANTL V.Milk protein-derived opioid receptor ligands[J].Biopolymers,1997,43(2):99-117.
[6]王德心.活性多肽与药物开发[M].北京:中国医药科技出版社,2008:77-80.
[7]田垒,霍建丽,王卫国,等.新的抗凝血三肽及其改造物的合成和生物活性[J].西北药学杂志,2009,24(3):191-194.
Synthesis and Bioactivity of Milkκ-Casein Active Peptides and Transformation Peptides
WANG Xiao-qing1,ZHAO Hong-ling1,GAO Yang1,GONG Wen-jing2,YIN Zhi-feng1,WANG Liang-you1
(1.HebeiKeyLaboratoryofResearchandDevelopmentforTraditionalChineseMedicine,ChengdeMedical
College,Chengde067000,China;2.ChengdeTianchuangBiologicalProductsCorporation,Chengde067000,China)
Abstract:In order to obtain peptides with higher anticoagulant activity,eleven peptide(f106-116) from milk κ-casein(κ-CN) and its transformations were successfully synthesized according to its peptide sequence using Wang resin as a solid supporter with Fmoc-amino acids as raw materials and HOBT/DIC as condensing agent.The peptide was cleaved from the resin with the reagent of TFA/thioanisole/EDT/anisole.After purified by RP-HPLC,9 peptides with the purity above 95% were obtained and confirmed by an ESI-MS.The TT,APTT and PT activities of all synthetic peptides were measured.The anticoagulant activity of transformation peptide was lower than that of eleven peptide,whilst the activity of TT was enhanced with the increase of hydrophobicity of eleven peptide from milk κ-CN.
Keywords:milk κ-casein active peptides;solid-phase synthesis;anticoagulant activity
中图分类号:Q 516O 623.736
文献标识码:A
文章编号:1672-5425(2016)01-0030-03
作者简介:王小青(1984-),女,河北承德人,助理研究员,研究方向:生物活性多肽药物的研发,E-mail:wangxqsmart@163.com;通讯作者:王良友,副教授。
收稿日期:2015-10-23
基金项目:河北省海外高层次人才“百人计划”资助项目(E201200002)
doi:10.3969/j.issn.1672-5425.2016.01.007
