脾气虚和脾阳虚模型大鼠空肠组织葡萄糖转运体5表达水平变化的实验研究
2016-02-20丛培玮王艳杰赵丹玉冯晓帆
尚 冰,丛培玮,王艳杰,赵丹玉,冯晓帆,张 林
脾气虚和脾阳虚模型大鼠空肠组织葡萄糖转运体5表达水平变化的实验研究
尚 冰,丛培玮,王艳杰,赵丹玉,冯晓帆,张 林
【摘要】目的建立脾气虚、脾阳虚模型,观察大鼠空肠组织葡萄糖转运体(GLUT)5表达水平变化,以探讨不同阶段脾虚能量代谢的实质与差异。方法2015年3—9月,选取SPF级雄性SD大鼠24只,按照随机数字表法分为对照组、脾气虚组、脾阳虚组,每组8只。脾气虚模型的建立采用饮食失节结合劳倦过度的原则,脾阳虚模型则在脾气虚的基础上施加苦寒泻下法建立。观察大鼠一般体征状态(体质量、体温、进食量等)、前肢抓力(肌力检测)、行为学变化(旷场实验)对模型进行评价。采用实时定量荧光聚合酶链式反应(RT-PCR)法测定GLUT5 mRNA表达水平,Western blotting法测定GLUT5表达水平。结果脾气虚组体质量、进食量、前肢抓力均低于对照组(P<0.05);脾阳虚组体质量、体温、进食量、前肢抓力均低于对照组(P<0.05);脾阳虚组体温低于脾气虚组(P<0.05)。脾气虚组中心区域、周边区域停留时间长于对照组,角落区域停留时间短于对照组(P<0.05);脾阳虚组中心区域、角落区域、周边区域停留时间均短于对照组、脾气虚组(P<0.05)。对照组、脾气虚组、脾阳虚组角落区域、周边区域停留时间均长于中心区域(P<0.05);脾气虚组、脾阳虚组周边区域停留时间长于角落区域(P<0.05)。脾气虚组、脾阳虚组GLUT5 mRNA、GLUT5表达水平低于对照组(P<0.05);脾阳虚组GLUT5 mRNA表达水平低于脾气虚组(P<0.05)。结论脾虚状态下,大鼠空肠组织GLUT5 mRNA及其蛋白表达水平均降低,这可能是脾气亏虚、能量代谢障碍的重要分子机制之一。
脾气虚和脾阳虚是脾虚不同的发展阶段。初期脾气虚后,常会累及脾脏阳气,产生虚寒症状,脾阳虚较脾气虚病情更加深入。脾胃因其“后天之本、气血生化之源”的地位,被认为是人体生命活动、能量来源的基础保障[1]。大量研究发现,人类摄入的碳水化合物大部分在小肠上皮被分解为单糖,通过小肠上皮吸收转运进入血循环,从而提供机体的绝大部分能量,其在体内代谢首先需要进入细胞,这一过程需要依赖一种葡萄糖转运体(glucose transporter,GLUT)来完成[2]。而这种吸收-转运-入血的简单过程却提供了绝大部分人体每日生存所必需的糖类物质[3]。目前,关于脾虚本质的研究诸多[4],但针对脾虚患者临床主要出现的思虑劳倦、精神气血日亏等一系列“神疲乏力”等能量代谢的脾虚本质探讨的相关报道鲜见。本研究以脾气虚、脾阳虚模型大鼠为载体,通过肌力检测和旷场实验对“神疲乏力”进行量化评价,同时通过观察不同模型大鼠空肠组织GLUT5表达水平,探讨不同阶段脾虚能量代谢的实质与差异,以期为脾虚的临床治疗提供新的靶点。
1材料与方法
1.1实验动物2015年3—9月,选取SPF级雄性SD大鼠24只〔由本溪实验动物中心提供,许可证号:SCXK(辽)2010-0001〕,体质量(200±10)g,饲养于辽宁中医药大学实验动物中心。
1.2主要试剂和仪器RNAiso Plus试剂盒、实时定量荧光聚合酶链式反应(RT-PCR)试剂盒(Takara公司);兔抗大鼠GLUT5(一抗)、羊抗兔IgG(二抗)(Abcam公司);三羟甲基胺甲烷缓冲液(TBST)、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、蛋白定量试剂盒(武汉博士德生物工程有限公司);TM-Vision行为学实验系统(成都泰盟软件有限公司);YLS-13A大小鼠抓力测定仪(济南益延科技发展有限公司);7500 RT-PCR仪(ABI公司)。
1.3动物分组、模型建立和评价24只大鼠按照随机数字表法分为对照组、脾气虚组、脾阳虚组,每组8只。脾气虚、脾阳虚模型的建立和评价参考笔者的前期报道[5],在此基础上本课题组进行了改良设计,具体如下:(1)对照组:相同室温及湿度环境,自由饮水进食。(2)脾气虚组(饮食失节+劳倦型):室温18~23 ℃,相对湿度45%~55%,自由饮水进食,适应性饲养1周后开始实验。先饱食1 d,再禁食2 d,均不禁水,共5个循环;每日水温35~37 ℃游泳至力竭。(3)脾阳虚组(饮食失节+劳倦+苦寒泻下型):每日灌服20%番泻叶水浸剂(2 ml/100 g),早晚各1次,连续7 d。观察大鼠一般体征状态(体质量、体温、进食量等)、前肢抓力(肌力检测)、行为学变化(旷场实验)对模型进行评价。
1.3.1体质量、体温、进食量检测测量3组大鼠体质量、体温后,放于代谢笼中,计算24 h进食量。
1.3.2肌力检测采用YLS-13A大小鼠抓力测定仪进行肌力检测。先用右手将大鼠按放在抓力板上,左手向前推抓力板,然后右手向后滑至大鼠尾部,左手轻轻松开抓力板,待大鼠用力抓住抓力板时,及时加力后拉,以得到最大前肢抓力。检测由专人操作,轻拿轻放,避免激怒大鼠,每只大鼠连续测量3次,取平均值。
1.3.3旷场实验采用TM-Vision行为学实验系统进行检测。检测箱底部分为25个小格,规定中间9格为中心区域,四角的4格为角落区域,其他12个格为周边区域。实验时将大鼠放入检测箱中心,观察5 min内大鼠在检测箱内不同区域停留的时间。彻底清洁检测箱后,检测下1只大鼠。
1.4RT-PCR法测定GLUT5 mRNA表达水平造模结束后取大鼠近端空肠组织,采用RNAiso Plus试剂盒提取组织总RNA,紫外分光光度计检测RNA纯度:A260/A280为1.8~2.2。去除基因组DNA,反转录PCR,条件:37 ℃ 15 min,85 ℃5 s,4 ℃保存。利用RT-PCR试剂盒进行扩增反应,条件:95 ℃ 10 s,95 ℃ 20 s,60 ℃ 35 s,32个循环。采用7500 RT-PCR仪检测GLUT5 mRNA表达水平。引物序列:GLUT5基因:上游引物为5′-CTCATCTTCCCGTTCATTC-3′,下游引物为5′-CGTCCGATACCTTGTTCTT-3′;GAPDH基因:上游引物为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物为5′-ATGGTGGTGAAGACGCCAGTA-3′。
1.5Western blotting法测定GLUT5表达水平造模结束后取大鼠近端空肠组织,提取各组大鼠空肠组织总蛋白,采用蛋白定量试剂盒对GLUT5定量分析,取80 μg总蛋白进行二烷基硫酸钠-聚丙烯乙胺凝胶电泳,电泳完毕后以150 V恒压30 min半干转印至PVDF膜,将膜用5%脱脂奶粉常温下摇床封闭2 h,加入一抗(稀释比例均为1∶100),4 ℃过夜。TBST洗膜3次,15 min/次;加入二抗,常温下孵育1 h,TBST洗膜3次,15 min/次,化学发光法显影。

2结果
2.13组大鼠一般体征状态及前肢抓力比较对照组大鼠动作敏捷,行动灵活,皮毛光泽紧致,大便正常;脾气虚组大鼠有所消瘦,神疲乏力,部分大鼠行动缓慢,反应略显迟钝,被毛蓬起无光泽,便较软;脾阳虚组大鼠明显消瘦,神疲倦怠,反应迟钝,行动缓慢,被毛蓬起无光泽,便软。3组大鼠体质量、体温、进食量、前肢抓力比较,差异有统计学意义(P<0.05)。脾气虚组体质量、进食量、前肢抓力均低于对照组,差异有统计学意义(P<0.05);脾阳虚组体质量、体温、进食量、前肢抓力均低于对照组,差异有统计学意义(P<0.05);脾阳虚组体温低于脾气虚组,差异有统计学意义(P<0.05,见表1)。
2.23组大鼠旷场实验结果比较3组大鼠中心区域、角落区域、周边区域停留时间比较,差异均有统计学意义(P<0.05)。脾气虚组中心区域、周边区域停留时间长于对照组,角落区域停留时间短于对照组,差异有统计学意义(P<0.05);脾阳虚组中心区域、角落区域、周边区域停留时间均短于对照组、脾气虚组,差异有统计学意义(P<0.05)。对照组、脾气虚组、脾阳虚组角落区域、周边区域停留时间均长于中心区域,差异有统计学意义(P<0.05);脾气虚组、脾阳虚组周边区域停留时间长于角落区域,差异有统计学意义(P<0.05,见图1、表2,本文图1、2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.33组大鼠空肠组织GLUT5 mRNA及其蛋白表达水平比较3组大鼠GLUT5 mRNA、GLUT5表达水平比较,差异有统计学意义(P<0.05)。脾气虚组、脾阳虚组GLUT5 mRNA、GLUT5表达水平低于对照组,差异有统计学意义(P<0.05);脾阳虚组GLUT5 mRNA表达水平低于脾气虚组,差异有统计学意义(P<0.05,见图2、表3)。
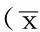
Table 1Comparison of body mass,temperature,food-intake and forelimb grip force among the three groups

组别只数体质量(g)体温(℃)进食量(g)前肢抓力(g)对照组8314.2±14.437.2±0.523.0±7.11563±208脾气虚组8180.6±9.4a36.8±0.915.7±3.1a1206±173a脾阳虚组8173.6±19.9a34.4±0.4ab15.0±7.2a1149±180aF值23.927.874.8610.58P值<0.0010.010.04<0.001
注:与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05

图1 3组大鼠旷场实验运动轨迹
Table 2Comparison of stay time in each area in open field test among the three groups

组别只数中心区域角落区域周边区域对照组825.06±10.53136.49±38.42c138.50±31.06c脾气虚组847.25±13.75a88.40±28.30ac164.30±28.33acd脾阳虚组89.21±4.57ab39.57±13.21abc84.63±13.57abcdF值18.3215.4351.84P值<0.0010.002<0.001
注:与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05;与同组中心区域比较,cP<0.05;与同组角落区域比较,dP<0.05

注:1、2、3为脾阳虚组,4、5为对照组,6、7、8为脾气虚组;GLUT5=葡萄糖转运体5
图2二烷基硫酸钠-聚丙烯乙胺凝胶电泳结果
Figure 2Result of SDS-PAGE
表33组大鼠空肠组织GLUT5 mRNA及其蛋白表达水平比较

Table 3Comparison of mRNA and protein expression of GLUT5 among the three groups in jejunum

组别只数GLUT5mRNAGLUT5对照组81.00±0.002.92±0.26脾气虚组80.67±0.10a1.19±0.14a脾阳虚组80.31±0.11ab1.16±0.06aF值137.4053.97P值<0.001<0.01
注:GLUT5=葡萄糖转运体5;与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05
3讨论
对脾虚本质的研究一直是中医基础研究的重点[6]。长期以来,人们对脾虚模型的研究多集中在神经内分泌、微量元素、免疫、消化、酶学等方面[1],而在脾虚能量代谢方面的机制研究还未见报道。
本研究脾气虚模型的建立采用了饮食失节结合劳倦过度的原则,脾阳虚模型则是在脾气虚的基础上施加苦寒泻下法完成[5]。结果显示,脾气虚组大鼠消瘦,神疲乏力,行动缓慢,反应略显迟钝,被毛蓬起,便较软;脾阳虚组大鼠明显消瘦,神疲倦怠,反应迟钝,被毛无光泽,便软;脾气虚组体质量、进食量均低于对照组,脾阳虚组体质量、体温、进食量均低于对照组,脾阳虚组体温低于脾气虚组。说明本实验饮食失节+劳倦型脾气虚模型及饮食失节+劳倦+苦寒泻下型脾阳虚模型制作成功。
“神疲乏力”是评价脾虚模型的重要指征之一,但长期以来,人们对脾虚模型“神疲乏力”的评价手段仅停留在肉眼观察大鼠状态的层面上,造成了一定的误差[7]。本研究创新采用肌力检测和旷场实验对“神疲乏力”进行量化评价,以进一步完善脾虚模型客观化评价方法。前肢肌力检测可以评价肢体力量,用以判断神经系统和运动系统的损伤[8],本研究结果显示,脾气虚组、脾阳虚组大鼠前肢抓力低于对照组,其原因可能涉及运动神经系统和前肢肌肉损伤等方面。旷场实验主要用于观察啮齿类动物在新环境中的探索性行为,能够较为客观地反映中枢神经系统的兴奋性[9],本研究结果显示,对照组大鼠角落区域、周边区域停留时间长于中心区域,反映其好奇程度较高。脾气虚组大鼠中心区域、周边区域停留时间长于对照组,角落区域停留时间短于对照组,角落区域、周边区域停留时间长于中心区域,周边区域停留时间长于角落区域,说明脾气虚组大鼠对外界事物关注度降低,好奇程度下降,且反应迟钝,提示大鼠的中枢结构可能出现损伤,但也不能排除饮食不节所造成的肌肉失养或力竭游泳导致的肌肉损伤。脾阳虚组大鼠中心区域、角落区域、周边区域停留时间均短于对照组、脾气虚组,角落区域、周边区域停留时间长于中心区域,周边区域停留时间长于角落区域,说明脾阳虚大鼠在脾气虚基础上进一步体现畏寒惧冷、喜聚堆懒动的状态。
葡萄糖是中枢神经系统主要的能源物质,机体所需能量的50%~70%来源于糖[10]。葡萄糖作为营养性碳水化合物主要的消化尾产物,被机体吸收后,能提供能量并为合成其他生命物质提供碳源[11]。GLUTs家族(GLUT1~GLUT5)是细胞葡萄糖转运的主要载体。目前发现,GLUT5主要分布于成熟的小肠绒毛、基地外侧膜、肾近区小管及游动的精子[12]。Honma等[13]研究了连续3 d饥饿大鼠空肠组织GLUT5 mRNA表达水平,发现饥饿大鼠GLUT5 mRNA表达水平明显下降,对其进行高糖喂食后,空肠组织GLUT5 mRNA表达水平升高,提示GLUT5在哺乳动物空肠单糖吸收过程中起重要作用。Barone等[14]在对GLUT5基因敲除小鼠空肠内果糖吸收量分析后证实,正常饮食小鼠空肠内果糖吸收量降低大约75%,而血清中果糖含量也降低近90%,提示GLUT5基因缺失对小鼠单糖的吸收产生显著影响。本研究结果显示,脾气虚组、脾阳虚组GLUT5 mRNA、GLUT5表达水平低于对照组,脾阳虚组GLUT5 mRNA表达水平低于脾气虚组,证实脾虚状态下,GLUT5 mRNA及其蛋白表达水平均有不同程度的降低。
本课题组在模型量化评价上采用肌力检测和旷场实验完善了对脾虚状态下“神疲乏力”的半定量数据分析,但脾虚模型评价仍有很多证型表现有待于进一步探索其量化研究评价体系。本研究目前仅以葡萄糖在体内转运机制为出发点对脾虚能量代谢本质展开研究,脾虚能量代谢本质实验复杂,故还需做进一步研究加以验证。
综上所述,脾虚状态下,大鼠空肠组织GLUT5 mRNA及其蛋白表达水平均降低,这可能是脾气亏虚、能量代谢障碍的重要分子机制之一,其深入研究有待进一步论证。
作者贡献:尚冰进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;丛培玮、王艳杰、赵丹玉进行实验实施、评估、数据整理;冯晓帆、张林进行实验实施、审校。
本文无利益冲突。
参考文献
[1]聂建华,孙世发.中医脾虚证的近10年相关研究[J].中医药学报,2011,39(1):128-130.
[2]Rand EB,Depaoli AM,Davidson NO,et al.Sequence,tissue distribution,and functional characterization of the rat fructose transporter GLUT5[J].Am J Physiol,1993,264(6 Pt 1):G1169-1176.
[3]Ren Z,Niu WX.Basic physiology and function of the intestinal glucose transporter:GLUT5 and SGLT1[J].International Journal of Pathology and Clinical Medicine,2006,26(6):536-541.(in Chinese)
任重,牛伟新.小肠上皮单糖转运体GLUT5与SGLT1的基本生理和功能[J].国际病理科学与临床杂志,2006,26(6):536-541.
[4]Zhan LB,Chu Y,Zhao XJ,et al.Study on the nature of Spleen Qi deficiency based on metabonomics[J].World Science and Technology-Modernization of Traditional Chinese Medicine,2011,13(4):622-625.(in Chinese)
战丽彬,初艳,赵欣捷,等.基于代谢组学的脾气虚证本质研究[J].世界科学技术-中医药现代化,2011,13(4):622-625.
[5]尚冰.脾气虚证、脾阴虚证、脾阳虚证模型大鼠MDA、SOD、GSH-Px、T-AOC、8-OHdG、端粒长度变化的实验研究[D].沈阳:辽宁中医药大学,2006.
[6]Cong PW,Shang B,Xu NY,et al.Mechanism study of spleen being the source of Qi and blood[J].Liaoning Journal of Traditional Chinese Medicine,2013,40(5):1036-1038.(in Chinese)
丛培玮,尚冰,许南阳,等.“脾为气血生化之源”生血、统血机制的实验研究[J].辽宁中医杂志,2013,40(5):1036-1038.
[7]Zhao P,Li XT.Study of systematic evaluation on the literature of spleen-deficiency syndrome diagnostic standard[J].Liaoning Journal of Traditional Chinese Medicine,2013,40(7):1304-1306.(in Chinese)
赵平,李先涛.脾虚证诊断标准文献系统评价研究[J].辽宁中医杂志,2013,40(7):1304-1306.
[8]Shang B,Cong PW,Wang RF,et al.Research of ffuzzy mathematics mode identification on spleen deficiency rats models[J].Journal of Liaoning University of TCM,2013,15(3):64-66.(in Chinese)
尚冰,丛培玮,王蕊芳,等.对脾虚大鼠模型建立模糊数学评价体系的研究[J].辽宁中医药大学学报,2013,15(3):64-66.
[9]Liu YP,Liu T,Bi H,et al.Effects of strain,sex and circadian rhythm on open field test on mice[J].Journal of Xi′an Jiaotong University (Medical Sciences),2014,35(5):634-638.(in Chinese)
刘友平,刘田,毕航,等.品系、性别和生物节律对小鼠旷场实验的影响[J].西安交通大学学报:医学版,2014,35(5):634-638.
[10]Jiang C,Xie J,Chen HF.The mechanism of conformation transformation of glucose transporter 1[J].Genomics and Applied Biology,2015,34(7):1372-1377.(in Chinese)
江诚,谢俊,陈海峰.葡萄糖转运蛋白的转运机制研究[J].基因组学与应用生物学,2015,34(7):1372-1377.
[11]Peng J,Hu YH,Huang XS.A study on expressional distribution spectrum of the pathological features of glucose transporter5 (GLUT5) in a animal model on the syndrome of dampness incumbering middle energizer in jejunal tissue and the intervention by pingwei dosage[J].Lishizhen Medicine and Materia Medica Research,2014,25(5):1238-1240.(in Chinese)
彭晋,呼永河,黄秀深.湿阻中焦证模型空肠葡萄糖转运蛋白5的病理特征性表达分布谱以及平胃散干预的研究[J].时珍国医国药,2014,25(5):1238-1240.
[12]Inukai K,Asano T,Katagiri H,et al.Cloning and increased expression with fructose feeding of rat jejunal GLUT5[J].Endocrinology,1993,133(5):2009-2014.
[13]Honma K,Masuda Y,Mochizuki K,et al.Re-feeding rats a high-sucrose diet after 3 days of starvation enhances histone H3 acetylation in transcribed region and expression of jejunal GLUT5 gene[J].Biosci Biotechnol Biochem,2014,78(6):1071-1073.
[14]Barone S,Fussell SL,Singh AK,et al.Slc2a5 (Glut5) is essential for the absorption of fructose in the intestine and generation of fructose-inducedhypertension[J].J Biol Chem,2009,284(8):5056-5066.
(本文编辑:崔丽红)
【关键词】脾气虚;脾阳虚;空肠;葡萄糖转运体5型
尚冰,丛培玮,王艳杰, 等.脾气虚和脾阳虚模型大鼠空肠组织葡萄糖转运体5表达水平变化的实验研究[J].中国全科医学,2016,19(3):332-336.[www.chinagp.net]
Shang B,Cong PW,Wang YJ,et al.Expression of GLUT5 in jejunum of model rats with spleen-qi deficiency syndrome and spleen-yang deficiency syndrome[J].Chinese General Practice,2016,19(3):332-336.
Expression of GLUT5 in Jejunum of Model Rats With Spleen-qi Deficiency Syndrome and Spleen-yang Deficiency SyndromeSHANGBing,CONGPei-wei,WANGYan-jie,etal.AcademyofTCM,LiaoningUniversityofTraditionalChineseMedicine,Shenyang110847,China
【Abstract】ObjectiveTo build rat models of spleen-qi deficiency syndrome and spleen-yang deficiency syndrome and observe the changes of GLUT5 expression in jejunum of rats,in order to investigate the essence and differences of spleen deficiency syndrome and energy metabolism in different stages.MethodsFrom March to September in 2015,selected 24 male SD rats of SPF grade and divided them into control group,spleen-qi deficiency group and spleen-yang deficiency group,with 8 rats in each group.Models of spleen-qi deficiency were built by the methods of dietary irregularity and overfatigue,and spleen-yang deficiency syndrome models were built by the above methods plus discharge fire withbitter-cold method.General physical signs (body mass,body temperature and food intake),forelimb grip strength (muscle force test) and behavioral changes (open field test) were evaluated.RT-PCR was employed to detect the expression of GLUT5 mRNA,and Western blotting method was used to measure the expression of GLUT5.ResultsSpleen-qi deficiency group was lower than control group in body mass,food intake and forelime grip force (P<0.05);spleen-yang deficiency group was lower than control group in body mass,temperature,food intake and forelimb grip force (P<0.05);spleen-yang deficiency group was lower than spleen-qi deficiency group in temperature (P<0.05).Spleen-qi deficiency group was longer in the stay time in central area and peripheral area and was shorter in the stay time in corner area than control group (P<0.05);spleen-yang deficiency group was shorter than control group and spleen-qi deficiency group in the stay time in central area,corner area and peripheral area (P<0.05).The three groups all had longer stay time in corner area and peripheral area than in central area (P<0.05);spleen-qi deficiency group and spleen-yang deficinecy group had longer stay time in peripheral area than in corner area(P<0.05). Spleen-qi deficiency group and spleen-yang deficiency group were lower than control group in the expression of GLUT5 mRNA and GLUT5 (P<0.05);spleen-yang deficiency group was lower than spleen-qi deficiency group in the expression of GLUT5 mRNA (P<0.05).ConclusionIn the status of spleen deficiency,GLUT5 mRNA and its protein expression of jejunum of rats decreases,which may be one of the most important molecular mechanisms of spleen deficiency and metabolic disorder of energy.
【Key words】Spleen-qi deficiency;Spleen-yang deficiency;Jejunum;Glucose transporter type 5
(收稿日期:2015-08-25;修回日期:2015-12-11)
【中图分类号】R 256.3
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.03.019
通信作者:王艳杰,110847 辽宁省沈阳市,辽宁中医药大学基础医学院;E-mail:15940157054@163.com
基金项目:国家重点基础研究发展计划(973计划)(2013CB531702)
作者单位:110847 辽宁省沈阳市,辽宁中医药大学中医文献研究院(尚冰),教学实验中心(丛培玮),基础医学院(王艳杰,赵丹玉,冯晓帆,张林)
·中医·中西医结合研究·
