基于黏蛋白1的非小细胞肺癌基因疫苗的构建及免疫原性评价
2016-02-17岳红红
岳红红 赵 亮 姜 威
(武警总医院1 过敏反应科,2 医务部,北京市 100039,E-mail:cctv201166@126.com)
论著·基础研究
基于黏蛋白1的非小细胞肺癌基因疫苗的构建及免疫原性评价
岳红红1赵 亮2姜 威2
(武警总医院1 过敏反应科,2 医务部,北京市 100039,E-mail:cctv201166@126.com)
目的 构建基于黏蛋白1(MUC1)的非小细胞肺癌基因疫苗,并对其免疫原性进行评价。方法 利用弗林蛋白酶(furin)/2A序列将MUC1基因与粒细胞-巨噬细胞集落刺激因子(GM-CSF)基因进行连接,克隆入真核表达载体pVAX1,构建基因疫苗pVAX1-MUC1-F2A-GM-CSF。对基因疫苗进行鉴定后将该疫苗体外转染COS7细胞,利用流式细胞术和酶联免疫吸附测定法(ELISA)分别对MUC1、GM-CSF的表达情况进行检测。将32只Balb/c小鼠分为空白对照组、空质粒pVAX1组、pVAX1-MUC1组和pVAX1-MUC1-F2A-GM-CSF组,每组8只。除空白对照组外,其余实验组每只小鼠肌肉注射相应质粒100 μg,并进行电穿孔刺激,末次免疫后14 d采用ELISA和酶联免疫斑点法分别检测其诱导的体液免疫和细胞免疫反应。结果 成功克隆并构建了非小细胞肺癌基因疫苗pVAX1-MUC1-F2A-GM-CSF,流式细胞检测结果显示MUC1在COS7细胞中的阳性表达率为10%,ELISA检测结果显示pVAX1-MUC1-F2A-GM-CSF组GM-CSF表达水平高于空载体pVAX1组(P<0.05)。将疫苗免疫接种小鼠模型后,pVAX1-MUC1-F2A-GM-CSF组诱导的MUC1抗体水平高于pVAX1-MUC1组(P<0.05),pVAX1-MUC1-F2A-GM-CSF组的小鼠脾细胞分泌干扰素-γ的斑点数多于pVAX1-MUC1组(P<0.05)。结论 pVAX1-MUC1-F2A-GM-CSF能够同时诱导较高的体液免疫和细胞免疫反应。
非小细胞肺癌;基因疫苗;黏蛋白1;粒细胞-巨噬细胞集落刺激因子;体液免疫;细胞免疫
非小细胞肺癌约占肺癌的80%,恶性程度高,转移早而广泛,对化疗、放疗敏感,初治缓解率虽高,但极易发生继发性耐药,容易复发,其治疗以全身化疗为主。化疗以传统化疗药物为主,包括依托泊苷、顺铂、环磷酰胺、阿霉素、伊立替康、紫杉醇、多西他赛等。研发其新型有效的治疗方法和手段是目前的当务之急。基因疫苗作为主动的免疫治疗方式,由于其能够诱导强烈的细胞免疫应答而成为肿瘤免疫治疗研究的热点之一[1-2]。
在免疫治疗中,靶抗原的选择对治疗的特异性和有效性具有重要的作用。黏蛋白1(mucin 1,MUC1)是一种跨膜糖蛋白,通常表达于乳腺导管上皮细胞的顶端表面[3]。而乳腺、前列腺、肺、结肠上皮腺癌表达异常形态的MUC1[1-2]。因此,靶向肿瘤表达的MUC1抗原的主动免疫治疗可能有很大的治疗价值。此外,一种编码人类黏蛋白1(human mucin 1,hMUC1)的DNA疫苗已经在高表达MUC1的上皮癌中进行尝试,其证明能够有效抑制表达MUC1肿瘤的生长[4]。本研究将MUC1基因与粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)基因构建于同一个真核表达载体,并对其诱导的体液和细胞免疫反应进行初步评价。
1 材料和方法
1.1 基因疫苗的构建和鉴定 将MUC1[GenBank(https://www.ncbi.nlm.nih.gov/genbank/)序列号:X80761.1]的胞外段编码区和GM-CSF(GenBank序列号:M11220.1)的编码区基因之间以弗林蛋白酶(furin)/2A序列进行连接,构成融合基因MUC1-F2A-GM-CSF,融合基因的上、下游分别引入酶切位点HindⅢ和 XboⅠ。融合基因在Invitrogen公司进行全基因合成,然后将其克隆至基因疫苗常用真核表达载体pVAX1,获得基因疫苗pVAX1-MUC1-F2A-GM-CSF。利用限制性内切酶的酶切和基因测序对基因疫苗进行鉴定,主要步骤:利用NEB公司的内切酶HindⅢ(R0104V)和 XboⅠ(R0146V),对获得的基因疫苗pVAX1-MUC1-F2A-GM-CSF进行酶切,能够切下与目的基因MUC1-F2A-GM-CSF大小一致的条带,即为构建成功。
1.2 基因疫苗的真核表达 为了验证pVAX1-MUC1-F2A-GM-CSF的真核表达情况,利用脂质体2000转染试剂(Invitrogen公司,货号:11668019)将其转染至COS7细胞(购于中科院上海细胞库),以空载体pVAX1作为阴性对照,检测GM-CSF表达时同时设立pVAX1-MUC1组,分别收集细胞培养上清液和六孔板中的细胞进行检测,操作严格按照说明书步骤进行。转染简要步骤如下:转染前1 d,将对数生长期的COS 7细胞接种于6孔培养板,转染时细胞汇合度应达到80%左右;利用无血清培养基分别配置转染A液和B液,A液含有10 μl的转染试剂,B液含有4 μg的转染级质粒,A和B液在室温下放置5 min后,将A液加入到B液中,此为C液,轻柔混匀,室温放置20 min。将C液小心加入含有2 ml培养基和80%汇合度细胞的6孔培养板中,轻柔混匀,置于细胞培养箱孵育5 h。孵育结束后,用新鲜培养基洗涤6孔板中的细胞,最后加入2 ml新鲜的完全培养基。转染48 h后,进行检测。
由于MUC1是细胞膜表达,将收集的转染细胞洗涤后,分别采用鼠源抗人MUC1抗体(Abcam公司,货号:ab28081)和藻红蛋白标记的山羊抗小鼠IgG(Abcam公司,货号:ab97024)为一抗和二抗,并分别孵育30 min后,上流式细胞仪(BD公司,型号:BD AccuriTMC6)检测MUC1的阳性表达率(红色荧光表示)。GM-CSF是分泌表达,所以将转染细胞培养上清液包被于96孔微板中,采用鼠源的抗人GM-CSF单克隆抗体(Abcam公司,货号:ab54429)作为一抗,二抗为辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG(北京中杉金桥生物技术公司,货号:ZDR-5307),显色并终止反应后,酶标仪(美国伯乐公司,型号:Bio-Rad iMark)检测波长在450 nm处的吸光度(A)值,样品孔数值大于等于阴性孔数值2倍以上为阳性。
1.3 实验动物分组和免疫接种 雌性Balb/c小鼠32只,购于北京维通利华实验动物技术公司,4~6周龄,体重20~25 g,实验动物的喂养按照实验动物的护理和使用指南[5]。采用配对比较法随机分组法将小鼠分为空白对照组、空质粒pVAX1组,pVAX1-MUC1组和pVAX1-MUC1-F2A-GM-CSF组,每组8只。除空白对照组外,其余实验组每只小鼠肌肉注射相应质粒100 μg,并进行电穿孔刺激[6],分别在一免后的第7天和第14天加强免疫,并进行电穿孔刺激。末次免疫后的第14天,处死小鼠后内进行免疫原性检测。
1.4 抗体滴度检测和酶联免疫斑点法检测
1.4.1 抗体滴度检测:末次免疫后14 d,小鼠眼眶取血约100 μl左右,室温下自然沉淀2~3 h,然后1 500 r/min离心5 min,分离血清,检测小鼠血清中的抗体滴度。将10 μg重组MUC1抗原(Abcam公司,货号:ab80082)包被于96孔微板中,然后加入系列稀释的各实验组小鼠血清,孵育洗涤后,加入HRP标记山羊抗小鼠IgG抗体,孵育洗涤后,3,3′,5,5′-四甲基联苯胺溶液显色,反应终止后,使用酶标仪在450 nm波长处读取数值。实验组A450的数值≥阴性对照2倍为阳性。
1.4.2 酶联免疫斑点法(enzyme-linked immunospot assay,ELISpot):末次免疫后14 d,无菌分离各个实验组小鼠脾细胞,利用预先以抗干扰素-γ(interferon-γ,IFN-γ)抗体包被的聚偏氟乙烯板,将分离的各组小鼠脾细胞分别加入到相应的包被孔中。其中,加入MUC1蛋白作为刺激物的板孔为ELISpot检测的实验组孔,不加刺激抗原的板孔称为阴性对照孔;同时,还要设立阳性对照孔,即加入佛波酯的板孔。详细操作过程参照ELISpot试剂盒(达科为生物技术有限公司,货号:DKW22-2000-500)说明书进行。
1.5 统计学分析 采用GraphPad Prism 5进行统计学分析,计量资料以(x±s)表示,比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 基因疫苗的构建和抗原表达检测 基因疫苗构建进行测序鉴定正确;将其转染COS7细胞,孵育后流式细胞术检测结果显示,可以检测到MUC1在COS7细胞中的表达,阳性表达率为10%,见图1。酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测结果显示,pVAX1-MUC1-F2A-GM-CSF组GM-CSF水平明显高于空载体pVAX1组(P=44.57,P<0.001),见表1。
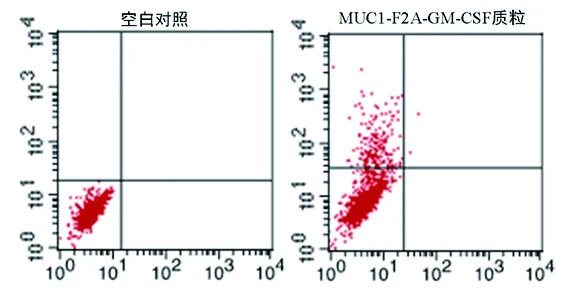
图1 流式细胞术检测重组质粒中MUC1蛋白的表达
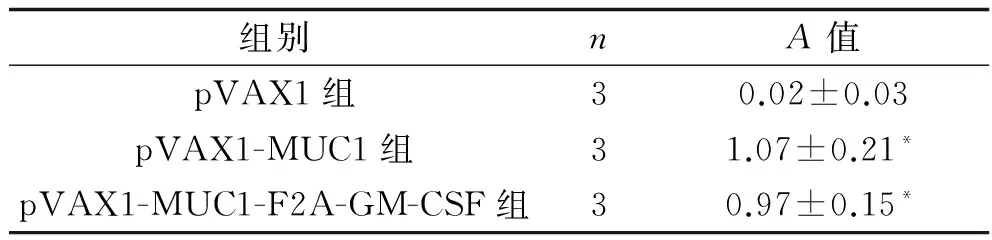
组别nA值pVAX1组30.02±0.03pVAX1-MUC1组31.07±0.21*pVAX1-MUC1-F2A-GM-CSF组30.97±0.15*
注:与pVAX1组比较,*P<0.05。
2.2 ELISA检测疫苗诱导的体液免疫应答 单独抗原pVAX1-MUC1组和融合抗原pVAX1-MUC1-F2A-GM-CSF组都能产生一定强度MUC1的抗体反应,见图2;但pVAX1-MUC1-F2A-GM-CSF组诱导的MUC1抗体水平高于单独抗原pVAX1-MUC1组(F=67.12,P<0.001),见表2。

图2 各实验组抗体滴度比较

组别n抗MUC1抗体滴度水平pVAX1组424.4±16.7pVAX1-MUC1组42140.0±207.4*pVAX1-MUC1-F2A-GM-CSF组43460.0±792.5*#
注:与pVAX1组比较,*P<0.05;与pVAX1-MUC1组比较,#P<0.05。
2.3 ELISPOT法检测疫苗诱导的细胞免疫应答 与对照组相比,无论是单独抗原pVAX1-MUC1组还是融合抗原pVAX1-MUC1-F2A-GM-CSF组免疫小鼠后的脾脏淋巴细胞,经特异性抗原MUC1刺激后,均能产生IFN-γ分泌的斑点,见图3。融合抗原疫苗pVAX1-MUC1-F2A-GM-CSF组的小鼠脾细胞分泌IFN-γ的斑点数多于单独抗原pVAX1-MUC1组(F=85.13,P<0.001),见表3。
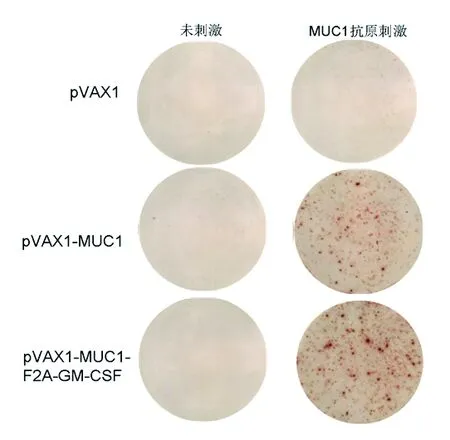
图3 具有代表性的各实验组ELISpot检测斑点图

组别n斑点数pVAX1组85.00±4.6pVAX1-MUC1组8152.0±45.0*pVAX1-MUC1-F2A-GM-CSF组8232.0±41.0*#
注:与pVAX1组比较,*P<0.05;与pVAX1-MUC1组比较,#P<0.05。
3 讨 论
当前的免疫治疗方法包括被动免疫和主动免疫两大类:被动免疫常用方式就是单克隆抗体或者一些具有免疫活性的细胞因子等;而主动免疫就是疫苗类的制剂,诸如蛋白疫苗、树突状细胞疫苗以及基因疫苗等。虽然抗体免疫反应和细胞免疫反应对于肿瘤的治疗都具有相应的作用,但是辅助性T细胞1(helper T cell 1,Th1)类细胞免疫反应,特别是细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)反应以及由此产生的一系列相关的细胞因子,如IFN-γ、肿瘤坏死因子-α及白细胞介素-2(interleukin,IL-2)[7],可能是最终抑制和消除肿瘤的关键因素。因此理想的抗肿瘤疫苗必须既有能力诱导体液免疫反应,又有能力诱导细胞免疫反应,特别是Th1和CTL反应。
在众多不同类型的疫苗中,基因疫苗由于能够以模拟病毒感染的自然过程的方式进行抗原递呈,也就是主要组织相容性复合体-Ⅰ类分子递呈途径,因此其能够诱导高效的细胞免疫反应,特别是Th1类免疫应答和 CTL反应[8]。另外由于基因疫苗制备简便,易于运输与储存,成本低廉等优势,成为近年来肿瘤免疫和感染免疫方面研究的热点[9]。多年来,由于基因疫苗的免疫原性较低,其研究和发展受到了一定的限制,曾经一度出现停滞不前的现象。但是,自从在体电脉冲转染这种高效的基因疫苗递送方式用于基因疫苗的免疫接种后,其发展非常迅速[3]。当然,提高基因疫苗效果的方法很多,将具有免疫刺激和调节功能的细胞因子以分子内佐剂的方式与肿瘤抗原融合是研究热点之一。当前研究最为成熟的免疫刺激分子之一是GM-CSF。它能够刺激多种免疫细胞,例如DC细胞、巨噬细胞等发育和活化;它和IL-12及IL-2一样,都是具有非常重要免疫调节作用的细胞因子;GM-CSF目前已经发展成为蛋白药物,临床上用于肿瘤的辅助治疗[10-11]。具有重要的免疫调节功能。此外,很多学者将其以辅助分子或者分子内佐剂的方式加以应用,这些都体现了其良好的抗肿瘤或者提高抑瘤效果的能力[12-13]。
近年来,肺癌的发病率在逐年提高,非小细胞肺癌更是难防难治,但其免疫治疗手段却取得了一些重要的突破性进展。MUC1是当前肺癌靶向治疗中研究较多的一个靶抗原,以MUC1为靶点的肺癌疫苗已经进行到Ⅲ期临床试验,且取得了较为理想的效果,因此,MUC1被看做是肺癌免疫治疗的潜在理想靶抗原之一[14-15]。
本研究将具有重要免疫调节功能的分子GM-CSF与非小细胞肺癌高表达抗原MUC1进行融合,经抗原表达检测,可以检测到MUC1在COS7细胞中的表达,且GM-CSF表达水平检测结果显示,pVAX1-MUC1-F2A-GM-CSF组A值明显高于空载体pVAX1组(P<0.05),提示GM-CSF在COS7细胞内能够有效分泌表达,成功构建了肺癌基因疫苗。将疫苗免疫接种小鼠模型后,ELISA检测结果显示,pVAX1-MUC1-F2A-GM-CSF组诱导的抗体水平高于单独抗原pVAX1-MUC1组(P<0.05),提示将MUC1抗原与GM-CSF融合表达,能够显著提高MUC1诱导的特异性抗体的产生,增强了体液免疫反应;此外,融合抗原疫苗pVAX1-MUC1-F2A-GM-CSF组的小鼠脾细胞分泌IFN-γ的斑点数多于单独抗原pVAX1-MUC1组(P<0.05),提示与单独抗原pVAX1-MUC1组相比,pVAX1-MUC1-F2A-GM-CSF能够诱导产生较强细胞免疫反应,说明GM-CSF作为分子内佐剂,能够显著提高抗原诱导特异性免疫应答的能力。在后续实验中,我们将深入研究该疫苗抑制肿瘤的效果,同时将利用其他肺癌靶抗原和成熟的佐剂分子,进一步提高优化和改善疫苗的效果,以期获得一个良好的非小细胞肺癌基因疫苗候选品种。
[1] Guo C,Manjili MH,Subjeck JR,et al.Therapeutic cancer vaccines:past,present,and future[J].Adv Cancer Res,2013,119:421-475.
[2] Pol J,Bloy N,Obrist F,et al.Trial watch:DNA vaccines for cancer therapy[J].Oncoimmunology,2014,3(1):e28 185.
[3] Grunwald T,Ulbert S.Improvement of DNA vaccination by adjuvants and sophisticated delivery devices:vaccine-platforms for the battle against infectious diseases [J].Clin Exp Vaccine Res,2015,4(1):1-10.
[4] Pillai K,Pourgholami MH,Chua TC,et al.MUC1 as a potential target in anticancer therapies[J].Am J Clin Oncol,2015,38(1):108-118.
[5] Office of Laboratory Animal Welfare.Public health service policy on humane care and use of laboratory animals[EB/OL].(2015-03-16)[2016-03-23].http://grants.nih.gov/grants/olaw/references/phspol.htm.
[6] Zhang L,Wang Y,Xiao Y,et al.Enhancement of antitumor immunity using a DNA-based replicon vaccine derived from Semliki Forest virus[J].PLoS One,2014,9(3):e90 551.
[7] Yong X,Xiao YF,Luo G,et al.Strategies for enhancing vaccine-induced CTL antitumor immune responses[J].J Biomed Biotechnol,2012,2012:605045.
[8] Nishikawa H,Shiku H.DNA vaccine[J].Nihon Rinsho,2008,66(10):1 867-1 872.
[9] Xenopoulos A,Pattnaik P.Production and purification of plasmid DNA vaccines:is there scope for further innovation?[J].Expert Rev Vaccines,2014,13(12):1 537-1 551.
[10]Young PA,Morrison SL,Timmerman JM.Antibody-cytokine fusion proteins for treatment of cancer:engineering cytokines for improved efficacy and safety[J].Semin Oncol,2014,41(5):623-636.
[11]Goshima F,Esaki S,Luo C,et al.Oncolytic viral therapy with a combination of HF10,a herpes simplex virus type 1 variant and granulocyte-macrophage colony-stimulating factor for murine ovarian cancer[J].Int J Cancer,2014,134(12):2 865-2 877.
[12]Dranoff G,Jaffee E,Lazenby A,et al.Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent,specific,and long-lasting anti-tumor immunity[J].Proc Natl Acad Sci U S A,1993,90(8):3 539-3 543.
[13]Li JW,Gong JY,Li K,et al.Construction of a fusion expression plasmid containing the G250 gene and human granulocyte-macrophage colony stimulating factor and its significance in renal cell carcinoma[J].Oncol Lett,2011,2(2):343-347.
[14]Klinge CM,Radde BN,Imbert-Fernandez Y,et al.Targeting the intracellular MUC1 C-terminal domain inhibits proliferation and estrogen receptor transcriptional activity in lung adenocarcinoma cells[J].Mol Cancer Ther,2011,10(11):2 062-2 071.
[15]Sharma S,Srivastava MK,Harris-White M,et al.MUC1 peptide vaccine mediated antitumor activity in non-small cell lung cancer[J].Expert Opin Biol Ther,2011,11(8):987-990.
Construction and immunogenicity evaluation of non-small cell lung cancer gene vaccine based on mucin 1
YUEHong-hong1,ZHAOLiang2,JIANGWei2
(1DepartmentofAllergicReaction,2DepartmentofMedicalAffairs,GeneralHospitalofArmedPoliceForces,Beijing100039,China)
Objective To construct the non-small cell lung cancer gene vaccine based on mucin 1(MUC1),and to evaluate its immunogenicity.Methods MUC1 gene was fused with granulocyte-macrophage colony-stimulating factor(GM-CSF) by furin/2A sequence,and the fused gene was cloned into pVAX1 to construct the gene vaccine pVAX1-MUC1-F2A-GM-CSF.The gene vaccine was transfected into COS7 cells after identification,and then the expressions of MUC1 and GM-CS were detected by flow cytometry and enzyme-linked immunosorbent assay(ELISA) respectively.Thirty-two Balb/c mice were divided into blank control group,pVAX1 group,pVAX1-MUC1 group and pVAX1-MUC1-F2A-GM-CSF group,with 8 mice in each group.Except the blank control group,the corresponding plasmids(100 μg) were injected into the mice of the experimental groups and electroporation stimulation was also performed in each mice.After 14 days of last immunization,the induced humoral immune and cellular immune responses were detected by ELISA and enzyme-linked immunospot assay respectively.Results Non-small cell lung cancer gene vaccine pVAX1-MUC1-F2A-GM-CSF was successfully cloned and constructed.The result of flow cytometry detection showed that MUC1 expressed in COS7 cell and the positive expression rate was 10%.And the result of ELISA showed that the GM-CSF expression level of pVAX1-MUC1-F2A-GM-CSF group was higher than that of pVAX1 group(P<0.05).After the mice models injected with the vaccine,the expression of MUC1 antigen induced by pVAX1-MUC1-F2A-GM-CSF group was higher than that induced by pVAX1-MUC1 group(P<0.05),and the spots of interferon-γ secreted by mice splenocytes in the pVAX1-MUC1-F2A-GM-CSF group was more than that in the pVAX1-MUC1 group(P<0.05).Conclusion The pVAX1-MUC1-F2A-GM-CSF can induce either high humoral immune response or cellular immune response. 【Key words】 Non-small cell lung cancer,Gene vaccine,Mucin 1,Granulocyte-macrophage colony-stimulating factor,Humoral immunity,Cellular immunity
岳红红(1975~),女,博士,主治医师,研究方向:过敏反应学。
姜威(1972~),男,硕士,主治医师,研究方向:呼吸内科危重症救治及肺癌的相关基础研究,E-mail:wuweiwenzhang07@sohu.com。
R 392.11
A
0253-4304(2016)09-1197-04
10.11675/j.issn.0253-4304.2016.09.03
2016-05-09
2016-06-29)
