磁共振波谱量化工具LCModel和TARQUIN的对比
2016-02-16薛爱国刘任远徐令仪万遂人
薛爱国 刘任远 徐令仪 张 冰 孙 钰 万遂人#*
1(东南大学医学电子学实验室,南京 210096)2(南京大学医学院附属鼓楼医院医学影像科,南京 210008)
磁共振波谱量化工具LCModel和TARQUIN的对比
薛爱国1刘任远2徐令仪1张 冰2孙 钰1万遂人1#*
1(东南大学医学电子学实验室,南京 210096)2(南京大学医学院附属鼓楼医院医学影像科,南京 210008)
磁共振波谱(MRS)技术能够提供组织内部的代谢物信息,而且是一项能够在活体内无创伤测定代谢物浓度的技术。然而,不同的波谱量化算法会得到不同的计算结果。根据LCModel和TARQUIN这两种算法,采用21个健康志愿者的海马数据进行分析对比。采用图像分割和图像匹配的办法,实现CSI体素的自动选择。在LCModel和TARQUIN的对比中,首先比较参数start point对TARQUIN分析结果的影响,然后对比TARQUIN和LCModel分析的代谢物浓度比的相关性,最后讨论TARQUIN和LCModel分析结果的平均偏差。结果显示,TARQUIN和LCModel有非常相似的模型信号。然而LCModel分析结果的基线比TARQUIN更加平滑。对于Ins/TCr、TNAA/TCr、Cho/TCr和Cho/TCr,TARQUIN和LCModel计算结果的相关系数分别为0.42、0.26、0.84、0.67。 在代谢物浓度比Ins/TCr、TNAA/TCr、Cho/TCr和(Glu+Gln)/TCr方面,TARQUIN 分析结果总体比LCModel偏小。对于TNAA/TCr和(Glu+Gln)/TCr,相对偏差为0.34和.032。Ins/TCr 和Cho/TCr、TARQUIN和LCModel之间的平均偏差较小,不高于8%。LCModel和TARQUIN计算的模型信号较为接近,但代谢物相对浓度差别较大,TARQUIN分析的结果比LCModel分析的结果平均偏小,可比性较差。
磁共振谱;LCModel;TARQUIN
引言
人大脑内代谢物浓度会随着年龄和健康程度发生变化,不同的代谢物浓度代表着不同的信息。在传统的方法中只有活检才能测定代谢物浓度,然而活检危险性也较大,不易多次使用。磁共振波谱(MRS)技术是一项无创伤地提供活体组织内部代谢物浓度信息的检测技术[1-2]。MRS技术在神经病学[3]、白质炎症性疾病[4]、阿尔兹海默病[5]等临床领域有着广泛的应用。在MRS技术中,代谢浓度的测定基础是MRS信号的量化。现有的MRS信号量化算法有很多[6],然而不同算法的量化结果却不一样,对于不同的量化结果也没有统一的评价标准。不同的MRS量化方法得到结果之间的差异性已经成为波谱量化工作者们关心的问题。LCModel是目前临床应用最为广泛的商业化MRS量化工具[7]。TARQUIN作为一个免费的MRS量化工具提供了和LCModel相同的功能[8-9]。本研究对LCModel和TARQUIN的计算结果进行对比,为这两个不同的工具的使用者提供参考。
Wilson等曾用大脑白质的单体素MRS信号对TARQUIN和LCModel计算的绝对浓度做了对比[9]。然而,这种方法的最大局限性在于,代谢物的真实绝对浓度是未知的,而且在绝对浓度计算中需要用到水信号,实际中不同大脑区域的水信号是无法准确获得的。另外,其实验中采用的是单体素采集[10]方法,体素位置是由人工确定的,对于不同的被试无法保证体素的位置选取是一致的。在实际应用中,一般研究代谢物相对浓度,而不是代谢物绝对浓度[11-13],大多数研究以肌酸(Cr)为体内参考信号的,例如阿尔兹海默病(AD)[14-16]和大脑肿瘤诊断[17-18],因此对比代谢物相对浓度会更加有实际意义。另外,计算相对浓度不需要放缩校正和弛豫校正,对部分容积效应也不敏感。本研究采用多体素的定位方法采集MRS数据,对比一些主要代谢物相对浓度。由于在MRS量化算法中Cr和磷酸肌酸(PCr)难以区分,所以本研究中将使用Cr+PCr(TCr)作为体内参考信号。在MRS中,乙酰天冬氨酰谷氨酸(NAAG)和NAA的谱线很难区分开,同时胆碱磷酸(PCh)和甘油磷酰胆碱(GPC),以及谷氨酸盐(Glu)和谷氨酰胺(Gln)的谱线也都难以区分。NAA+NAAG(TNAA)浓度的和比单独的NAA或者NAAG浓度计算更为准确,对TCr,GPC+PCh(Cho),Glu+Gln同样也是如此。所以我们比较TNAA的浓度而不是比较单独的NAA或者NAAG的浓度,同理比较Cho,Glu+Gln的相对浓度。同时也比较LCModel和TARQUIN计算的Ins的相对浓度。研究中采用健康志愿者的海马区波谱数据进行对比,采用多体素化学位移成像(CSI)[1, 19]。对MRI图像进行分割,通过和CSI图像的匹配,自动选取海马的体素。
在代谢物浓度比对比中,首先分析TARQUIN中参数start point对计算结果的影响,然后分析LCModel和TARQUIN计算结果的相关性,最后对比LCModel和TARQUIN计算的一致性。Bland Altman曾通过分析两种测量方法的绝对差值来对比两种方法的一致性[20]。在本研究中,改进Bland Altman的方法,采用差值相对于真实值的比值来分析LCModel和TARQUIN计算的一致性。
1 材料和方法
1.1 材料
21个健康成年人作为研究对象,采集了志愿者海马的MRS数据。所有被试或其代理人均签署了书面形式的实验知情同意书。采集中使用8通道相控阵列线圈。在飞利浦Achieva 3.0磁共振仪上进行数据采集。采用三维turbo快速回波T1WI序列来获取全脑结构图像,并用于海马的分割。序列参数:重复周期(TR)/回波时间(TE)=9.8 ms/4.6 ms,翻转角为8°,平面内分辨率1 mm×1 mm,FOV(field of view)=256 mm×256 mm,选层厚度为1 mm。在飞利浦Achieva 3T工作站上重建双侧海马横断位三维图像,并用于MRS采集定位。然后,2D-PRESS序列用于采集双侧海马的MRS数据。用三平面自动匀场过程进行匀场以确保磁场的均匀性。PRESS序列采集MRS数据前,采用多优化不敏感抑制链(MOIST)对水信号进行压制。
1.2 方法
1.2.1 体素选择
为了选取合适的体素进行分析,使用图像分割和配准的办法,实现体素的自动选取,具体步骤如下:
1)使用FreeSurfer,对全脑3D T1加权图像分割得到海马;
2)对CSI体素和分割结果进行配准;
3)计算CSI中每个体素包含的海马的体积;
4)寻找CSI体素中包含海马最多的体素,作为LCModel和TARQUIN对比使用的体素。
对于每个志愿者,双侧海马都进行了计算,具体流程如图1所示。
1.2.2 TARQUIN和LCModel的对比
采用本文第1.2.1节中选择的体素,对于每个选择的体素分别用LCModel (version 6.3-1J)和TARQUIN (version 4.3.8)进行分析。在LCModel和TARQUIN的信号模型中,有如下关系[7, 9]:
原始信号=模型信号+残留信号
模型信号=代谢物信号+基线
比较包括4个步骤:
1)比较TARQUIN中参数start point对结果的影响。
2)分析TARQUIN和LCModel计算结果的相关性。虽然相关性不能代表TARQUIN和LCModel分析的结果是一致的,但是如果有很高的相关性,那么对于两者的比较也是有很大的意义的。
3)数据绘图。以LCModel得到的值为横轴,TARQUIN得到的值为纵轴,画点状图。如果LCModel和TARQUIN得到的结果完全一致,那么所有的点将落在直线y=x上,可以帮助观察LCModel和TARQUIN的计算结果是否一致。
4)分析LCModel和TARQUIN计算结果相对差值及其标准差。记代谢物浓度比值实际值为s,LCModel计算的代谢物浓度比值为s1,TARQUIN计算的代谢物浓度比值为s2。为了计算相对值,使用s1和s2的均值作为代谢物浓度实际值,计算TARQUIN和LCModel的相对误差,并给出其r均值95%的置信区间,有
(1)
(2)
2 结果
图2显示了LCModel和TARQUIN对一个体素的分析结果。从图2可以看出LCModel和TARQUIN分析的模型信号形状比较接近。图2的(b)~(d)可以明显看出基线的差别,说明参数start point明显地影响了基线形状。Start point取默认值20时,TARQUIN相比LCModel的基线更加平滑。
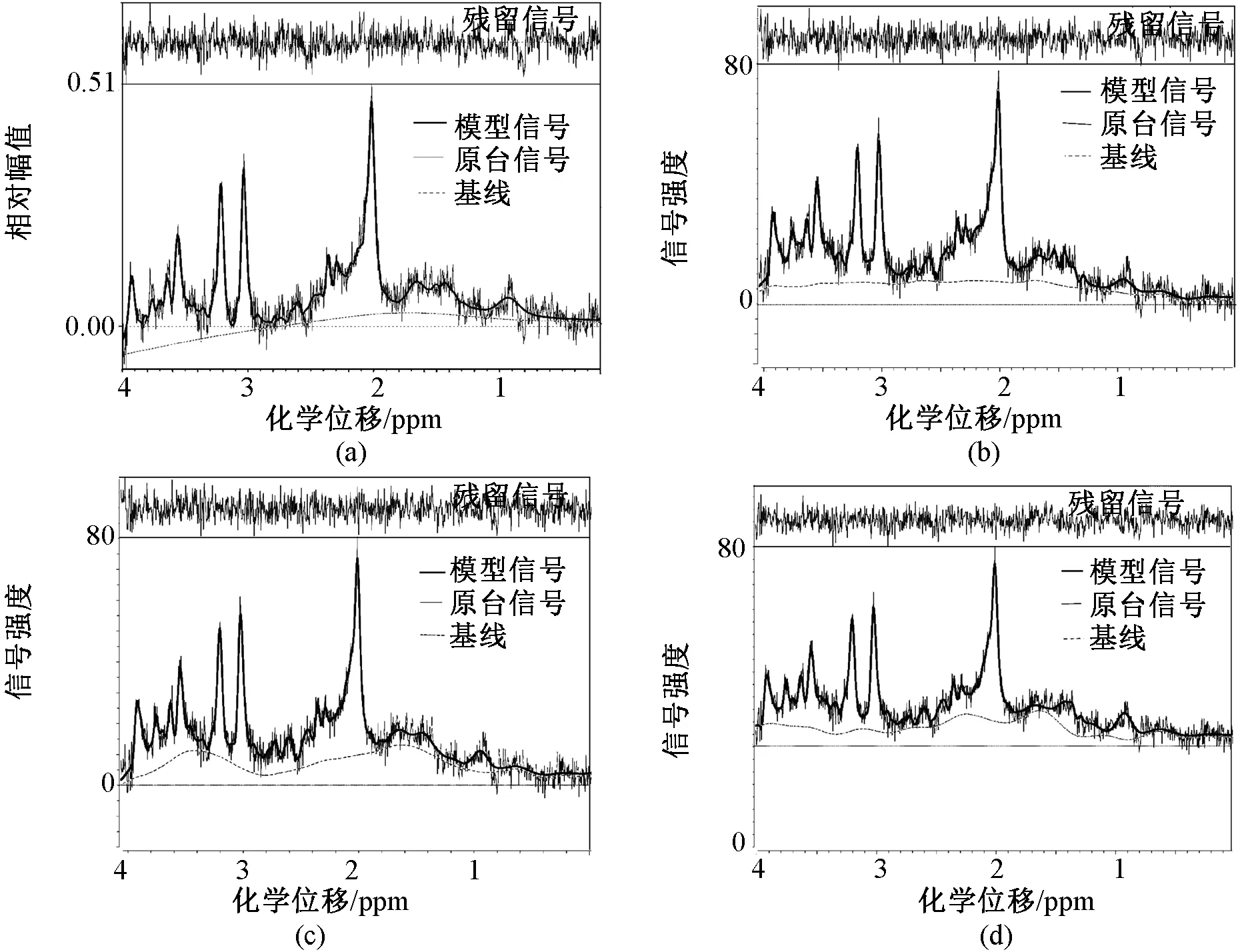
图2 健康志愿者海马区波谱分析结果。 (a) LCModel; (b) TARQUIN,start point=5;(c) TARQUIN,start point=20; (d) TARQUIN,start point=50Fig.2 Healthy hippocampus MRS fitting results. (a) LCModel; (b) TARQUIN with start point=5; (c) TARQUIN with start point=20; (d) TARQUIN with start point=50
TARQUIN和LCModel分析结果相关性如表1所示。其中Cho/TCr的相关系数较高,达0.84。对于其他三种的代谢物浓度比,LCModel和TARQUIN计算结果相关性比较差。
LCModel和TARQUIN计算结果点状图如图3所示,可以看出LCModel分析得到的代谢物浓度比值和LCModel得到的结果并不完全一致。
表1 TARQUIN 和LCModel分析结果相关系数
Tab.1 The correlation coefficients between TARQUIN and LCModel
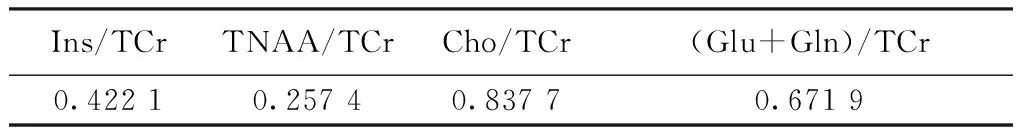
Ins/TCrTNAA/TCrCho/TCr(Glu+Gln)/TCr0.42210.25740.83770.6719
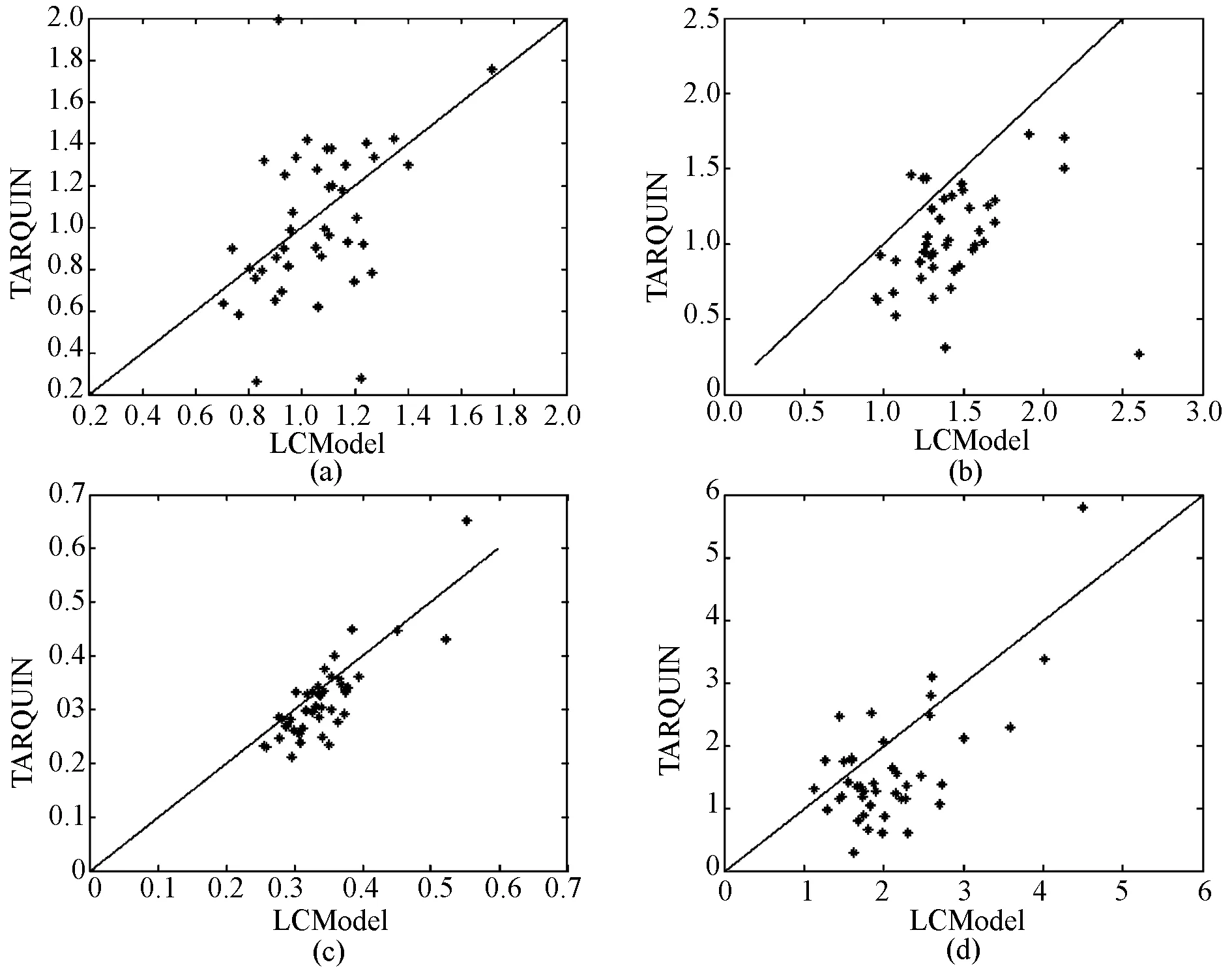
图3 代谢物浓度比点状图。 (a) Ins/TCr; (b) TNAA/TCr; (c) Cho/TCr; (d) (Glu+Gln)/TCrFig.3 Metabolite concentration ratio calculated by LCModel and TARQUIN. (a) Ins/TCr; (b) TNAA/TCr; (c) Cho/TCr; (d) (Glu+Gln)/TCr
表2显示了TARQUIN和LCModel分析结果的相对差值。第2列为r均值,第3和第4列为r均值置信区间,第4列为r的方差。对于Ins/TCr 和Cho/TCr,TARQUIN和LCModel差值平均小于8%,而对TNAA/TCr 和 (Glu+Gln)/TCr,TARQUIN和LCModel的计算结果差别较大。对于Cho/TCr,TARQUIN和LCModel计算结果的差值方差较小。整体来说,LCModel和TARQUIN计算的代谢物浓度比值差别较大。
表2 TARQUIN 和LCModel分析结果差值
Tab.2 The difference of the analyzed result between LCModel and TARQUIN
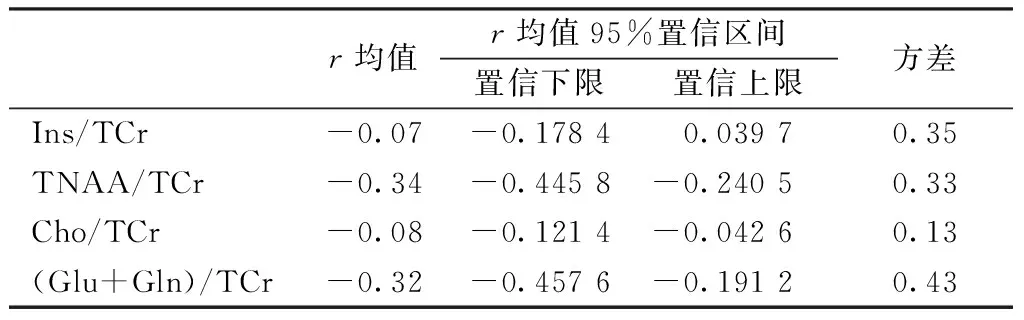
r均值r均值95%置信区间置信下限置信上限方差Ins/TCr-0.07-0.17840.03970.35TNAA/TCr-0.34-0.4458-0.24050.33Cho/TCr-0.08-0.1214-0.04260.13(Glu+Gln)/TCr-0.32-0.4576-0.19120.43
3 讨论
本研究在波谱采集时采用了多体素采集方法,在CSI体素的选择时,采用了图像分割和图像匹配的办法实现了体素的自动选取,避免了人工选择给实验带来的误差。
TARQUIN参数start point明显地影响了基线的形状,这一点和文献[9]的对比结果相同。当start point取默认参数20时(见图2(c)),TARQUIN的分析结果和LCModel分析结果最为接近,尤其是对于模型信号在1.4~1.8×10-6处。在默认参数设置下,LCModel分析的基线一般比TARQUIN分析的基线更加平滑,这一点和文献[9]的分析不同,其中采用的是单体素采集,而本研究采用的是多体素采集,此时体素定位会更加准确,但缺点是回波时间TE会增大,T2弛豫影响会增大,这可能是导致结果差异的重要原因。
从表1中可以,看到只有Cho/TCr,LCModel和TARQUIN的分析结果相关性较强,相关系数为0.837 7。从图3(a)和图3(b)中以看到,下面有两个点TARQUIN计算的结果比LCModel计算的结果小很多,较低的相关系数可能是由这两个点导致的。另外,随机误差也会使得相关系数降低。从表2中可以看到,代谢物浓度比Ins/TCr, Cho/TCr, TNAA/TCr and (Glu+Gln)/TCr,TARQUIN的计算结果平均水平要比LCModel的计算结果低,这可能是TARQUIN对于TCr比LCModel计算的偏高造成的。对与几种代谢物浓度比,LCModel和TARQUIN计算的结果一致性较差。在计算过程中,对与基集(basis set)[7],采用了LCModel和TARQUIN的默认基集。在LCModel和TARQUIN中,默认基集采用的是同一型号的多台磁共振仪同一序列协议所测得的平均基集。使用平均基集有助于不同磁共振仪之间的MRS量化结果的对比,但是机器之间的差别却成为了一个随机误差。同时,LCModel和TARQUIN的基集也并不完全一致,这也增加了实验结果的随机误差。
在本研究中可以看到,TARQUIN和LCModel计算的相对浓度差异较大,但是并不能判断在临床使用中那个算法更优。在临床大脑组织发生病变时,MRS信号会发生变化。例如:在阿尔兹海默病中,患者海马区的NAA/Cr会下降;在脑肿瘤中,患者脑肿瘤处的Cho/Cr会升高。所以,在后续的对比工作中,可以采集一组正常人波谱数据和一组脑肿瘤患者的波谱数集,用LCModel计算相对代谢物Cho/Cr的值,计算在正常和脑肿瘤患者之间Cho/Cr组间差异的显著性值,然后再用TARQUIN进行计算,得到其组间差异的显著性值,最后通过比较两次计算的显著性值来判断LCModel和TARQUIN在分析脑肿瘤波谱数据时哪个表现得更好。同样,也可以比较LCModel和TARQUIN在分析其他疾病波谱时的优劣。
4 结论
采用多体素采集波谱数据,并用图像分割和图像配准的方法,实现了CSI体素的自动选取。然后,对比了TARQUIN中start point参数对TARQUIN计算结果的影响,分析了LCModel和TARQUIN计算结果的相关系数和相对偏差。结果显示,TARQUIN计算的模型信号和LCModel的结果非常接近。TARQUIN中参数start point的值会明显地影响基线的形状。然而,对于代谢物的浓度比Ins/TCr、TNAA/TCr、Cho/TCr 和(Glu+Gln)/TCr,TARQUIN和LCModel 的分析结果并不完全一致,TARQUIN分析的结果比LCModel分析的结果平均偏小。在MRS研究和临床应用中,使用这LCModel和TARQUIN得到的结果差别较大,可比性较差。
[1] De Graaf RA. Spectroscopic imaging and multivolume localization [M]//De Graaf RA. In Vivo NMR Spectroscopy. Chichester: John Wiley & Sons Ltd, 2007: 349-387.
[2] Allen D. Elster Md JHBM. Questions and answers in magnetic resonance imaging [M]. (2nd ed). St Louis: Mosby, 2001.
[3] Panigrahy A, Nelson MD, Jr Bluml S. Magnetic resonance spectroscopy in pediatric neuroradiology: Clinical and research applications [J]. Pediatr Radiol, 2010, 40(1): 3-30.
[4] Rosen Y, Lenkinski RE. Recent advances in magnetic resonance neurospectroscopy [J]. Neurotherapeutics, 2007, 4(3): 330-345.
[5] Soares DP, Law M. Magnetic resonance spectroscopy of the brain: review of metabolites and clinical applications [J]. Clin Radiol, 2009, 64(1): 12-21.
[6] Poullet JB, Sima DM, Van Huffel S. MRS signal quantitation: A review of time- and frequency-domain methods [J]. J Magn Reson, 2008, 195(2): 134-144.
[7] Provencher SW. Estimation of metabolite concentrations from localized in vivo proton NMR spectra [J]. Magn Reson Med, 1993, 30(6): 672-679.
[8] Reynolds G, Wilson M, Peet A, et al. An algorithm for the automated quantitation of metabolites in in vitro NMR signals [J]. Magn Reson Med, 2006, 56(6): 1211-1219.
[9] Wilson M, Reynolds G, Kauppinen RA, et al. A constrained least-squares approach to the automated quantitation of in vivo 1H magnetic resonance spectroscopy data [J]. Magn Reson Med, 2011, 65(1): 1-12.
[10] De Graaf RA. Single volume localization and water suppression [M]//De Graaf RA. In Vivo NMR Spectroscopy. Chichester: John Wiley & Sons Ltd, 2007: 297-348.
[11] Sajja BR, Wolinsky JS, Narayana PA. Proton magnetic resonance spectroscopy in multiple sclerosis [J]. Neuroimaging Clin N Am, 2009, 19(1): 45-58.
[12] Bertolino A, Callicott JH, Nawroz S, et al. Reproducibility of proton magnetic resonance spectroscopic imaging in patients with schizophrenia [J]. Neuropsychopharmacology, 1998, 18(1): 1-9.
[13] Vermathen P, Laxer KD, Matson GB, et al. Hippocampal structures: anteroposterior N-acetylaspartate differences in patients with epilepsy and control subjects as shown with proton MR spectroscopic imaging [J]. Radiology, 2000, 214(2): 403-410.
[14] Kantarci K. 1H magnetic resonance spectroscopy in dementia [J]. Br J Radiol, 2007, 80 Spec No 2(S)146-152.
[15] Ross BD, Bluml S, Cowan R, et al. In vivo MR spectroscopy of human dementia [J]. Neuroimaging Clin N Am, 1998, 8(4): 809-822.
[16] Valenzuela MJ, Sachdev P. Magnetic resonance spectroscopy in AD [J]. Neurology, 2001, 56(5): 592-598.
[17] Fountas KN, Kapsalaki EZ, Gotsis SD, et al. In vivo proton magnetic resonance spectroscopy of brain tumors [J]. Stereotact Funct Neurosurg, 2000, 74(2): 83-94.
[18] Yang D, Korogi Y, Sugahara T, et al. Cerebral gliomas: prospective comparison of multivoxel 2D chemical-shift imaging proton MR spectroscopy, echoplanar perfusion and diffusion-weighted MRI [J]. Neuroradiology, 2002, 44(8): 656-666.
[19] Brateman L. Chemical shift imaging: A review [J]. AJR Am J Roentgenol, 1986, 146(5): 971-980.
[20] Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement [J]. Lancet, 1986, 1(8476): 307-310.
A Comparison of Magnetic Response Spectroscopy Quantification
Tools between TARQUIN and LCModel
Xue Aiguo1Liu Renyuan2Xu Lingyi1Zhang Bing2Sun Yu1Wan Suiren1#*
1(MedicalElectricsLaboratoryofSoutheasternUniversity,Nanjing210096,China)
2(DepartmentofRadiology,TheAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing210008,China)
magnetic resonance spectroscopy; LCModel; TARQUIN
10.3969/j.issn.0258-8021. 2016. 03.017
2016-01-28, 录用日期:2016-03-18
R318
D
0258-8021(2016) 03-0375-05
# 中国生物医学工程学会会员(Member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: srwan@seu.edu.cn
