血液机械损伤体外模拟剪切装置研究进展
2016-02-16尹成科徐博翎
陈 汐 尹成科 吴 鹏 徐博翎
(苏州大学机电工程学院,苏州大学人工心脏研究所,江苏 苏州 215021)
血液机械损伤体外模拟剪切装置研究进展
陈 汐 尹成科*吴 鹏 徐博翎
(苏州大学机电工程学院,苏州大学人工心脏研究所,江苏 苏州 215021)
近年来,由于饮食环境及社会老龄化等多方面因素,心血管患者越来越多,且在中低收入国家的发病率呈上升趋势。机械循环辅助装置(MCSDs)可辅助或替代人体天然器官的泵血及氧合功能,是挽救终末期心衰患者生命的重要治疗手段,临床需求十分迫切。但在中长期临床应用中,MCSDs中非生理性流场引起的血液机械损伤已成为其发展的严峻挑战。研究人员已开发多种体外模拟血液机械损伤的血液剪切装置(BSDs)来研究血液机械损伤,但其损伤机理到目前为止尚未得到很好的阐释。回顾具代表性的锥板型和环形库特流血液剪切装置及其优缺点,对目前主流的环形库特流血液剪切装置进行了较为详尽的阐述和对比分析,讨论装置中影响实验结果的重要因素,从间隙精度、流道设计、密封及支撑方式、温度控制等方面对血液机械损伤体外模拟剪切装置的发展提出展望。
机械循环辅助;血液机械损伤;血液剪切装置;剪应力;作用时间
引言
近年来,由于饮食环境及社会老龄化等多方面因素,心血管患者越来越多,且在中低收入国家的发病率呈上升趋势[1-3]。机械循环辅助装置(mechanical circulatory support devices, MCSDs)的目的是维持、改善终末期或急危重患者的循环状况及重要脏器的血液灌注,保证机体氧供,为心肺功能恢复或进一步治疗争取时间[4-5]。MCSDs主要种类有全人工心脏(total artificial heart, TAH)、心室辅助装置(ventricular assist device,VAD)及体外膜肺氧合器(extracorporeal membrane oxygenation, ECMO)等[6-8]。在供体器官紧缺的现实情况下,MCSDs临床需求十分迫切。全球每年有超过15 000个长期或短期血泵应用于临床,并呈逐年增长趋势[9]。2006—2014年,共13 155个VAD和303个TAH被植入人体[10]。美国FDA已经批准了多个产品进入临床应用,较具代表性的有Heartmate II、HVAD等[11-13],而国内的相关研究才刚刚起步[14]。
随着中长期MCSDs临床应用的普及,其并发症也逐渐受到重视,其中血液相容性问题已经成为临床应用上的严峻挑战。Whitson等的统计结果显示,2005—2012年间植入了Heartmate II LVAD的193例心衰患者中,有13.4%的患者发生了溶血或凝血[15]。在Bhat等报告的227例Heartmate II植入患者中,有7.49%发生溶血[16]。Katz等的调查结果显示,在260个植入VAD的患者中有5.36%发生溶血,从植入到发生溶血的平均时间仅为7.4个月[17]。
血液是一种包含红细胞、白细胞、血小板及各类蛋白等复杂成分的生物活性液体,剪应力对其生物活性成分有一定的影响。在人体循环系统的生理性流场中,血管壁面剪应力(wall shear stress,WSS)平均约为1 Pa,当心室收缩时约为4 Pa,在小动脉中最高可达15 Pa,如图1所示,其中黑色线表示平均WSS,灰色线表示心脏收缩期的最高WSS[18]。但在MCSDs的非生理性流场中,其剪应力往往远高于人体循环系统的生理性流场中的剪应力,如ECMO中的最高剪应力达到52 Pa;旋转血泵中叶片某些局部区域的剪应力甚至超过1 000 Pa[19-20],超出人体生理性流场中最大值的67倍。血液细胞在非生理性流场的高剪应力作用下,经过一段时间会发生不可逆的损伤,如红细胞破裂溶血、血小板损伤凝血和纤溶等,严重的血液机械损伤会引起患者一系列术后并发症甚至危及生命[21-22]。
一般认为,MCSDs中的非生理性流场剪应力对血液机械损伤机理是高剪应力导致的血红细胞或血小板变形变性等[23]。然而,非生理性流场剪应力对血液活性成分的机械损伤机理目前尚未得到完全的阐释。因此,自20世纪60年代中期开始,研究人员开始利用体外模拟血液机械损伤的血液剪切装置(blood shearing devices,BSDs),研究非生理性流场中的血液机械损伤。研究关注点主要是血液细胞所受剪应力大小及其作用时间与血液机械损伤结果的关系,也有学者研究了机械表面粗糙度、血液压强与血液损伤的关系。根据所产生的剪应力和作用时间的范围差异,可将目前的血液剪切装置分为锥板型剪切装置和环形库特流剪切装置两大类。下面分别介绍这两种典型结构的几种不同实现方案,分析其主要参数范围和优缺点,并讨论今后血液剪切装置的发展方向。
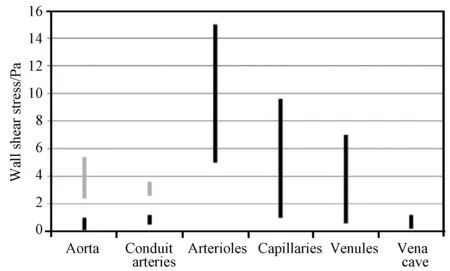
图1 生理性流场各部分WSS[18]Fig.1 WSS in a physiological flow field[18]
1 血液剪切装置
1.1 锥板型血液剪切装置
锥板型血液剪切装置由锥板黏度计改装而来,其结构如图2所示,主要由锥形转子和板形定子组成。当锥形转子旋转时,可在被试血液中产生均匀的速度梯度,从而形成均匀的剪应力。为了保证间隙内的剪切流场均匀,同时也有利于减少实验血液用量,锥面和板平面之间的夹角通常在0.5°~1°之间。锥板型血液剪切装置中的流场特征可以通过下式给出的雷诺数评估,即
(1)
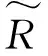
研究表明,当雷诺数小于0.5时,间隙内能够产生稳定的无涡周向层流;而当雷诺数大于4时,间隙内会出现径向涡流[24-25]。为了保证间隙内流场为稳定的无涡周向层流,液体黏度υ不能过低,转子转速ω不能过高。因此,锥板型血液剪切装置较适用于研究血液在低剪应力作用下的机械损伤。
锥板型血液剪切装置自20世纪80年代早期开始,被广泛用于测量剪应力作用下血小板活跃程度、血液黏度及红细胞损伤[26-28]。1977年,Williams等用锥板型血液剪切装置(见图2)研究了剪应力作用下红细胞的易碎性[26],其装置包括一个半径3.5cm的不锈钢锥形转子,一个不锈钢板型定子,转子与定子保持临界接触,血液在锥与板之间的间隙里承受剪应力。整个实验进行了5min。通常来说,锥板型剪切装置中的血液在剪切间隙内受到反复多次剪切,剪切作用时间普遍较长。
图3 锥板-库特流血液剪切装置[29]Fig.3 Cone-plate-Couette BSD[29]
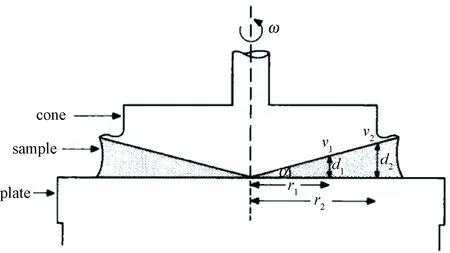
图2 锥板型血液剪切装置[26]Fig.2 Cone-plate BSD[26]
除红细胞损伤外,近几年学者们开始研究剪应力对血小板的影响。Nobili等在2008年改进了Blackman的血液剪切装置,研究了剪应力作用下血小板活跃程度的变化[29-30]。该装置如图3所示,结合了锥板型血液剪切装置与库特流血液剪切装置的特点,锥与板之间的间隙为10μm,呈2°锥角,环状定子的内壁与锥外壁之间形成大约720μm宽度的库特流剪切环间隙。相比单纯锥板型剪切装置而言,Nobili等改进后的装置流场更为稳定,最高可实现7.5Pa剪应力而不会产生径向涡流。
也有学者对血液压强可能造成的血液损伤进行了研究。Yasuda等在2001年搭建了锥杯型血液剪切装置[31],实现了静压力、剪应力及温度这三个实验参数引起血液机械损伤的定量测量。实验中利用空气压缩机维持锥-杯腔内的静态压力,使用水冷系统使温度保持恒定。结果显示,红细胞承受高剪应力时,静压力对溶血影响较大。
综上所述,锥板型血液剪切装置中为了实现无涡周向层流,避免径向涡流甚至湍流,要求转子转速不能过高,因此可实现的最大剪应力低于10Pa。由于结构本身的限制,锥板型血液剪切装置难以实现更高的剪应力,无法模拟旋转式血泵中的高剪应力流场,也无法实现较短剪切作用时间的血液损伤测量。因此,在血液机械损伤研究中逐渐被环形库特流血液剪切装置替代。
1.2 环形库特流血液剪切装置
环形库特流血液剪切装置由电控库特黏度计原理发展而来,利用两个同轴圆柱构成环形剪切间隙,它们相对转动时剪切间隙内产生剪应力。液体从环形间隙的一侧流入,从另一侧流出,剪切作用时间可以通过流速准确地控制。现有的环形库特流血液剪切装置中的最大剪应力可达到800~900 Pa,其最短作用时间已接近毫秒量级,相比锥板型血液剪切装置,库特流血液剪切装置可针对高剪应力短作用时间进行血液机械损伤实验,更能满足旋转式血泵的非生理性流场优化设计需求,因此成为了血液机械损伤体外模拟装置的主要发展方向。环形库特流血液剪切装置中的流场特征可以通过下式给出泰勒数评估[32],有
(2)
式中,T为泰勒数,R0是外圆柱的内径,Ri是内圆柱的外径,ω是内外圆柱的旋转角速度之差,δ是环形间隙的大小,υ是液体的运动黏度。
研究表明,当泰勒数大于1 712时,环形剪切间隙中产生泰勒涡。泰勒数越大,流动越不稳定,最终将成为湍流[33]。
最早的环形库特流血液剪切装置见于Pohl在2000年的实验,他为了验证聚丙烯酰胺溶液(Polyacrylamides,PAA)代替血液做溶血实验的可行性,设计了如图4所示的环形板板血液剪切装置[34]。该装置由旋转的上圆盘和静止的下圆盘组成,两圆盘之间的间隙为0.3mm,通过改变上圆盘的旋转速度可改变间隙中的剪应力。血液由注射泵从圆盘下方推入并流经剪切域,通过改变流速可改变剪切作用时间。该装置剪切间隙容易调整,但间隙两侧的槽内容易发生涡状回流,流场特征不是十分理想,密封部分也会引入实验误差。
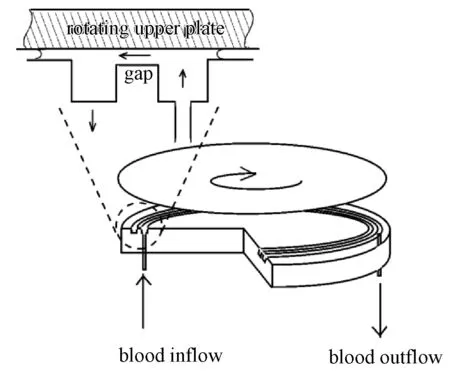
图4 环形板板血液剪切装置[34]Fig.4 The annular plate-plate BSD[34]
德国亚琛工业大学在血液机械损伤方面进行了大量的研究,他们采用了库特流血液剪切方案,并利用液体密封来降低血液的二次损伤。Klaus等开发的装置剪切间隙为0.12mm,内部转子用血液相容性优良的钛合金(TiAl6V4)制成,外部定子用聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)制成以方便观测。装置上下各有两个入口注入密封液体Perfluorcarbon(一种碳氟化合物),血液从一侧由注射泵注入环形间隙,在间隙中与密封液体混合,在另一侧出口处取得混合溶液,再将其分离得到血液样本进行溶血检测[35]。检测结果用溶血指数(indexofhemolysis,IH)来表征,它被定义为血浆游离血红蛋白占全部血红蛋白的百分比,由下式计算得到:
(3)
式中,IH为溶血指数,Hct为红细胞比容,fHb为血浆游离血红蛋白浓度,Hb为血红蛋白浓度。
2001年,Klaus等用猪血完成了体外剪切实验[35],结果显示血液机械损伤导致的溶血现象存在一个相对安全的范围。在剪应力400Pa以下,作用时间400ms以内,测得的溶血指数非常低,只有超出上述范围后才会发生明显溶血(IH>0.75%)。Klaus等认为,之所以他们得到的发生明显溶血的临界剪应力值远低于前人的结果,在于用液体密封取代了前人实验装置中传统的机械密封[36-38],降低了对血液的额外损伤。在此之后,Leverett、Wurzinger均在不同溶血临界剪应力及其作用时间的单一实验条件下验证了血液损伤范围[39-41]。Paul等采用了0.15mm的环形间隙,并使装置在无泰勒涡情况下产生了500Pa的剪应力,作用时间为0.001~1s。结果显示,溶血安全范围(IH<0.8%)对应的临界剪应力为425Pa、作用时间为620ms,在实验参数范围内的最大溶血指数为3.5%。与Klaus的装置相比,该装置中的环形间隙大30μm(25%)。剪切间隙变大后,对同样的机械轴承误差而言,间隙变化导致剪应力相对误差变小,结果应该更为准确。Paul等同时分别用猪血和牛血进行了剪切实验并做了对比,发现猪血比牛血更接近于人血,容易在剪应力下发生损伤[35,42],因此用于血液损伤实验更为可靠。
Boehning等在2014年改进了Klaus及Paul的血液剪切装置。改进后的装置如图5所示,主要优化了液体密封结构,在实验过程中密封液不会混入血液,避免了后续分离步骤,提高了实验的可信度[43]。同时,为了增加装置所能产生的剪应力幅值,剪切间隙缩小至55、47μm。在剪应力为24、592、702、842Pa,作用时间为54、873ms的条件下分别进行实验,结果表明剪应力超过600Pa、作用时间超过873ms以上才会发生明显的溶血(IH>0.9%),进一步拓展了之前的血液机械损伤安全范围。值得一提的是,他测出在温度为23℃、剪应力为40~50Pa时,Hct为40%的猪血平均黏度为5mPa·s,而不是前人惯用的经验值3.6mPa·s,使得实验结果更加可信。

图5 Boehning等改进的环形库特流血液剪切装置[43]Fig.5 The annular Couette BSD developed by Boehning, et al[43]
2006年,Maruyama等为了研究表面粗糙度对溶血的影响,设计了转子为锥-柱-锥型的血液剪切装置[44]。该装置的转子两侧为锥形,中间为圆柱形,剪切间隙为0.85 mm,如图6所示。利用喷砂改变转子剪切表面的粗糙度,粗糙面积可以通过喷砂范围进行调整。实验液体为牛血,实验时间为30 min。结果发现,粗糙度从Ra=0.1 μm到Ra=0.6 μm,溶血指数变化不明显,而粗糙度从Ra=0.6 μm到Ra=0.8 μm,溶血指数升高了73.85%。粗糙面积百分比从0到10%,溶血指数升高了138.24%,而粗糙面积百分比从10%到100%,溶血指数变化不明显。该实验显示,粗糙度和粗糙面积都存在某个溶血安全范围,但其中的机理尚不清楚。

图6 Maruyama等开发的环形库特流血液剪切装置[44]Fig.6 The annular Couette BSD developed by Maruyama, et al[44]
2011年,马里兰大学的Zhang等将Jarvik 2000和CentriMag血泵转子叶片替换为锥-柱-锥型或柱型结构,改造出了两种库特流血液剪切装置,分别称为H型、L型血液剪切装置[45],剪切间隙分别为0.1和0.15 mm,如图7所示。室温下的血液由外部泵推送流经剪切间隙,通过调节转子转速和血液流速,产生了50~320 Pa的剪应力以及0.039~1.48 s的作用时间。实验测得溶血指数为0.001 9%~1.45%,平均值为0.36%,标准偏差为0.31%。相比以前的实验结果,在同等实验参数范围内测出的溶血指数明显降低。原因可能是这两个血泵分别是部分/完全磁悬浮血泵,避免了机械密封产生的额外血液损伤等实验误差[42]。
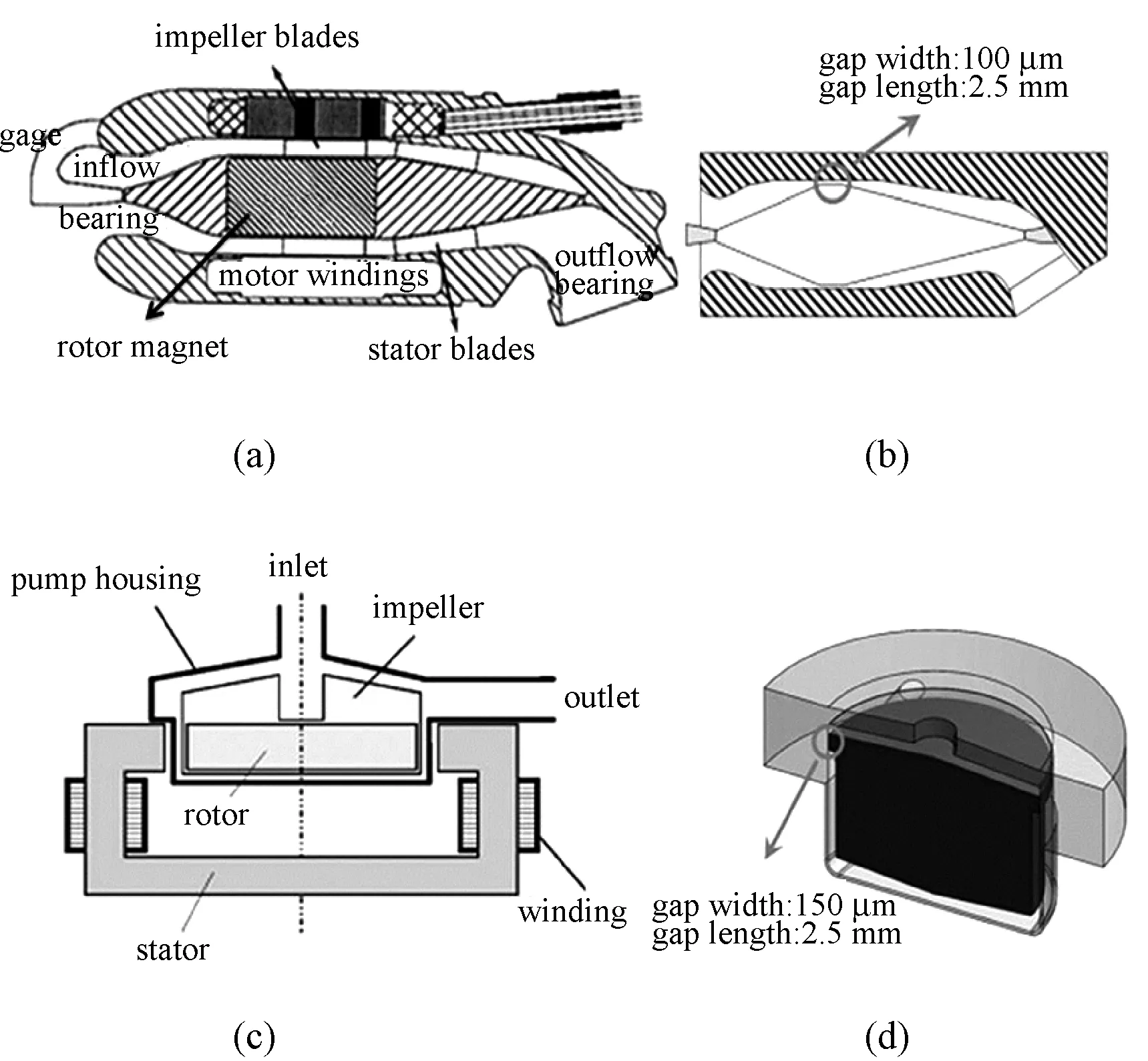
图7 Zhang等改造的环形库特流血液剪切装置[45] (a)Jarvik 2000血泵;(b)H型血液剪切装置;(c)CentriMag血泵;(d)L型血液剪切装置Fig.7 The annular Couette BSD developed by Zhang, et al[45] (a) Jarvik 2000 blood pump and its resulting; (b) Hemolyzer-H BSD; (c)CentriMag blood pump and its resulting; (d)Hemolyzer-L BSD

图8 Chen等改装的环形库特流血液剪切装置[46]Fig.8 The annular Couette BSD developed by Chen, et al[46]
非生理性流场中的高剪应力除了损伤红细胞引发溶血,也会使血小板糖蛋白脱落引发凝血。马里兰大学的Chen等在2015年改装Jarvik 2000血泵,得到了如图8所示的血液剪切装置。装置转子也呈锥-柱-锥型,由注射泵将血液推送经过剪切域,在不同的剪应力幅值(150、225、300 Pa) 和作用时间(0.05、0.5 s)下研究了短时间高剪应力下血小板糖蛋白的脱落现象[46]。
改装血泵得到的血液剪切装置的优点是比较接近血泵中的实际情况,避免了密封引起的实验误差,无需从零开始设计剪切实验装置;但缺点在于血泵内的流场往往是为水力学效率等优化的,流场形态相对复杂,不同血细胞所经历的剪切过程不同,只能得到一个综合性的结果,无法分析出剪应力与血液损伤的具体量化关系,具有一定的局限性。
在此之前,研究人员通常假设库特流剪切域内每一处的剪应力大小及其作用时间均相同。然而,Wu于2005年指出,血液进入和离开环形剪切间隙时有较大的速度梯度,存在剪应力峰值;剪切间隙出口附近液体会发生分离或回流,部分血液可能会经历更长时间的剪切[47],因此不同的剪切间隙对实验结果也会有影响。于是,Wu等设计了一种间隙可调的血液剪切装置。该装置具有中空外转子竖直流道和一个很短的倾斜环形库特流剪切区域,可通过调整定转子剪切部件的相对轴向位置来调整剪切间隙。该装置的优点在于剪切域轴向长度很短(最大3.4 mm),剪切间隙可以调整,可以测试高剪应力、短作用时间下的血液损伤。Wu用CFD模拟了该装置中血液细胞的流动路径及所承受的剪应力,认为该结构的流场具有更好的泰勒稳定性,能产生更均匀的剪应力,但该装置尚无后续的实验结果报道。
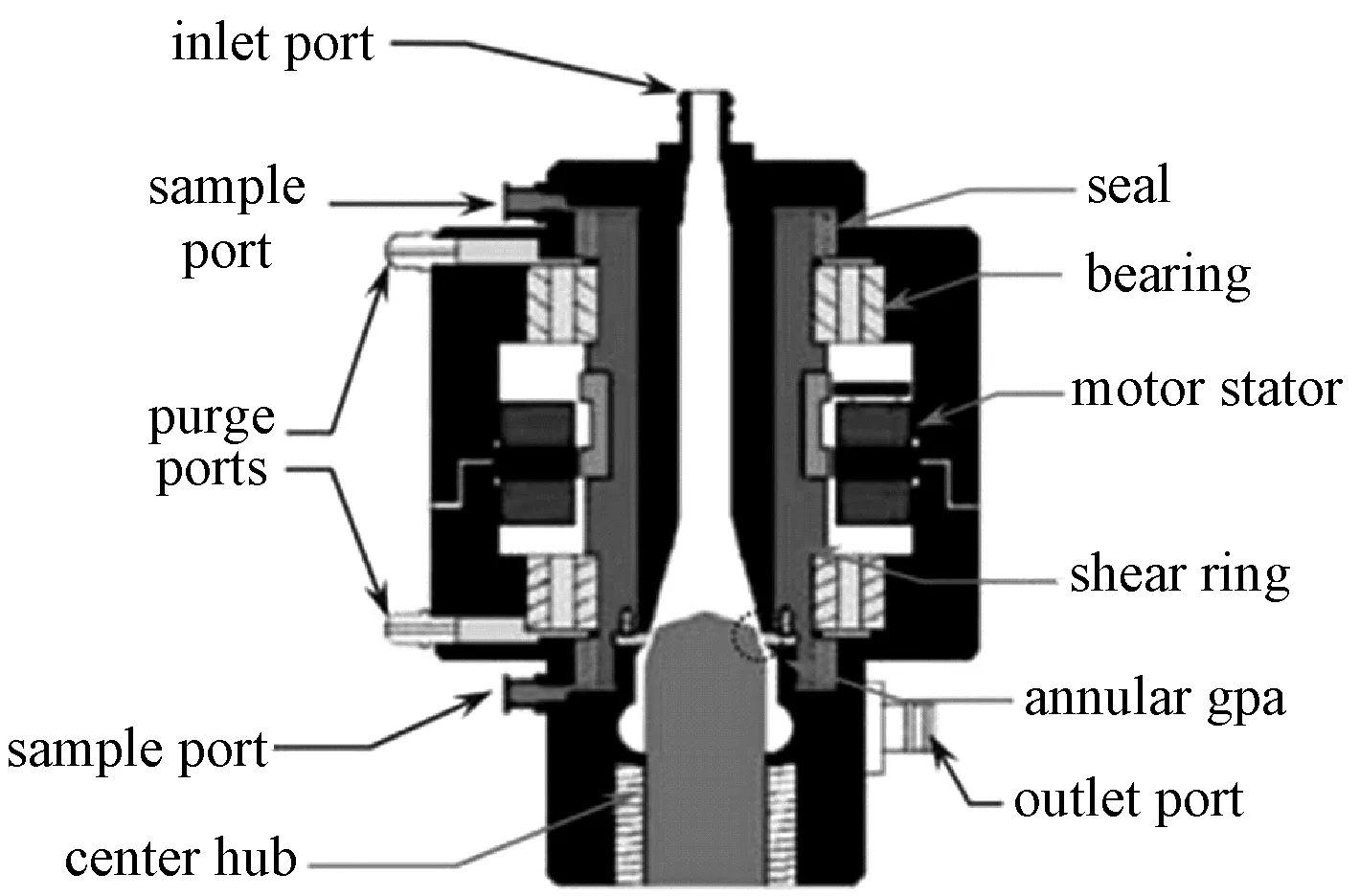
图9 间隙可调的库特流血液剪切装置[47]Fig.9 The Couette BSD with adjustable gap[47]
2 讨论
现有的血液剪切装置仍不能满足对MCSDs血液相容性研究的需求,不发生明显溶血的剪应力及其作用时间的安全范围、血液机械损伤的深层机理还未得到很好的揭示和阐释,准确的溶血数学模型尚未建立。MCSDs中的流场大部分区域剪应力较低,但局部剪应力远高于生理性流场中的剪应力。锥板型血液剪切装置由于结构本身的限制,仅适合在低剪应力长作用时间下进行实验。环形库特流血液剪切装置可以实现较高的剪应力,作用时间也容易准确控制,但目前能提供的最高稳定剪应力仅能达到800~900 Pa,仍未达到MCSDs的需求[19-20]。进一步提高剪应力需要更高的转速或更小的剪切间隙,但受泰勒不稳定性和机械轴承精度的限制,提高剪应力的同时保证流场的稳定性和一致性是环形库特流血液剪切装置的发展需要解决的难题。此外,针对亚毫秒量级作用时间的剪切装置还不成熟。目前锥板型与环形库特流血液剪切装置的比较见表1。
为了快速评估不同剪应力及其作用时间下造成的溶血情况,根据实验数据,研究人员总结出了溶血数学模型[36,39,48-50],有
(3)
式中,IH为溶血指数,A、α、β为系数,τ为剪应力大小,t为剪应力作用时间。
表1 现有的锥板型及环形库特流血液剪切装置优缺点
Tab.1 Merits and drawbacks of current cone-plate BSDs and annular Couette BSDs
然而,不同环形库特流血液剪切装置给出的模型系数存在较大的差异(见表2),原因是各个装置的结构和实验条件都不尽相同:
1)密封方式不同。机械密封会引起额外的血液损伤,液体密封可能会引起混合的问题。
2)支撑方式不同。机械轴承自身也会损伤血液,引起实验误差。
3)温度不同。大部分实验并未精确地控制和考察温度的影响。
4)血液类型不同。不同物种的血液在性质上存在较大差异。
表2 剪应力及其作用时间与溶血指数的数学模型系数
Tab.2 Coefficients of mathematic models for shearing stress, exposure time and IH

系数Lambert1976[42]Heuser1980[38]Giersiepen1990[36]Zhang2011[45]A11.8×10-63.62×10-51.228×10-5α11.9912.4161.9918β0.50.7650.7850.6606
现有环形库特流血液剪切装置的实验条件对比见表3。
目前,血液机械损伤的研究主要集中在红细胞破裂引发的溶血,而其他形式的血液机械损伤机理(如血小板糖蛋白脱落引发的凝血等方面)的研究还刚刚起步。其中,式(3)所示的红细胞损伤的数学模型被使用了很长时间,但现在正逐渐被人们所质疑:一是该模型显示血液承受低剪应力的长时间作用亦会引发明显的溶血,显然与生理性流场的情况不相符;二是从现有的实验结果来看,剪应力、作用时间引起的溶血可能存在某个安全范围,只有超出这一范围后才会导致明显溶血。因此,溶血指数与剪应力、作用时间的关系应该具有分段特征。但
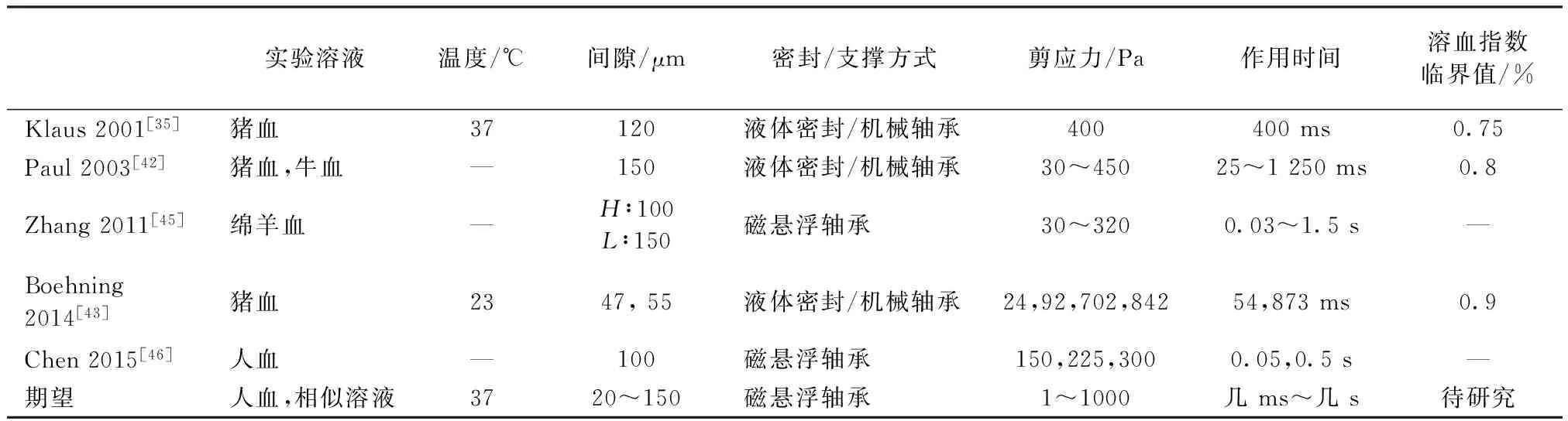
表3 环形库特流血液剪切装置实验条件对比及其期望Tab.3 Comparison between experimental conditions for annular Couette BSDs and expectations
是,现有数学模型与此不符。所以,开发出更优良的血液剪切损伤装置,获得更准确全面的实验结果,进而建立新的溶血数学模型,已成为推动未来血液机械损伤研究的重要基础。
3 发展趋势
综上所述,血液剪切装置的关键指标为:
1)可产生均匀稳定一致的剪切流场;
2)剪应力、作用时间要满足要求,且这两个参数可以独立调整;
3)剪切过程中温度可控;
4)剪切过程易于观察,测量分析步骤简洁高效;
5)避免机械轴承和密封对血液的额外损伤;
6)装置材料的血液相容性好,表面粗糙度可控。
总体来说,环形库特流血液剪切装置比锥板血液剪切装置更有优势,但现有的环形库特流血液剪切装置还存在不足。笔者认为,未来可从间隙精度、流道设计、密封及支撑方式、温度控制等方面加以改进。
3.1 间隙精度
旋转血泵中叶轮边缘局部区域剪应力高达1 000 Pa[19-20]。目前,大多数血液剪切装置的剪切间隙为100~150 μm,剪应力在30~450 Pa之间,剪应力作用时间在几十毫秒到几秒的范围内。为了进一步提高剪应力,Boehning等将间隙缩小到几十微米,可产生高达842 Pa的剪应力[43]。但对于如此小的剪切间隙,机械支撑轴承间隙变化对剪切间隙的影响不可忽视,而剪切间隙的波动将直接导致剪应力的波动,引起实验误差。因此,在机械轴承支撑的血液剪切装置中,进一步减小剪切间隙存在一定困难。磁悬浮轴承或液力悬浮轴承或能达到更高的位置精度,将来可予以考虑。
3.2 流道设计
现有剪应力和作用时间导致溶血的数学模型尚未完全确立,不同实验得到的结果差别很大,主要原因之一是各装置的流道都不相同。除了剪切区域,部分血液很可能在剪切环出入口附近经受了更大的剪应力和更长的剪切时间。未来应设计简单直观的流道,重点优化装置的入口和出口的流场、剪切间隙附近的流场、剪切间隙内的流场,尽量减小前切区域出入口附近的高剪应力峰值,避免流道中出现涡流。
3.3 密封及支撑方式
密封及支撑方式对实验结果的准确度有较大的影响,液体密封引起的混合及分离可能引入实验误差。对比磁悬浮剪切装置及其他装置得出的实验结果,可以看出相近参数下前者的溶血指数明显较低[45],表明机械轴承自身会损伤血液引入误差。最新发展的第三代人工心脏采用了流体力学悬浮或磁悬浮方案,以解决支撑和密封问题[51],显著降低了血泵内大部分区域的剪应力,具备更好的血液相容性[52-55]。因此,目前基于机械轴承的血液剪切装置已经难以满足需求,而无需密封、悬浮式支撑的血液剪切装置应是今后的主要发展方向。
3.4 温度控制
血液是典型的非牛顿流体,温度改变会引起黏度改变及血液生理性质改变。研究表明,当血液红细胞比容为40%时,血液黏度在25℃比在37℃高0.59 mPa·s,且随着红细胞比容升高,这两种温度下的血液黏度差呈上升趋势[56]。可见,在血液机械损伤中,损伤程度与血液温度也有密切的关联[57]。目前,只有少数实验装置考虑了温度控制,大部分装置均在无控制的室温下进行。因此,温度控制特别是剪切间隙内的温度控制,是未来的血液剪切装置中要考虑的重要因素。
目前,机械循环辅助装置中非生理性流场引起的血液相容性问题已经成为亟待解决的难题,其中剪应力造成的血液机械损伤是目前所知的重要因素之一。但是,血液机械损伤的机理和数学模型还未得到完全揭示,除溶血外其他形式的血液机械损伤研究还刚刚起步,相应的基础实验装置也不能满足机械循环辅助装置的设计优化需求。笔者回顾了近30年来具有代表性的锥板型及环形库特流血液剪切装置,分析了两者的优缺点,指出环形库特流血液剪切装置在剪应力及其作用时间等实验条件的控制方面更具有优势。并且,进一步对现有的环形库特流血液剪切装置进行详细对比和分析,最后从间隙精度、流道设计、密封及支撑方式、温度控制等方面探讨血液机械损伤体外模拟剪切装置的发展趋势。
[1] Joshi R, Jan S, Wu Y, et al. Global inequalities in access to cardiovascular health care: Our greatest challenge[J]. Journal of the American College of Cardiology, 2008, 52(23): 1817-1825.
[2] Farmer SA, Lenzo J, Magid DJ, et al. Hospital-level variation in use of cardiovascular testing for adults with incident heart failure: Findings from the cardiovascular research network heart failure study [J]. JACC: Cardiovascular Imaging, 2014, 7(7): 690-700.
[3] Piepoli MF, Corrà U, Abreu A, et al. Challenges in secondary prevention of cardiovascular diseases: A review of the current practice [J]. International Journal of Cardiology, 2015, 180: 114-119.
[4] 贾明, 邵涓涓, 陈英, 等. 机械循环辅助装置治疗围手术期急性心肺功能衰竭 [J]. 心肺血管病杂志, 2008, 27(6): 340-343.
[5] Shreenivas SS, Rame JE, Jessup M. Mechanical circulatory support as a bridge to transplant or for destination therapy [J]. Current Heart Failure Reports, 2010, 7(4): 159-166.
[6] 李崇剑, 王喜梅. 心源性休克的机械循环辅助装置治疗进展 [J]. 心血管病学进展, 2012, 33(1): 36-38.
[7] 马旭东, 杨碧波. 机械循环辅助装置的临床应用 [J]. 医疗装备, 2007, 20(3): 190-192.
[8] 吴龙, 翁渝国, 孙宗全, 等. 心室辅助装置临床应用现状及进展[J]. 中华胸心血管外科杂志, 2012, 28(10): 627-631.
[9] Song X, Throckmorton AL, Untaroiu A, et al. Axial flow blood pumps [J]. ASAIO Journal, 2003, 49(4): 355-364.
[10] Kirklin JK, Cantor RS, Myers SL, et al. Interagency registry for mechanically assisted circulatory support [EB/OL]. http://www.uab.edu/medicine/intermacs/images/descriptive_slides/Federal_Partners_Report_2015_Q1_Slides.ppt. 2015-03-31/2015-09-18.
[11] Topkara VK, O'neill JK, Adam C, et al. HeartWare and HeartMate II left ventricular assist devices as bridge to transplantation: a comparative analysis [J]. Annals of Thoracic Surgery, 2014, 97(2): 506-512.
[12] Sheikh FH, Russell SD. HeartMate© II continuous-flow left ventricular assist system [J]. Expert Review of Medical Devices, 2011, 8: 11-21.
[13] Romano MA, Haft J, Pagani FD. HeartWare HVAD: Principles and techniques for implantation [J]. Operative Techniques in Thoracic and Cardiovascular Surgery, 2013, 18(3): 230-238.
[14] 胡盛寿. 全人工心脏离我们有多远 [EB/OL]. http://www.365heart.com/n/shownews.asp?newsid=97397&Page=2. 2014-02-20/2015-09-18.
[15] Whitson BA, Eckman P, Kamdar F, et al. Hemolysis, pump thrombus, and neurologic events in continuous-flow left ventricular assist device recipients [J]. Annals of Thoracic Surgery, 2014, 97(6): 2097-2103.
[16] Bhat G, Mohamedali B, Yost G. Hemolysis: Predictors of risk factors post left ventricular assist device implantation [J]. Journal of the American College of Cardiology, 2015, 65: A896.
[17] Katz JN, Jensen BC, Chang PP, et al. A multicenter analysis of clinical hemolysis in patients supported with durable, long-term left ventricular assist device therapy [J]. J Heart Lung Transplant, 2014, 34(4): 701-709.
[18] Fraser K. Mechanical stress induced blood trauma [J]. Heat Transfer & Fluid Flow in Biological Processes, 2015: 305-333.
[19] Giersiepen M, Krause U, Knott E, et al. Velocity and shear stress distribution downstream of mechanical heart valves in pulsatile flow [J]. International Journal of Artificial Organs, 1989, 12(4): 261-269.
[20] Li TY, Ye L, Hong FW, et al. The simulation of multiphase flow field in implantable blood pump and analysis of hemolytic capability [J]. Journal of Hydrodynamics, Ser B, 2013, 25(4): 606-615.
[21] Bente T, Bastian B, Jens S, et al. Numerical analysis of blood damage potential of the HeartMate II and HeartWare HVAD rotary blood pumps [J]. Artificial Organs, 2015, 39: 651-659.
[22] Jessup ML, Goldstein D, Ascheim DD, et al. 5 risk for bleeding after MCSD implant: An analysis of 2358 patients in INTERMACS [J]. The Journal of Heart and Lung Transplantation, 2011, 30(4): S9.
[23] Alkhamis TM, Beissinger RL, Jr C. Artificial surface effect on red blood cells and platelets in laminar shear flow [J]. Blood, 1990, 75(7): 1568-1575.
[24] Shankaran H, Neelamegham S. Nonlinear flow affects hydrodynamic forces and neutrophil adhesion rates in cone-plate viscometers [J]. Biophysical Journal, 2001, 80(6): 2631-2648.
[25] Shankaran H, Neelamegham S. Effect of secondary flow on biological experiments in the cone-plate viscometer: Methods for estimating collision frequency, wall shear stress and inter-particle interactions in non-linear flow [J]. Biorheology, 2001, 38(4): 275-304.
[26] Williams AR, Escoffery CT, Gorst DW. The fragility of normal and abnormal erythrocytes in a controlled hydrodynamic shear field [J]. Br J Haematol, 1977, 37(3): 379-389.
[27] Schwartz JA, Keagy BA, Jr J G. Determination of whole blood apparent viscosity: experience with a new hemorheologic technique [J]. Journal of Surgical Research, 1988, 45(2): 238-247.
[28] Giorgio TD, Hellums JD. A cone and plate viscometer for the continuous measurement of blood platelet activation [J]. Biorheology, 1988, 25(4): 605-624.
[29] Nobili M, Sheriff J, Morbiducci U, et al. Platelet activation due to hemodynamic shear stresses: Damage accumulation model and comparison to in vitro measurements [J]. ASAIO Journal, 2008, 54(1): 64-72.
[30] Blackman BR, García-Cardea G, Gimbrone MJ. A new in vitro model to evaluate differential responses of endothelial cells to simulated arterial shear stress waveforms [J]. Journal of Biomechanical Engineering, 2002, 124(4): 397-407.
[31] Yasuda T, Funakubo A, Miyawaki F, et al. Influence of static pressure and shear rate on hemolysis of red blood cells [J]. ASAIO Journal, 2001, 47(4): 351-353.
[32] Taylor GI. Stability of a viscous liquid contained between two rotating cylinders [J]. Philosophical Transactions of the Royal Society of London, 1923, 233(605-615): 289-343.
[33] Chandrasekhar S. Hydrodynamic and hydromagnetic stability [M]. Oxford: Clarendon Press, 1961: 652.
[34] Pohl M, Wendt MO, Koch B, et al. Mechanical degradation of polyacrylamide solutions as a model for flow induced blood damage in artificial organs [J]. Biorheology, 2000, 37(4): 313-324.
[35] Klaus S, Paul R, Reul H, et al. Investigation of flow and material induced hemolysis with a Couette type high shear system [J]. Materialwissenschaft und Werkstofftechnik, 2001, 32(12): 922-925.
[36] Giersiepen M, Wurzinger LJ, Opitz R, et al. Estimation of shear stress-related blood damage in heart valve prostheses—in vitro comparison of 25 aortic valves [J]. International Journal of Artificial Organs, 1990, 13(5): 300-306.
[37] Wurzinger LJ, Opitz R, Eckstein H. Mechanical bloodtrauma. An overview [J]. Angéiologie, 1986, 38: 81-97.
[38] Heuser G, Opitz R. A Couette viscometer for short time shearing of blood [J]. Biorheology, 1980, 17(1-2): 17-24.
[39] Leverett LB, Hellums JD, Alfrey CP, et al. Red blood cell damage by shear stress [J]. Biophysical Journal, 1972, 12(3): 257-273.
[40] Sutera SP, Mehrjardi MH. Deformation and fragmentation of human red blood cells in turbulent shear flow [J]. Biophysical Journal, 1975, 15(1): 1-10.
[41] Sutera SP, Croce PA, Mehrjard M. Hemolysis and subhemolytic alterations of human RBC induced by turbulent shear-flow [J]. Transactions American Society for Artificial Internal Organs, 1972, 18: 335-341.
[42] Paul R, Apel JR, Klaus S, et al. Shear stress related blood damage in laminar Couette flow [J]. Artificial Organs, 2003, 27(6): 517-529.
[43] Boehning F, Mejia T, Schmitz-Rode T, et al. Hemolysis in a laminar flow-through Couette shearing device: An experimental study [J]. Artificial Organs, 2014, 38(9): 761-765.
[44] Maruyama O, Nishida M, Yamane T, et al. Hemolysis resulting from surface roughness under shear flow conditions using a rotational shear stressor [J]. Artificial Organs, 2006, 30(5): 365-370.
[45] Zhang T, Taskin ME, Fang HB, et al. Study of flow-induced hemolysis using novel Couette-type blood-shearing devices [J]. Artificial Organs, 2011, 35(12): 1180-1186.
[46] Chen Z, Mondal NK, Ding J, et al. Shear-induced platelet receptor shedding by non-physiological high shear stress with short exposure time: glycoprotein Ibα and glycoprotein VI [J]. Thrombosis Research, 2015, 135(4): 692-698.
[47] Wu J, Antaki JF, Snyder TA, et al. Design optimization of blood shearing instrument by computational fluid dynamics [J]. Artificial Organs, 2005, 29(6): 482-489.
[48] Blackshear PL, Dorman FD, Steinbach JH, et al. Shear, wall interaction and hemolysis [J]. Asaio Journal, 1966, 12(1): 113-120.
[49] Hellums JD. 1993 Whitaker Lecture: biorheology in thrombosis research [J]. Annals of Biomedical Engineering, 1994, 22(5): 445-455.
[50] Yeleswarapu KK, Antaki JF, Kameneva MV, et al. A mathematical model for shear-induced hemolysis [J]. Artificial Organs, 1995, 19(7): 576-582.
[51] 韩青. 人工心脏液力悬浮支承结构设计及其血液相容性研究 [D]. 杭州:浙江大学, 2012.
[52] Chen C, Yin C, Ma Y, et al. Preliminary evaluation of implantability and biocompatibility of a miniaturized magnetically suspended centrifugal blood pump of a miniaturized magnetically suspended centrifugal blood pump [C]//Slaughter MS, Schneditz D, eds. ASAIO Journal. Philadelphia: Celia Braithwait, 2012: 26.
[53] De RF, Birks EJ, Rogers P, et al. Clinical performance with the levitronix centrimag short-term ventricular assist device [J]. Journal of Heart & Lung Transplantation, 2006, 25(2): 181-186.
[54] John R, Liao K, Lietz K, et al. Experience with the Levitronix CentriMag circulatory support system as a bridge to decision in patients with refractory acute cardiogenic shock and multisystem organ failure [J]. The Journal of Thoracic and Cardiovascular Surgery, 2007, 134(2): 351-358.
[55] Wu G, Lin C, Li H, et al. Initial in vivo evaluation of a novel left ventricular assist device [J]. Bio Med Research International, 2015, 2015: 1-7.
[56] 寇丽筠, 张淑萍, 杨大鹏, 等. 红细胞压积及温度对血黏度的影响 [J]. 北京医学院学报, 1981, 13(1): 34-36.
[57] 王翠兰, 崔娜. 温度在医学检验中的重要性分析 [J]. 齐齐哈尔医学院学报, 2010, 31(8): 1260.
Shearing Device forin-vitroSimulation of Mechanical Blood Damage: A Review
Chen Xi Yin Chengke*Wu Peng Xu Boling
(SchoolofMechanicalandElectricalEngineering,LaboratoryofArtificialOrganTechnology,SoochowUniversity,Suzhou215021,Jiangsu,China)
Due to the increase of dietary changes and aging population, cardiovascular disease (CVD) has surged in modern society. Mechanical circulatory support devices (MCSDs) have become a viable therapeutic solution to assist or replace the failing heart and/or lung, maintaining patients′ physiological circulation. Despite that MCSDs have been developed as bridges to save patients′ lives, blood damage due to non-physiological high shear stress in the flow field within MCSDs has been a major disadvantage. To date, the underlying mechanism has not been studied thoroughly. Therefore, various types of blood shearing devices (BSDs) have been developed. In this paper, a number of representative BSDs were reviewed, including cone-plate and annular Couette types of BSDs. The annular Couette BSDs that are being widely-used were discussed in details. Furthermore, this review discussed the influence of certain parameters and experimental setup on the results. At last, from gap precision, flow design, method of seal and support, even temperature controlling, an outlook for future BSDs was given.
mechanical circulatory support devices; blood damage; blood shearing device; shearing stress; exposure time
10.3969/j.issn.0258-8021. 2016. 03.013
2015-09-18, 录用日期:2015-12-22
江苏省高校自然科学研究面上项目(15KJB310020);江苏省高等学校大学生创新创业训练计划(201410285035Z);国家青年自然科学基金(51406127)
R54; TH122
A
0258-8021(2016) 03-0348-09
*通信作者(Corresponding author), E-mail: yinck@suda.edu.cn
