集成化荧光激活液滴分选系统研究
2016-02-16盛广济樊瑜波
盛广济 朱 君 樊瑜波 李 昂
(北京航空航天大学生物与医学工程学院,北京 100191)
集成化荧光激活液滴分选系统研究
盛广济 朱 君 樊瑜波#李 昂*
(北京航空航天大学生物与医学工程学院,北京 100191)
高通量的荧光激活液滴分选技术在大规模生化试验中能够显著降低实验成本,缩短实验时间,因此在微生物菌株筛选、新药研发、高通量单细胞研究等众多领域具有广泛的应用。然而,目前使用的荧光激活液滴分选系统大多基于光学试验器件搭建,系统的灵活性、稳定性相对较差,搭建的技术门槛较高,限制了该技术在生命科学研究等领域的推广应用。设计一种集成化的荧光激活液滴分选系统,通过特定光路设计,系统所需的荧光激发和探测光路实现集成化、模块化封装,荧光激发和探测功能模块缩小到160 mm×143 mm×54 mm,大幅缩减系统体积。可以通过给普通显微镜增加功能模块的方式,快速实现分选系统的搭建,从而提高荧光激活液滴分选技术的易用性。相比现有文献报道的荧光激活液滴分选系统,成本下降到1/5,体积减小为1/40,有利于该技术的工业化推广。
荧光激活;液滴分选;集成化
fluorescence activated; droplet sorting; system integration
引言
微流控技术能够在很小的尺度上精细地操作流体的运动,配合特殊设计的芯片,能够在片上实现从样品的制备、孵育到反应产物的纯化、分析等一系列操作[1-2],因而催生了片上实验室的概念。该技术能够大大简化传统生化试验流程,降低实验试剂的消耗,提高试验的自动化程度,近年来得到了广泛关注。在微流控技术中,依据反应体系的存在形式,可以分为连续流体体系和微液滴体系。其中,微液滴反应体系是在特殊设计的微流控芯片中,利用水在油相中的乳化效应,将反应体系分割成为相互隔离的微小液滴。液滴在油相中悬浮,在表面活性剂的作用下能够稳定存在。目前,微液滴的生成、融合和液滴可控注入等操作都相对成熟,操作的通量高达每秒钟103个液滴[3],因此能够满足高通量实验的需求。
微液滴实验技术具有的高通量、超小反应体系等突出特点,使得该技术在菌株筛选、药物研发、高通量单细胞研究、微量样品富集等众多领域得到了广泛关注[4-6]。尤其是近年来,以伯乐(Biorad)为代表的微液滴数字PCR技术能够将传统PCR技术的探测灵敏度大大提高,在癌症的早期诊断、测序文库制备等领域都具有极高的应用价值[7]。
但是,目前微液滴技术缺乏标准化的操作平台。其中,液滴的生成、融合、再注入等操作相对简单,研究人员配合特定的微流控芯片能够较简单地完成,但对于液滴的分析以及特定目标的高通量筛选操作非常复杂。试验系统包括复杂的荧光激发、探测以及高压介电筛选等组成部分,虽然已有文献对荧光激活液滴分选系统(fluorescence activated droplet sorting system, FADS)搭建方法进行了报道[8],但自行搭建系统对研究人员的技术要求极高,现有的系统实现方案复杂,集成化难度大,维护成本高,目前市场上还没有相应的产品出现。实验平台的缺失,很大程度地限制了FADS的发展[9-10]。
本研究基于荧光激活液滴分选技术,提出了集成化FADS解决方案。该方案将荧光激发、多通道荧光探测光路巧妙地与成像光路相结合,实现了FADS的集成化、模块化。实验人员搭建FADS只需为显微镜安装相应的功能模块,无需复杂的光路调整和优化。同目前见诸文献报道的系统相比,该方案具有体积小、成本低、荧光探测灵敏度高、使用方便等显著特点,对荧光激活液滴分选技术的推广具有一定的推动作用。
1 系统原理与设计
1.1 FAD原理
荧光激活液滴分选技术首先将样品分成相互隔绝、大小均一的微液滴,每一微液滴构成了一个独立的反应器(单分散性)。如图1所示,生成的液滴通过孵育培养后,包含目标产物的阳性液滴和液滴中包裹的标记物反应,从而产生特定的荧光信号。当该阳性液滴混杂在大量阴性液滴中依次高速通过FADS的荧光检测区域时,荧光信号超过设定分选阈值,触发分选高压,从而在高压介电电泳力的作用下被筛选到特定的流体通道,实现阳性液滴的富集[1-3]。
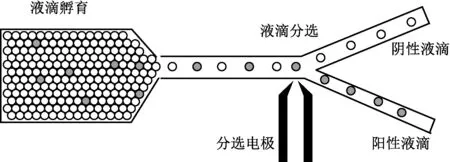
图1 FADS工作原理Fig.1 Fluorescence activated droplet sorting system
1.2 FADS组成
FADS包括液滴荧光激发模块、荧光探测模块和高压分选模块。其中,荧光激发模块和荧光探测模块涉及光路的搭建,光路的设计也决定FADS系统的使用灵活性、可维护性以及信号探测质量的好坏。
目前,研究人员多基于荧光显微镜搭建光路系统[11]。激光光路和荧光探测光路在显微镜内由二向色片合束,通过显微物镜聚焦于微流控芯片的荧光探测位置(见图2)。
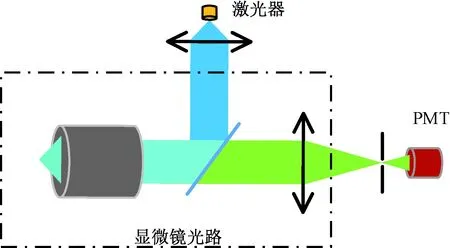
图2 基于荧光显微镜光路搭建的FADSFig.2 Configuration of FADS based on fluorescence microscope
通常,为了减小探测荧光的背景噪声,需要在光电倍增管(photomultiplier tube, PMT)前安装小孔,防止微流控芯片中荧光探测位置以外的干扰信号进入PMT。光路要求小孔的位置与激光激发位置在显微镜像平面的像重合,大小和激光光斑的像大小相等。小孔大小通常在10~100 μm,因此对小孔的位置和大小调整要求极其精确[8]。又因为小孔位于荧光光路中,通常荧光信号很弱,肉眼不可见,因此调整难度很高。
另外,由于激光光路和荧光探测光路是分离的,如果激发光光束位置稍有变化,会造成荧光探测位置在显微镜像平面的像与小孔位置偏离,从而造成荧光探测效率降低,因此这种设计往往需要经常校准小孔的位置来保证系统荧光探测效率,系统维护复杂。
为了解决该问题,配合显微成像系统光路,设计FADS的荧光激发和探测模块(见图3)。显微镜光路能够将样品投影到像平面,形成清晰的像,如果在该像平面处安装小孔,就会形成一个激光激发和荧光探测的共用窗口。激光聚焦于小孔位置形成光斑,在显微镜光路作用下,投影到微流控芯片荧光探测位置,该位置激发出的荧光在小孔所在位置成像,最终被PMT接收。
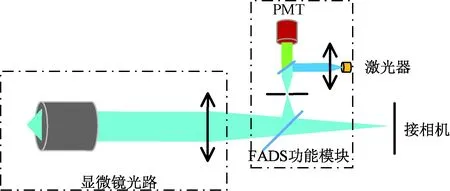
图3 集成化FADS功能模块与显微镜配合Fig.3 Configuration of FADS based on integration FADS functional module
这种设计能够保证小孔处透过激光激发的荧光必然返回小孔处以形成荧光信号,而小孔位置以外的背景杂光则能够被完全阻挡。这种光路设计能够保证激光激发和荧光探测达到最高效率,相当于能够自动保证常规光路设计条件下小孔位置始终处于理论最优位置,荧光信号的信噪比始终保持在最高水平。当激光光腰直径略大于小孔孔径时,即使小孔的位置稍有偏移,对荧光激发和探测不会造成影响,从而大大降低了系统的维护难度。另外,由于激光模块和荧光探测模块在光路中处在同一位置,因此能够方便地将该部分进行封装,从而形成完整的FADS功能模块,称之为FADS功能模块。该模块内光路一旦调整完成,就无需在后续的使用中调整。模块可以配合任意成像设备,如正置显微镜、倒置显微镜、体式显微镜,甚至微距镜头组成FADS。科研人员能够灵活地将荧光激活液滴分选技术集成到现有试验系统中(如双光子显微镜、拉曼显微镜等),组成复杂的微流控分析分选平台。
1.3 模块集成化
围绕成像系统像平面设计小孔位置,激光和荧光经过同一小孔位置进入成像系统,这种设计能够方便地将荧光探测光路和激光光路进行紧凑的整合,从而实现FADS的集成化、模块化设计。图4展示了FADS集成化设计之后的功能扩展模块,其中包含激光器、三通道荧光探测PMT、PMT高压电源、24位精密模数转换电路,以及分选高压触发输出控制单元。模块尺寸为160 mm×143 mm×54 mm,相对在光学平台上搭建的FADS体积明显缩小。另外,模块全密封设计,使得系统的抗干扰能力增强,荧光信号探测质量得到很大提高。
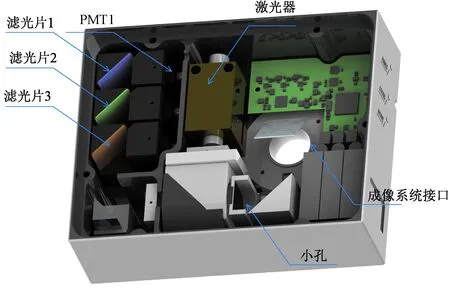
图4 FADS功能模块内部组成Fig.4 Component in FADS functional module
2 系统测试
将集成化FADS功能模块安装到倒置荧光显微镜拍照接口上,能够快速搭建FADS(见图5)。本研究设计了系统测试芯片,测试FADS的荧光探测灵敏度、信噪比、分选通量,以及分选正确率。

图5 采用集成化设计方案搭建的FADS(A为FADS功能模块,实现荧光的激发和探测;B为超高速相机,实现对液滴生成及分选过程的观察;C为FADS电源模块,负责系统的供电;D为FADS高压分选模块,负责产生液滴分选所需的千伏高频电压)Fig.5 FADS build with integrated functional modules (A: FADS functional module, used for fluorescence activation and detection; B: Ultra-high speed camera, used for droplet generation and sorting real-time observation; C: FADS system power module, used for power up the system. D: FADS system high voltage generation module, used for generating high frequency high voltage AC signal to sorting positive droplet)
芯片设计如图6所示,片上实现两路液滴生成,一路生成包含转染了GFP大肠杆菌的液滴作为阳性液滴,另一路生成空液滴作为阴性对照,液滴体积约50 pL。生成的液滴汇流到一个通道中,阳性液滴与阴性液滴依次间隔排列。最后,液滴依次通过荧光检测通道,通过FADS功能模块读取液滴的荧光强度信号,当强度超过设定的分选阈值后,给出分选触发信号,触发高压分选,从而将阳性液滴分选到上方通道,完成阳性液滴的富集。
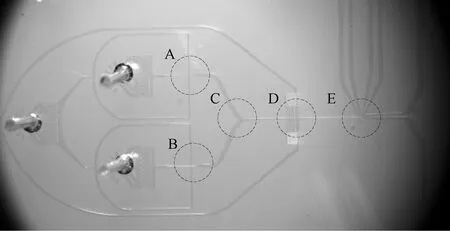
图6 用于验证FADS的微流控芯片(A,B为液滴生成;C为液滴汇流;D为液滴加速,扩大液滴间距离;E为荧光探测,液滴分选)Fig.6 Microfluidic chips used for FADS testing (A, B: generate droplet; C: positive and negative droplet converge; D: speed up droplet; E: fluorescence detection and droplet sorting)
3 结果
微流控芯片中液滴生成通量在每通道100~200个/s时,液滴的生成、汇流排列、液滴加速分离、荧光激活分选都能够实现(见图7)。阳性液滴的荧光信号能够很好地和阴性液滴区分开,并成功地实施分选,液滴的分选正确率为100%(通过超高速相机检测了20 000个液滴的分选过程)。当液滴生成通量进一步提高时,设计的微流控芯片阴性阳性液滴汇流处无法保证阳性液滴阴性液滴依次排列,因此无法校验后端FADS分选结果的正确性。

图7 FADS功能测试试验。(a)液滴生成;(b)阳性液滴阴性液滴汇流依次排列;(c)加速液滴;(d)液滴分选Fig.7 Experiment for testing FADS. (a)Generating droplet; (b) Positive and negative droplet converge;(c)Speed up droplet;(d)fluorescence detection and droplet sorting
将荧光信号导出阳性液滴的信号强度AD转换结果为2 829 260,背景噪声RMS=751.455,对应的信号强度Vs=971.38 mV,背景噪声强度Vn=258 μV,探测系统的信噪比SNR=79.7 dB。PMT的探测灵敏度约为750 V/nW,可得系统的荧光探测下限为3.5 fW。取荧光信号波长λ=532 nm,系统能够探测到的荧光强度下限约为104光子/s,系统的AD采样速率为10 kHz,则在一次采样周期内(100 μs),液滴荧光信号只要有不小于2个光子进入到系统中就能够被探测到,荧光探测灵敏度接近单光子探测水平(见图8)。
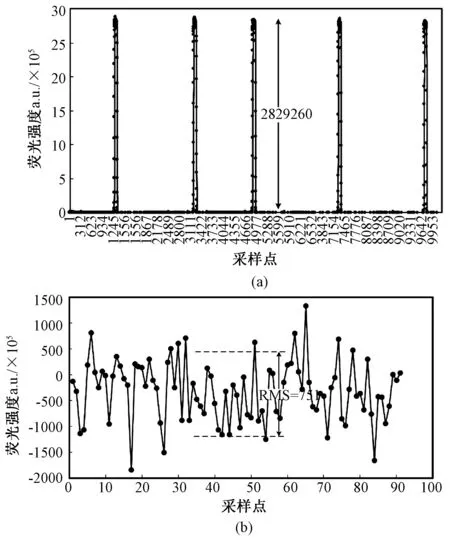
图8 FADS荧光信号探测性能。(a)FADS导出的荧光信号强度(b)FADS的噪声水平Fig.8 FADS fluorescence detection performance. (a) Fluorescence signal output by FADS (b) Noise level of FADS
4 讨论
在试验中,测试了集成化功能模块搭建的FADS,系统对含有GFP荧光转染的大肠杆菌的阳性液滴进行了可靠的分选。目前,实现通量能达到200液滴每秒,分选的通量主要受限于微流控芯片。系统荧光探测下限可以达到2个光子,理论上分选通量能够达到采样率的1/4,约2 500滴/s。在实际实验过程中,阴性液滴也会产生一定的荧光信号,该信号将成为系统的重要干扰因素。因此,FADS的液滴分选通量受限于实验体系、微流控芯片设计,以及FADS等多方面的因素。
采用FADS功能模块集成化设计、荧光激发和探测光路,以及PMT信号的模数转换电路,可以集成到180 mm×143 mm×54 mm大小的功能模块中;而采用分立的光学试验组件搭建的FADS[8],光路部分尺寸为600 mm×800 mm×130 mm。因此,本研究提出的FADS功能模块集成化设计方法,能够有效减小FADS的体积。根据文献报道,采用通用仪器搭建的FADS成本约为28万元[8],而搭建本研究提出的集成化FADS硬件成本约为5万元,系统的搭建成本大幅降低。
采用集成化FADS功能模块搭建FADS,荧光激发、荧光探测光路紧凑地集成在一个功能附件中。一方面,系统搭建无需对光学组件进行复杂的调整工作,只需为显微成像系统增添功能附件;另一方面,由于荧光激发光路和荧光探测光路集成在同一模块中,系统无需频繁地调整光路来减少由于光路失调对荧光探测效率的影响,降低了系统维护难度。
本研究提出的集成化FADS,在降低系统成本、减小系统体积的同时,实现了系统核心敏感组件的模块化封装、系统的模块化搭建,为FADS的推广提供了一个可行的解决方案。
目前,搭建的FADS分选判断依据是液滴荧光信号强度是否超过设定阈值。当荧光信号强度超过设定阈值时,判定液滴为阳性,触发高压分选,否则为阴性,系统不动作。这种方式简单高效,但是在实际操作中发现,荧光探测系统输出常伴有尖峰状噪声,如果单纯根据强度阈值来判断,容易造成假阳性结果。如果能够引入“过阈值时间”判断标准,即荧光强度超过阈值的时间达到一定长度才判定当前信号有效,则能够避免尖峰噪声造成的系统假阳性错误,从而进一步提高系统的可靠性。另外,本研究提出的FADS系统集成了3个荧光探测通道,如何综合三通道荧光强度来给出阳性液滴的判断条件较为复杂。3个荧光探测通道分别设置3个对应的阈值,最终的判断结果等于三通道独立判断结果的布尔运算。这种方式适用于采用的荧光标记物发射荧光波长能够较好地匹配探测波长,即单一标记物荧光波长与特定探测通道波长相匹配。如图9(a)所示,标记物发射荧光能够被单一通道探测,没有出现明显混叠。当标记物荧光光谱较宽或者发射波长位于两个探测通道之间时,荧光信号分布于多个探测通道中,从而造成单一标记物引发两个通道荧光信号超过阈值。当微液滴中包裹了多种荧光标记物时,系统的阳性判断就会出现混乱。系统无法对单一标记物的阳性、阴性结果做出准确的判断。如何实现多种荧光标记物同时存在于复杂反应体系中,通过三通道荧光探测结果准确分辨某一荧光标记物在多通道荧光检测FADS中至关重要。另外,由于FADS要求从荧光检测到做出分选判断时间延迟足够小(通常小于1 ms),从而满足分选通量的要求,因此对算法的实时性要求较高。该稳定算法的开发,以及如何实现在嵌入式系统中实时运行优化,是下一步多通道探测FADS系统研究的重点。
5 结论
本研究提出了一种集成化设计的FADS功能模块,相对于目前文献中报道的系统具有体积小、成本低、易于维护等特点。另外,本研究提出基于成像系统像平面设计荧光激发和探测光路的方法,能够有效地将FADS集成化,封装成独立的拓展功能模块。使用该模块,可以在成像设备的基础上,灵活地拓展荧光激活液滴分选功能。实验表明,使用该模块搭建FADS,能够稳定可靠地实现200液滴/s的分选通量,并且理论上仍具有很大的提升空间,对荧光激活液滴分选技术的推广具有重要意义。
[1] Agresti JJ, Antipov E, Abate AR, et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution[J]. Proceedings of the National Academy of Sciences, 2010, 107(9): 4004-4009.
[2] Verpoorte E. Microfluidic chips for clinical and forensic analysis[J]. Electrophoresis, 2002, 23(5): 677-712.
[3] Simon MG, Lee AP. Microfluidic droplet manipulations and their applications[M]//Microdroplet Technology. New York: Springer New York, 2012: 23-50.
[4] Brouzes E, Medkova M, Savenelli N, et al. Droplet microfluidic technology for single-cell high-throughput screening[J]. Proc Natl Acad Sci, 2009, 106: 14195-14200.
[5] Kumaresan P, Yang CJ, Cronier SA, et al. High-throughput single copy DNA amplification and cell analysis in engineered nanoliter droplets[J]. Anal Chem, 2008, 8: 3522-3529.
[6] Boedicker JQ, Li L, Kline TR, et al. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics[J]. Lab Chip, 2008, 8: 1265-1272.
[7] Laurie MT, Bertout JA, Taylor SD, et al. Simultaneous digital quantification and fluorescence-based size characterization of massively parallel sequencing libraries[J]. Bio Techniques, 2013, 55(2): 61-67.
[8] Mazutis L, Gilbert J, Ung WL, et al. Single-cell analysis and sorting using droplet-based microfluidics[J]. Nature Protocols, 2013, 8(5): 870-891.
[9] Rakszewska A, Tel J, Chokkalingam V, et al. One drop at a time: toward droplet microfluidics as a versatile tool for single-cell analysis[J]. NPG Asia Materials, 2014, 6(10): e133.
[10] Shields IV CW, Reyes CD, López GP. Microfluidic cell sorting: a review of the advances in the separation of cells from debulking to rare cell isolation[J]. Lab on a Chip, 2015, 15(5): 1230-1249.
[11] Agresti JJ, Antipov E, Abate AR, et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution [J]. Proc Natl Acad Sci, 2010, 107(9): 4004-4009.
10.3969/j.issn.0258-8021. 2016. 03.016
2015-10-19, 录用日期:2016-02-26
R318
D
0258-8021(2016) 03-0370-05
Research on Integrated Fluorescence Activated Droplet Sorting System
Sheng Guangji Zhu Jun Fan Yubo#Li Ang*
(SchoolofBiomedicalScienceandMedicalEngineeringBeihangUniversity,Beijing100191,China)
# 中国生物医学工程学会会员(Member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail:eangli@yahoo.com
