Eag1对骨肉瘤细胞增殖、迁移与侵袭的影响及其机制
2016-02-15袁忠胡俊雷家维付璐珩俞曾强汪海燕
袁忠,胡俊,雷家维,付璐珩,俞曾强,汪海燕
(江西中医药大学附属洪都中医院,南昌330006)
Eag1对骨肉瘤细胞增殖、迁移与侵袭的影响及其机制
袁忠,胡俊,雷家维,付璐珩,俞曾强,汪海燕
(江西中医药大学附属洪都中医院,南昌330006)
目的 探讨Eag1对骨肉瘤细胞增殖、迁移与侵袭的影响及其机制。方法将骨肉瘤Saos-2细胞随机分为Eag1沉默组和对照组,分别转染Eag1 siRNA及scramble。分别采用荧光定量PCR法和Western blotting法检测两组Eag1 mRNA和蛋白相对表达量;MTT法检测两组培养24、48、72、96及120 h的细胞增殖能力(以OD值表示),细胞划痕试验检测两组细胞迁移能力(以划痕愈合率表示),Transwell侵袭试验检测两组细胞侵袭能力(以进入膜下的细胞数量表示);采用Western blotting法检测两组STAT3蛋白相对表达量。结果Eag1沉默组与对照组Eag1 mRNA相对表达量分别为0.50±0.04、1.00±0.12,Eag1蛋白相对表达量分别为0.30±0.06、1.00±0.10,两组比较P均<0.05。Eag1沉默组接种24、48、72、96及120 h的OD值均低于对照组(P<0.05或<0.01)。Eag1沉默组和对照组划痕愈合率分别为42.34%±4.22%、95.12%±2.32%,进入膜下的细胞数量分别为(352±32)、(642±34)个,STAT3蛋白相对表达量分别为0.79±0.15、1.64±0.23,两组比较P<0.05或<0.01。结论Eag1沉默可抑制骨肉瘤细胞的增殖、迁移及侵袭;下调STAT3蛋白表达可能是其作用机制。
骨肉瘤;Eag1;STAT3;钾离子通道蛋白;细胞增殖;细胞侵袭;细胞迁移
骨肉瘤细胞起源于成骨细胞[1,2],具有肿瘤细胞特征,可形成不成熟的骨或骨组织。骨肉瘤恶性程度较高,外科手术结合新辅助化疗的治疗效果较好,患者5年生存率可达75%,但40%~50%的患者会发展为难治性转移癌,预后较差[2]。近期研究表明,电压门控钾离子通道蛋白与骨肉瘤的发生密切相关,并有望成为骨肉瘤诊断和治疗的潜在靶点[3]。2015年1月~2016年1月,我们观察了一种新的电压门控钾离子通道蛋白Eag1对骨肉瘤细胞增殖、迁移与侵袭的影响,现分析结果并探讨其相关机制。
1 材料与方法
1.1 材料 细胞:骨肉瘤Saos-2细胞购自南昌大学医学院实验中心。试剂:实验所需的一抗购自美国Santa Cruz公司,HRP标记的二抗购自英国Abcam公司,转染试剂Liposome 2000、TRIzol试剂均购自美国Invitrogen公司。Eag1 siRNA以及scrambles均由上海吉玛公司定制合成。
1.2 细胞分组处理 将对数生长期的Saos-2细胞随机分为Eag1沉默组和对照组,待细胞长满培养皿后利用Lipofectamine 2000分别转染Eag1 siRNA及scramble,严格按照转染试剂盒说明书操作。加入DMEM培养基,于37 ℃、5% CO2、饱和湿度的恒温细胞培养箱中进行培养,用于以下试验。
1.3 细胞Eag1 mRNA表达检测 采用荧光定量PCR法。取对数生长期的两组细胞,待细胞长满培养皿后加入TRIzol试剂,提取总RNA。按照TaqMan RNA reverse transcription kit说明书,将5 ng总RNA逆转录合成cDNA。以cDNA为模板,在ABI 7500实时定量PCR仪中进行荧光定量PCR反应。引物序列:Eag1上游引物:5′-GCTTTTGAGAACGTGGATGAG-3′,下游引物:5′-CGAAGATGGTGGCATAGAGAA-3′;以β-actin为内参,上游引物:5′-TGGCACCCAGCACAATGAA-3′,下游引物:3′-CTAAGTCATAGTCCGCCTAGAAGCA-5′。反应条件:95 ℃预变性30 s,95 °C变性5 s,60 °C退火34 s,40个循环。以2-ΔΔCt法计算Eag1 mRNA相对表达量。
1.4 细胞Eag1蛋白表达检测 采用Western blotting法。取对数生长期的两组细胞,待细胞长满培养皿后加入裂解液,提取细胞总蛋白,浓缩胶80 V电泳40 min,分离胶100 V电泳2 h。常规湿法转膜,5%脱脂奶粉封闭2 h;分别加入Eag1和GAPDH一抗(1∶200)孵育过夜,加入二抗(1∶1 000)孵育2 h,ECL法化学发光。采用Quantity One 1-D软件对蛋白质印迹条带进行定量分析,以Eag1与GAPDH灰度值的比值表示其相对表达量。
1.5 Eag1对Saos-2细胞增殖、迁移与侵袭影响的观察
1.5.1 细胞增殖能力 采用MTT法。取对数生长期的两组细胞,以2×103个/孔接种于96孔板。分别于接种24、48、72、96及120 h,每孔加入5 mg/mL MTT溶液40 μL。孵育4 h后每孔加入200 μL二甲基亚砜(DMSO),置于摇床上充分震荡。采用酶标仪测定两组各时间点570 nm处的光密度值(OD值)。每组设置6个复孔,取平均值。
1.5.2 细胞迁移能力 采用细胞划痕试验。取对数生长期的两组细胞,以2×104个/孔接种于6孔板。细胞融合后,采用灭菌枪头沿直线用力划。分别于划痕后即刻、48 h在显微镜下观察划痕修复情况,计算划痕愈合率。划痕愈合率=(划痕后即刻面积-划痕后48 h面积)/划痕后即刻面积×100%。试验重复3次,取平均值。划痕愈合率越高,表示细胞迁移能力越强。
1.5.3 细胞侵袭能力 采用Transwell侵袭试验。将两组细胞培养24 h后,取2×104个接种于Transwell小室的碳酸磷脂表面,上室 BioCoatTM包被Matrigel基质胶,37 ℃培养24 h。取出上层小室,将膜下面的侵袭细胞与1%多聚甲醛混合,0.2%结晶紫溶液染色15 min。于200倍显微镜下随机取10个视野,计数进入膜下的细胞数量,取平均值。试验重复3次。
1.6 细胞STAT3蛋白表达检测 参照1.4的方法,采用Western blotting法检测两组细胞STAT3蛋白相对表达量。

2 结果
2.1 两组Eag1 mRNA和蛋白相对表达量比较 Eag1沉默组Eag1 mRNA相对表达量为0.50±0.04,对照组为1.00±0.12,两组比较P<0.05。Eag1沉默组Eag1蛋白相对表达量为0.30±0.06,对照组为1.00±0.10,两组比较P<0.05。
2.2 两组细胞增殖能力比较 见表1。
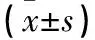
表1 两组各时间点细胞增殖能力比较
注:与对照组同时间点比较,*P<0.05,#P<0.01。
2.3 两组细胞迁移能力比较 Eag1沉默组划痕愈合率为42.34%±4.22%,对照组为95.12%±2.32%,两组比较P<0.05。
2.4 两组细胞侵袭能力比较 Eag1沉默组进入膜下的细胞数量为(352±32)个,对照组为(642±34)个,两组比较P<0.01。
2.5 两组STAT3蛋白表达比较 Eag1沉默组STAT3蛋白相对表达量为0.79±0.15,对照组为1.64±0.23,两组比较P<0.05。
3 讨论
骨肉瘤好发于长骨端,局部肿痛、跛行为其常见临床表现,软组织肿块、骨皮质增生及特征性的Codmans三角为其常见影像学特征[4]。骨肉瘤组织镜下可见肿瘤细胞呈高度异型性,以梭形或多边形为主,大小形态不一,可见病理性核分裂相。肿瘤分期、转移或复发、化疗、解剖部位、肿瘤大小都可以影响骨肉瘤患者的预后[5]。研究报道,30岁以下的骨肉瘤患者5年生存率达60%,30~49岁患者为50%,而50岁以上者仅为30%[6]。现代肿瘤学认为,肿瘤的发生是一系列基因(p53、p21等)表达发生异常改变的结果,而骨肉瘤的发生、发展机制目前仍不清楚。
近年来,钾离子通道蛋白成为肿瘤生物学的研究热点[7]。一些钾离子通道蛋白,特别是Eag1与肿瘤生长、进展和转移关系密切。Eag基因于1969年克隆自黑腹果蝇[8],由三个亚科形成:Eag、Erg (Eag相关基因)和Elk(Eag类似基因),其中Eag的两个成员分别是Eag1和Eag2[9]。正常生理状况下,Eag1基因表达往往仅限于大脑组织;但部分肿瘤组织中Eag1却出现异常高表达[10]。因此Eag1可能是一个潜在的肿瘤标志物。Liu等[11]报道,Eag1表达与乳腺癌的肿瘤直径、TNM分期、淋巴结转移等恶性生物学特征相关。Eag1高表达与急性白血病、卵巢癌、结肠癌和食管癌预后差相关[12,13],尽管已有研究证明Eag1在骨肉瘤组织中异常表达[14],但其是否与骨肉瘤细胞的增殖、迁移和侵袭等生物学行为有关却依然未有定论。本研究结果显示,Eag1沉默组Eag1 mRNA及其蛋白相对表达量均明显低于对照组,表明Eag1沉默组Eag1基因沉默成功。Eag1沉默组接种24、48、72、96及120 h的OD值均低于对照组,说明Eag1沉默可抑制骨肉瘤细胞的增殖;Eag1沉默组划痕愈合率和进入膜下的细胞数量均低于对照组,说明Eag1沉默可抑制骨肉瘤细胞的迁移和侵袭。研究表明,Eag1可促进乳腺癌细胞的迁移[15]。本研究与上述报道结论一致。
STAT3蛋白与多种肿瘤的发生、发展相关,其中也包括骨肉瘤[16]。本研究结果显示,Eag1沉默组STAT3蛋白相对表达量明显低于对照组,说明Eag1基因沉默可下调STAT3蛋白表达。研究表明,沉默STAT3可调控血管生长因子的表达,而血管生长因子与骨肉瘤细胞的增殖、迁移和侵袭密切相关[17]。因此,我们推测沉默Eag1可能通过下调STAT3而调控血管生长因子表达,从而发挥抑制骨肉瘤细胞增殖、迁移和侵袭的生物学效应,但其具体机制仍需进一步研究。
综上所述,Eag1沉默可抑制骨肉瘤细胞的增殖、迁移及侵袭,下调STAT3蛋白表达可能是其作用机制。本研究为进一步研究骨肉瘤的发病机制提供了新的思路,Eag1有望成为骨肉瘤诊断的一种潜在的生物标记物,其是否可以成为骨肉瘤治疗的新靶点仍需深入探讨。
[1] Mirabello L, Troisi RJ, Savage SA. International osteosarcoma incidence patterns in children and adolescents, middle ages and elderly persons[J]. Int J Cancer, 2009,125(1):229-234.
[2] Hawkins DS, Arndt CA. Pattern of disease recurrence and prognostic factors in patients with osteosarcoma treated with contemporary chemotherapy[J]. Cancer, 2003,98(11):2447-2456.
[3] Hameed M, Dorfman H. Primary malignant bone tumors-recent developments[J]. Semin Diagn Pathol, 2011,28(1):86-101.
[4] 任为端,程开明,蓝健君.磁共振成像诊断骨肉瘤的临床价值[J].山东医药,2004,44(2):23-24.
[5] 李磊,寇玉,杨宇,等.青少年和儿童骨肉瘤患者预后影响因素分析[J].广东医学,2015,36(18):2809-2811.
[6] Damron TA, Ward WG, Stewart A. Osteosarcoma, chondrosarcoma, and Ewing′s sarcoma: national cancer data base report[J]. Clin Orthop Relat Res, 2007(459):40-47.
[7] Pardo LA, Contreras-Jurado C, Zientkowska M, et al. Role of voltage-gated potassium channels in cancer[J]. J Membr Biol, 2005,205(3):115-124.
[8] Kaplan WD, Trout WE. The behavior of four neurological mutants of Drosophila[J]. Genetics, 1969,61(2):399.
[9] Schreiber R. Ca2+signaling, intracellular pH and cell volume in cell proliferation[J]. J Membr Biol, 2005,205(3):129-137.
[10] Camacho J. Ether a go-go potassium channels and cancer[J]. Cancer Lett, 2006,233(1):1-9.
[11] Liu GX, Yu YC, He XP, et al. Expression of eag1 channel associated with the aggressive clinicopathological features and subtype of breast cancer[J]. Int J Clin Exp Med, 2015,8(11):15093.
[12] Wu J, Wu X, Lian K, et al. Overexpression of potassium channel ether a go-go in human osteosarcoma[J]. Neoplasma, 2011,59(2):207-215.
[13] Hammadi M, Chopin V, Matifat F, et al. Human ether à-gogo K+channel 1 (hEag1) regulates MDA-MB-231 breast cancer cell migration through Orai1 dependent calcium entry[J]. J Cell Physiol, 2012,227(12):3837-3846.
[14] Fossey SL, Liao AT, McCleese JK, et al. Characterization of STAT3 activation and expression in canine and human osteosarcoma[J]. BMC cancer, 2009,9(1):81.
[15] Niu G, Wright KL, Huang M, et al. Constitutive Stat3 activity up-regulates VEGF expression and tumor angiogenesis[J]. Oncogene, 2002,21(13):2000-2008.
[16] Agarwal JR, Griesi-nger F, Stühmer W, et al. The potassium channel ether a go-go is a novel prognostic factor with functional relevance in acute myeloid leukemia[J]. Mol Cancer, 2010,9(1):1.[17] Ding XW, Wang XG, Luo HS, et al. Expression and prognostic roles of Eag1 in resected esophageal squamous cell carcinomas[J]. Digest Dis Sci, 2008,53(8):2039-2044.
10.3969/j.issn.1002-266X.2016.48.010
R738.1
A
1002-266X(2016)48-0033-03
2016-03-27)
