miR-214在狼疮性肾炎小鼠肾小球系膜细胞增殖中的作用及其机制
2016-02-15姚菲菲孙立秋方伟王化民姚东升崔蕊徐佳王莉王秀梅
姚菲菲,孙立秋,方伟,王化民,姚东升,崔蕊,徐佳,王莉,王秀梅
(哈尔滨医科大学第四附属医院,哈尔滨150001)
miR-214在狼疮性肾炎小鼠肾小球系膜细胞增殖中的作用及其机制
姚菲菲,孙立秋,方伟,王化民,姚东升,崔蕊,徐佳,王莉,王秀梅
(哈尔滨医科大学第四附属医院,哈尔滨150001)
目的 探讨微小RNA-214(miR-214)在狼疮性肾炎(LN)小鼠肾小球系膜细胞增殖中的作用及其相关机制。方法将MRL-Faslpr/JNju小鼠(简称LN小鼠,20只)和野生型小鼠(20只)处死,分离、培养其肾小球系膜细胞;将LN小鼠肾小球系膜细胞随机分为两组,分别转染miR-214 mimics(观察组)和NC mimics control(对照组)。采用实时荧光定量PCR法检测两种小鼠及两组肾小球系膜细胞miR-214相对表达量,采用MTT法检测两组转染1、2、3天的细胞增殖抑制率。采用生物信息学方法预测细胞中miR-214的靶基因,并经双荧光素酶报告基因试验验证,YKL-40是miR-214的靶基因。采用实时荧光定量PCR法和Western blotting法检测两组YKL-40 mRNA及蛋白相对表达量。取对数生长期的LN小鼠肾小球系膜细胞,分别转染siYKL-40和negative control,采用MTT法检测转染1、2、3天的细胞增殖抑制率。结果LN小鼠和野生型小鼠肾小球系膜细胞miR-214相对表达量分别为0.35±0.09、1,两者比较P<0.01。观察组和对照组miR-214相对表达量分别为85.54±12.07、1,两组比较P<0.01。观察组转染1、2、3天的细胞增殖抑制率均高于对照组(P<0.05或<0.01)。与对照组比较,观察组YKL-40 mRNA及蛋白相对表达量均降低(P均<0.05)。与转染negative control比较,转染siYKL-40的LN小鼠肾小球系膜细胞转染1、2、3天的细胞增殖抑制率均升高(P<0.05或<0.01)。结论LN小鼠肾小球系膜细胞中miR-214表达降低,上调miR-214表达可抑制其增殖;下调YKL-40表达可能是miR-214的作用机制。
狼疮性肾炎;微小RNA-214;肾小球系膜细胞;细胞增殖;YKL-40;小鼠
肾小球系膜细胞过度增殖是狼疮性肾炎(LN)的主要病变特点,过度增殖的系膜细胞可以释放更多的炎症因子,分泌细胞外基质,加剧炎症和引起肾小球硬化。微小RNA分子(microRNAs)简称miRNAs,广泛参与胚胎发育、细胞分化、肿瘤形成及损伤修复等生理病理过程[1,2]。研究发现,LN组织中有36个miRNAs 表达上调、30个 miRNAs表达下调,关于miR-214 在LN发生、发展中的作用报道较少[3]。2014年1月,我们观察了miR-214对LN小鼠肾小球系膜细胞增殖能力的影响,并探讨其机制。
1 材料与方法
1.1 材料 ①动物:10周龄MRL-Faslpr/JNju小鼠(简称LN小鼠)20只,体质量(24.5±2.6)g;10周龄野生型小鼠20只,体质量(22.3±1.8)g;均为SPF级,由南京大学动物模式研究所提供。②试剂:总RNA提取试剂(TRIzol试剂)、DMEM培养基及胎牛血清均购于美国Invitrogen公司,反转录试剂盒 (TaqMan MicroRNA Reverse Transcription Kit)、SYBR premix Ex TaqTMⅡ PCR Kit均购于日本TaKaRa公司,miR-214 mimics(5′-UCAUGUGUCUGCCUGUCUACACUU-3′)及YKL-40 siRNA(5′-CCAGAUGCCCUUGACCGCUUCCUCU-3′)均购于上海吉凯基因化学技术有限公司,鼠YKL-40(ab86428)单克隆抗体购于英国Abcam公司,双荧光素酶检测试剂盒购于美国Promega公司。
1.2 肾小球系膜细胞miR-214表达检测 采用实时荧光定量PCR法。将LN小鼠和野生型小鼠处死,参照Costa-Reis等[4]的方法分离、培养肾小球系膜细胞,并予以鉴定。取培养3~6代对数期生长的肾小球系膜细胞,加入TRIzol试剂提取总RNA,逆转录合成cDNA。在LightCycler480Ⅱ荧光定量PCR仪上进行荧光定量PCR反应,严格按照SYBR premix Ex TaqTMⅡ PCR Kit试剂盒说明书操作。miR-214上游引物 5′-TGGCTGGACAGAGTTGTCATGTGT -3′,下游引物为日本TaKaRa公司试剂盒提供的通用引物;以U6作为内参,上游引物5′-GCACCATGCTCTTCTACTCCTTT-3′,下游引物5′-TGACACTGATGTCGGTTAGTTTGATA-3′。反应体系:模版cDNA 1 μL,miR-214特异性引物 0.4 μL,10×miScript Universal Primer 2 μL,2×SYBR premix Ex TaqTMⅡ PCR 10 μL,加RNase-free water至反应总体积为20 μL。PCR反应条件:95 ℃ 30 min,95 ℃ 20 s,60 ℃ 20 s,72 ℃ 10 s,共45个循环。以2-ΔΔCT法[5]计算miR-214相对表达量。
1.3 miR-214对LN小鼠肾小球系膜细胞增殖的影响
1.3.1 miR-214 mimics转染 取培养3~6代对数期生长的LN小鼠肾小球系膜细胞,按2×105个/孔接种于6孔板中,待细胞贴壁且细胞融合至50%~70%时换为无血清无双抗培养基。将LN小鼠肾小球系膜细胞随机分为两组,分别转染miR-214 mimics(观察组)和NC mimics control(对照组),严格按照 lipofectamine 2000转染试剂说明书操作。培养6 h后,换为有血清的细胞培养基,继续培养48 h,参照1.2的方法检测miR-214相对表达量。
1.3.2 细胞增殖抑制率检测 采用MTT法。将1.3.1中分别转染miR-214 mimics和NC mimics control的两组细胞接种于96 孔板,每孔细胞数为8 000~9 000个,每孔设置3个复孔。当细胞融合至75%左右时,每孔加入 16 μL MTT(5 g/L)作用4 h,弃去上清,加入130 μL二甲亚砜(DMSO)进行溶解,以450 nm波长时的光密度值(OD值)计算细胞增殖抑制率,取平均值。连续检测3天。
1.4 miR-214的靶基因预测及验证
1.4.1 靶基因生物信息学预测 采用TargetScan(http://www.targetscan.org/)、miRanda(http://www. targetscan.org/)和PicTar(http://pictar.mdc-berlin. de/)等生物信息学数据库预测miR-214的靶基因,结果提示YKL-40是其靶基因。
1.4.2 靶基因验证 采用双荧光素酶报告基因试验。方法如下:①构建靶基因荧光素酶报告基因:参照1.2的方法,分离、培养LN小鼠肾小球系膜细胞,提取总RNA,以反转录合成的cDNA作为模板,按以下引物扩增靶基因YKL-40的3′-UTR区域。上游引物:5′-CCGCTCGAGCCCTCTGTTCTGCACACAGCACGGG-3′(XhoⅠ),下游引物: 5′-AAGGAAA-AAAGCGGCCGCAATAAAGTACAAGAGCTTAACAG-TG-3′(NotⅠ)。PCR扩增产物使用XhoⅠ+NotⅠ双酶切后,接入同样经过XhoⅠ+NotⅠ双酶切的双荧光素酶报告载体psiCHECK2中,将连接好的重组质粒转化大肠杆菌感受态,采用PCR法鉴定菌落。将含有目的片段的菌落进行摇菌,按照质粒提取试剂盒方法提取质粒,将提取好的质粒送上海生工生物工程有限公司进行序列验证。YKL-40 mRNA 3′-UTR结合miR-214的互补序列进行GGACGAC到UUGAUGA点突变,此序列由上海生工生物工程有限公司制备,并经测序验证。②双荧光素酶报告基因验证:将1.3.1中分别转染miR-214 mimics和NC mimics control的两组细胞接种于24孔板,每孔细胞数为4×104个。当细胞融合至75%左右时,分别转染psiCHECK2-YKL-40-3′-UTR-WT(野生型)、psiCHECK2-YKL-40-3′-UTR-MUT(突变型),严格按照lipofectamine 2000转染试剂说明书操作。转染6 h后换液,24 h后裂解细胞,分别检测萤火虫及海肾荧光素酶的荧光强度,计算相对荧光素酶活性。结果证实YKL-40为miR-214的靶基因,miR-214与YKL-40 mRNA 3′-UTR结合区域预测为GGACGAC。观察组野生型和突变型相对荧光素酶活性分别为40.21%±3.37%、1,对照组分别为98.72%±5.64%、1;观察组野生型和突变型比较P<0.05。
1.5 miR-214对LN小鼠肾小球系膜细胞YKL-40表达的影响
1.5.1 miR-214对LN小鼠肾小球系膜细胞YKL-40 mRNA表达的影响 采用实时荧光定量PCR法。取1.3.1中分别转染miR-214 mimics和NC mimics control的两组细胞,以GAPDH为内参,参照1.2的方法检测YKL-40 mRNA相对表达量。
1.5.2 miR-214对LN小鼠肾小球系膜细胞YKL-40蛋白表达的影响 采用Western blotting法。取1.3.1中分别转染miR-214 mimics和NC mimics control的两组细胞,加入10 μL RIPA裂解液,10 min后提取总蛋白,并测定蛋白浓度。将提取好的蛋白采用BCA定量试剂盒定量到5 μg/μL,按比例加入5×SDS上样缓冲液,105 ℃加热15 min。制备SDS聚丙烯酰胺凝胶,每孔上样量为20 μL,常规电泳、转膜、封闭。加入抗YKL-40抗体(ab86428,1∶1 000),4 ℃孵育过夜;加入相应的二抗(1∶10 000),室温孵育1 h。TBST洗涤3次,ECL发光液处理后暗室内曝光胶片,于室温下自然风干,扫描仪扫描结果。以目的蛋白与内参蛋白灰度值的比值作为YKL-40蛋白相对表达量。
1.6 YKL-40对LN小鼠肾小球系膜细胞增殖的影响 取培养3~6代对数生长期的LN小鼠肾小球系膜细胞,按2×105个/孔接种于6孔板中,待细胞贴壁且细胞融合为50%~70%时换为无血清无双抗培养基。参照1.3.1的方法分别转染siYKL-40和negative control,采用MTT法检测转染1、2、3天的细胞增殖抑制率。

2 结果
2.1 肾小球系膜细胞miR-214表达 LN小鼠和野生型小鼠肾小球系膜细胞miR-214相对表达量分别为0.35±0.09、1,两者比较P<0.01。观察组和对照组miR-214相对表达量分别为85.54±12.07、1,两组比较P<0.01。
2.2 两组细胞增殖抑制率比较 见表1。
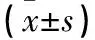
表1 两组细胞增殖抑制率比较
注:与对照组同时间点比较,*P<0.05,#P<0.01。
2.3 两组YKL-40 mRNA及蛋白相对表达量比较 观察组和对照组YKL-40 mRNA相对表达量分别为0.37±0.09、1,YKL-40蛋白相对表达量分别为0.21±0.07、1,两组比较P均<0.05。
2.4 YKL-40对LN小鼠肾小球系膜细胞增殖的影响 见表2。
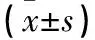
表2 转染siYKL-40和negative control的LN小鼠肾小球系膜细胞增殖抑制率比较
注:与转染negative control的LN小鼠肾小球系膜细胞比较,*P<0.05,#P<0.01。
3 讨论
miRNAs主要与靶基因mRNA的3′-UTR 区域结合,通过降解或转录后抑制或减少靶基因蛋白的形成。自1993年miRNAs家族成员lin-4和let-7被发现以来,临床上通过分子克隆及生物信息学方法至今已经发现了9 000多种miRNAs,人类基因组编码了超过1 000个miRNAs[6]。miR-214属于miRNAs家属成员之一,关于miR-214的研究主要集中在肿瘤诊断与治疗方面。如miR-214在结肠癌和膀胱癌中表达明显降低,并可作为肿瘤转移的重要标志物[7,8]。miR-214可以通过下调p53基因表达而显著抑制乳腺癌的侵袭与转移[9],还可作为抑癌基因调控食管癌的发生、发展[10]。本研究结果显示,LN小鼠肾小球系膜细胞miR-214相对表达量明显低于野生型小鼠,表明miR-214表达降低与LN的发生有关;而转染miR-214 mimics的观察组miR-214表达明显升高,且可以明显抑制肾小球系膜细胞增殖,并呈时间依赖性,表明过表达miR-214可显著抑制LN小鼠肾小球系膜细胞增殖。
本研究进一步发现YKL-40为miR-214的靶基因,获取了YKL-40 mRNA 的3′-UTR序列,通过生物信息学方法分析发现YKL-40 3′-UTR存在miR-214的保守结合位点;双荧光素酶报告基因试验显示,miR-214可降低野生型报告基因的相对荧光素酶活性,而对突变型报告基因的相对荧光素酶活性无影响。本研究结果显示,观察组YKL-40 mRNA及蛋白表达均明显低于对照组,说明上调miR-214表达可明显抑制YKL-40表达水平。上述结果提示,miR-214以完全配对的方式结合YKL-40 mRNA 的3′-UTR序列,且miR-214对靶基因YKL-40的表达具有重要的调控效应。
YKL-40是一种细胞因子,可参与多种免疫性疾病的发生与发展,如选择性IgA缺乏症、慢性淋巴细胞性白血病及淋巴瘤等[11,12]。研究发现,干扰YKL-40表达可延缓慢性淋巴细胞性白血病的进展[13]。最新研究发现,YKL-40在正常肾组织中表达降低,并具有抑制肾小球系膜细胞增殖的作用[14]。本研究结果显示,转染siYKL-40的LN小鼠肾小球系膜细胞增殖抑制率明显高于转染negative control的细胞;说明干扰YKL-40表达同样可降低LN小鼠肾小球系膜细胞的增殖,其作用与过表达miR-214一致。以上结果提示,miR-214可能通过介导YKL-40而调控肾小球系膜细胞的增殖,进而参与LN的发生与发展。
综上所述,LN小鼠肾小球系膜细胞miR-214表达降低,其可能通过下调YKL-40表达而抑制细胞增殖。miR-214有望成为LN诊断和治疗的新分子标志物,亦可能作为LN基因治疗的一个有效靶点,但是其具体的作用机制还有待于进一步研究。
[1] Mo YY. Microrna regulatory networks and human disease[J]. Cell Mol Life Sci, 2012,69(21):3529-3531.
[2] Ivey KN, Srivastava D. Micrornas as Developmental Regulators[J]. Cold Spring Harb Perspect Biol, 2015,7(7):8144.
[3] Rai G, Rai R, Saeidian AH, et al. Microarray to deep sequencing: transcriptome and mirna profiling to elucidate molecular pathways in systemic lupus erythematosus[J]. Immunol Res, 2016,64(1):14-24.
[4] Costa-Reis P, Russo PA, Zhang Z, et al. The role of micrornas and human epidermal growth factor receptor 2 in proliferative lupus nephritis[J]. Arthritis Rheumatol, 2015,67(9):2415-2426.[5] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative c(t) method[J]. Nat Protoc, 2008,3(6):1101-1108.
[6] Williams AE. Functional aspects of animal micrornas[J]. Cell Mol Life Sci, 2008,65(4):545-562.
[7] Wang J, Zhang X, Wang L, et al. Downregulation of urinary cell-free microrna-214 as a diagnostic and prognostic biomarker in bladder cancer[J]. J Surg Oncol, 2015,111(8):992-999.
[8] Zhang KC, Xi HQ, Cui JX, et al. Hemolysis-free plasma mir-214 as novel biomarker of gastric cancer and is correlated with distant metastasis[J]. Am J Cancer Res, 2015,5(2):821-829.
[9] Wang F, Lv P, Liu X, et al. Microrna-214 enhances the invasion ability of breast cancer cells by targeting p53[J]. Int J Mol Med, 2015,35(5):1395-1402.
[10] Phatak P, Byrnes KA, Mansour D, et al. Overexpression of mir-214-3p in esophageal squamous cancer cells enhances sensitivity to cisplatin by targeting survivin directly and indirectly through Cug-Bp1[J]. Oncogene, 2015,35(16):2087-2097.
[11] Bonneh-Barkay D, Bissel SJ, Wang G, et al. YKL-40, a marker of simian immunodeficiency virus encephalitis, modulates the biological activity of basic fibroblast growth facto[J]. Am J Pathol, 2008,173(1):130-143.
[12] Knight PA, Pate J, Smith WD, et al. An ovine chitinase-like molecule, chitinase-3 like-1 (ykl-40), is upregulated in the abomasum in response to challenge with the gastrointestinal nematode, teladorsagia circumcincta [J]. Vet Immunol Immunopathol, 2007,120(1-2):55-60.
[13] Johansen JS, Pedersen AN, Schroll M, et al. High serum ykl-40 level in a cohort of octogenarians is associated with increased risk of all-cause mortality [J]. Clin Exp Immunol, 2008,151(2):260-266.
[14] Hall IE, Stern EP, Cantley LG, et al. Urine ykl-40 is associated with progressive acute kidney injury or death in hospitalized patients[J]. BMC Nephrol, 2014(15):133.
Effect of microRNA-214 on proliferation of mouse mesangial cells with lupus nephritis
YAOFeifei,SUNLiqiu,FANGWei,WANGHuamin,YAODongsheng,CUIRui,XUJia,WANGLi,WANGXiumei
(FourthHospitalofHarbinMedicalUniversity,Harbin150001,China)
Objective To investigate the effect and molecular mechanism of microRNA-214 (miR-214) on the proliferation of mouse mesangial cells with lupus nephritis (LN). Methods The MRL-Faslpr/JNju mice (LN mice,n=20) and wild-type mice (n=20) were sacrificed and the glomerular mesangial cells were isolated and cultured. The relative expression of miR-214 was detected by real-time fluorescence quantitative PCR. The glomerular mesangial cells in the logarithmic phase were randomly divided into two groups, which were separately transfected by MiR-214 mimics (observation group) and NC mimics control (control group). The inhibitory rate of proliferation of mouse mesangial cells was detected by MTT. The target gene of miR-214 was predicted by bioinformatics analysis and verified by dual luciferase reporter assay. Furthermore, the mRNA and protein expression levels of YKL-40 were examined by real-time fluorescence quantitative PCR and Western blotting. LN mouse mesangial cells in the logarithmic phase were selected and then were transfected with siYKL-40 and negative control, respectively, and the inhibitory rate of cell proliferation was detected by MTT assay. Results The expression of miR-214 in the mouse mesangial cells of LN group was 0.35±0.09, which was significantly down-regulated as compared with that of the control group (1) (P<0.01). The expression of miR-214 in the miR-214 mimics group and NC mimics control group was 85.54±12.07 and 1 (P<0.01). The inhibitory rate of proliferation in the observation group was higher than that of the control group on day 1, 2 and 3 (P<0.05 orP<0.01). Compared with the control group, the relative expression of YKL-40 mRNA and protein decreased in the observation group (allP<0.05). Compared with that transfected with negative control, the proliferation inhibition rate of glomerular mesangial cells in the LN mice transfected with siYKL-40 increased (P<0.05 orP<0.01). Conclusions The expression of miR-214 is down-regulated in LN mouse mesangial cells. Up-regulation of miR-214 expression inhibits the proliferation of mouse mesangial cells, which may be mediated by YKL-40 down-regulation.
lupus nephritis; microRNA-214; mesangial cells; proliferation; YKL-40; mice
黑龙江省青年科学基金资助项目(QC2010094)。
姚菲菲(1980-),女,主治医师,研究方向为肾脏病学基础与临床。E-mail: yaofeifeidoctor@sina.com
王秀梅(1962-),女,副主任医师,研究方向为肾脏病学基础与临床。E-mail: wxmhaerbing2010@163.com
10.3969/j.issn.1002-266X.2016.48.005
R593.2424
A
1002-266X(2016)48-0016-04
2015-12-24)
