番茄褪绿病毒郑州分离物外壳蛋白基因的克隆与序列分析
2016-02-06胡京昂万秀娟李自娟应芳卿郑州市蔬菜研究所河南郑州450015
胡京昂,万秀娟,李自娟,应芳卿,黄 文(郑州市蔬菜研究所,河南 郑州 450015)
番茄褪绿病毒郑州分离物外壳蛋白基因的克隆与序列分析
胡京昂,万秀娟,李自娟,应芳卿,黄 文
(郑州市蔬菜研究所,河南 郑州 450015)
近年来郑州番茄产区发现疑似番茄褪绿病毒(ToCV)侵染引起的叶脉间褪绿症状,为了确定病原种类,采集典型症状的叶片,提取RNA,根据已知的ToCV基因组序列设计特异性引物ToCVCPF/ToCVCPR,采用RT-PCR方法对样品进行检测,扩增得到约750 bp大小的目的条带,对获得的特异性片段回收、克隆、测序后进行序列同源性及系统进化分析。结果显示,郑州病样的病毒分离物外壳蛋白基因由774 bp组成,其核苷酸和氨基酸序列与ToCV其他分离物同源性均在96%以上;进化分析表明,郑州分离物与河北、天津分离物亲缘关系最近。造成郑州番茄产区褪绿症状的病原为ToCV。
番茄褪绿病毒; 外壳蛋白; 基因克隆; 序列分析
番茄是一种高效益的蔬菜作物,随着设施蔬菜产业的发展,良好的保护地设施为番茄提供了适宜的生态环境,但也为番茄上的各种病虫害提供了发生和扩散的条件,造成番茄病虫害的大面积暴发。其中,病毒病成为影响番茄产量与品质的主要病害,据报道多种病毒可侵染番茄并造成危害,如番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)、番茄褪绿病毒(tomato chlorosis virus,ToCV)、番茄斑萎病毒(tomato spotted wilt virus,TSWV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、马铃薯Y病毒(potato virus Y,PVY)等[1]。世界范围内烟粉虱大面积发生,由其传播的病毒病给番茄生产带来了巨大的损失,危害番茄的由烟粉虱传播的病毒主要有TYLCV、ToCV和番茄侵染性褪绿病毒(tomato infectious chlorosis virus,TICV)。自国内报道TYLCV发生以来,番茄黄化曲叶病毒病已经成为国内番茄生产上的主要病害[2-7]。近几年,在山东、北京、河南等地一种疑似营养缺失的症状在番茄产区出现,利用ToCV和TICV特异性引物进行分子生物学检测,结果表明,该症状是ToCV侵染引起的番茄褪绿病毒病导致[8-11]。
ToCV 1998 年首次在美国佛罗里达州被发现[12],随后意大利、巴西、以色列等地相继报道[13-15]。ToCV属于长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus)成员[16]。该病毒基因组为二分体正义单链RNA,一共包含有13个开放阅读框,基因组全长约16.8 kb,其中RNA1长8 594 bp,RNA2长8 242 bp,分别包裹在2种粒子中。外壳蛋白(coat protein,CP)主要参与病毒的组装、包被以及病毒运输,外壳蛋白的缺失会导致病毒无法形成完整的病毒粒子[17]。在自然条件下,ToCV可以通过4 种分属于2个属的粉虱传播,可以侵染茄科、番杏科、苋科、夹竹桃科、藜科等植物,不能通过摩擦接种和种子传播。感染ToCV的植株,其典型症状类似营养缺失的褪绿黄化,首先在植株的下部叶片上出现,发病初期叶片除叶脉仍保持绿色外,脉间变黄,叶片变厚,同时伴随部分叶片边缘卷曲、叶片黄化、出现坏死斑点等症状,到后期造成整株死亡,果实受到严重影响[16]。本研究以郑州地区表现突出症状的植株为样品,根据已经发表的ToCV基因组序列设计引物,通过RT-PCR扩增ToCVCP基因序列,并对其进行进化分析,明确郑州分离物的分类地位,以期为该病毒病的防治和抗病毒品种的培育提供理论依据。
1 材料和方法
1.1 材料
1.1.1 病毒样本 2014年8月在郑州蔬菜研究发展中心番茄大棚中采集叶脉间褪绿、黄化的番茄叶片,编号为ZZ;并同时采集相应大棚中健康番茄叶片作为阴性对照;实验室保存的被ToCV感染的叶片作阳性对照。
1.1.2 生化试剂 TRIzol 购自Invitrogen公司;RTase M-MLV(RNase H-)、RNase Inhibitor购自Promega公司;凝胶回收纯化试剂盒、Taq酶和DL2000 DNA Marker均购自杭州博日科技有限公司;dNTPs和T4 DNA Ligase 购自TaKaRa公司;GeneFinderTM购自厦门百维信生物科技有限公司。
1.1.3 菌株和载体 大肠杆菌(Escherichiacoli)DH5α菌株由郑州市蔬菜生物技术重点实验室保存;克隆载体pMD18-T 购自TaKaRa公司。
1.2 方法
1.2.1 植物总RNA提取 采用TRIzol提取法。取番茄叶片样本约0.1 g,在液氮中研磨后迅速转移到1.5 mL DEPC处理的离心管中,加入1 mL TRIzol试剂,振荡均匀放置室温5 min后,12 000 r/min离心5 min;将上清液转移到新的DEPC处理的1.5 mL离心管中,加入0.2 mL氯仿混匀,室温放置10 min后再次12 000 r/min离心15 min;仍将上清液转移到DEPC处理的离心管中,加入0.5 mL异丙醇混匀,置于-20 ℃静置30 min,12 000 r/min离心10 min后,用75%乙醇洗涤沉淀;最后用无核酸酶的去离子水溶解,置于-20 ℃保存备用。
1.2.2 RT-PCR扩增、克隆和测序 根据已经发表的ToCV基因组序列,设计特异性引物ToCVCPF(5′-ATGGAGAACAGTGCTGTTGCAA-3′)和ToCVCPR(5′-TTAGCAACCAGTTATCGATGCA-3′),对获得的植物总RNA进行RT-PCR扩增。
在DEPC处理的离心管中加入总RNA 5.0 μL、10 μmol/L ToCVCPR引物1.0 μL、10 mmol/L dNTP Mix 1.0 μL,用无核酸酶的超纯水补充总体积至10 μL,70 ℃变性10 min,立即冰上放置2 min。再加入5×M-MLV Buffer 5.0 μL、200 U/μL RTase M-MLV(RNase H-)1.0 μL、40 U/μL RNase Inhibitor 0.5 μL,用无核酸酶的超纯水补充总体积至25 μL,37 ℃水浴60 min。
以获得的cDNA第一链为模板,扩增ToCVCP基因序列。PCR反应体系(25 μL)如下:cDNA 5.0 μL、5 U/μLTaqDNA Polymerase 1.0 μL、10 μmol/L ToCVCPF和ToCVCPR引物各1.0 μL、10×Buffer 2.5 μL、10 mmol/L dNTP Mix 1.0 μL,ddH2O补充至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃复性45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。取5 μL PCR产物,加入Loading buffer和GeneFinder后,用1.0%琼脂糖凝胶电泳检测扩增产物,在可见光透视仪上显示电泳结果。PCR产物经凝胶回收试剂盒纯化后,将其克隆到pMD18-T载体上,阳性克隆经验证后送北京三博远志生物技术有限公司测序,将测序的序列提交GenBank数据库收录,登录号为KR150986。
1.2.3 序列比对分析 利用NCBI序列比对工具BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)分析测得的序列,根据相似性确定病毒种类,并与国际上报道的ToCVCP序列进行相似性分析。已报道的ToCV分离物为美国分离物(ToCV-USA,登录号:AY903448)、日本分离物(ToCV-Japan,登录号:AB513443)、韩国分离物(ToCV-HS,登录号:KP137099)、西班牙分离物(ToCV-Spain,登录号:DQ136146)、希腊分离物(ToCV-Greece,登录号:HG380088)、法国分离物(ToCV-France,登录号:EU625350)、中国山东分离物(ToCV-SDSG,登录号:KC709510)、南京分离物(ToCV-Nanjing,登录号:KJ815045)、北京分离物(ToCV-BJ,登录号:KC887999)、天津分离物(ToCV-TJ6,登录号:KP219722)、河北分离物(ToCV-HBSJZ,登录号:KP217200)。
2 结果与分析
2.1 番茄田间病害症状
番茄植株感病后主要症状为植株中下部叶片黄化,叶脉浓绿而脉间褪绿,与缺素症状相似(图1)。
2.2 番茄样品RT-PCR扩增结果
以反转录得到的cDNA为模板,利用ToCVCPF/ToCVCPR特异性引物对番茄样品进行PCR扩增,ZZ样品中扩增出750 bp左右的特异性条带,与ToCV侵染的番茄样品(阳性对照)中扩增的条带大小一致(图2),表明待检测样品可能感染ToCV。
2.3 ToCV郑州分离物序列分析
将ZZ样品中PCR扩增的特异性片段纯化、克隆、测序,结果表明,ToCV郑州分离物CP基因序列由774 bp组成。将获得的CP基因序列用DNAMAN Version 4.0进行处理和分析,结果见表1,该分离物CP基因核苷酸序列与法国分离物和西班牙分离物的同源性分别为97.7%和97.2%,与其他ToCV分离物同源性均在99%以上。ToCV郑州分离物CP基因氨基酸序列比对表明:郑州分离物与日本、天津和美国分离物的同源性均在99%以上,而与其他地区分离物的同源性在96.9%~98.8%。

图1 感染ToCV叶片症状
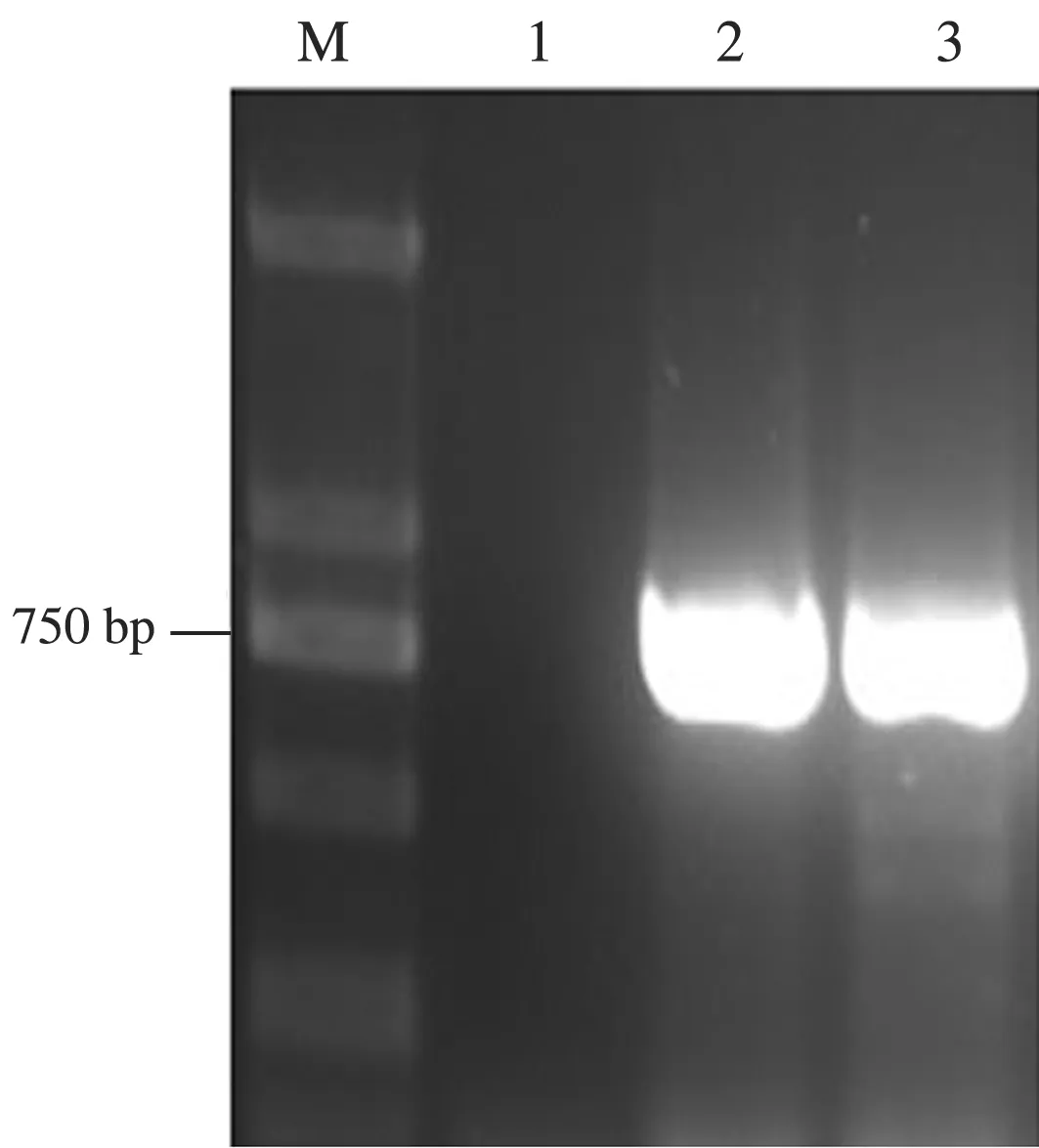
M:DL2000 DNA Marker; 1:阴性对照; 2:ZZ样品; 3:阳性对照图2 番茄样品PCR检测结果
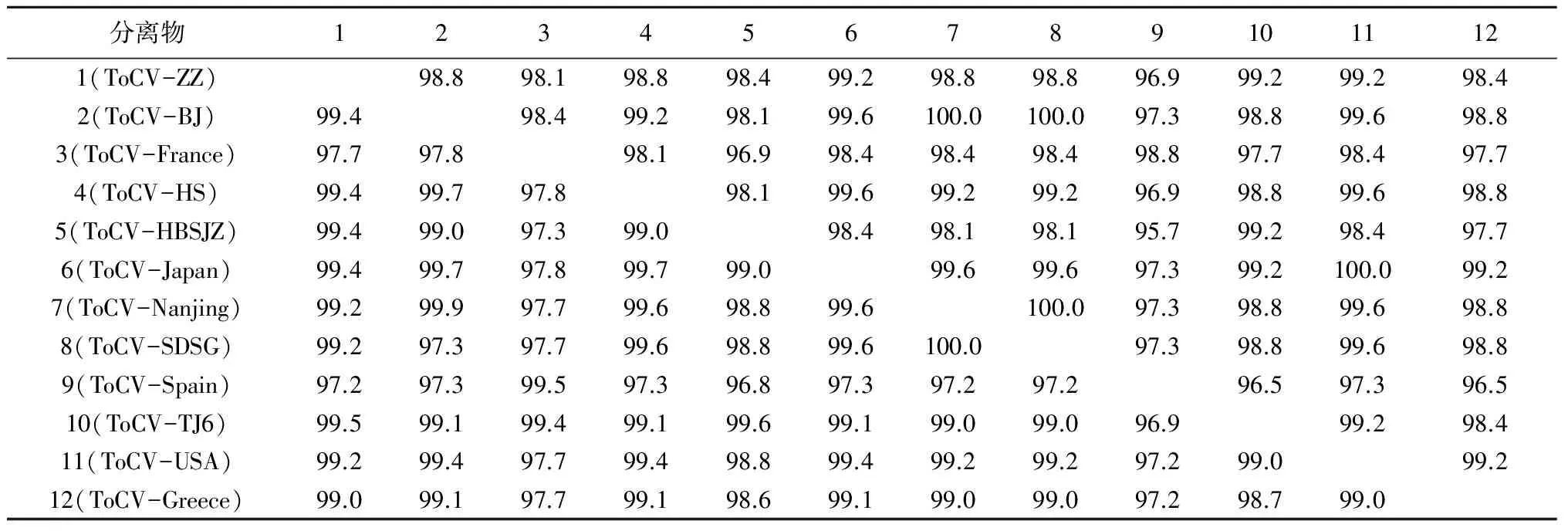
表1 不同地区ToCV分离物CP基因核苷酸(左下方)和氨基酸(右上方)序列同源性比较 %
采用Mega 4.0的临近相邻法(Neighbor-Joining)将该分离物CP基因核苷酸序列与其他11个具有代表性的ToCV分离物序列构建系统进化树(图3),结果显示:郑州分离物与希腊分离物、西班牙分离物及法国分离物分别在3个不同的大分支;来源于国内的南京、北京、山东、河北、天津、郑州分离物和韩国、美国、日本分离物聚在一个小分支,其系统进化关系较近;郑州分离物与河北、天津分离物系统进化关系较其他国内分离物近。
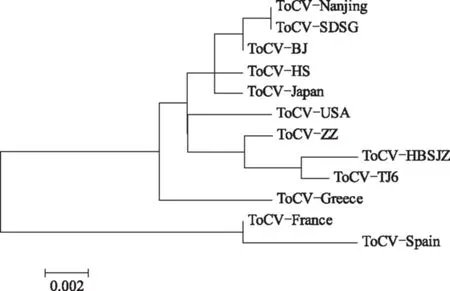
图3 不同地区ToCV分离物CP基因核苷酸序列系统进化树
3 结论与讨论
番茄褪绿病毒病是继番茄黄化曲叶病毒病后又一种危害严重的番茄病毒病,可由2个属的粉虱传播,由于传播介体种类多,加大了该病害的发生与扩散程度,粉虱的防控难度较大,因而该病害的及时发现与鉴定尤为重要。本研究利用分子生物学技术,对郑州地区表现褪绿症状的番茄样品中ToCVCP基因进行克隆和分析发现,ToCV郑州分离物CP基因序列由774 bp组成,该基因核苷酸序列及氨基酸序列与ToCV其他分离物的同源性均在96%以上,系统进化树分析表明,来源于国内的南京、北京、山东、河北、天津、郑州分离物和韩国、美国、日本分离物聚在一个小分支,其系统进化关系较近,其中郑州分离物与河北、天津分离物的系统进化关系较其他国内分离物近。我国的ToCV来源于韩国、日本及美国的可能性较大,可能与国际交往中番茄及烟粉虱活体带毒传播相关。郑州地区与河北、天津距离较近,其ToCV分离物亲缘关系密切,可能与种苗调运、烟粉虱的扩散有关。
由于番茄黄化曲叶病毒病在国内普遍发生,近几年,通过物理、化学防控传播介体和抗TYLCV番茄品种推广等措施的应用,该病害得到一定程度的控制。抗TYLCV番茄品种的种植,降低了该病害在生产中的危害,然而在种植过程中农户忽视对烟粉虱的防控,造成烟粉虱虫口密度过大,烟粉虱是TYLCV和ToCV的共同传播介体,在本研究采集样品的大棚里,大量的烟粉虱聚集在番茄叶片上,因此,郑州地区番茄褪绿病毒病的流行可能是烟粉虱传播导致。番茄褪绿病毒病在国内的山东、北京、河北、河南、天津等地均有发生,其症状易与缺素症状混淆,在生产中会造成误判,延误防控时机,给农业生产造成极大危害和损失,因此对该病毒病的检测、鉴定和防控是当务之急,确立规范的病毒基因检测体系和便捷快速的检测方法显得尤为重要。利用分子检测手段比传统的人工接种方法更迅速、便捷和准确,本研究利用设计的CP基因特异性引物,通过RT-PCR方法可以检测ToCV,为该病害的快速、准确检测和鉴定提供了技术支持。
国内对番茄褪绿病毒病的研究主要集中在病原的检测与病害的鉴定方法上,生产上缺乏抗该病的番茄品种,对番茄种质的抗病性评价只能通过烟粉虱接种,限制了抗原的筛选速率,因此,构建高效的ToCV侵染性克隆载体,建立快速的抗病性评价方法,培育抗ToCV的番茄品种是生产上亟待解决的问题。此外,本研究仅对郑州分离物的CP基因进行了检测和序列分析,需要进一步对各地ToCV分离物进行鉴定与分析,明确该病害的发生区域,并加强该病毒在不同地区变异及防治技术等方面的研究。
[1] 冯兰香,蔡少华,郑贵彬,等.我国番茄病毒病的主要毒原种类和番茄上烟草花叶病毒株系的鉴定[J].中国农业科学,1987,20(3):60-66.
[2] 张穗,王冬生,瞿培荣,等.上海市番茄黄化曲叶病毒(TYLCV)病的初步鉴定[J].上海农业学报,2006,22(3):126.
[3] 胡京昂,郭竞,崔杏春,等.番茄黄化曲叶病毒郑州分离物外壳蛋白基因的克隆与序列分析[J].河南农业科学,2013,42(9):87-90.
[4] 胡京昂,周建华,蔡雨惠.河南省番茄黄化曲叶病毒病的发生与综合防治[J].中国瓜菜,2010,23(4):49-50.
[5] 甘海玲.杨陵区番茄黄化曲叶病毒病的发生及综合防治[J].现代农业科技,2011(24):196,198.
[6] 王梦扬,王勇,代永青,等.保护地番茄黄化曲叶病毒病的发生及其防控技术[J].现代农业科技,2015(11):155,157.
[7] 马妙芳.番茄黄化曲叶病毒的危害机理及防治方法[J].内蒙古农业科技,2015,43(6):86-87.
[8] 赵黎明,李刚,刘永光,等.番茄褪绿病毒与番茄黄化曲叶病毒复合侵染的分子鉴定[J].中国蔬菜,2014(12):15-20.
[9] 赵汝娜,王蓉,师迎春,等.侵染甜椒的番茄褪绿病毒的分子鉴定[J].植物保护,2014,40(1):128-130.
[10] 胡京昂,万秀娟,李自娟,等.河南番茄褪绿病毒的分子鉴定[J].中国蔬菜,2015(12):25-28.
[11] Panno S,Davino S,Rubio L,etal.Simultaneous detection of the seven main tomato-infecting RNA viruses by two multiplex reverse transcription polymerase chain reactions[J].Journal of Virological Methods,2012,186:152-156.
[12] Wisler G C,Li R H,Liu H Y,etal.Tomato chlorosis virus:A new whitefly-transmitted,phloem-limited,bipartite closterovirus of tomato[J].Phytopathology,1998,88(5):402-409.
[13] Accotto G P,Vaira A M,Vecchiati M,etal.First report of tomato chlorosis virus in Italy[J].Plant Disease,2001,85(11):1208.
[14] Segev L,Wintermantel W M,Polson J E,etal.First report of tomato chlorosis virus in Israel[J].Plant Disease,2004,88(10):1160.
[15] Freitas D M S,Nardin I,Shimoyama N,etal.First report of tomato chlorosis virus in potato in Brazil[J].Plant Disease,2012,96(4):593-594.
[16] Wintermantel W M,Wisler G C.Vector specificity,host range,and genetic diversity ofTomatochlorosisvirus[J].Plant Disease,2006,90(6):814-819.
[17] Agranovsky A A,Folimonova S Y,Folimonov A S,etal.The beet yellows closterovirus p65 homologue of HSP70 chaperones has ATPase activity associated with its conserved N-terminal domain but does not interact with unfolded protein chains[J].Journal of Geneal Virology,1997,78:535-542.
Cloning and Sequence Analysis of Coat Protein Gene of Tomato Chlorosis Virus Isolate from Zhengzhou
HU Jing’ang,WAN Xiujuan,LI Zijuan,YING Fangqing,HUANG Wen
(Zhengzhou Vegetable Research Institute,Zhengzhou 450015,China)
The disease which showed intervinal chlorosis in tomato,the typical symptom of tomato chlorosis virus(ToCV),occurred seriously in Zhengzhou during the past several years.A pair of specific primers ToCVCPF/ToCVCPR was designed according to known genome sequences of ToCV.The disease samples were collected,and a reverse transcription(RT)-PCR assay was used to detect the virus with total RNA isolated from the disease samples using the primers ToCVCPF/ToCVCPR.The generated specific segment was collected,cloned and sequenced,and then homology comparison and molecular evolution analysis were conducted.The result indicated that a band of about 750 bp was amplified by RT-PCR,and the coat protein gene was determined to be 774 bp.The homology of the isolate from Zhengzhou was 96% or more with the other ToCV isolates at nucleotide and amino acid level.The phylogenetic analysis showed that the Zhengzhou isolate was closely related to Hebei and Tianjin isolates of ToCV.According to the classification criteria ofCrinivirus,the Zhengzhou isolate should belong to an isolate of ToCV,which caused tomato intervinal chlorosis in Zhengzhou.
tomato chlorosis virus; coat protein; gene cloning; sequence analysis
2016-03-11
河南省科技攻关计划项目(162102110069);河南省现代农业产业技术体系建设专项(S2010-03-G02)
胡京昂(1979-),男,河南滑县人,助理研究员,博士,主要从事番茄遗传育种研究。E-mail:hujingang05@126.com
S436.412.1
A
1004-3268(2016)09-0084-05
