小鼠异基因造血干细胞移植后使用G-CSF对aGVHD的影响*
2016-01-31朱康儿
王 亮, 朱康儿, 张 涛, 陈 洁
(暨南大学附属第一医院 1肿瘤科, 2血液科,广东 广州 510632)
小鼠异基因造血干细胞移植后使用G-CSF对aGVHD的影响*
王亮1,朱康儿2△,张涛2,陈洁2
(暨南大学附属第一医院1肿瘤科,2血液科,广东 广州 510632)
[摘要]目的: 探讨小鼠异基因造血干细胞移植(allo-HSCT)后使用粒细胞集落刺激因子(G-CSF)对急性移植物抗宿主病(aGVHD)的影响及其可能的机制。方法: 以雄性C57BL/6小鼠(H-2b)为异基因供鼠,雄性BALB/c小鼠(H-2d)为同基因供鼠;以接受8 Gy[60Co]γ射线全身照射(TBI)预处理雌性BALB/c小鼠为受鼠,并随机分为7组:单纯TBI组、同基因骨髓+脾细胞移植(Syn-BMST)组、异基因骨髓移植(allo-BMT)组、异基因骨髓+脾细胞移植(allo-BMST)组、Syn-BMST后G-CSF给药(Syn-BMST+G-CSF)组、allo-BMT后G-CSF给药(allo-BMT+G-CSF)组和allo-BMST后G-CSF给药(allo-BMST+G-CSF)组,各G-CSF给药组从移植后第1天(+1 d)开始皮下注射G-CSF 2 μg/d,观察至+60 d。比较各组生存时间、aGVHD发生情况和病理改变,流式细胞术检测骨髓p-Kb+细胞百分率(异基因嵌合率),比较allo-BMST和allo-BMST+G-CSF组+10 d时血清细胞因子(IL-2、IL-4、IFN-γ和TNF-α)水平、脾总有核细胞数(SpTNC)和脾细胞免疫表型的差异。结果: 单纯TBI组小鼠于照射后9~15 d死于造血衰竭,其余各组+10 d时均100%获得造血重建,随机抽取2只异基因骨髓移植受鼠,+30 d供者细胞嵌合率分别为99.8%和99.4%,表明清髓性allo-HSCT模型建立成功。Syn-BMST、Syn-BMST+G-CSF、allo-BMT和allo-BMT+G-CSF组小鼠观察至+60 d均未发生aGVHD。与allo-BMST组相比,allo-BMST+G-CSF组受鼠出现aGVHD时间早、程度重、病理改变严重、存活时间明显缩短(P<0.05)、+10 d SpTNC明显增加(P<0.05)、脾脏NK细胞显著扩增 (P<0.01)、DC1/DC2比值减低(P<0.05),而2组血清IL-2、IL-4、IFN-γ和TNF-α水平差异无统计学意义。结论: 移植后使用G-CSF对小鼠异基因单纯骨髓移植后aGVHD无明显影响,但能显著加重allo-BMST后aGVHD的严重程度并缩短受鼠生存时间,该效应可能与G-CSF诱导供鼠NK细胞扩增有关,提示临床allo-HSCT后早期使用G-CSF可能触发或加重aGVHD的风险。
[关键词]粒细胞集落刺激因子; 急性移植物抗宿主病; 小鼠异基因造血干细胞移植
粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)在异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)中广泛用于供者动员和促进移植后髓系造血重建。近年研究发现G-CSF对移植免疫具有广泛的调节作用[1],如供者G-CSF动员能增强供者T细胞免疫耐受,使得异基因外周血干细胞移植(allogeneic peripheral blood stem cell transplantation,allo-PBSCT)受者虽输入较异基因骨髓移植(allogenic bone marrow transplantation,allo-BMT)多10倍以上T细胞而急性移植物抗宿主病(acute graft-versus-host disease,aGVHD)的发生率和严重程度无明显增加。然而,allo-HSCT后受者使用G-CSF对异基因免疫和移植结果的影响尚不明确[2],几项回顾性研究[3-6]的临床资料显示,移植后使用G-CSF者Ⅱ~Ⅳ度aGVHD 和/或慢性移植物抗宿主病(chronic graft-versus-host disease,cGVHD)的发生率显著增加,提示移植后使用G-CSF可能促进异基因免疫反应。因此,本研究在小鼠allo-HSCT模型中初步探讨移植后持续G-CSF给药对aGVHD的影响及其可能机制。
材料和方法
1实验动物
雄性C57BL/6小鼠(H-2b, 8~10周龄)为异基因供鼠,雄性BALB/c小鼠(H-2d, 8~10周龄)为同基因供鼠,雌性BALB/c小鼠(H-2d, 8~10周龄)为受鼠,体重18~22 g。实验动物均为无特定病原体(specific-pathogen free,SPF)级,购自中山大学实验动物中心,生产许可证号为SCXK(粤)2009-0011。在无菌、恒温、恒湿条件下饲养。
2主要试剂
重组人G-CSF为山东齐鲁制药有限公司产品,RPMI-1640培养基为Gibco产品;硫酸庆大霉素注射液为广州白云山天心制药股份有限公司产品;红霉素为北京天佑达生物工程科技有限公司产品;台盼蓝和ELISA试剂盒为Sigma产品;抗小鼠FITC-CD3e、APC-CD4、PerCP-Cy5.5-CD8a、PE-NK1.1、PE-CD69、PerCP-Cy5.5-CD25、APC-CD11c、FITC-CD80、PE-CD86和PerCP-eFluor®710-p-Kb单克隆抗体为eBioscience产品。
3主要方法
3.1受鼠准备和预处理受鼠移植前7 d(-7 d)接受添加抗生素(红霉素250 mg/L,庆大霉素32万 U/L)的灭菌饮水进行肠道准备,并维持至移植后21 d(+21 d)。移植当天接受8 Gy [60Co] γ射线单次全身照射(total body irradiation,TBI)预处理(国产175型[60Co]治疗机由暨南大学附属第一医院肿瘤放疗科提供,剂量率为0.7421 Gy/min,源皮距为100 cm)。照射后立即补充饮水,休息4~6 h后经尾静脉注射终体积为0.2 mL的移植细胞悬液。
3.2供鼠骨髓细胞和脾细胞的制备颈椎脱臼法处死供鼠,在75%乙醇中浸泡5 min,无菌剥离股骨和胫骨,剪去两端骨骺,自近端向远端用RPMI-1640培养液反复冲洗出骨髓腔,制成骨髓细胞(bone marrow cells,BMCs)悬液,调整细胞浓度至1×1011/L备用。无菌取出脾脏,置于200目不锈钢筛网中轻轻碾压,同时滴加RPMI-1640培养液使脾细胞通过钢筛网眼,制成脾细胞(spleen cell,SpC)悬液,调整细胞浓度至5×1010/L备用。
3.3研究分组和HSCT将受鼠随机分为7组:(1)单纯TBI组:TBI后尾静脉注射0.2 mL的PBS,次日开始皮下注射生理盐水(NS)0.1 mL/d;(2)同基因骨髓+脾细胞移植(Syn-BMST)组:TBI后尾静脉注射BALB/c供鼠1×107BMCs+5×106SpCs,+1 d开始皮下注射NS 0.1 mL/d;(3)异基因骨髓移植(allo-BMT)组:TBI后尾静脉注射C57BL/6供鼠1×107BMCs,+1 d开始皮下注射NS 0.1 mL/d;(4)异基因骨髓+脾细胞移植(allo-BMST)组:TBI后尾静脉注射C57BL/6供鼠1×107BMCs+5×106SpCs,+1 d开始皮下注射NS 0.1 mL/d;(5)Syn-BMST后G-CSF给药(Syn-BMST+G-CSF)组:Syn-BMST后自+1 d开始皮下注射G-CSF 2 μg/d;(6)allo-BMT后G-CSF给药(allo-BMT+G-CSF)组:allo-BMT后自+1 d开始皮下注射G-CSF 2 μg/d;(7)异基因骨髓+脾细胞移植后G-CSF给药(allo-BMST+G-CSF)组:allo-BMST后自+1 d开始皮下注射G-CSF 2 μg/d。G-CSF每日给药剂量参考文献[7],时间自+1 d直至受鼠死亡或+60 d。组(1)、(2)、(5)和(6)每组10只,组(3)12只(其中2只用于异基因嵌合率分析),组(4)和(7)每组22只(其中7只用于检测分析)。
3.4移植后观察每日观察受鼠饮食及活动情况,注意有无倦怠、体重下降、弓背、翘毛、脱毛、皮肤溃疡、腹泻或肛门有排泄物等表现,观察终点为+60 d。+10 d每组随机抽取2只小鼠计数外周血白细胞(white blood cells,WBC)数,所有濒死小鼠采血计数WBC后处死取材,其存活时间记至处死次日。WBC计数方法:断尾采血10 μL,加入白细胞稀释液 190 μL中混匀,改良Neubauer计数板充池,静置1 min后按常规计数。
3.5死亡原因判别(1)aGVHD:出现弓背、脱毛、皮肤溃疡、腹泻或肛门有排泄物、倦怠、体重下降等临床表现,WBC≥1×109/L,小肠、皮肤、肝脏组织学检查存在aGVHD病理改变;(2)造血衰竭:死亡前WBC<1×109/L;(3)移植相关死亡:死亡前WBC ≥ 1×109/L,但无aGVHD临床表现和病理改变。
3.6组织病理学检查取濒死小鼠肝、脾、皮肤和小肠,10%甲醛溶液固定,常规石蜡切片,苏木素-伊红(HE)染色,光学显微镜下观察。
3.7细胞因子检测+10 d从allo-BMST组和allo-BMST+G-CSF组中各随机抽取7只小鼠摘除眼球采血,ELISA法测定血清IL-2、IL-4、IFN-γ和TNF-α的水平。
3.8脾总有核细胞数(spleen total nucleated cells count,SpTNC)和脾细胞免疫表型检测+10 d从allo-BMST组和allo-BMST+G-CSF组摘眼球采血处死的小鼠中各随机抽取5只小鼠,完整取出脾脏,制备脾细胞悬液(定容5 mL)。取20 μL细胞悬液加入380 μL白细胞稀释液中混匀,然后滴加到细胞计数板上,水平静置1 min后计数4个大方格中细胞数(N),SpTNC = (N÷4)×10×20×106/mL×5 mL。调整脾细胞浓度至5×1010/L,取320 μL细胞悬液分置于4个2 mL平底离心管中,每管80 μL:管① 加入FITC-CD3e、APC-CD4、PerCP-Cy5.5-CD8a和PE-NK1.1单抗工作液各5 μL;管②加入FITC-CD3e、APC-CD4、PerCP-Cy5.5-CD25和PE-CD69单抗工作液各5 μL;管③加入FITC-CD80、APC-CD11c、PerCP-Cy5.5-CD8a和PE-CD86单抗工作液5 μL;管④加入PerCP-eFluor®710-p-Kb单抗工作液5 μL。混匀,4 ℃避光孵育30 min;充分裂解红细胞后用PBS洗涤2次并重悬至200~500 μL上机容积;应用BD FACSAria型流式细胞仪分析30 000个活细胞,测定CD3+、CD4+、CD8+、CD3+NK1.1-(T细胞)、CD3-NK1.1+(NK细胞)、CD3+NK1.1+(NKT细胞)、CD4+CD25+、CD3+CD25+、CD3+CD69+、CD11c+(DC)、CD11c+CD8a-(DC1)、CD11c+CD8a+(DC2)、CD80+、CD86+和p-Kb+细胞百分率,计算DC1/ DC2比值。
4统计学处理
采用SPSS 13.0统计学软件处理数据,计量资料用均数±标准差(mean±SD)表示,计数资料用百分率表示。时间的比较用 Mann-Whitney 检验,率的比较用 Chi-square 检验;对存活时间绘制Kaplan-Meier生存曲线,用时序检验(log-rank test)比较组间小鼠存活时间,以P<0.05为差异有统计学意义。
结果
1小鼠异基因造血干细胞移植模型的建立
单纯TBI组小鼠于照射后3 d开始出现厌食、活动减少、体重进行性下降,于照射后9~15 d死亡,平均存活时间(12.0±1.9) d,死亡前WBC为 0~0.1×109/L(造血衰竭死亡)。其余各组移植小鼠+10 d时均100%获得造血重建。+30 d随机抽取2只异基因骨髓移植受鼠,流式细胞术检测骨髓p-Kb+细胞百分率分别为99.8%和99.4%(图1),表明异基因移植成功。
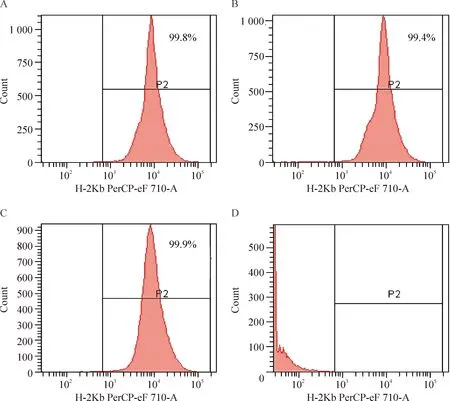
Figure 1.Analysis of donor mice cell chimerism rate (p-Kb positive cells percentage) at day +30 post-transplantation. A, B: recipient mice of allogeneic hematopoietic stem cell transplantation; C: a normal C57BL/6 mouse; D: a normal BALB/c mouse.
图1移植后30 d骨髓供鼠细胞嵌合率(p-Kb+细胞百分率)分析
2移植后使用G-CSF对生存时间和aGVHD的影响
Syn-BMST、Syn-BMST+G-CSF、allo-BMT和allo-BMT+G-CSF组的小鼠观察至+60 d均无aGVHD表现。allo-BMT+G-CSF组有1只小鼠+50 d死亡,无典型aGVHD表现和病理改变,死因判别为移植相关死亡。4组生存时间无显著差异。allo-BMST组于+22 d开始出现aGVHD表现,于+28 d~+42 d死亡;allo-BMST+G-CSF组小鼠于+10 d即开始出现弓背体姿、脱毛、腹泻、不食不动、体重进行性下降等典型aGVHD表现,死亡高峰期为+13 d~+25 d,仅1只存活至+37 d。2组存活时间分别为(34.8±4.5)d和(19.8±6.1)d,+30 d存活率分别为80%和6.7%,差异有统计学意义(P<0.05),见图2。
allo-BMST+G-CSF组濒死小鼠的肝脏、小肠、皮肤和脾组织学检查可见典型aGVHD 病理改变:(1)肝脏可见肝细胞浊肿、变性,肝索排列紊乱,中央静脉扩张,小静脉周围及汇管区可见大量淋巴细胞浸润; (2)小肠可见黏膜上皮细胞变性坏死,绒毛脱落,假膜形成,黏膜和黏膜下层明显充血、水肿,腺体减少,间质出血,伴较多淋巴细胞浸润; (3)皮肤角质层脱落,基底细胞空泡变性,真皮层可见淋巴细胞浸润; (4)脾脏可见正常结构破坏,白髓消失,间质出血,伴巨噬细胞和淋巴细胞浸润。而同期allo-BMST组小鼠的病理改变较之明显减轻。
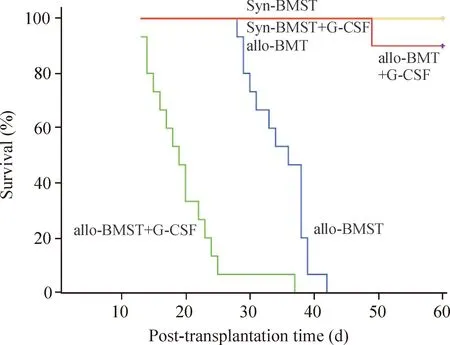
Figure 2.Kaplan-Meier of post-transplantation survival difference in Syn-BMST, allo-BMT, allo-BMST, Syn-BMST+G-CSF, allo-BMT+G-CSF and allo-BMST+G-CSF groups.
图2各组小鼠移植后Kaplan-Meier生存曲线
3移植后使用G-CSF对SpTNC和脾细胞免疫表型的影响
与allo-BMST组相比,allo-BMST+G-CSF组受鼠+10 d SpTNC明显增加(P<0.05);脾脏NK细胞显著扩增(P<0.01),见图3,嵌合体检测显示脾有核细胞中p-Kb+细胞>99%,说明扩增的NK细胞为供鼠来源。G-CSF给药对总DCs数量无明显影响,但DC1亚群减少(P<0.01),而DC2亚群增多(P<0.01),DC1/DC2比值明显减低(P<0.05)。DC表面共刺激分子CD80表达无明显变化(P>0.05),CD86表达降低(P<0.05)。2组CD3+、CD4+、CD8+、CD3+NK1.1+、CD4+CD25+、CD3+CD25+、CD3+CD69+细胞百分率无明显差异,见表1。
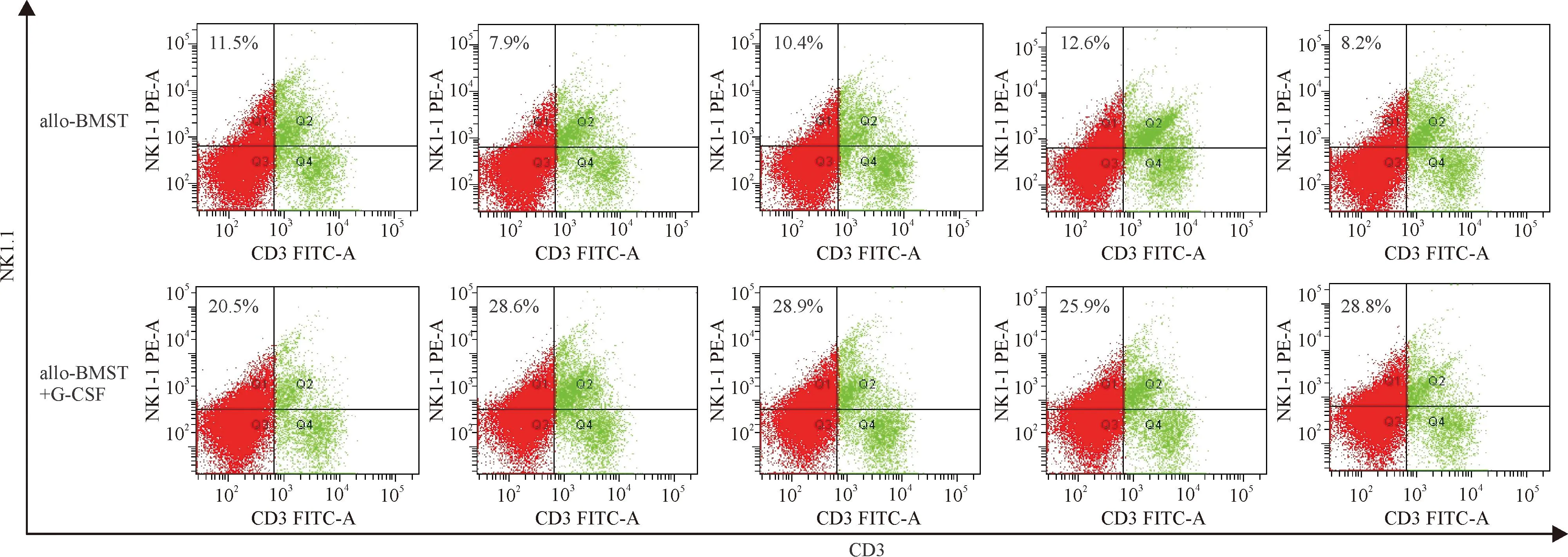
Figure 3.Continuous administration of G-CSF after allogeneic bone marrow cells plus spleen cells transplantation can increase the spleen NK cells (CD3-NK1.1+) subset at day +10 in a murine model.
图3小鼠allo-BMST后连续G-CSF给药能扩增+10 d脾脏NK(CD3-NK1.1+)细胞
表1小鼠allo-BMST后连续G-CSF给药对脾细胞免疫表型的影响
Table 1.The impact of continuous administration of G-CSF after allogeneic bone marrow cells plus spleen cells transplantation on the immunophenotypes of splenocytes at day +10 in a murine model (%. Mean±SD.n=5)
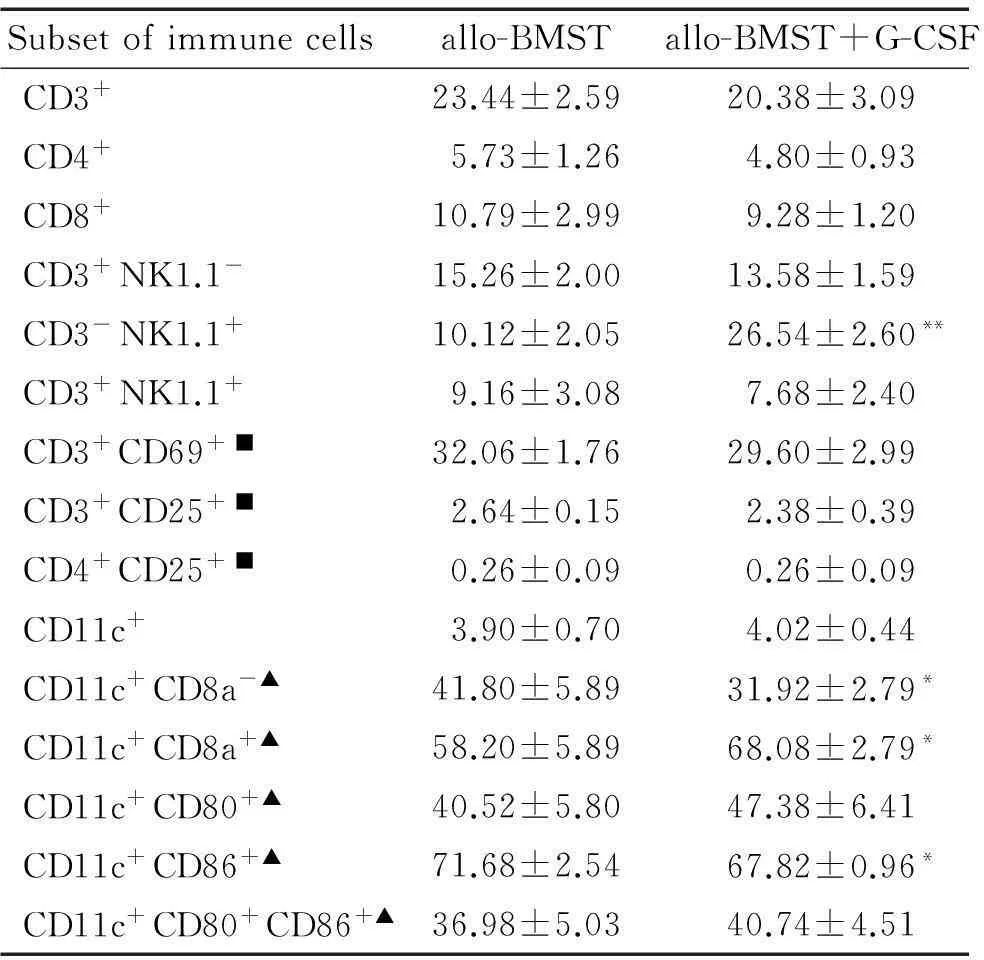
Subsetofimmunecellsallo-BMSTallo-BMST+G-CSFCD3+23.44±2.5920.38±3.09CD4+5.73±1.264.80±0.93CD8+10.79±2.999.28±1.20CD3+NK1.1-15.26±2.0013.58±1.59CD3-NK1.1+10.12±2.0526.54±2.60**CD3+NK1.1+9.16±3.087.68±2.40CD3+CD69+■32.06±1.7629.60±2.99CD3+CD25+■2.64±0.152.38±0.39CD4+CD25+■0.26±0.090.26±0.09CD11c+3.90±0.704.02±0.44CD11c+CD8a-▲41.80±5.8931.92±2.79*CD11c+CD8a+▲58.20±5.8968.08±2.79*CD11c+CD80+▲40.52±5.8047.38±6.41CD11c+CD86+▲71.68±2.5467.82±0.96*CD11c+CD80+CD86+▲36.98±5.0340.74±4.51
■: precent of CD3+cells (T-cells);▲: precent of CD11c+cells (dendritic cells, DCs).*P<0.05,**P<0.01vsallo-BMST.
4移植后使用G-CSF对血清细胞因子水平的影响
allo-BMST组和allo-BMST+G-CSF组+10 d血清的IL-2、IL-4、IFN-γ和TNF-α水平在2组间差异均无统计学意义,见表2。
讨论
G-CSF最早因发现具有髓系生长刺激作用而得名,在allo-HSCT中广泛用于供者外周血干细胞动员和促进移植后粒细胞恢复,近年来发现G-CSF对免疫系统还具有广泛调节作用[1]。然而,临床上allo-HSCT后应用G-CSF对免疫学和移植结果的影响仍不清楚[2],特别是对GVHD和生存时间(OS)的影响存在争议[3-6]。此外,有临床研究[8-13]显示,G-CSF对移植后复发白血病有一定治疗作用,获得疗效者多伴随出现GVHD,推测其疗效机制可能与诱导伴随GVHD的移植物抗白血病(graft-versus-leukemia, GVL)效应有关,我们的临床研究中也有类似发现。因此,本研究进一步应用小鼠allo-HSCT模型探讨移植后使用G-CSF对GVHD的影响及其可能机制。
人与小鼠G-CSF具有较高的同源性,两者73%的氨基酸序列相同,因而人G-CSF可用于小鼠模型的研究。我们在H-2不相合小鼠(C57BL/6→BALB/c)allo-HSCT模型中,受鼠移植1×107BMCs+5×106SpCs后自+1 d开始持续给予G-CSF 2 μg/d,结果与allo-BMST对照组相比较,G-CSF给药组小鼠aGVHD加重,生存时间明显缩短,而在同基因移植小鼠中未见上述效应,与Morris等[7]在H-2半相合小鼠(B6→B6D2F1)allo-HSCT模型中的研究结果相似。同时我们还发现在异基因单纯骨髓细胞移植(1×107BMCs)后持续给予G-CSF,未导致aGVHD加重,2组受鼠生存时间无差异,提示aG-CSF须通过输入的异基因供鼠脾细胞介导加重aGVHD的效应。
表2小鼠allo-BMST后连续G-CSF给药对血清IL-2、IL-4、IFN-γ和TNF-α水平的影响
Table 2.The impact of continuous administration of G-CSF after allogeneic bone marrow cells plus spleen cells transplantation on the levels of serum IL-2, IL-4, IFN-γ and TNF-α at day +10 in a murine model (ng/L. Mean±SD.n=7)

GroupIL-2IL-4IFN-γTNF-αallo-BMST82.07±22.6284.21±14.56197.26±22.1510.13±2.94allo-BMST+G-CSF95.01±37.5673.26±11.98215.57±25.7310.71±2.52
由于allo-BMST后G-CSF给药组+10 d开始即有小鼠陆续出现aGVHD表现,因此我们在后续实验时选择+10 d检测脾细胞免疫指标,结果发现G-CSF能增加脾有核细胞数,嵌合体检测显示脾细胞中p-Kb+细胞百分率>99%,即完全供者型嵌合体,表明扩增细胞为供者来源。进一步应用四色流式细胞术检测发现,G-CSF给药组小鼠脾脏中NK(CD3-NK1.1+)细胞显著扩增,而T细胞(CD3+NK1.1-)和NKT细胞(CD3+NK1.1+)百分率无明显变化,提示供者NK细胞扩增可能是G-CSF加重aGVHD的一个重要机制。
NK细胞是一种重要的固有免疫细胞,通过抑制性杀伤细胞免疫球蛋白样受体(KIR)结合MHC-Ι类分子识别“自我” ,而通过“丢失自我”机制杀伤MHC-Ι类分子表达缺陷或结构异常的细胞,其杀伤作用无MHC限制性。近年来发现,除供者T淋巴细胞之外,供者NK细胞是另一种在GVHD和GVL效应中起重要作用的效应细胞。多数研究肯定了供者NK细胞异基因反应活性介导GVL效应的作用,Ruggeri等[14]首先报道在HLA半相合HSCT中KIR-配体(KIR-L)错配/不相容能增强GVL效应,复发率显著降低,同时还减轻GVHD和移植物排斥。然而,在非血缘造血干细胞移植(UDT)中,KIR-L不相容对GVHD的影响存在相反结果,Davies等[15]发现KIR-L(HLA-Bw4和HLA-C位点)不相容UDT中GVHD有升高趋势。Miller等[16]分析2 062例髓系白血病的UDT时发现,受者缺失1个或以上的KIR配体与复发率减低和Ⅲ~ΙV度aGVHD增加相关,NK细胞异基因反应活性能同时增强GVL效应和GVHD。因此,不同类型移植中其供者NK细胞对GVHD的影响有所不同。本研究所使用的C57BL/6供鼠和BALB/c受鼠为2种品系不同的近交系小鼠,供鼠KIR与受鼠MHC-Ι类抗原不相容,供鼠NK细胞可通过“丢失自我”机制损伤宿主正常细胞而介导GVHD。
Morris等[7]在小鼠H-2半相合(B6→B6D2F1)allo-HSCT模型中发现,G-CSF主要通过供者NKT细胞活化和CTL扩增等效应介导GVHD的加重,与本研究G-CSF诱导供者NK细胞扩增的结果不同,推测可能与研究使用了不同的移植模型有关,也可能与所用检测手段差异有关,Morris等[7]的研究应用α-GalCer负载的CD1d四聚体技术结合流式细胞术检测NKT细胞(α-GalCer负载的CD1d四聚体和CD3双阳性细胞),而本研究单以流式细胞术检测CD3+NK1.1+为NKT细胞指标,前者能反映NKT细胞活化的情况,而后者反映的是NKT细胞量的变化。此外,本研究还发现,G-CSF给药后树突状细胞(dendritic cells,DCs)数量无明显变化,但DC1亚群减少,DC2亚群增多,DC1/DC2比值明显减低。表明G-CSF促进了DCs向DC2方向的极化,这与G-CSF动员供者外周血干细胞的免疫学变化相似,但难以直接解释aGVHD加重的现象,此外,本研究也未发现G-CSF对+10 d血清的IL-2、IL-4、IFN-γ和TNF-α水平有影响,推测移植后应用G-CSF可能作用于与介导aGVHD相关的多条通路,而不同研究条件下的局部效应可能有所差异,但最终的影响结果乃取决于多条通路的“合力”方向。因此,移植后应用G-CSF对免疫系统的影响及其确切机制还有待进一步深入研究。
[参考文献]
[1]Rutella S, Zavala F, Danese S, et al. Granulocyte colony-stimulating factor: a novel mediator of T cell tolerance [J]. J Immunol, 2005, 175(11): 7085-7091.
[2]Morris ES, MacDonald KP, Hill GR, et al. Stem cell mobilization with G-CSF analogs: a rational approach to separate GVHD and GVL? [J]. Blood, 2006, 107(9): 3430-3435.
[3]Ringdén O, Labopin M, Gorin NC, et al. Treatment with granulocyte colony-stimulating factor after allogeneic bone marrow transplantation for acute leukemia increases the risk of graft-versus-host disease and death: a study from the Acute Leukemia Working Party of the European Group for Blood and Marrow Transplantation [J]. J Clin Oncol, 2004, 22(3):416-423.
[4]Remberger M, Naseh N, Aschan J, et al. G-CSF given after haematopoietic stem cell transplantation using HLA-identical sibling donors is associated to a higher incidence of acute GVHD II-IV [J]. Bone Marrow Transplant, 2003, 32(2):217-223.
[5]Khoury HJ, Loberiza Jr FR, Ringden O, et al. Impact of posttransplantation G-CSF on outcomes of allogeneic hematopoietic stem cell transplantation [J]. Blood, 2006, 107(4): 1712-1716.
[6]Ho VT, Mirza NQ, del Junco D, et al. The effect of hematopoietic growth factors on the risk of graft-vs-host disease after allogeneic hematopoietic stem cell transplantation: a meta-analysis [J]. Bone Marrow Transplant, 2003, 32(8):771-775.
[7]Morris ES, MacDonald KP, Kuns RD, et al. Induction of natural killer T cell-dependent alloreactivity by administration of granulocyte colony-stimulating factor after bone marrow transplantation[J]. Nat Med, 2009, 15(4):436-441.
[8]Atkinson K, Champlin R, Ritz J, et al. Clinical bone marrow and blood stem cell transplantation [M]. 3rd ed. Cambridge: Cambridge University Press, 2004: 1374-1383.
[9]Giralt S, Escudier S, Kantarjian H, et al. Preliminary results of treatment with filgrastim for relapse of leukemia and myelodysplasia after allogeneic bone marrow transplantation[J]. N Engl J Med, 1993, 329(11):757-761.
[10]Bishop MR, Tarantolo SR, Pavletic ZS, et al. Filgrastim as an alternative to donor leukocyte infusion for relapse after allogeneic stem-cell transplantation [J]. J Clin Oncol, 2000, 18(11):2269-2272.
[11]Carral A, Sanz GF, Sanz MA. Filgrastim for the treatment of leukemia relapse after bone marrow transplantation [J]. Bone Marrow Transplant, 1996, 18(4):817-819.
[12]Law L, Tuscano J, Wun T, et al. Filgrastim treatment of acute myelogenous leukemia (M7) relapse after allogeneic peripheral stem cell transplantation resulting in both graft-versus-leukemia effect with cytogenetic remission and chronic graft-versus-host disease manifesting as polyserositis and subsequent bronchiolitis obliterans with organizing pneumonia[J]. Int J Hematol, 2002, 76(4):360-364.
[13]Howrey RP, Martin PL, Driscoll T, et al. Graft-versus-leukemia-induced complete remission following unrelated umbilical cord blood transplantation for acute leukemia [J]. Bone Marrow Transplantat, 2000, 26(11):1251-1254.
[14]Ruggeri L, Capanni M, Urbani E, et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants[J]. Science, 2002, 295 (6): 2097-2100.
[15]Davies SM, Ruggieri L, DeFor T, et al. Evaluation of KIR ligand incompatibility in mismatched unrelated donor hematopoietic transplants[J]. Blood, 2002, 100(10): 3825-3827.
[16]Miller JS, Cooley S, Parham P, et al. Missing KIR ligands are associated with less relapse and increased graft-versus-host disease (GVHD) following unrelated donor allogeneic HCT [J]. Blood, 2007, 109(11):5058-5061.
(责任编辑: 陈妙玲, 余小慧)

*[基金项目]国家自然科学基金资助项目(No. 81260241)
Effect of granulocyte colony-stimulating-factor on acute graft-versus-host disease after allogeneic hematopoietic stem cell transplantation in a murine modelWANG Liang1, ZHU Kang-er2, ZHANG Tao2, CHEN Jie2
(1DepartmentofOncology,2DepartmentofHematology,FirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:tzhuker@jnu.edu.cn)
[ABSTRACT]AIM: To explore the impact of granulocyte colony-stimulating factor (G-CSF) on acute graft-versus-host disease (aGVHD) after allogeneic hematopoietic stem cell transplantation (allo-HSCT) in a murine model and its possible mechanisms. METHODS: Male C57BL/6 (H-2b) and BALB/c (H-2d) mice were used as the allogeneic and syngeneic donor mice, respectively. Moreover, female BALB/c mice were used as recipient mice. The recipient mice were conditioned by a single dose (8 Gy) of total body irradiation (TBI). The recipient mice were randomly divided into 7 groups: TBI group, Syn-BMST control group, post-Syn-BMST G-CSF administration (Syn-BMST+G-CSF)group, allo-BMT control group, post-allo-BMT G-CSF administration (allo-BMT+G-CSF)group, allo-BMST control group and post-allo-BMST G-CSF administration (allo-BMST+G-CSF) group. The mice in control groups and G-CSF administration groups were subcutaneous injected with 0.1 mL normal saline (NS) and 0.1 mL NS containing 2 μg G-CSF per day from 1st day, respectively. The effect of G-CSF on aGVHD was evaluated by clinical manifestations and pathological changes, as well as survival time of the mice in different groups. The serum levels of IL-2, IL-4, IFN-γ and TNF-α in allo-BMST and allo-BMST+G-CSF groups were detected by ELISA at 10th day. Flow cytometry was used to analyze the immunophenotypes of splenocytes at 10th day. RESULTS: The mice in TBI group were all died for hematologic failure on 9~15 d after TBI. No effect of G-CSF on the survival of the mice underwent Syn-BMST and transplantation of single allogeneic marrow cells was observed. The mean survival days in allo-BMST group and allo-BMST+G-CSF group were (34.8±4.5) d and (19.8±6.1) d’respectively (P<0.01). Moreover, post-transplant administration of G-CSF increased the spleen total nucleated cells count (SpTNC), NK cells subset, and DC1/DC2 ratio in the spleen with over 99% of donor chimerism rate at 10th day. No difference in the levels of serum IL-2, IL-4, IFN-γ and TNF-α between the 2 group at 10th day was found. CONCLUSION: The administration of G-CSF after allo-BMST significantly aggravates mouse aGVHD. The expansion of NK cells stimulated by G-CSF may be involved in the mechanism of generating alloreactivity against host cells. These results imply there may be potential risk of evoking or aggravating acute GVHD if G-CSF is administered in the early stage of clinical allo-HSCT.
[KEY WORDS]Granulocyte colony-stimulating-factor; Acute graft-versus-host disease; Allogeneic hematopoietic stem cell transplantation, Murine
通讯作者△Tel: 0993-2057151; E-mail: 1257067540@qq.com
[收稿日期]2015- 05- 03[修回日期] 2015- 07- 22
[文章编号]1000- 4718(2015)12- 2195- 07
doi:10.3969/j.issn.1000- 4718.2015.12.013
[中图分类号]R392.4
[文献标志码]A
