急性髓系白血病干细胞及靶向治疗的研究进展
2016-01-21庄文芳盛慧明马骏上海交通大学医学院附属同仁医院上海200336
庄文芳 盛慧明 马骏(上海交通大学医学院附属同仁医院 上海 200336)
急性髓系白血病干细胞及靶向治疗的研究进展
庄文芳 盛慧明 马骏*
(上海交通大学医学院附属同仁医院 上海 200336)
摘 要尽管近年来联合化疗的应用使得成人急性髓细胞白血病的治疗取得了长足进步,但总体长期生存率仍不高,主要是复发率高和化疗耐药的影响。白血病干细胞(LSCs) 已被确认是白血病复发的根源,随着研究的深入,发现其生物特性也与耐药性相关,这引起了研究人员的特殊关注,进而探究靶向消除白血病干细胞的创新疗法。本综述旨在总结近年来急性髓系白血病干细胞及其靶向治疗的研究进展,探讨治疗该疾病未来可能的研究方向。
关键词急性髓系白血病 白血病干细胞 靶向治疗
The research progress of the stem cells
of acute myeloid leukemia and its targeting treatment
ZHUANG Wenfang, SHENG Huiming, MA Jun*
(Tongren Hospital Affiliated to School of Medicine, Shanghai Jiao Tong University, Shanghai 200336, China)
ABSTRACTGreat progress has been recently made in the treatment of adult acute myelogenous leukemia (AML) with the application of combined chemotherapy. However, the overall long-term survival is still lower mainly due to high recurrence rate and resistance to chemotherapy. It is known that leukemia stem cells (LSCs) are most responsible for its relapse, and it is also found that drug resistance is related to their biological properties with the deepening of research work, which results in the particular concern of researchers and draws their attention to exploring an innovative therapy for targeting elimination of leukemia stem cells. In this article, we summarize the recent studies on the stem cells of acute myelogenous leukemia and its targeting therapy and discuss the potential future strategies for the treatment of AML.
KEY WORDSacute myelogenous leukemia (AML); leukemia stem cells (LSCs); targeting therapy
众所周知,成人急性髓细胞白血病(acute myelogenous leukemia,AML)的预后较差,年轻患者中仅40%~50%有5年生存期,而在老年患者中平均生存期不足1年。尽管近年来应用联合化疗使得AML的治疗取得了长足进步,AML的完全缓解率和长期生存率也均有了较大的提高,但仍面临白血病的反复发作和化疗耐药的难题。有大量证据表明,几乎所有的肿瘤都是来自于最初的微量细胞或单个细胞,研究者们将其命名为干细胞。白血病复发的根源已被确认是白血病干细胞(leukemia stem cells,LSCs),这类细胞具有以下特点:通常处于静息态即细胞周期的G0期,复制缓慢却具有无限更新的能力,对化疗的杀伤作用不敏感,轻易逃避化疗药物杀伤[1-2]。正是因为其独特的表型,使其对经典化疗药物反应性不佳,这些引起了研究人员的特殊关注。2014年加拿大干细胞科学家约翰·迪克博士(Dick, John E)实验室的研究取得重大突破,表述AML初发于骨髓中的干细胞,称之为前白血病-骨髓间充质干细胞(preLHSCs),首次清晰的阐述LSCs与HSCs之间在白血病发生发展过程中的关联[3]。新成果对于理解一个普通细胞经过怎样的步骤发展成AML是一个质的飞跃,进而通过检测和靶向消除白血病干细胞的创新疗法来防止病情复发,为促进个性化癌症医疗做好了准备。本文对近年来急性髓系白血病干细胞及靶向治疗的研究做了简单的总结。
1 急性髓细胞白血病干细胞一些重要表型标志
Bonnet等[4]经过大量研究发现,CD34+CD38-细胞
群与正常造血干细胞(hematopoietic stem cell, HSC)表面标志相似,可用来鉴别AML中具有无限增殖、分化能力的细胞,研究表明虽然该类细胞群在AML患者体内所占比例很少,但将AML患者体内分离出的CD34+CD38-的白血病细胞亚群异基因移植入非肥胖糖尿病/重症联合免疫缺陷小鼠(non-obese diabetic / severe combined immune deficient mice,NOD/SCID)体内可引发AML,后将此细胞群定义为LSCs,支持了LSC起源于正常HSC的假说。
之后的研究表明LSC的表面标志极为复杂,因人而异,实验证明在某些情况下,具有不同表型的细胞亚群都具有LSCs活性[5-7],CD34+CD38-已不再是界定LSCs的特殊免疫表型。最近的研究发现很多新的标志物在CD34+CD38-的LSCs而非在HSC表达,如CLL-1、CD96、TIM3、CD47、CD32和CD25等。现有的研究总结了LSCs的一些具体表达情况(表1)[8],并已利用这些表型在最近的临床试验中成功证实LSCs[9]。
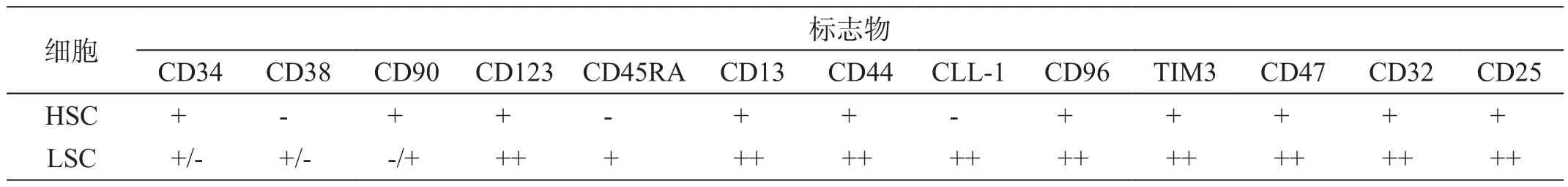
表1 LSCs细胞部分表面免疫表型表达情况a)
2 白血病干细胞的靶向治疗
2.1 针对LSC表面特异性标志物的靶向药物
正因为发现了LSC和HSC在标志物和功能性质上的决定性差异[8],使得研制对HSC无毒性、能维持其正常的造血作用,仅针对LSC的靶向药物成为可能。在基础研究中,针对细胞标志物的特异性抗体在体外均达到不同程度的杀伤LSC的作用。现在较为成熟的靶向药物研究较多的是针对发现较早的特异性细胞标志物,发展较为迅速的是CD123的相关靶向药物。
Jordan等[10]发现,IL-3Ra(IL-3受体a链,CD123)在AML患者的LSC表面几乎全表达,而在正常HSC中几乎不表达,后来的研究显示在正常HSC中也有表达,但明显少于在LSC中的表达[11-12]。因此,CD123的水平常用来评估LSC的数量及增殖情况,通过检测已缓解的患者体内CD123的含量,可以预测患者的复发率和生存率。而以CD123介导的靶治疗机制主要是通过抑制归巢、活化固有免疫和(或)抑制细胞内信号肽完成。目前研究较多是特异性抗CD123抗体与其他相结合的融合试剂。Jin等[13]报道特异性抗CD123抗体在异体移植模型中能减少AML中LSC的生长。Tettamanti等[14]利用特异性抗CD123抗体和CAR整合的细胞因子诱导性杀伤性T细胞结合,在靶向消除LSC方便起到了很好的疗效。CSL362是特异性抗CD123抗体和Fc的混合物,可诱导自身NK细胞杀伤LSC,以达到治疗AML的目的[15]。
CD96也是AML患者LSC表面一种发现较早的特异性细胞标志物,在免疫调控、介导杀伤、炎症反应、T细胞增殖和分化等中起重要作用,并且与NK细胞对肿瘤细胞的杀伤和黏附密切相关。但在临床药物研究方面,没有明显重大的发现。
2.2 针对信号转导通路的靶向治疗
酪氨酸激酶是最常见的生长因子受体,通过阻断酪氨酸激酶可破坏肿瘤细胞的信号传递,从而达到抗肿瘤的目的。Dos Santos等[16]的研究显示c-Kit和SRC激酶家族在LSC中的表达高于在正常HSC中,进而使用抑制剂达沙替尼(dasatinib)在体外和移植免疫小鼠体内已证实可提高化疗药物消灭白血病细胞的能力。Saito 等[17]将AML患者的LSC移植到免疫缺陷型新生小鼠(NOD/SCID)中,构建了可用于研究AML和LSC的小鼠模型。他们在这一小鼠模型中发现,与正常造血干细胞相比,有一种SRC家族激酶-造血细胞激酶(HCK)在LSC中的含量异常升高。研究人员发现,HCK抑制剂对体外培养的LSC非常有效。进而将该化合物应用于小鼠,发现其可使小鼠血液中的人类AML细胞显著减少,同时也减少了小鼠骨髓中的人类LSC。另一种极有前途的靶向治疗靶点是酶Flt3。细胞膜酪氨酸激酶Flt3持续激活是AML细胞的共性,Flt3可激活ras,而ras转而可以活化NF-κB。因此,Flt3信号传导通路传递NF-κB的活化信息,利用Flt3的抑制剂处理LSCs可诱导其凋亡。在临床研究中其基因变异可在1/4 AML患者中发现,并已证实其与复发风险增加相关。已有一些FLT3抑制剂
如索拉菲尼、quizartinib、米哚妥林、crenolanib在进行Ⅱ-Ⅲ期临床试验中[18],其中quizartinib在2012年12月的临床Ⅱ期试验报告中显示,其对携带FLT3突变的半数测试者有明显疗效,而对于缺乏突变的人群亦有三分之一有疗效[19],进一步的Ⅲ期临床已在筹划中。
根据已有研究,调控LSCs自我更新能力并增加生存能力的基因和信号通路有WNT/β-catenin信号通路、Notch 和HOX家族的转录因子等[8,20],相关的靶向药物还在研究之中。此外还有一个影响自我更新的信号通路是通过上调Smo激活LSC中的SHH(Sonic hedgehog)[21-22]。Kobune 等[23]已证实Hh(Hedgehog)信号抑制剂能降低CD34+细胞的耐药能力,这说明Hh信号在LSC的生存和耐药性中发挥重要作用。Zahreddine等[24]今年进一步证实SHH的转录因子神经胶质瘤相关蛋白1(glioma-associated protein 1,GLI1)的表达在LSCs细胞中升高,并指出阿糖胞苷(cytarabine,Ara-C)相关治疗耐药性也与之相关。Hh信号抑制剂vismodegib和PF-04449913现在已进入临床试验阶段(NCT01880437、NCT01546038)。
丝/苏氨酸激酶在有丝分裂中起到重要作用,在AML细胞系及病人标本内该酶表达增加,体外已证实可影响肿瘤细胞的分裂,抑制肿瘤的形成。Aurora B激酶是丝/苏氨酸激酶的一种,在有丝分裂纺锤体聚集时起调节作用;barasertib是该酶的抑制剂,在其Ⅱ期临床试验中,相对于低剂量阿糖胞苷(LDAC)组,barasertib在治疗新发AML且不能耐受密集诱导化疗方案的老年人群中的结果显示,总生存率虽无统计学差异,但患者反应较好,中位生存期延长[25],其Ⅱ/Ⅲ期临床试验仍在进行中。在相似的人群研究中,另一种丝/苏氨酸激酶的抑制剂volasertib,其Ⅱ期临床研究显示,联合应用volasertib和LDAC的患者比单独应用LDAC的有更高的完全缓解率,且总生存期也明显延长[26]。
LSCs维持自身增殖的一大策略是抗凋亡。核因子kappa B(NF-κB)是一种与抗凋亡作用相关的转录因子,NF-κB的异常激活是许多肿瘤细胞增殖所必需的。Guzman等[27]研究发现在AML-LSCs中转录因子NF-κB持续性激活,而在正常造血干细胞中未见其表达,可见NF-κB对于维持LSC生存具有重要作用,这为选择性清除LSCs及特异性治疗AML提供了有力的靶标;他们利用蛋白酶体抑制剂MG2132处理原代AML细胞,使NF-κB表达下调,诱导CD34+/CD38-细胞发生凋亡。研究还发现MG132处理的原代AML细胞在NOD/SCID小鼠中的增殖能力受损,而对正常的CD34+CD38-细胞却无影响。抑制NF-κB信号通路的药物目前在研的有蛋白酶体抑制剂,如硼替佐米(bortezomib)和小白菊内酯(parthenolide,PTL)。小白菊内酯最早证实可应用于消除白血病细胞及其前体细胞[28]。硼替佐米是临床最早应用的蛋白酶体抑制剂,现已广泛应用于多发性骨髓瘤的治疗。在AML的治疗中,当与去甲氧柔红霉素或Ara‐C联合作用时,协同作用加强,白血病细胞增殖分化及存活能力进一步受到明显抑制。近期,硼替佐米的Ⅱ期临床试验已结束,结果显示,其可单药治疗不适合常规化疗药物的患者,对患白血病的过半数患者有效[29]。Guzman等[30]研究发现小白菊内酯的类似物二甲氨基‐小白菊内酯(DMAPT)细胞毒性较强,能诱导LSC快速大量死亡,而对正常HSC无明显伤害。DMAPT在水中溶解度为PTL的1 000倍,其生物利用度较高,具有与小白菊内酯相似的生物学作用,因此,具有靶向清除LSC的潜能,现正开展进一步的临床研究。
2.3 针对白血病微环境的靶向治疗
LSC需要在一定的微环境中才可以维持其干细胞特征,微环境即龛(niche),提供各种信号维持LSC的静止状态及自我更新,是LSC生存、成熟、增殖分化等的必要条件[4]。姚佳峰等[31]详细地介绍了微环境及影响微环境的各种因素,以及可以应用于靶向治疗的药物。值得一提的是,近期Chen等[32]利用IDH2突变所致AML小鼠模型进行了研究。将白血病细胞自IDH2突变诱导的AML小鼠分离,体外培养时加入特殊的IDH2突变抑制剂(AGI-6780),结果AML细胞停止增殖和分化。这表明IDH2突变是肿瘤维持其生长所必须的。作者还在IDH2诱导AML小鼠对体内注入含溴区(bromodomaincontaining)蛋白Brd4抑制剂——另一个AML相关靶向治疗药物——结果治疗有效,为靶向治疗白血病提供了一个潜在的新途径。
当然,在研究临床靶向药物治疗的过程中也不总是成功的,Stein等[33]研究发现在经典诱导缓解方案中[阿糖胞苷、蒽环霉素(7+3)]加入新型靶向药物,并没有得到额外的疗效。同样的,FLT3抑制剂索拉菲尼,其在欧洲人群的临床试验显示,与单用阿糖胞苷、蒽环霉素(7+3)相比无生存率的改善[34]。吉妥单抗(gemtuzumab ozogamicin,GO)是重组人源化抗CD33单抗与细胞毒药物卡奇霉素的复合物,被FDA批准应用首次复发的60岁以上CD33抗原阳性的急性髓细胞性白血病或不宜用细胞毒性药物治疗的CD33阳性的AML患者,但Ⅲ期
临床显示在总生存率指标上未得到统计学差异。CSL360(一种特异性抗CD123抗体)Ⅰ期临床试验显示尚未达到治疗AML的作用[35],还需进一步研究。因此,我们需要看到研究靶向治疗药物的广阔前景,也要在研究靶向治疗中更深入地认识LSC的固有异质性,以便研发出不受该差异影响而对所有LSC均有效的治疗方法。
参考文献
[1] Pollyea DA, Gutman JA, Gore L, et al. Targeting acute myeloid leukemia stem cells: a review and principles for the development of clinical trials[J]. Haematologica, 2014, 99(8): 1277-1284.
[2] Ishikawa F, Yoshida S, Saito Y, et al. Chemotherapy-resistant human AML stem cells home to and engraft within the bonemarrow endosteal region[J]. Nat Biotechnol, 2007, 25(11): 1315-1321.
[3] Shlush LI, Zandi S, Mitchell A, et al. Identification of preleukaemic haematopoietic stem cells in acute leukaemia[J]. Nature, 2014, 506(7488): 328-333.
[4] Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med, 1997,3(7): 730-737.
[5] Sarry JE, Murphy K, Perry R, et al. Human acute myelogenous leukemia stem cells are rare and heterogeneous when assayed in NOD/SCID/IL2Rgammac-deficient mice[J]. J Clin Invest, 2011, 121(1): 384-395.
[6] Taussig DC, Vargaftig J, Miraki-Moud F, et al. Leukemiainitiating cells from some acute myeloid leukemia patients with mutated nucleophosmin reside in the CD34(-) fraction[J]. Blood, 2010, 115(10): 1976-1984.
[7] Terwijn M, Kelder A, Snel AN, et al. Minimal residual disease detection defined as the malignant fraction of the total primitive stem cell compartment offers additional prognostic information in acute myeloid leukaemia[J]. Int J Lab Hematol, 2012, 34(4): 432-441.
[8] Horton SJ, Huntly BJ. Recent advances in acute myeloid leukemia stem cell biology[J]. Haematologica, 2012, 97(7): 966-974.
[9] Chavez-Gonzalez A, Dorantes-Acosta E, Moreno-Lorenzana D, et al. Expression of CD90, CD96, CD117, and CD123 on different hematopoietic cell populations from pediatric patients with acute myeloid leukemia[J]. Arch Med Res, 2014, 45(4): 343-350.
[10] Jordan CT, Upchurch D, Szilvassy SJ, et al. The interleukin-3 receptor alpha chain is a unique marker for human acute myelogenous leukemia stem cells[J]. Leukemia, 2000, 14(10): 1777-1784.
[11] Goardon N, Marchi E, Atzberger A, et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia[J]. Cancer Cell, 2011, 19(1): 138-152.
[12] Taussig DC, Pearce DJ, Simpson C, et al. Hematopoietic stem cells express multiple myeloid markers: implications for the origin and targeted therapy of acute myeloid leukemia[J]. Blood, 2005, 106(13): 4086-4092.
[13] Jin L, Lee EM, Ramshaw HS, et al. Monoclonal antibodymediated targeting of CD123, IL-3 receptor alpha chain, eliminates human acute myeloid leukemic stem cells[J]. Cell Stem Cell, 2009, 5(1): 31-42.
[14] Tettamanti S, Biondi A, Biagi E, et al. CD123 AML targeting by chimeric antigen receptors: A novel magic bullet for AML therapeutics?[J]. Oncoimmunology, 2014, 3: e28835. doi: 10.4161/onci.28835.
[15] Busfield SJ, Biondo M, Wong M, et al. Targeting of acute myeloid leukemia in vitro and in vivo with an anti-CD123 mAb engineered for optimal ADCC[J]. Leukemia, 2014, doi:10.1038/leu.2014.128.
[16] Dos Santos C, McDonald T, Ho YW, et al. The Src and c-Kit kinase inhibitor dasatinib enhances p53-mediated targeting of human acute myeloid leukemia stem cells by chemotherapeutic agents[J]. Blood, 2013, 122(11): 1900-1913.
[17] Saito Y, Yuki H, Kuratani M, et al. A pyrrolo-pyrimidine derivative targets human primary AML stem cells in vivo[J]. Sci Transl Med, 2013, 5(181): 181ra152.
[18] Montalban-Bravo G, Garcia-Manero G. Novel drugs for older patients with acute myeloid leukemia[J]. Leukemia, 2014, doi: 10.1038/leu.2014.244.
[19] Katsnelson A. Drug development: target practice[J]. Nature, 2013, 498(7455): S8-S9.
[20] Wang Y, Krivtsov AV, Sinha AU, et al. The Wnt/beta-catenin pathway is required for the development of leukemia stem cells in AML[J]. Science, 2010, 327(5973): 1650-1653.
[21] Zhao C, Chen A, Jamieson CH, et al. Hedgehog signalling is essential for maintenance of cancer stem cells in myeloid leukaemia[J]. Nature, 2009, 458(7239): 776-779.
[22] Funayama K, Murai F, Shimane M, et al. Adhesion-induced drug resistance in leukemia stem cells[J]. Pharmacology, 2010, 86(2): 79-84.
[23] Kobune M, Takimoto R, Murase K, et al. Drug resistance is dramatically restored by hedgehog inhibitors in CD34+leukemic cells[J]. Cancer Sci, 2009, 100(5): 948-955.
[24] Zahreddine HA, Culjkovic-Kraljacic B, Assouline S, et al. The sonic hedgehog factor GLI1 imparts drug resistance through
inducible glucuronidation[J]. Nature, 2014, 511(7507): 90-93.
[25] Kantarjian HM, Martinelli G, Jabbour EJ, et al. Stage I of a phase 2 study assessing the efficacy, safety, and tolerability of barasertib (AZD1152) versus low-dose cytosine arabinoside in elderly patients with acute myeloid leukemia[J]. Cancer, 2013, 119(14): 2611-2619.
[26] Dohner H, Lubbert M, Fiedler W, et al. Randomized, phase 2 trial of low-dose cytarabine with or without volasertib in AML patients not suitable for induction therapy[J]. Blood, 2014, 124(9): 1426-1433.
[27] Guzman ML, Neering SJ, Upchurch D, et al. Nuclear factorkappaB is constitutively activated in primitive human acute myelogenous leukemia cells[J]. Blood, 2001, 98(8): 2301-2307.
[28] Guzman ML, Rossi RM, Karnischky L, et al. The sesquiterpene lactone parthenolide induces apoptosis of human acute myelogenous leukemia stem and progenitor cells[J]. Blood, 2005, 105(11): 4163-4169.
[29] Sarlo C, Buccisano F, Maurillo L, et al. Phase II study of bortezomib as a single agent in patients with previously untreated or relapsed/refractory acute myeloid leukemia ineligible for intensive therapy[J]. Leuk Res Treatment, 2013, 2013: 705714. doi: 10.1155/2013/705714.
[30] Guzman ML, Rossi RM, Neelakantan S, et al. An orally bioavailable parthenolide analog selectively eradicates acute myelogenous leukemia stem and progenitor cells[J]. Blood, 2007, 110(13): 4427-4435.
[31] 姚佳峰, 李志刚. 白血病干细胞及其微环境:生物学特性与靶向治疗[J]. 国际输血及血液学杂志, 2011, 34(6): 566-569.
[32] Chen C, Liu Y, Lu C, et al. Cancer-associated IDH2 mutants drive an acute myeloid leukemia that is susceptible to Brd4 inhibition[J]. Genes Dev, 2013, 27(18): 1974-1985.
[33] Stein EM, Tallman MS. Remission induction in acute myeloid leukemia[J]. Int J Hematol, 2012, 96(2): 164-170.
[34] Serve H, Krug U, Wagner R, et al. Sorafenib in combination with intensive chemotherapy in elderly patients with acute myeloid leukemia: results from a randomized, placebocontrolled trial[J]. J Clin Oncol, 2013, 31(25): 3110-3118.
[35] He SZ, Busfield S, Ritchie DS, et al. A phase 1 study of the safety, Pharmacokinetics, and Anti-leukemic Activity of the anti-CD123 monoclonal antibody, CSL360, in relapsed, refractory or high-risk acute myeloid leukemia (AML)[J]. Leuk Lymphoma, 2014, 1-23. doi:10.3109/10428194.2014.95 6316.
收稿日期:(2014-10-16)
通讯作者:*马骏,副主任医师,从事血液病研究。czwf1991@163.com
文章编号:1006-1533(2015)03-0064-05
文献标识码:A
中图分类号:R730.54; R733.71
