Cx43基因修饰对人肺鳞癌NCI-H226细胞增殖和迁移能力的影响
2015-12-29勾建强,张秀义
Cx43 基因修饰对人肺鳞癌NCI-H226细胞增殖和迁移能力的影响
勾建强张秀义
(承德市中心医院呼吸内科,河北承德067000)
摘要〔〕目的通过重组质粒pBudCE4.1-Cx43转染人肺鳞癌NCI-H226细胞,探讨Cx43基因对细胞的生长、细胞周期及肿瘤迁移等的作用。方法用LipofectamineTM2000转染的方法将重组表达质粒pBudCE4.1-Cx43转染人肺鳞癌NCI-H226细胞,通过RT-PCR、Western印迹检测Cx43在转染后的mRNA和蛋白的表达情况,划痕染料示踪法检测细胞间通讯功能,流式细胞仪检测细胞周期并通过CCK-8 增殖实验、划痕愈合实验、细胞侵袭实验评价转染Cx43基因对人肺鳞癌NCI-H226细胞增殖、迁移、侵袭能力的影响。结果实验组Cx43 mRNA和蛋白表达较对照组和空白组显著升高(P<0.05);细胞传递的荧光强度较对照组和空白组显著升高(P<0.01),实验组细胞的生长速度明显减慢,细胞周期被阻滞在G0/G1期,S期细胞数明显减少(P<0.05)。与对照组和空白组相比,实验组NCI-H226细胞增殖受到明显抑制(P<0.001),尤以72 h 为著。实验组迁移能力、NCI-H226细胞的侵袭能力显著下降(P<0.05)。结论转染Cx43基可抑制人肺鳞癌NCI-H226细胞的迁移能力,并抑制肿瘤细胞增殖。
关键词〔〕肺鳞癌;缝隙连接蛋白43;转染;NCI-H226细胞;细胞增殖
中图分类号〔〕R734.2〔
Doi7Ruttenstock EM,T,Dingemann J, et al.Prenatal retinoic acid upregulates connexin 43 (Cx43) gene expression in pulmonary hypoplasia in the nitrofen-induced congenital diaphragmatic hernia rat model〔J〕.J Pediat Surg,2012;47(2):336-40.
肺癌的发病是一个多因素、多步骤的渐进过程,肺鳞癌是肺癌一种组织学类型,发病年龄逐渐年轻化,可出现淋巴或血行早期转移〔1〕。随着人类基因组计划的完成和功能基因学的不断发展,发现肿瘤细胞的增殖、迁移与基因调控密切相关,涉及多种基因复杂的激活、失活,提供了有效治疗肿瘤新的途径〔2,3〕。缝隙连接由细胞膜上整合膜蛋白-缝隙连接蛋白(Cx)亚单位构成,是相邻细胞间的膜连接通道,包括Cx43,细胞通过它所介导的细胞缝隙连接通讯(GJIC)在细胞间传递信息和能量, 调控细胞的生长、增殖分化及内环境的稳定,因此推断如果阻断肿瘤细胞中Cx43的表达能有效抑制肿瘤〔4〕。本实验通过重组质粒pBudCE4.1-Cx43转染人肺鳞癌NCI-H226细胞,评价其影响人肺鳞癌NCI-H226细胞增殖、侵袭、迁移的能力。
1材料与方法
1.1主要材料人肺鳞癌NCI-H226细胞购于中国科学院上海细胞库;DMEM培养基、Opti-MEM (GIBCO BRL, 美国)、胎牛血清 (中国医学科学院血液学研究所);重组真核表达质粒pBudCE4.1-Cx43及空载质粒pbudCE4.1由天津肿瘤医院刘凤华老师馈赠;脂质体转染试剂Lipofectamine2000TM(美国Gibco公司);L质粒提取试剂盒、RNA 提取试剂Trizol、 G418、DNA凝胶纯化回收试剂盒(南京凯基生物技术发展有限公司);罗氏黄液(lucifer yellow,Sigma) DNA marker、RT-PCR两步法试剂盒(美国Promcga公司),cDNA合成试剂盒(日本TOYOBO公司);AMV逆转录试剂盒(杭州博日); PCR 引物序列(Invitrogen 公司化学合成);CCK-8(上海炎彬化工公司);兔抗人Cx43多克隆抗体(美国Abcam公司);HRP 标记的羊抗鼠IgG(美国Santa Cruz 公司);鼠抗GAPDH 单克隆抗体(美国Santa Cruz公司);HRP 标记的兔抗羊IgG(北京博奥森公司);PVDF膜(美国Bio-Rad公司);Matrigel gel(美国B.D.公司);ECL化学发光试剂盒(美国Thermo公司)。
1.2Cx43 基因修饰肺鳞癌细胞株NCI-H226培养于含10%小牛血清的DMEM培养基中,置于37℃ 5%CO2密闭式孵箱内培养,传代。实验时取对数生长期的细胞。按2×105个/孔将NCI-H226接种于6孔板中,当融合率达80%时以脂质体法进行转染。转染时分为3组:转染pbudCE4.1-Cx43载体者为NCI-H226/pbudCE4.1-Cx43组(实验组),转染空载质粒pbudCE4.1者为NCI-H226/control组(即对照组),未转染的肝癌NCI-H226为NCI-H226组(即空白组)。于转染后48 h进行转染效应的检测。
1.3RT-PCR检测细胞弃培养液后PBS冲洗3次,通过TRIzol法提取总RNA,用cDNA合成试剂盒反转录合成cDNA。分别扩增Cx43和内参GAPDH。Cx43引物序列: 上游:5′-GTCGACATGGGTGACTGGAGCGCCTT-3,下游:5′-GCGGCCGCCTAGATCTCCAGGTCATCAGG-3',扩增产物为1 149 bp。GAPDH上游:5'-GAGTCAACGGATTGGTCGT-3',下游:5'-GACAAGCTTCCCGTTCTCAG-3',扩增产物为185 bp。PCR反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环。PCR产物采用2%的琼脂糖凝胶电泳鉴定,紫外灯下观察电泳结果,UVI 凝胶成像系统摄像,Image-Pro Plus 7.0 软件分析条带灰度值,用Cx43/GAPDH 代表Cx43 mRNA的相对表达量。
1.4Western印迹检测每组收集1×107个细胞,PBS冲洗3次,提取总蛋白,通过BCA法测定蛋白质浓度,吸取50 μg总蛋白,去离子水补至20 μl,入等体积2×上样缓冲液,99℃变性10 min。离心后吸取30 μl上样,经10%SDS-PAGE分离后,用半干法电转移至PVDF膜上,5%脱脂奶粉,37℃封闭,2 h,加入1∶1 000稀释的Cx43多克隆一抗,4℃过夜。TBST洗膜5次,每次5 min,加入1∶5 000 HRP标记的二抗和GAPDH,于37℃孵育2 h。PBS洗涤,采用ECL法检测。暗室曝光X线胶片,冲洗胶片,UVI凝胶成像系统摄像Image-Pro Plus 7.0软件分析条带灰度值,用Cx43/GAPDH代表代表Cx43的相对表达量。
1.5划痕荷载染料传输试验分别将3组细胞接种于培养皿中,待细胞融合达到100%时,弃去培养液,PBS洗涤3次,加入0.05%罗氏黄液,手术刀片在玻片上轻轻划线数条,之后将细胞浸泡3 min,除去染料,PBS再洗3次,再加少量PBS湿润细胞,荧光显微镜下观察照相,从头至尾随机取10个区域拍照后用OLMPUS光学显微镜下观察,Imagepro5.1图像分析仪测定荧光强度,求其平均值,作为荧光的相对强度。
另外,在介绍红色文化的名人时,在英译版本中还省略了名人们的出生地点。比如“丁日昌(1823-1882),丰顺人”“陈少白(1869-1934),新会人”“叶挺(1896-1946),归善(今惠阳)人”等,其中地点的翻译均被省略,首先,外国游客对这些地点并不熟悉,所以没有必要翻译出来。并且,出生地点不属于重要细节,省译并不影响其红色文化的传播,对于多数外国游客而言,参观游览时,了解重点知识和细节才是最重要的。
1.6流式细胞仪检测收集3组细胞,以冷PBS 洗涤2次,细胞沉淀用70%的冷乙醇(4℃) 混匀备用,洗涤细胞,再用PBS调细胞浓度为1×106/L与含50 μg/ml RNA酶的Tris-HCl缓冲液(pH7.4)共同孵育30 min。100 μg/ ml(1 μg/ml)碘化丙啶(PI)进行细胞的DNA染色,暗室中放置1 h后通过流式细胞仪检测细胞周期,实验重复3次。
1.7CCK-8检测指数生长期细胞接种于96孔板,调整细胞密度每孔达到2×103,加入含10%胎牛血清DMEM培养基200 μl,每组设6个复孔,培养24 h后,每孔加入10 μl CCK-8,培养箱温育4 h后,以不加细胞空白孔为对照,用酶标仪检测450 nm处的吸光度A值。以细胞吸光度A值平均值为纵坐标,以时间48、72、96及120 h为横坐标绘制生长曲线。
1.8细胞划痕损伤实验取对数生长期将上述3组细胞分别以5×103个/孔的密度接种于6孔板,待培养的3组细胞生长形成细胞单层后,用10 L的液枪头单层细胞上呈“一”字划痕。PBS轻柔洗涤,每孔加入2 ml不含血清的DMEM培养液继续培养,于48 h后倒置显微镜100倍下观察细胞迁移情况。
1.9小室侵袭实验在聚碳酸酯微孔滤膜上铺Matrigel 50 μg/孔,在聚合好的小室下室加入10%的胎牛血清做条件培养液,在上室加入按上述3组处理过的NCI-H226细胞悬液100 μl(细胞总数为3×105/L),培养箱中培养24 h取出,以棉签小心刮除滤膜上室面未穿过的瘤细胞,95%乙醇固定5 h,PBS轻轻漂洗3遍,苏木精染色10 min,用BS冲洗小室,自然晾干,将上室的聚碳酸酯滤膜沿边缘用手术刀片小心取下,用树脂胶固定于玻片上(膜内面朝上),封片;干燥后在200×光镜下每膜计数上、下、左、右、中5个视野的侵袭细胞数,计算平均值。每组平行设3个小室,重复3次。
1.10统计学方法采用SPSS16.0统计软件进行单因素方差分析及q检验。
2结果
2.1Cx43 mRNA的表达与对照组(0.38±0.07)和空白组(0.37±0.08)比较,实验组Cx43 mRNA表达(0.82±0.12)的条带明显变宽(P<0.05)。见图1。
2.2Cx43蛋白的表达与对照组(0.65±0.08)和空白组(0.66±0.09)比较,实验组条带Cx43蛋白表达(1.11±0.11)明显变宽(P<0.05),见图2。
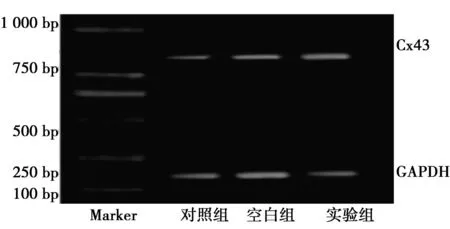
图1 RT-PCR检测NCI-H226细胞中Cx43 mRNA的表达
2.3划痕荷载染料传输试验荧光染料传递表明,对照组和空白组细胞通讯缺失,实验组转染pbudCE4.1-Cx43后的细胞通讯功能明显恢复,即划痕细胞内的荧光染料可传递至毗邻3~4列细胞,见图3。
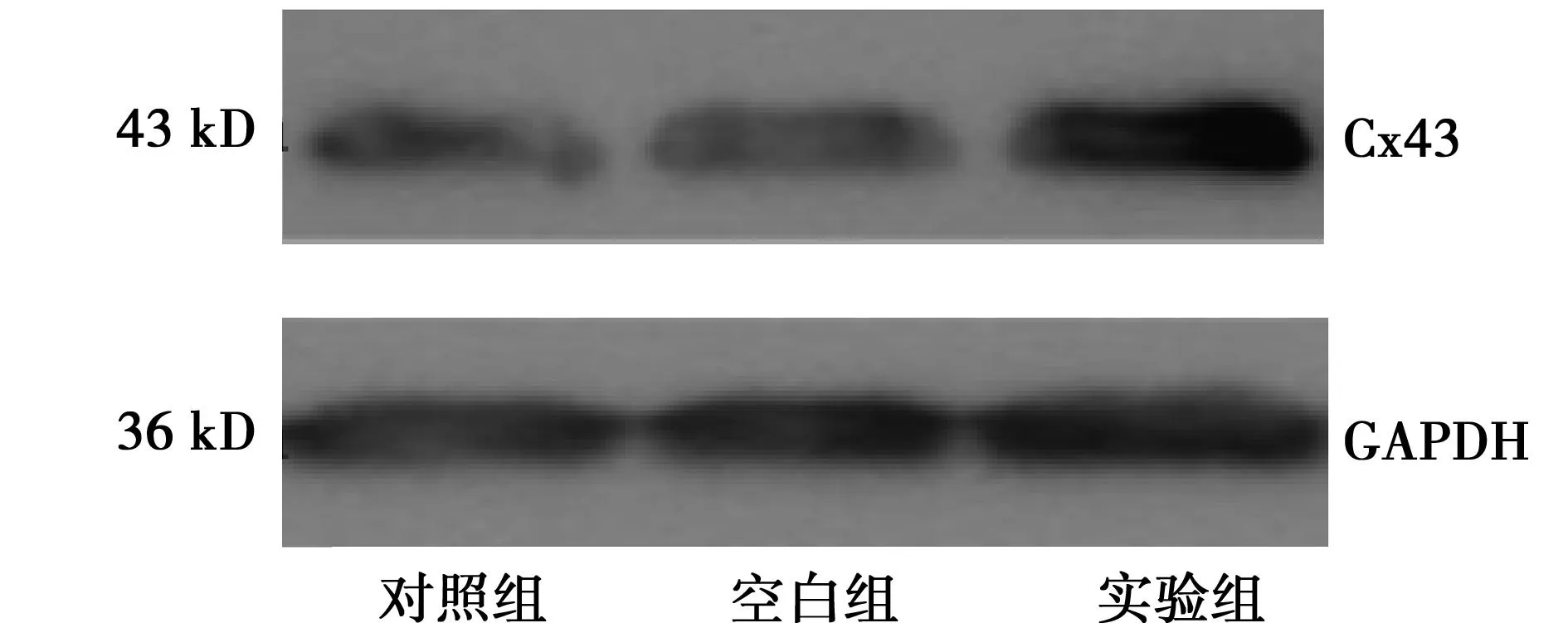
图2 Western印迹检测NCI-H226细胞中Cx43蛋白表达

图3 3组细胞通讯功能(×200)
2.4细胞周期检测G0/G1期,实验组较对照组和空白组略有增加,S期略有减少(P<0.05),M期细胞无明显变化(P>0.05)。表明Cx43 基因修饰将细胞周期阻滞在G0/G1期,见表1。
2.5对细胞增殖的影响实验组较对照组和空白组曲线明显降低(P<0.05),见表2。
表1 Cx43 基因修饰对NCI-H226细胞周期的影响
与空白组、对照组比较:1)P<0.05;下表同
表2 3组OD450 nm吸收值比较
2.6细胞划痕损伤实验48 h后实验组细胞划痕愈合缓慢,而对照组和空白组细胞划痕已基本长满,见图4。
2.7NCI-H226细胞体外侵袭力的变化对照组和空白组穿过滤膜的细胞数量较多分别为(64.34±3.65)和(65.21±4.70)个/40倍视野,实验组穿膜细胞数明显减少至(27.48±4.54)个/40倍视野(P<0.05),表明Cx43 基因修饰能有效地降低NCI-H226细胞的侵袭力。见图5。
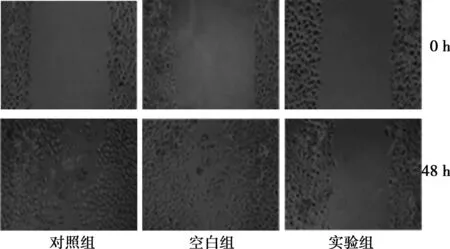
图4 3组细胞划痕损伤实验结果(×40)
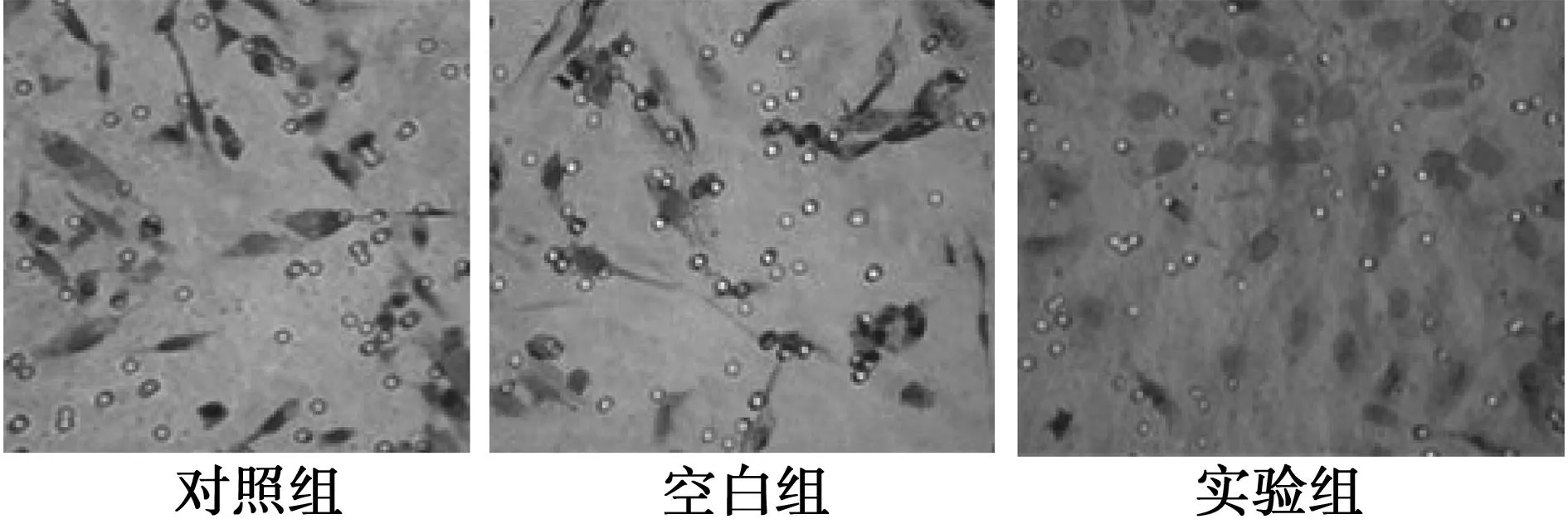
图5 3组小室侵袭实验结果(×40)
3讨论
肺癌患者可出现淋巴或血行早期转移〔1〕。目前临床医生主要采取手术治疗、化疗、放疗、内分泌治疗、生物分子靶向治疗等综合治疗方案,但其局部复发、远处转移是复杂的生物学过程〔5〕。肺鳞癌是肺癌一种组织学类型。随着人类基因组计划的完成和功能基因科学的发展,医学界非常重视肿瘤的基因方面治疗〔2〕。肺鳞癌的增殖、侵袭、迁移涉及多种基因功能及结构的异常,明确肺鳞癌发病中的关键基因对治疗肺鳞癌意义重大〔6〕。
细胞连接主要包括缝隙连接、紧密连接、桥粒连接三种〔7〕。缝隙连接主要参与正常细胞间的能量物质交换和信息交流,调控细胞的增殖、分化、维持细胞内环境稳定、新陈代谢等生理过程,在细胞膜中Cx43是主要构成缝隙连接蛋白亚单位〔8〕。肿瘤的发病、转移与肿瘤细胞增殖失控和异常分化有关〔9〕。研究表明〔10,11〕,Cx43在正常细胞中阳性表达, Cx43在肿瘤细胞中表达明显下降,导致了最重要的细胞间接触抑制在肿瘤细胞中消失,肿瘤细胞间的结合能力下降,提示Cx43基因表达下调导致GJIC功能异常或消失,使正常细胞逃避生长控制及免疫监视,使肿瘤细胞生长过度并易于扩散和转移,参与肿瘤的发病、转移,是近些年来被发现新的抑制肿瘤基因。近些年来随着RNA干扰技术的发展,成为肿瘤基因治疗研究中的热点,由dsRNA分子介导的转录后沉默基因能高效、特异的抑制多种与肿瘤发病有关的基因表达,达到有效治疗肿瘤的目的〔12〕。
综上,Cx43的表达下降与肿瘤发生和发展有关。Cx43基因修饰后可抑制人肺鳞癌NCI-H226细胞的增殖、迁移能力。
4参考文献
1Feist A,Lee R,Osborne S,etal.Increased incidence of cutaneous squamous cell carcinoma in lung transplant recipients taking long-term voriconazole〔J〕.J Heart Lung Transpl,2012;31(11):1177-81.
2Bastide K,Ugolin N,Levalois C,etal.Are adenosquamous lung carcinomas a simple mix of adenocarcinomas and squamous cell carcinomas,or more complex at the molecular level〔J〕?Lung Cancer,2010;68(1):1-9.
3Kunert-Keil C,Steinmüller F,Jeschke U,etal.Immunolocalization of glycodelin in human adenocarcinoma of the lung, squamous cell carcinoma of the lung and lung metastases of colonic adenocarcinoma〔J〕.Acta Histochem,2011;113(8):798-802.,Steinmüller F,Jeschke U,etal.Immunolocalization of glycodelin in human adenocarcinoma of the lung, squamous cell carcinoma of the lung and lung metastases of colonic adenocarcinoma〔J〕.Acta Histochem,2011;113(8):798-802.
4Wayakanon P,Bhattacharjee R,Nakahama K,etal.The role of the Cx43 C-terminus in GJ plaque formation and internalization〔J〕.Biochem Biophys Res Comm, 2012;420(2):456-61.
5Ho CF,Chan KW,Yeh HI,etal.Ketone bodies upregulate endothelial connexin 43 (Cx43) gap junctions〔J〕.Veteri J,2013;198(3):696-701.
6Chen XS,Zhang YG.Myocardial Cx43 expression in the cases of sudden death due to dilated cardiomyopathy〔J〕.Forensic Sci Int, 2006;162(1-3):170-3.
8Ton QV,Kathryn Iovine M.Semaphorin 3d mediates Cx43-dependent phenotypes during fin regeneration〔J〕.Develop Biol,2012;366(2):195-203.
9Teixeira TF,da Silva TC,Fukumasu H,etal.Histological alterations in the livers of Cx43-deficient mice submitted to a cholestasis model〔J〕.Life Sci, 2007;81(5):380-4.
10Solan JL,Lampe PD.Specific Cx43 phosphorylation events regulate gap junction turnover in vivo〔J〕.FEBS Lett, 2014;588(8):1423-9.
11Moore JC,Tsang SY,Rushing SN,etal.Functional consequences of overexpressing the gap junction Cx43 in the cardiogenic potential of pluripotent human embryonic stem cells〔J〕.Biochem Biophy Res Commu,2008;377(1):46-51.
12Neuhaus J,Heinrich M,Schwalenberg T,etal.TGF-β1 inhibits Cx43 expression and formation of functional syncytia in cultured smooth muscle cells from human detrusor〔J〕.Eur J Urol,2009;55(2):491-8.
〔2013-12-26修回〕
(编辑苑云杰)
