红汁乳菇菌丝体发酵过程的参数变化及发酵终点的确定
2015-12-27衣雪竹曹文涛
杨 平,衣雪竹,曹文涛
(1.大连百傲化学股份有限公司,辽宁大连116038;2.贵州省发酵工程与生物制药重点实验室,贵州贵阳550003)
红汁乳菇菌丝体发酵过程的参数变化及发酵终点的确定
杨 平1,衣雪竹1,曹文涛2
(1.大连百傲化学股份有限公司,辽宁大连116038;2.贵州省发酵工程与生物制药重点实验室,贵州贵阳550003)
研究了红汁乳菇菌丝体摇瓶发酵过程中菌丝体形态、干质量、pH、还原糖含量、蛋白酶活等变化趋势,综合分析确定发酵终点。结果显示,各项指标对发酵培养过程控制均具有指示性,在培养6 d时蛋白酶活达到峰值0.65 U,菌丝干质量也达到较高值0.48 g/100 m L,其他指标变化趋势也提示可在此时间结束发酵。
红汁乳菇菌丝体;参数变化;发酵终点
红汁乳菇(Lactarius hatsudake)是一种美味食用菌,富含蛋白质、有机酸、核苷酸、多糖、微量元素等营养物质,具有抗菌活性,但因其是植物外生菌根菌,目前尚无法人工栽培出菇[1-2]。运用深层培养的方式培养菌丝体是近年来食用菌生产的新途径,其特点是生产周期短、产量大,一年四季可以稳定供应。通过深层培养可以大量生产菌丝体,再从菌丝体和发酵醪液中提取抗肿瘤多糖、有机酸、核酸、抗生素、香味物质和具生物活性的代谢产物等。目前在红汁乳菇菌丝体的发酵培养研究中,多涉及培养基成分、培养条件的优化[3-8],菌丝体营养成分的分析和多糖提取等[9-12],对培养过程中菌丝体主要生理指标的报道与终点确定的关系少有报道。结合近年来对食用菌液体发酵动态及终点判定的研究,对红汁乳菇培养过程中的菌丝体形态、干质量、pH、还原糖、蛋白酶活等参数变化进行了检测分析[13-16],为菌丝体放大生产的过程控制及发酵终点判定提供了实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌种
实验菌种为野生红汁乳菇子实体中分离驯化得到。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g马铃薯,洗净去皮切碎,加水大约1 000 m L煮沸0.5 h,两层纱布过滤,加入20 g葡萄糖和20 g琼脂,加水补至1 000 m L,121℃灭菌20 min左右后取出分装备用。
发酵培养基:采用实验优化培养基,果糖30.253 g/L,蛋白胨3.576 g/L,K2HPO42.5 g/L。
1.2 仪器与设备
BJ-1CD超净工作台、YXQ-LS-50SII高压灭菌锅:上海博讯实业有限公司医疗设备厂;UV-2500紫外分光光度计:日本岛津公司;TDL80-2B台式离心机:上海安亭科学仪器厂;ECLIPSE-E200显微镜:日本Nikon公司;ZHWY-111B恒温摇床:上海智城分析仪器制造有限公司;DZF-0真空干燥箱:上海跃进医疗器械厂;AG135梅特勒-托利多天平:上海梅特勒仪器公司。
1.3 方法
1.3.1 摇瓶菌丝体培养
用250m L三角瓶分装优化培养基,每瓶装液量为60m L,0.12 MPa、121℃灭菌30 min,冷却后接入培养3 d的液体菌种,27℃、140 r/min摇床培养10 d,每天取一瓶做各项指标检测及形态观察。
1.3.2 菌丝干质量的测定
将发酵液于3 000 r/min离心15 min。弃去上清液,用蒸馏水清洗沉淀的菌丝体后再离心分离,重复2次,将沉淀的菌丝体于40℃下真空干燥至恒质量,称质量。
1.3.3 菌丝形态观察
取发酵不同天数的菌丝体进行肉眼及镜下观察,镜下观察先压片染色(石炭酸-美兰),在100倍显微镜下观察并选取形态显著的菌丝拍片。
1.3.4 理化指标的测定
pH值:用pH计测量;黏度:用黏度计测量。
发酵滤液OD值测定:取离心发酵滤液,用分光光度计在波长540 nm处测OD值。
还原糖的测定:取离心发酵滤液,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定发酵滤液还原糖。
胞外蛋白酶活的测定:取50 mg酪蛋白作为底物,添加4.9 m L 0.2 mol/L的Tris-HCl缓冲液(pH 7.0)及0.1 m L发酵滤液混合,37℃水浴反应20 min,加0.5 m L 50%三氯醋酸溶液后终止反应,混合液经过滤于波长280 nm处测定吸光度值,以煮沸的发酵滤液作空白对照。酶活力单位定义为1 U=△OD/(min·m L)。
2 结果与分析
2.1 不同发酵时间红汁乳菇菌丝体的外观及镜检形态
对菌丝形态的观察可以更加直观地了解发酵的进程及变化,为发酵培养及其控制提供依据。发酵过程中菌丝体外观以及形态分别见图1及图2。

图1 发酵过程中菌丝体外观Fig.1 Mycelia appearance in fermentation process

图2 发酵过程中菌丝体形态Fig.2 Morphology of mycelia in fermentation process
由图1可知,菌丝体发酵初期(1 d)时呈白色羽毛状,分散于培养液中。随着发酵的进行,菌丝逐渐浓稠形如絮状,菌体分泌色素使菌丝颜色变为浅棕色,发酵液的颜色也随之加深。随着培养时间增加,菌丝体的大量生长使发酵液也越来越黏稠,且发酵液产生浓郁的香味,说明此时代谢产生了大量芳香类营养物质。培养后期(6 d)菌丝部分呈片状,菌体出现自溶现象。取发酵菌丝体压片镜检,发现不同培养时间点发酵菌丝有很大不同。由图2可知,培养初期(1 d)菌丝分枝较少,且分枝很短,菌丝分散性较好,菌丝发酵中期(3 d)时菌丝分枝增长加粗,菌丝交织成网状,相互缠绕、聚集,但并未形成菌丝球,发酵至后期(6 d)菌丝出现自溶现象,镜下可以看到菌体的残渣。结果表明,发酵3 d时菌丝外观形态及镜下均显示菌丝尚处于生长旺盛阶段,发酵6 d时菌丝外观颜色最深,镜下出现菌体残渣提示发酵已近终点。
2.2 红汁乳菇发酵培养过程各项参数的变化趋势
菌丝体干质量及发酵液OD值常用来恒量发酵生物量,发酵液黏度也可间接反映出发酵过程中菌丝体浓度及发酵液传质能力,这些指标变化与菌体生长和产物生成有着重要的关系。发酵过程中菌丝干质量、发酵液黏度及OD值的变化见图3。发酵过程中pH值、还原糖及蛋白酶活的变化见图4。

图3 发酵过程中菌丝干质量、发酵液黏度及OD值的变化Fig.3 Variation of mycelial dry weight,broth viscosity and OD in fermentation process
由图3可知,接入红汁乳菇液体菌种发酵很快进入对数生长期,培养1~3 d时菌丝干质量增长迅速,4~6 d时生长速率变慢,7 d菌丝干质量达到峰值0.56 g/100 m L,之后菌丝干质量开始下降;发酵液的OD值和黏度在培养1~7 d内都呈上升的趋势,发酵7 d黏度达到205 mPa·s,是初期的4倍多,7 d后菌体开始老化,菌丝体分解导致发酵液黏度下降,发酵液OD值8 d时达0.27,之后上升趋势不明显。从菌丝干质量、发酵液黏度及OD值三者的变化总体趋势来看,前两者均在7 d达到峰值,而OD值7 d后仍有上升,可能是菌丝体生长过程中有色素产生所致,故可在培养6~7 d时结束发酵。
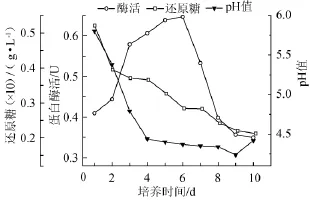
图4 发酵过程中pH值、还原糖及蛋白酶活的变化Fig.4 Variation of pH,reducing sugar and protease activity in fermentation process
由图4可知,发酵液的pH值在1~4 d内持续下降,从5.8降至4.4,此时菌丝体生长过程中有大量的酸性物质生成,且生成速率较快,提示菌丝体生长旺盛,之后pH值趋于稳定。在发酵整个过程中,还原糖的含量呈整体下降趋势,这与菌丝生长代谢需消耗糖类物质呈正相关,1~6 d糖利用速度较快,发酵6 d时消耗近一半糖量,7 d后糖消耗速率放慢,提示发酵进入后期;在2~3 d时蛋白酶活性急剧升高,发酵6 d时活性最大,之后急剧下降至初期水平,提示培养液中蛋白已几尽消耗。从以上三个指标变化来看,蛋白酶活力值对发酵终点的判断有显著的指示性,可据此将6 d作为发酵终点。
从发酵过程中各参数的变化趋势来看,菌体产生的色素干扰使OD值在测定生物量时有偏差,故在发酵放大生产中可将菌丝体干质量和发酵液黏度作为判断发酵液生物量的指标,而发酵液中还原糖、蛋白酶活及pH值的变化直接反应了原料消耗及菌丝体的发酵代谢情况,可根据指标变化适时结束培养或补料增加培养时间,获得更多的生物量或代谢产物。
3 结论
综上结果,液体菌种接入摇瓶后可以快速进入增殖期(第1~第4天),新的菌丝片段不断产生,菌丝干质量及发酵液黏度、OD值均显著增加,糖类物质被迅速地分解,蛋白酶活性不断增大,第6天达到高峰,说明此时的菌丝体活力最高。在发酵进行到第7天时菌丝干质量及发酵液黏度均达到最大值,之后开始下降。结合形态学观察,发酵第6天后菌体开始衰老,镜下可以检出菌体自溶现象,指示菌体的生长与代谢处于较低状态,应及时终止发酵。综合分析,发酵1~4 d为红汁乳菇液体菌种的快速增殖期,此阶段菌丝生长处于旺盛期,可用于接种,而摇瓶发酵培养的终点应控制在第6天。
本试验通过对红汁乳菇摇瓶发酵培养过程中菌丝干质量、黏度、pH、糖量及蛋白酶活等指标的检测分析,为发酵终点的判断和发酵过程的控制提供了技术参数,为红汁乳菇菌丝体发酵培养的进一步放大及生产利用奠定了基础。
[1]黄年来.中国食用菌百科[M].北京:中国农业出版社,1993.
[2]王军,莫文华.红汁乳菇子实体抗菌活性研究[J].食品科技,2008,33(9):91-94.
[3]马红梅,莫文华.红汁乳菇液体深层发酵培养基的筛选[J].食用菌学报,2003,10(4):34-37.
[4]周国英,李倩如.红汁乳菇菌丝液体发酵条件的优化[J].中南林学院学报,2004,24(5):36-38.
[5]李瑞婧,曹文涛,陈靖,等.红汁乳菇最适培养基及应用前景的初步研究[J].广州化工,2010,38(6):77-78.
[6]邓功成,赵洪,高礼安,等.红汁乳菇菌丝体液态发酵条件研究[J].江苏农业科学,2012,40(4):238-240.
[7]张鑫,刘云茂,曹文涛.液态发酵红汁乳菇动力学研究[J].中国酿造,2011,30(10):68-70.
[8]邓功成,赵洪.红汁乳菇酸奶发酵条件优化研究[J].食品研究与开发,2009,30(3):85-87.
[9]李志洲,杨海涛,邓百万.红汁乳菇多糖提取最佳工艺研究[J].中国食用菌,2003,22(5):40-42.
[10]曹文涛,张鑫.液态发酵红汁乳菇多糖提取工艺的优化[J].中国食用菌,2010,29(1):42-44.
[11]赵洪,邓功成.红汁乳菇菌丝体营养特性研究[J].食用菌,2008,30(6):9-10.
[12]曹文涛,张鑫.红汁乳菇子实体与液态发酵菌丝体营养成分分析[J].贵州农业科学,2010,38(4):80-82.
[13]程秀芳,张志焱,刘虹,等.灵芝发酵终点的确定及高产灵芝多糖菌种的筛选[J].齐鲁药事,2008,27(8):497-499.
[14]于兰兰,李维焕,甄世梅,等.平菇液体菌种发酵终点的简便检测方法[J].安徽农业科学,2010,38(18):9786-9786.
[15]李维焕,于兰兰,韩峰,等.2种食用菌液体菌种发酵终点的质量变化检测方法[J].中国酿造,2010,29(11):160-162.
[16]苏艳秋,王茂,竹文坤,等.木蹄层孔菌菌丝体发酵动态研究[J].食用菌,2009,31(2):11-12.
Parameter changes of Lactarius hatsudake mycelia fermentation and determination of the fermentation end-point
YANG Ping1,YI Xuezhu1,CAO Wentao2
(1.Dalian Bio-Chem Co.,Ltd.,Dalian 116038,China;2.Guizhou Province Key Laboratory of Fermentation Engineering and Biopharmacy, Guiyang 550003,China)
The changes of Lactarius hatsudake mycelia morphology,dry weigh,pH,reducing sugar content,protease activity was studied during shake flask fermentation,and the fermentation end-point was analyzed and determined.The results showed that the above indicators could guide for controlling the fermentation,some indexes indicating that 6 d was the optimum fermentation end-point when the protease activity reached the peak of 0.65 U,and mycelia dry weight reached 0.48 g/100 m l.The change of other indicators also pointed out that 6 d was the fermentation end-point.
Lactarius hatsudake mycelia;parameter changes;fermentation end-point
Q939.9
A
0254-5071(2015)03-0115-03
10.11882/j.issn.0254-5071.2015.03.027
2015-01-16
贵州省科学技术基金项目[黔科合J字(2008)2088]
杨平(1973-),女,工程师,硕士,主要从事微生物应用研究。
