5株酵母菌的系统发育树分析以及发酵性能测定
2015-12-27邢亚阁车振明罗建峰
蒋 丽,董 丹,邢亚阁,车振明*,罗建峰
(1.西华大学生物工程学院食品生物技术重点实验室,四川成都610039;2.理县塔斯酒庄有限公司,四川阿坝藏族羌族自治州623100)
5株酵母菌的系统发育树分析以及发酵性能测定
蒋 丽1,董 丹1,邢亚阁1,车振明1*,罗建峰2
(1.西华大学生物工程学院食品生物技术重点实验室,四川成都610039;2.理县塔斯酒庄有限公司,四川阿坝藏族羌族自治州623100)
从四川藏区高原威代尔冰葡萄渣泥中分离纯化出5株酵母,用18S rDNAD1/D2区域序列,通过序列比对及构建系统发育树分析,通过WL培养基的培养观察和普通光学显微镜观察,并且进一步对5种酵母菌的发酵性能进行测定。结果表明:JH、JH1、JH2、JH3和JH4分别鉴定为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、美极梅奇酵母(Metschnikowia pulcherrima)、酿酒酵母(Saccharomyces cerevisiae)、解脂耶罗维亚酵母(Yarrowia lipolytica)和异常威克汉姆酵母(Wickerhamomyces anomalus)。该5种酵母菌均有一定的发酵能力,并且发酵液总酚、还原糖、果糖以及总酸含量等均有不同变化。总体来说,JH2的发酵性能最好。
酵母菌;分离鉴定;发酵性能;系统发育树
酵母菌是葡萄酒酿造的主要微生物,酵母菌是发酵过程的主导,不同的酵母可以赋予葡萄酒不同给感官风味[1]。近年来人们开始重视众多天然酵母在原产地葡萄酒生产中的重要贡献,积极开发原生态天然菌群的耦合,实现多菌株组合发酵,充分凸现天然酵母的优良特性,酿造味感丰富、香气浓郁、风格独具的产地葡萄酒[2]。酿酒酵母属的发酵特性因菌株的不同而存在明显差异,菌株的不同导致利用的底物不同、生成的化学物质不同,从而使发酵产物的风味物质存在差异,赋予产品独特的风味[3]。川西高原藏区阿坝州理县以其特殊的气候条件,开发研制了威代尔等系列冰葡萄酒,不仅酒体口感好,味道独特,而且很受当地人的喜欢[4]。在冰葡萄酒生产中,由于影响葡萄酒品质的关键因素是其中的发酵微生物,而酵母菌作为主要的发酵微生物不仅对葡萄酒产量、质量和发酵生产管理影响很大,而且对葡萄酒特色和风格的形成也至关重要。所以为了找出更适合酿造冰葡萄酒的酵母菌,要求了解掌握酵母菌的一系列发酵性能。
随着应用于酵母菌分类的快速鉴定系统不断面市,Biolog系统以其数据库大、鉴定范围广,鉴定快速等优点,目前已经成为国际上酵母菌多相分类鉴定常用的技术手段[5-6]。已有文献表明,Biolog系统对于酿酒酵母的鉴定具有好的效果,鉴定结果可达100%,在KUTTZMANC P等[7]提及到的所定的同种内不同菌株间的差异不超过1%的标准。利用基因测序通过对威代尔葡萄汁发酵过程中的酵母菌JH、JH1、JH2、JH3和JH4菌种进行了系统发育树分析,并进一步研究了5株菌株的发酵性能,为川西藏区冰葡萄酒扩大生产及品质控制提供了一定的技术支持,对川西高原冰葡萄酒行业的发展具有十分重要的意义。
1 材料与方法
1.1 材料与试剂
龙泉巨峰葡萄:西华大学红光镇。
1.1.1 菌种来源
从四川藏区高原威代尔冰葡萄渣泥中分离出5株酵母菌,分别编号为JH、JH1、JH2、JH3和JH4。
1.1.2 试剂
氢氧化钠、基准邻苯二甲酸氢钾、葡萄糖、果糖等其他试剂均为分析纯:成都科龙化工厂。
1.1.3 培养基
WL营养琼脂培养基:酵母浸粉0.5%,胰蛋白胨0.5%,葡萄糖5%,琼脂2%。磷酸二氢钾0.055%,氯化钾0.042 5%,氯化钙0.012 5%,氯化铁0.000 25%,硫酸镁0.012 5%,硫酸锰0.000 25%,溴甲酚绿0.002 2%,将上述成分配好后加热溶解,pH 6.5,121℃灭菌20 min。
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基:酵母浸粉1%,蛋白胨2%,葡萄糖2%,琼脂2%,pH自然,121℃灭菌20 min。
1.2 仪器与设备
高压灭菌锅DHP-9052型电热恒温培养箱:上海益恒实验仪器公司;721分光光度计:上海精密科学仪器有限公司;SHB-B型恒温振荡箱:金坛市富华仪器有限公司;pHS-25精密pH计:上海精科雷磁仪器厂。
1.3 方法
1.3.1 酵母菌的形态学观察
菌落形态特征:将筛选菌株接种与YPD液体培养基和WL固体平板上,29℃培养3 d,分别观察固体菌落和液体菌落形态特征,液体菌落形态观察以不加菌液为参比对象。
细胞形态特征:用接种环挑取少许WL平板上培养48 h的菌株,滴加1滴1%美兰染色液染色后,在显微镜下观察细胞形态特征。
1.3.2 酵母菌的发酵性能实验
采用新鲜成熟的龙泉巨峰葡萄,运至实验室后破碎,调节pH值为3.6,二氧化硫含量为60 mg/kg,将5株酵母菌活化后,按0.6%的接种量分别接种与装有500 m L新鲜葡萄浆发酵罐中,15℃恒温发酵。测定指标有总酸、还原糖、果糖、总酚含量,同时以不添加任何酵母菌的葡萄汁作为对照实验。
1.3.3 总酚含量的测定[8]
正常发酵生产的葡萄酒中富含多酚类化合物。试样中的多酚化合物在碱性条件下,与福林酚试剂形成蓝色物质,在波长765 nm处测定吸光度值,可通过测定其吸光度值计算总酚的含量。
1.3.4 还原糖含量的测定
采用国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中直接滴定法。
1.3.5 总酸含量的测定
采用国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中电位滴定法,利用酸碱中和原理,用氢氧化钠标准溶液直接滴定样品中的有机酸,以pH=8.2为电位滴定终点,根据消耗氢氧化钠标准滴定溶液的体积,计算试样中的总酸含量。
1.3.6 果糖含量的测定
采用分光光度法测定发酵液中果糖的含量[9]。
1.3.7 ITS序列扩增、测序以及系统发育树构建
对分离出的5株酵母菌进行总脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取、基因间隔序列(internal transcript space,ITS)序列扩增以及测序[10-12],然后用核酸序列数据库GenBank中进行同源序列搜索,用Blast软件进行同源性比较,采用MEGA5.2软件进行ITS同源性分析,绘制系统发育树。
对于酵母菌株JH、JH1、JH2、JH3和JH4分别下载酵母属13、11、15、17和15个相关菌种模式株的18S rDNA D1/D2区序列采用同样方法进行序列分析和系统发育树分析。
采用18S rDNA序列分析法对分离出的菌株进行分子鉴定。采用玻璃珠法[14]提取基因组总DNA:聚合酶链反应(polymerase chain reaction,PCR)体系为30 μL重蒸水,5 μL 10×PCR扩增缓冲液(Mg2+Free),6 μL MgCl2(25 mmol/L),4μL三磷酸脱氧核苷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5mmol/L),正向引物NS1(5′-GTAGTCATATGCTTGTCTC-3′)和反向引物NS8(5′-TCCGCAGGTTCACCTACGGA-3′)各1 μL,1 μL Tap聚合酶(2.5 U/μL),2 μL总DNA模板。
PCR反应条件:95℃预变性5 min;95℃变性1 min,50℃退火1 min,72℃延伸2 min,经30个循环后最终72℃保持10 m in,然后等温度降至4℃停止运行。
2 结果与分析
2.1 酵母菌的形态学观察
2.1.1 菌落形态特征
各菌株在WL培养基上涂布培养3 d后,JH、JH1、JH2、JH3和JH4菌株的单菌落形态特征结果如图1所示。
由图1可知,单菌落的形态特征各不相同。JH菌落呈深绿色,平坦,表面光滑,不透明,奶油状,边缘光滑。JH1菌落呈棕色,平坦,表面光滑,不透明,奶油状,边缘光滑。JH2菌落呈奶油色带淡绿色,球形突起,表面光滑,不透明,奶油状,边缘光滑。JH3菌落呈淡蓝色,球形突起,表面光滑,不透明,奶油状,边缘光滑。JH4菌落呈乳白色,球形突起,表面光滑,不透明,奶油状,边缘光滑。

图1 JH、JH1、JH2、JH3和JH4菌株固体培养菌落特征Fig.1 Colonial characteristics of cultured JH,JH1,JH2,JH3 and JH4 on solid agar medium
2.1.2 细胞形态特征
JH、JH1、JH2、JH3和JH4菌株的细胞形态特征见图2。

图2 JH、JH1、JH2、JH3和JH4菌株单体出芽生殖形态Fig.2 Morphology of individual spores germ ination o f JH,JH1, JH2,JH3 and JH4
由图2可知,5种酵母菌细胞都呈卵圆形或球形,菌株的生长方式为出芽生殖。
2.2 PCR扩增目的基因的结果
标准品基因和目的基因扩增电泳结果见图3。由图3电泳结果可知,对样本的18S rDNA基因进行PCR扩增,所扩增片段的大小约为1.8 kb,和真核生物的18S rRNA/DNA基因片段大小一致,因此达到了对酵母的18S rDNA基因的PCR扩增目的。通过基因测序,采用BLAST和ClustalX程序与GenBank中以收录的酵母18S rDNA D1/D2区序列比对,鉴定出JH、JH1、JH2、JH3、JH4五种菌株分别为有孢汉逊酵母(Hanseniaspora uvarum)、美极梅奇酵母(Metschnikowia pulcherrima)、酿酒酵母(Saccharomyces cerevisiae)、解脂耶罗维亚酵母(Yarrowia lipolytica)和异常威克汉姆酵母(Wickerhamomyces anomalus)。

图3 目的基因扩增电泳图(琼脂糖1%)Fig.3 PCR amplification electrophoretogram of target gene (agarose 1%)
2.3 实验菌株JH的序列分析和系统发育树的构建
ITS区域核酸序列的相似性已经成为确定酵母菌分类地位的重要分子生物学依据[14],根据菌株JH、JH1、JH2、JH3、JH4的ITS测序结果进行Blast分析,以18S rDNA序列同源性为基础构建系统发育树,结果见图4。


图4 菌株JH(a)、JH1(b)、JH2(c)、JH3(d)和JH4(e)18S rDNA D1/D2基因序列NJ系统发育树Fig.4 Neighbor-joining phylogenetic tree constructed from 18S rDNA gene D1/D2 sequence of JH(a),JH1(b), JH2(c),JH3(d)and JH4(e)
由图4可知,菌株JH、JH1、JH2、JH3、JH4与GenBank中其他一些参考酵母菌株的亲缘关系。其中菌株JH与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)有较高相似性,相似度达99%以上,与其亲缘关系最近,故鉴定菌株菌株JH为萄汁有孢汉逊酵母(Hanseniaspora uvarum)。其中菌株JH1与美极梅奇酵母(Metschnikowia pulcherrima)有较高相似性,相似度达99%以上,与其亲缘关系最近,故鉴定菌株菌株JH1为美极梅奇酵母(Metschikowia pulcherrima)。菌株JH2与酿酒酵母(Saccharomyces cerevisiae)有较高相似性,相似度100%,与其亲缘关系最近,故鉴定菌株菌株JH2为酿酒酵母(Saccharomyces cerevisiae)。菌株JH3与解脂耶罗维亚酵母(Yarrowia lipolytica)有较高相似性,相似度100%,与其亲缘关系最近,故鉴定菌株菌株JH3为解脂耶罗维亚酵母(Yarrawia lipolytica)。其中菌株JH4与异常威克汉姆酵母(Wickerhamomyces anomalus)有较高相似性,相似度100%,与其亲缘关系最近,故鉴定菌株菌株JH4为异常威克汉姆酵母(Wickerhamomyces anomalus)。

图5 葡萄酒发酵期间总酚含量的变化Fig.5 Change of total phenols content during wine fermentation
2.4 总酚含量测定结果
由图5可知,这五种发酵液中的总酚含量都随着发酵时间的延长呈下降趋势,速度较快,这有可能是因为发酵过程中酵母释放次级代谢产物如丙酮酸、乙醛等到发酵液中,与多酚类的物质发生反应生成一些大分子衍生物;此外,微生物产生的酶也会使其发生降解,导致水溶性不断下降而沉淀下来[15]。添加JH1酵母的发酵液中的总酚含量下降得最快,从最初含量462.86 mg/L下降至112.86 mg/L,然而对于未添加酵母的发酵液中总酚含量变化趋势是先快后慢,尤其是在前6 d,从496.79 mg/L下降至327.14 mg/L,在后期,总酚含量下降趋于平缓,是所有发酵液中减慢速度最缓慢。结果表明,在发酵后期,发酵液中总酚含量比较:添加JH1酵母的发酵液<添加JH3酵母的发酵液<添加JH4酵母的发酵液<添加JH酵母的发酵液<添加JH2酵母的发酵液<未添加任何酵母的发酵液。
2.5 果糖含量测定结果
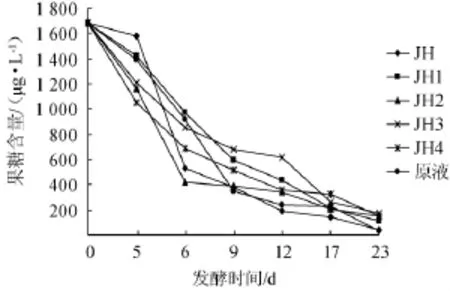
图6 葡萄酒发酵期间果糖含量的变化Fig.6 Change of fructose content during wine fermentation
由图6可知,在发酵葡萄汁初期,果糖最的含量达到1 751 μg/L,6种发酵液的果糖含量随着发酵天数的增加逐渐减少,在发酵初期(0~6 d),果糖含量减慢的速度最快,在6~17 d内,6种发酵液果糖含量下降缓慢,在发酵后期(17~23 d),其果糖含量基本保持平稳,变化不大。从酵母菌发酵性能的差异性来分析,在发酵6d内,添加JH和JH2酵母菌的发酵液在发酵中期果糖量最大,说明对果糖的利用率比较高,JH和JH2的果糖含量分别从1 685 μg/L下降至528.2 μg/L、416.11 μg/L,都比不添加酵母菌的发酵液减慢得快;但添加JH1酵母菌的发酵液消耗果糖量都比未添加酵母菌的发酵液小。从6 d到发酵结束,未添加JH酵母的发酵液消耗的果糖量比其他5种方式消耗的果糖量多,然而,添加酵母菌JH1、JH2、JH3和JH4酵母菌的发酵液中消耗果糖含量比未添加酵母菌消耗的果糖量少,这是可能添加的酵母菌有可能会抑制其他酵母菌的生长,使果糖的利用率降低。但在发酵后期,所有发酵液中的果糖含量降低速率基本一致即趋于平缓,这可能因为在发酵后期酒精含量增加,抑制酵母菌的生长;或是在发酵后期酵母菌数量减少也会使糖的利用率降低。

图7 葡萄酒发酵期间总酸含量的变化Fig.7 Change of total acid content during wine fermentation
2.6 总酸含量测定结果
葡萄酒中的酸类物质可以平衡酒体。适量的酸含量能在口感上平衡酒体里的酒精和甜度,让葡萄酒甜而不腻,增强葡萄鲜果的水果风味,增加味觉的舒适性[16]不同葡萄汁发酵过程中,不同酵母菌在相同温度下总酸含量变化如图7所示。由图7可知,在0~6 d内,添加JH、JH1、JH3和JH4菌的发酵液中的总酸含量在降低,而JH2和为添加酵母菌的发酵液总酸含量在0~5 d降低;随着时间的增加,6种发酵液的总酸含量都平缓增加。根据池成[17]报道醋酸菌会导致葡萄酒中醋酸等挥发酸含量显著升高,使葡萄酒产生特殊的令人不愉快的酸苦味,所以在葡萄酒酿造中合理控制发酵过程中总酸的产生是酿造葡萄酒的重要工艺流程之一。当发酵到最后各发酵液中总酸含量的比较:JH1>JH2>JH>JH4>原液>JH3,说明JH菌产生的总酸最多,其次是JH2、JH、JH4和未添加酵母菌,产生总酸最少是添加JH3菌的酵母菌。
2.7 还原糖含量测定结果

图8 葡萄酒发酵期间还原糖含量的变化Fig.8 Change of reducing sugar content during wine fermentation
由图8可知,6种发酵液的糖度随着发酵天数的增加逐渐减少,在发酵初期(0~9 d),还原糖减慢的速度较缓慢,在9~12 d内,6种发酵液还原糖含量急剧下降,在发酵后期,其还原糖含量平稳下降,变化不大。从酵母菌发酵性能的差异性来分析,添加JH和JH3酵母菌的发酵液在发酵中期消耗糖量最大,JH和JH3的还原糖含量分别从120.87 g/L、115.29 g/L变成47.56 g/L、42.22 g/L,都比不添加酵母菌的发酵液减慢得快;但添加JH1、JH2和JH4酵母菌的发酵液在发酵中期消耗糖量都比未添加酵母菌的发酵液小;尤其是添加JH1酵母菌的发酵液还原糖降低的含量最小。这是可能添加的酵母菌有可能会抑制其他酵母菌的生长,使糖的利用率降低。在发酵后期,所有发酵液中的还原糖含量降低速率基本一致即趋于平缓。这是可能因为在发酵后期酒精含量增加,会抑制酵母菌的生长;或是在发酵后期酵母菌数量减少也会使糖的利用率降低。
3 结论
本研究从四川藏区高原威代尔冰葡萄果实中分离纯化并鉴定出的菌株。系统进化树分析结果表明,该菌株与GenBank中相关标准菌株的18S rDNA D1/D2区序列构建的系统发育进化树显示,这五种菌株分别与Hanseniaspora uvarum、Metschnikowia pulcherrima、Saccharomyces cerevisiae、Yarrowia lipolytica和Wickerhamomyces anomalus处在同一分枝。根据酵母菌株同一个种的不同菌株18S rDNA D1/D2区核酸替换率不超过1%,因此将该五种菌株分别鉴定为葡萄汁有孢汉逊酵母、美极梅奇酵母、酿酒酵母、解脂耶罗维亚酵母和异常威克汉姆酵母。
通过对这五种酵母菌发酵性能实验分析,该5种酵母菌均有一定的发酵能力,发酵液中总酚含量、还原糖含量、果糖含量以及总酸含量随着发酵时间的延长而改变,并且添加葡萄汁有孢汉逊酵母的发酵液消耗的果糖多,消耗果糖最少的是添加解脂耶罗维亚酵母的发酵液;发酵液中总酸含量变化最大的是添加美极梅奇酵母,变化最小的是添加解脂耶罗维亚酵母;发酵液中添加解脂耶罗维亚酵母消耗的还原糖最多;添加JH1酵母的发酵液中的总酚含量下降最慢,不添加酵母的发酵液总酚含量下降最快。总体来说,菌株JH2发酵性能最好。
此研究对筛选川西冰葡萄酒产区特色酵母菌,并构建出冰葡萄酒发酵微生物资源库具有一定意义,并且为川西藏区冰葡萄酒标准化生产提供技术支持。
[1]郑元元,姚志伟,张亚黎.新疆冰葡萄酒产业发展对策研究[J].中国酿造,2013,32(2):164-166.
[2]程雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学硕士论文,2010.
[3]王国平.宁夏御马葡萄酒厂野生酵母菌株的分离鉴定及分子鉴定[J].中国酿造,2009,28(8):38-41.
[4]崔艳.菌种选育技术在葡萄酒酿造中的运用与发展[J].食品研究与开发,2011,32(9):171-175.
[5]张丽珠,邢亚阁,许青莲,等.川藏高原威代尔冰葡萄中酵母菌的分离、筛选及其耐受性研究[J].中国酿造,2013,32(10):94-97.
[6]许青莲,邢亚阁,车振明,等.川西高原冰酒发酵中Pichia anomala的鉴定与耐受性研究[J].中国酿造,2013,32(8):39-41.
[7]KURTZMAN C P,ROBNETT C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J].Anton Leeuw,1998,73(4):331-371.
[8]高畅,程大海,高欣,等.蓝莓果渣提取物总酚含量及抗氧化活性研究[J].植物研究,2010,30(2):253-256.
[9]张晓卿,谢涛,李媚,等.采用分光光度法测定发酵液中果糖的含量[J].光谱实验室,2004,21(5):12-13.
[10]刘宏媛,李光辉,罗惠波,等.大曲中酵母菌的分离及Biolog微生物系统分析鉴定[J].食品与发酵科技,2011(1):7-9,28.
[11]ABLIZ P,FUKUSHIMA K,TAKIZAWA K,et al.Identification of pathogenic dematiaceous fungi and related taxa based on large subunit ribosomal DNA D1/D2 domain sequence analysis[J].FEMS Immunol M ed M ic,2004,40(1):41-49.
[12]KURTZMA C P,FELL J W.The yeasts,a taxonomic study(4th edition) [M].Amsterdam:Elsevier Science Ltd.,1998.
[13]蒋丽,刑亚阁,车振明,等.川藏高原冰葡萄酒中五种酵母菌的鉴定及耐受性研究[J].中国酿造,2014,33(10):36-39.
[14]YANG S H,WANG P H.Three species of yeasts news to Taiwan[J].Taiwania,2003,48(2):99-105.
[15]张晓松,孙艳梅,胡振生.都柿果酒在酿制过程中总酚和花色苷含量和抗氧化活性[J].东北农业大学学报,2010,14(3):120-124.
[16]潘雪燕.广西山葡萄酒生产过程中有机酸的变化及其控制[D].南宁:广西大学硕士学位论文,2011.
[17]池成,胡文忠,张平,等.冰葡萄酒发酵过程中成分变化的研究[J].安徽农业科学,2013,41(2):807-809.
《中国酿造》杂志征稿启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技期刊。并历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊,也是学位与研究生教育的中文重要期刊。
本刊主要面向全国各大高等院校、科研院所、各级党政机关、相关企事业单位的广大专家学者、工程技术人员、本科生、硕士博士研究生、管理人员等。
《中国酿造》主要栏目有:研究报告、专论综述、创新与借鉴、经验交流、分析与检测、产品开发、酿造文化、海外文摘等。
欢迎踊跃投稿!
网站:www.chinabrewing.net.cn邮箱:zgnzzz@163.com电话:010-83152738/83152308
征稿范围:
(1)新工艺、新技术、新设备在酿造行业的应用;(2)调味品的研发创新与推广应用;(3)调味品产业生产管理及产品质量安全评价;(4)食品添加剂在酿造行业的应用;(5)现代高新检测技术在酿造行业的应用;(6)酿酒产品开发、生产管理及产品质量安全的控制;(7)发酵法制备酒精、氨基酸、高级醇及有机酸等工艺研究;(8)微生物发酵工艺及培养基发酵条件优化;(9)发酵工程菌种的筛育与人工诱变、杂交选育及基因工程改造研究;(10)生物质能源的开发利用及规模化制备;(11)传统发酵食品生产工艺改进、微生物菌种改良、发酵机理及规模化生产研究;(12)食品及发酵工业废水、废渣处理及综合利用;(13)益生菌及功能型发酵乳制品研究与开发;(14)行业实用技术、政策、法规、标准及行业动态和最新举措等。
注意事项:
(1)来稿要求论点明确、数据可靠、逻辑严密、文字精炼。在文稿首页用脚注说明论文属何项目、何基金(编号)资助,本刊将优先报道国家级、省部级及国际合作项目的科研成果;第一作者及通讯作者(一般为导师)简介(包括姓名、出生年月、性别、职称、学位、研究方向或目前主要从事的工作、邮箱、联系电话)。(2)稿件要求8000字以内,须有中图分类号,文献标志码,中英文标题、单位、作者,并有200~300字的中英文摘要和5~8个关键词,标题、摘要、表题、图题请用中英文对照。摘要内容应包括研究目的、方法、结果和结论;综述文章可写指示性摘要。(3)来稿内容涉及配方时,应写明配料的名称和配比,勿用代号;工艺过程要完整,不要省略;插图、表格需放在正文相应地方,不要集中;引用的图表要有出处,计量要用法定单位。(4)文稿参考文献一般研究论文约25篇参考文献,不可少于20篇,综述论文不少于35篇。研究性论文和综述性论文中近5年文献不少于参考文献总数的一半,外文文献不少于5篇,期格式请参照GT/T 7714—2005《文后参考文献著录规则》。(5)来稿必须是最新的、作者自身创造性的科研成果,且是在中外文正式刊物上未发表的论文。本刊严禁一稿多投、重复内容多次投稿、不同文种重复投稿。(6)我刊以实现对所有来稿的文字复制比对工作,若文字复制比超过30%的稿件我刊不予采用。(7)稿件一经录用,即被认为同意收录于《中国学术期刊(光盘版)》、万方数据库等,同意入编数据库及上网发布,与此有关的作者著作权使用费与稿酬一次性给付。作者如有异议,请在投稿时声明。
Phylogenetic analysis and fermentation properties of five yeast strains
JIANG Li1,DONG Dan1,X ING Yage1,CHE Zhenming1*,LUO Jianfeng2
(1.Key Laboratory of Food Biotechnology,College of Bioengineering,Xihua University,Chengdu 610039,China; 2.Lixian Tasijiuzhuang Co.,Ltd.,Ngawa Prefecture 623100,China)
Five strains of yeast were isolated from the Sichuan Tibetan Plateau Vidal Ice grape slag mud and identified using 18S rDNAD1/D2,after sequences analysis and phylogenetic tree construction and analysis.The yeasts were cultured by WL medium and observed by ordinary optical microscope,and further fermenting property of five strains of yeast were determined.Results showed that JH,JH1,JH2,JH3 and JH4 were identified as Hanseniaspora uvarum,Metschnikowia pulcherrima,Saccharomyces cerevisia,Yarrowia lipolytica,Wickerhamomyces anomalus,respectively.The five kinds of yeasts had certain fermenting property.The changes of total phenol,reducing sugar,fructose and total acidin fermentation broth were different.In conclusion,JH2 had the optimal fermenting property.
yeasts;isolation and identification;fermenting property;phylogenetic analysis
TS261.1
A
0254-5071(2015)03-0048-06
10.11882/j.issn.0254-5071.2015.03.011
2015-01-19
省科技支撑计划项目(2011SZ0284,2012SZ0117,13KCBZ0066);2012年西华大学食品生物技术重点实验室开放研究基金资助项目(SZjj2012-005);2013年西华大学研究生创新基金项目(ycjj201346)
蒋丽(1989-),女,硕士研究生,研究方向为食品科学。
*通讯作者:车振明(1960-),男,教授,本科,研究方向为食品发酵技术。
