投喂蚕豆对罗非鱼肝损伤及非特异性免疫功能的影响
2015-12-25陈度煌
陈度煌
(福建省淡水水产研究所,福建福州 350002)
罗非鱼是我国淡水养殖的主要水产品之一。研究表明,投喂蚕豆可使罗非鱼肉质变紧硬而爽脆,不易煮烂,切成鱼丝不易拉断,韧性和咀嚼性增加,风味独特,是改善罗非鱼肉质的一种独特方式,有利于罗非鱼加工和出口,显著提高了养殖的经 济 效 益 ( 伦 峰 ,2006;Grigorakis 和 Alexis,2005)。而目前有关投喂蚕豆对鱼体免疫力影响的研究却鲜见报道。本试验用浸泡蚕豆、配合饲料饲养罗非鱼,研究投喂蚕豆对罗非鱼肝损伤及非特异性免疫功能的影响,以期为更合理使用蚕豆进行肉质脆化提供理论参考。
1 材料与方法
1.1 试验材料 试验用新吉富罗非鱼(NEW GIFT,Oreochromis niloticus)由福建省淡水水产研究所榕桥试验基地提供,初始体重为 (118.62±10.28)g,每桶放养 10 尾。
1.2 试验设计 试验设两个处理:试验组投喂浸泡蚕豆,对照组投喂配合饲料,每组设3个重复。饵料营养水平测定值如表1所示。
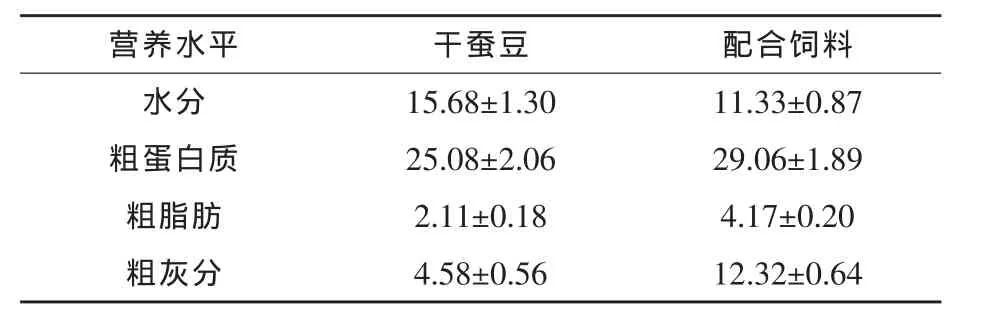
表1 饵料营养水平 %
1.3 饲养管理 试验在玻璃钢圆桶中进行,每个圆桶内径100 cm,高度90 cm,水深60~70 cm,使用小循环系统使其保持微流水状态。试验开始前,罗非鱼用3%食盐水消毒后放入暂养池,进行为期7 d左右的适应性驯化,待鱼适应后正式试验。采取固定人员专门管理:
(1)饲料和蚕豆严格按组投喂,投喂前将蚕豆于1%食盐水中浸泡24 h。每日投饵2次,投喂时间一般为上午 7∶00 ~ 7∶30,下午 17∶00 ~ 17∶30。投饲量根据鱼摄食状况而定,一般为鱼体重量的3%~4%,详细记录各组别的实际投饵量。
(2)每天定时测定水温。溶解氧,记录鱼活动情况,试验期间水温维持在26.0~31.5℃,溶解氧5.0~ 7.0 mg/L.。
(3)试验用水为经过曝气的自来水,每天进行加换水,排污,一般每天换水量在30%~40%,试验时间为60 d。
1.4 样品采集 试验期满罗非鱼禁食24 h后,参考白洁(2008)的方法适当修改,每桶取样5尾,用一次性注射器进行心脏采血,置于1.5 mL离心管内,于室温下静置2 h,然后放到4℃冰箱16 h,再以2500 r/min离心析出血清,-40℃保存,备用待测。
1.5 测定指标和方法 天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、腺苷脱氨酶(ADA)、乳酸脱氢酶 (LDH)、 酸性磷酸酶 (ACP)、 碱性磷酸酶(AKP)、髓过氧化物酶(MPO)、溶菌酶(LSZ)均采用试剂盒测定,测试盒购自南京建成科技有限公司,具体操作方法及计算方法参照试剂盒说明书。
1.6 数据统计与分析 试验结果采用 “平均值±标准差”表示。用SPSS 17.0对数据进行方差分析,显著性水平为0.05。
2 结果与分析
2.1 投喂蚕豆对罗非鱼肝损伤的影响 由表2可见,投喂蚕豆组的罗非鱼血清AST、ALT和ADA活性分别较对照组提高13.67%、12.93%、19.12%(P < 0.05),LDH 活性无显著变化(P > 0.05)。

表2 投喂蚕豆对罗非鱼肝损伤的影响
2.2 投喂蚕豆对罗非鱼非特异性免疫功能的影响 由表3可见,投喂蚕豆组的血清ACP和AKP活性与对照组相比,分别降低22.96%、19.70%(P<0.05),MPO和LSZ活性虽也下降,但差异不显著(P>0.05),说明长期投喂蚕豆一定程度上降低了罗非鱼非特异性免疫功能。

表3 投喂蚕豆对罗非鱼非特异性免疫功能的影响
3 讨论
3.1 投喂蚕豆对罗非鱼肝损伤的影响 天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)是水产动物血清中两种重要的转氨酶。在正常代谢过程中,血清中AST和ALT活性值都会维持一定水平,当机体组织中毒、发生病变,或者受损伤的组织范围较大,可引起血清中AST和ALT浓度上升,活性突然持续性增强。当肝细胞受到外来物质的损伤时,细胞膜的通透性加大,大量ALT和AST渗入血液,肝的ALT和AST活性明显下降,而血液中ALT和AST活性升高(陈鹏飞等,2005)。血清腺苷脱氨酸(ADA)主要来源于肝脏,因其为肝细胞的胞浆酶,所以任何原因所造成的肝细胞损伤,其肝细胞膜的通透性均会增强,致使血清中的ADA酶的活性升高,故该酶可以作为反映肝实质损伤的指标。乳酸脱氢酶(LDH)是糖的无氧酵解和糖异生的重要酶系之一,广泛存在于心脏、肝脏、肺以及其他各组织内,组织一经损伤血清中该酶即见升高,肝细胞损伤或者坏死后,会向血液释入大量的 LDH(贺丽虹等,2004;惠天朝等,2000)。
本试验发现,投喂蚕豆使得鱼体血清中肝损伤指标AST、ALT和ADA活性显著上升,可能是肝细胞膜功能的完整性遭到破坏,影响膜的流动性和其他各项功能,进而损害了罗非鱼肝脏功能,这可能是蚕豆中的某种特殊化学因子起作用导致的。而LDH活性在试验期内与对照组相比变化不大,原因有待进一步研究。
3.2 投喂蚕豆对罗非鱼非特异性免疫功能的影响 鱼类为较低等变温脊椎动物,其特异性免疫应答相对低下,而非特异性免疫系统在其防御病原体感染中具有非常重要的意义 (Tonya等,2000)。 酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、髓过氧化物酶(MPO)、溶菌酶(LSZ)是评价鱼类非特异性免疫力的常用指标。其中,ACP是水产动物体内公认的巨噬细胞溶酶体的标志酶,在体内直接参与磷酸基团的转移和代谢,其活力的高低反映了巨噬细胞的激活程度(李丽娟等,2013)。同时,ACP也是吞噬溶酶体的重要组成部分,在血细胞进行吞噬和包囊反应时,会释放酸性磷酸酶。
AKP是磷酸酶的一种,血清中的AKP主要来源于肝脏和骨骼,能将对应底物去磷酸化,生成磷酸根离子和自由的羟基,直接参与磷酸基团的转移,以及钙磷代谢。碱性磷酸酶能够通过改变病原体的表面结构,增强机体对病原体的识别和吞噬能力,起调理素的作用,加速吞噬细胞的吞噬和病原体的降解速度,进而提高鱼体的抗病力,可作为机体免疫标志酶(王玲等,2008)。
MPO是鱼体内一种重要的氧化酶,它是由中性粒细胞、单核细胞和某些组织的巨噬细胞分泌的血红素蛋白酶,主要存在于嗜中性粒细胞和单核细胞中。吴越等(2005)研究表明,MPO能催化过氧化氢与氯反应,产生次氯酸,具有很强的抗微生物作用,可直接影响机体的免疫功能。
LSZ是水产动物体内一种重要的非特异性免疫因子,存在于鱼体的吞噬细胞和血清中,对病原体有重要的防御作用。溶菌酶在机体免疫过程中,通过催化水解细菌细胞壁黏肽的乙酰胺基多糖,导致细菌裂解死亡。同时能清除其他抗菌因子作用后所残余的细菌细胞壁,并增强其他免疫因子的抗菌敏感性,诱导调节其他免疫因子的合成与分泌,共同抵制外来病原的入侵 (叶丹和连宾,2003)。鱼类血清溶菌酶活力的高低是衡量机体免疫状态的指标之一。血清溶菌酶活力提高,其免疫能力也相应提高。相反,鱼类血清溶菌酶的活性降低,机体免疫力降低。
本试验中,与普通配合饲料相比,用浸泡蚕豆投喂罗非鱼后,鱼体的非特异性免疫力降低,特别是ACP和AKP指标显著降低,可能是由于蚕豆适口性差,以及抗营养因子(蛋白酶抑制剂、单宁等)的存在。用蚕豆作为单一饵料脆化罗非鱼肉质,鱼体摄食量减少,营养不平衡,胃肠道各种消化酶活力降低,对营养物质的消化吸收及利用能力也降低,使得脆化期间鱼体所需营养得不到满足,从表观上看,鱼体的生长受到抑制,同时,各种非特异性免疫酶的合成和分泌受到了抑制,降低了鱼体的免疫力,削弱了鱼体的抗病能力。而MPO和LSZ活性虽也有下降趋势,但差异不显著,原因可能是试验时间还不够长,有条件的话,将做重复试验,延迟试验时间至90 d。
4 结论
本试验结果表明,以浸泡蚕豆饲养新吉富罗非鱼,虽可明显脆化罗非鱼肉质,但却一定程度上造成鱼体肝脏的损害,降低鱼体非特异性免疫功能。
[1]白洁.叶下珠对鱼类肝损伤保护机理的研究:[硕士学位论文][D].福州:福建农林大学,2008.
[2]陈鹏飞,杨德强,邹红.两种中草药组方对鲫鱼肝脏转氨酶的影响[J].饲料工业,2005,6:28 ~ 31.
[3]贺丽虹,孙绍永,黄建华.多糖在水产动物免疫促进方面的研究进展[J].河北渔业,2004,1(133):1 ~ 2.
[4]惠天朝,施明华,朱荫媚.硒对罗非鱼慢性镉中毒肝抗氧化酶及转氨酶的影响[J].中国兽医学报,2000,20(3):264 ~ 266.
[5]伦峰.蚕豆脆化草鱼、罗非鱼肉质的研究:[硕士学位论文][D].上海:上海水产大学,2006.
[6]李丽娟,龚全,权可艳,等.壳聚糖对黄颡鱼生长和非特异性免疫机能的影响[J].西南农业学报,2013,26(6):2614 ~ 2619.
[7]王玲,胡俊杰,郭延生,等.中药免疫增强剂的研究进展及其在水产养殖中的应用[J].中国饲料添加剂,2008,3:36 ~ 39.
[8]吴越,王典,于晓军.髓过氧化物酶及其多态性与疾病的研究进展[J].免疫学杂志,2005,21(3):89 ~ 92.
[9]叶丹,连宾.溶菌酶及其应用[J],贵州科学,2003,21(3):67 ~ 70.
[10]Grigorakis K,Alexis M N.Effects of fasting on the meat quality and flat deposition of commercial-size farmed gilthead sea bream SparusaurataL fed different dietary regimes[J].Aquaculture Nutrition,2005,11:341 ~ 344.
[11]Tonya L,Nichols,Chris A,et al.Transcriptional analysis of superoxide dismutase gene of Borrelia burgdorferi[J].FEMS microbiology letters,2000,183(1):37 ~ 42.
