液相色谱-串联质谱法检测禽蛋类产品中26种类固醇激素的含量
2015-12-25李新一
李新一(译)
(全国畜牧总站 中国饲料工业协会,北京朝阳 100125)
类固醇激素在动物的生长发育、成熟和衰老的各阶段发挥着重要的作用,其作用机制是在体内充当化学信使,通过与雄激素、雌激素、皮质激素的受体结合,激发信号转导,从而发挥相应的作用。过量接触此类激素会对动物产生相应的毒性危害,人体接触途径主要是通过摄入动物性食品。由于类固醇激素可促进动物生长(Ahmadkhaniha等,2009;Rambaud 等,2007),因此一些畜禽养殖企业在养殖过程中违规添加,严重影响了我国畜禽产品的质量,增加了食品安全风险。目前,类固醇激素残留检测已成为各国例行监测项目之一(Aufartovad 等,2011)。
类固醇激素是一类同源异构化合物,在动物体内含量极低(ng/kg~μg/kg),因此需要一种高灵敏度且能检出多种残留物的分析方法,用于有效检测动物产品中的类固醇激素残留水平。尽管酶联测定法已用于医疗诊断筛选分析,但特异性弱、不稳定性的特点限制了其在食品检测中的应用。色谱-串联质谱法,如气相色谱 (GC-MS)、(LC-MS)由于具有特异性强、稳定性好等特点,广泛用于动物产品中的类固醇激素残留分析(Bianchid 等,2010;Devierd 等,2010;Yangd 等,2009;Brabanderd 等 ,2007;Shaod 等 ,2005)。 与GC-MS方法相比,LC-MS方法更简便,不需繁琐的衍生化处理就可测定该激素的异构体和结合态的 类 固 醇激 素 (Verheydend 等 ,2010;Chod 等 ,2009;Yangd 等,2008)。
蛋类产品营养丰富,益于人体健康,但其含有的类固醇激素可对特定人群健康产生危害 (如婴幼儿、儿童、妊娠期妇女及乳腺癌病人)(Passantino,2012)。有研究表明,蛋类是一种复杂的基质,蛋黄中含有12.6%的蛋白质、10.6%的脂肪和10%的磷脂(USDA)。对蛋类进行脂质图谱分析较为复杂,需要适当的前处理,液液萃取 (Malone等,2009;Poucke 等,2007;Touber 等,2007)与固相萃取(Schmidt等,2012;Dusi G 等,2011;Deceuninck等,2011;Gineys等,2010) 是针对生物样品前处理的典型方法。为避免基质干扰,LC-ESI-MS检测的样品须处理得极其干净。稳定同位素标记的内标也有助于减少样品的基质效应,但流出的基质仍需被去除以避免目标物的灵敏度降低(Eeckhau 等,2009;Muller等,2002)。 此外,不是所有内标均具有实用性,而且仅一个内标去校正其他目标物可能会得到不准确的结果。
相关研究表明,GC-MS法可用于分析鸡蛋中的类固醇激素成分 (Hartmann等,1998),LC-MS/MS法能检出鸡蛋中雌激素(Wang等,2010)和孕激素(Yangd等,2008)。本研究应用LC-ESI-MS法建立了26种类固醇激素检测的方法,这些类固醇激素包括雄激素、雌激素、孕激素、皮质类激素和类固醇化学物。研究结果显示,本实验方法适用于分析蛋类产品中的类固醇激素残留,且可通过检测不同品种蛋类产品的类固醇激素残留量为食品安全评价提供依据。
1 材料与方法
1.1 药品与试剂 己烯雌酚、己烷雌酚、双烯雌酚、皮质醇、泼尼松龙、强的松、康力龙、孕酮、去氢表雄酮标准品,均购自德国Dr.Ehrenstorfer GmbH公司;β-雌二醇、雌酮、雌三醇、双氢睾酮、睾酮、地塞米松、孕烯醇酮、17α-羟孕酮、皮质酮、去氧皮质酮、17β-雌二醇-17β-D-葡萄糖醛酸钠、雌酮-3-硫酸钠、牛肝提取的β-葡萄糖醛酸酶、鲍鱼内脏提取的硫酸酯酶,均购自美国Sigma公司;表雄酮、4-雄烯二酮、5-雄烯二醇、雄酮、5β-雄烷二酮、甲基睾酮、可的松、β-葡萄糖醛酸酶/芳香硫酸酯罗曼蜗牛混合酶,均购自德国Merck公司。所有标准品纯度均大于99%。
甲醇、乙腈为HPLC级,均购自Fisher科技公司;实验用水为Milli-Q超纯水;甲酸(96%)和氨水(25%),购自北京化学试剂公司;氯化锌、二水磷酸二氢钠、十二水磷酸氢二钠,购自国药化学试剂有限公司;Bond Elut Plexa固相萃取柱(60 mg,3 cm3)、Bond Elut C18 (200 mg,3 cm3)、Bond Elut Plexa(60 mg,3 cm3)和 Bond Elut PLRP-S 在线固相萃取柱(2.1×12.5 mm),均购自美国 Agilent公司;Oasis HLB 固相萃取柱(60 mg,3 cm3)、Hybrid固相萃取-磷脂柱 (500 mg,6 cm3),均购自美国Sigma公司。
类固醇激素标准品用甲醇配制成浓度为1 mg/mL 的储备液。 用甲醇水(V/V,1∶1)溶液稀释标准储备溶液得到10 μg/mL与1 μg/mL的标准工作溶液。
1.2 样品提取与净化 称取2 g均匀的鲜蛋样品于50 mL聚丙烯离心管中,加入6 mL乙腈提取,涡旋 20 s,冰浴超声 10 min,12000 r/min、4℃离心10 min,转移上清液,再次添加6 mL乙腈进行第二次提取,合并两次上清液;加入1 g ZnCl2,振荡混匀,12000 r/min、4℃离心5 min;上清液转移至离心管后30℃恒温氮吹至2 mL;加入5 mL甲醇后再加5 mL水稀释,12000 r/min、4℃离心10 min后除去沉淀物,上清液待净化。
上清液净化选取Plexa固相萃取柱。具体净化方法如下:在线固相萃取柱在液相系统中处于脱机状态,流动相以300 μL/min流速进行洗脱,10 μL类固醇激素标准品注射其内,用3 mL甲醇、3 mL水活化Plexa固相萃取柱,样品液加入萃取柱后,依次加3 mL水、3 mL 20%甲醇水(V/V)溶液淋洗小柱,真空抽干2min。6 mL乙腈进行洗脱并收集洗脱液,洗脱液氮吹至干后重溶于1 mL 50%甲醇水(V/V)中。
1.3 样品酶解 使用三种不同类型水解酶测定结合态的类固醇激素,水解酶包括β-葡萄糖醛酸酶/芳香硫酸酯罗曼蜗牛混合酶、牛肝中提取的β-葡萄糖醛酸酶与鲍鱼内脏提取的硫酸酯酶。酶解过程如下:称取均匀的2 g鸡蛋样品于50 mL离心管中,加入4 mL磷酸盐缓冲液(0.2 mol/L,pH 5.0)后混匀,添加100 μL水解酶后37℃恒温水解16 h,水解结束后,加12 mL乙腈进行提取。提取和净化参考1.2中的方法。
1.4 仪器条件 实验采用配备有分析软件的高效液相色谱-电喷雾串联质谱法对样品进行分析。正离子与负离子模式的色谱分离分别采用Eclipse Plus-C18柱、Extend-C18柱,均使用线性梯度程序,进样量10 μL。表1为正/负离子流动相梯度条件。
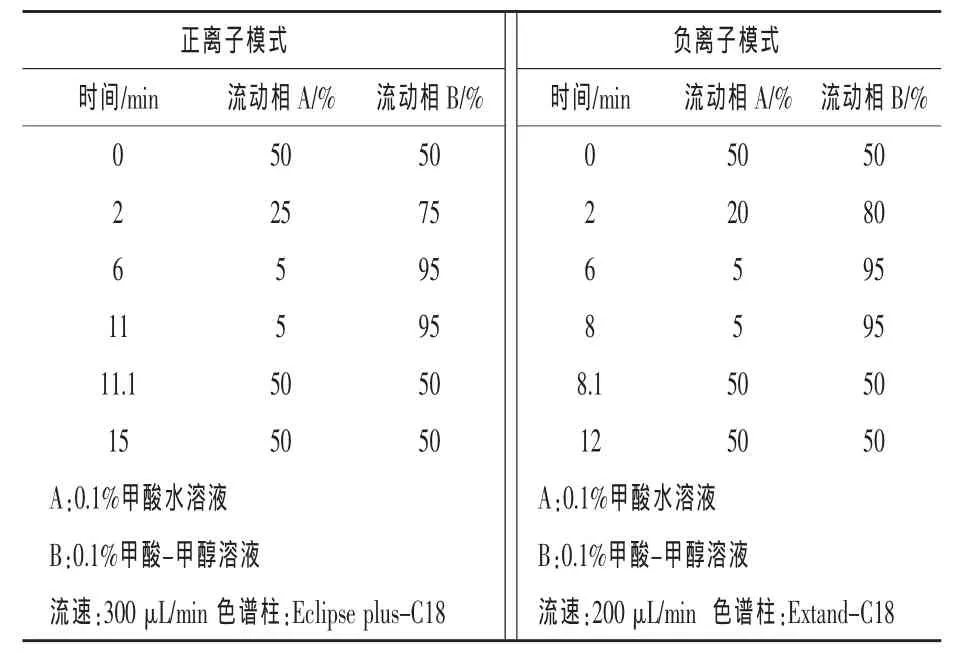
表1 正/负离子流动相梯度条件
正离子模式下的电喷雾串联质谱优化参数如下:卷帘气电压:20 psi;离子喷雾电压:5500 V;碰撞气压力:5 psi;雾化气压力与加热辅助气压力分别为70、50 psi;离子源温度:500℃。此模式下分析的类固醇激素有20种:皮质醇、可的松、皮质酮、泼尼松龙、强的松、地塞米松、康力龙、孕酮、孕烯醇酮、17α-羟孕酮、去氧皮质酮、表雄酮、4-雄烯二酮、5-雄烯二醇、5β-雄烷二酮、雄酮、双氢睾酮、睾酮、甲基睾酮和去氢表雄酮。
负离子模式下的电喷雾串联质谱优化参数如下:卷帘气压力:25 psi;离子喷雾电压:-4500 V;碰撞气压力:5 psi;雾化气与加热辅助气压力均为50 psi;离子源温度:450℃。此模式下分析的类固醇激素有6种:雌一醇、17β-雌二醇、雌三醇、己烯雌酚、双烯雌酚和己烷雌酚。
数据采集在质谱多反应监测模式 (MRM)下进行,且代表性的子离子被选取出来。每一化合物的采样参数:母离子、子离子、去簇电压、碰撞能量、碰撞室出口电压如表2所示。
1.5 基质干扰 样品中的基质干扰容易影响电喷雾离子化过程,而柱后注射法可以评估样品提取对基质干扰去除的影响(Bonfiglio等,1999)。实验采用添加与不添加ZnCl2的提取方法,然后注射泵将 1 μg/mL的混标溶液以5 μL/min恒定流速注射入质谱,同时10 μL鸡蛋样品提取物注入色谱柱,最后色谱柱流出物与注入物一起进入电喷雾质谱中进行分析。
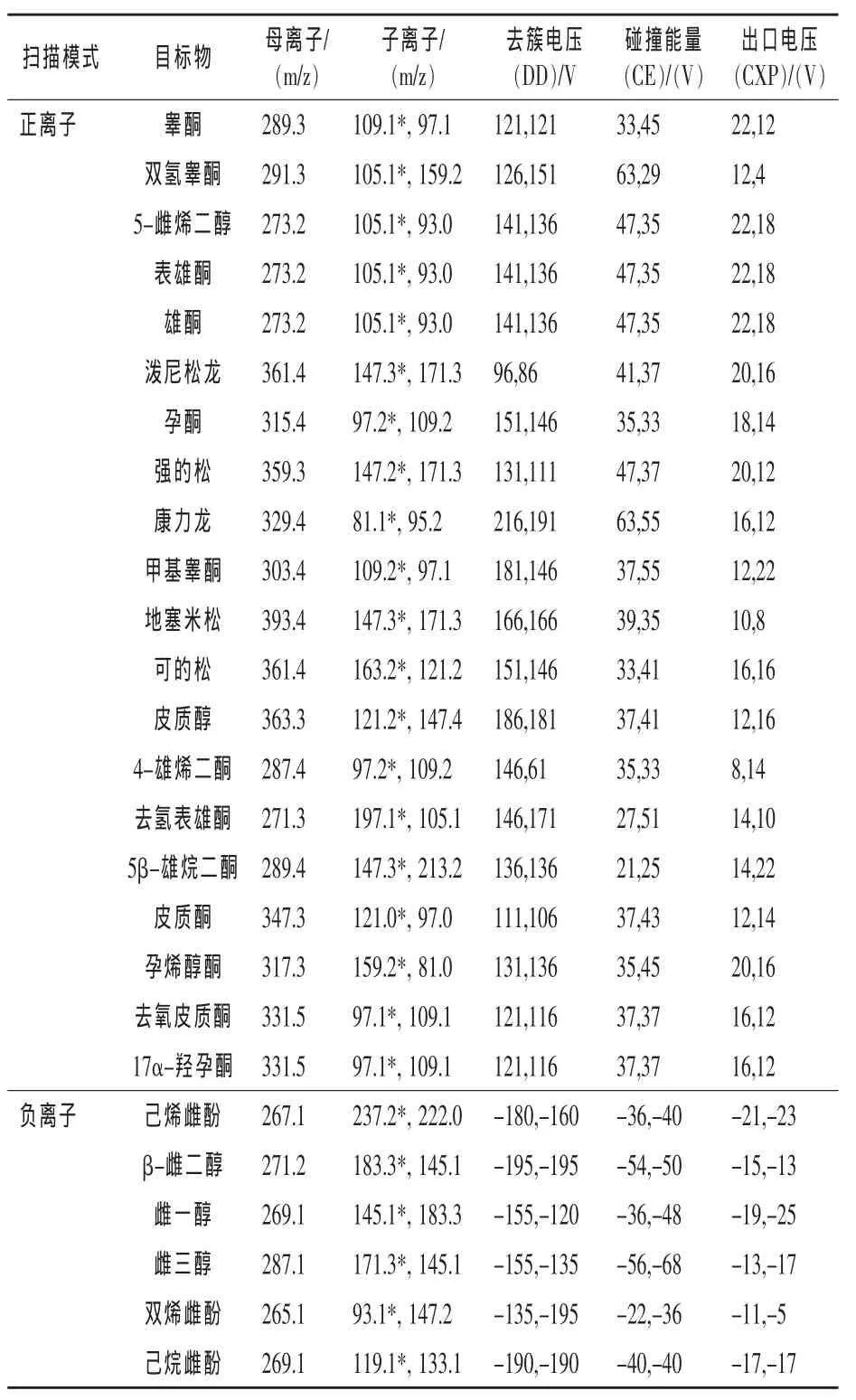
表2 26种类固醇激素的质谱优化参数
1.6 方法验证 类固醇激素的标准曲线是由0.1~500 ng/mL内的6个浓度点绘制。回收率的测定是通过向空白鸡蛋样品中添加三个浓度(10、20、50 ng/g)标准品计算,且空白样品中的类固醇激素含量将被扣除用于回收率的计算,每个浓度重复6次。方法精确度用相对标准偏差(RSD)表示。由于在质谱离子化中的低灵敏度,孕烯醇酮以50、100、250 ng/g水平添加。鸡蛋样品提取物中的分析物浓度是样品中的2倍。检测限与定量限分别是类固醇激素信噪比的3、10倍。对于高含量内源性类固醇激素的空白禽蛋样品,标准溶液可用于测定LOD与LOQ值。本实验测定了不同种类(鸡蛋、鹌鹑蛋、鸭蛋、鸽子蛋)以及不同饲养方式(散养、普通)的禽蛋类样品中的类固醇激素的含量,每个品种重复5次,该分析结果可以评价方法的选择性与重复性。
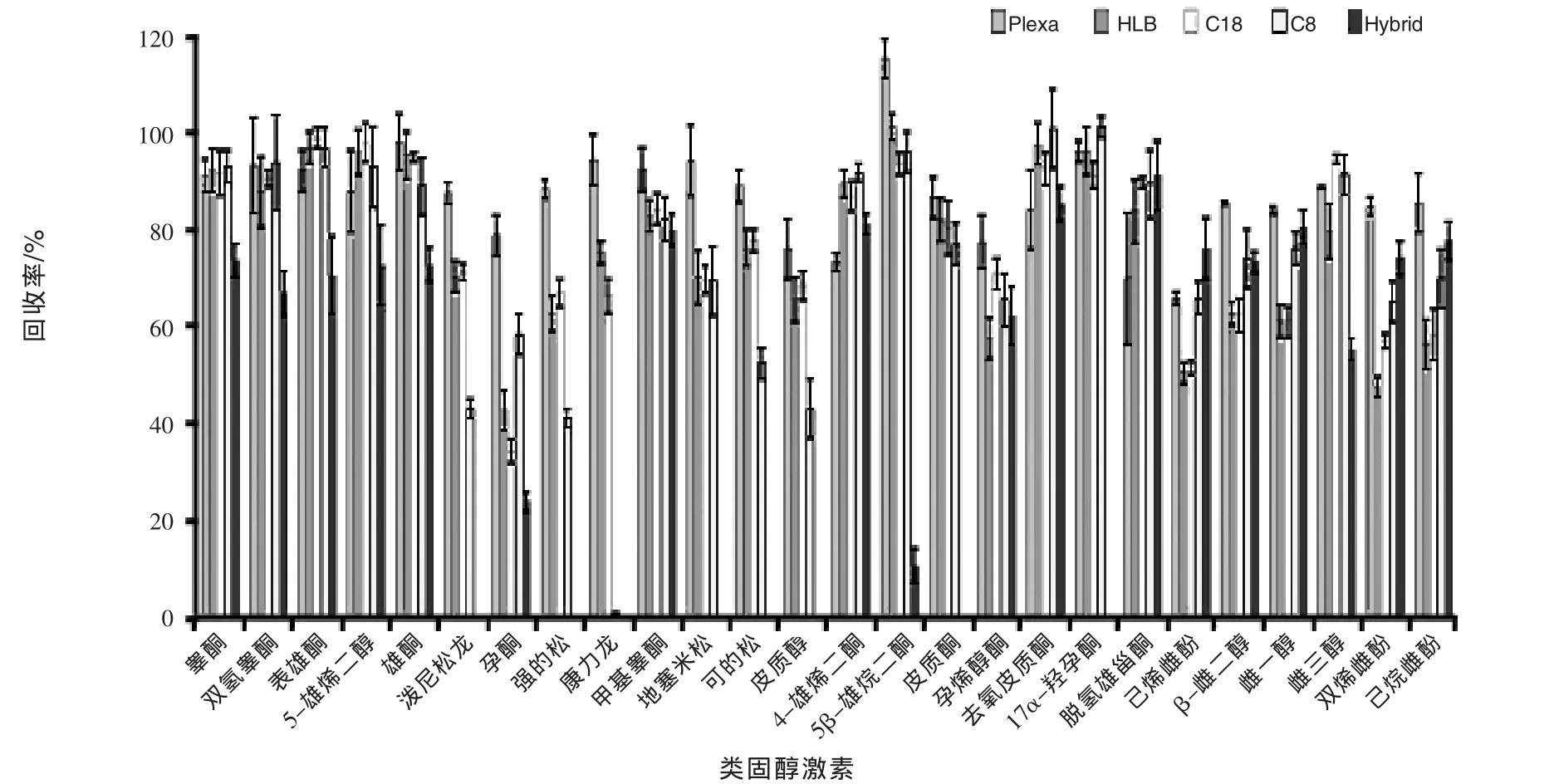
图1 不同SPE柱对类固醇激素的回收率比较
2 结果与讨论
2.1 样品制备与净化 鸡蛋富含蛋白质、脂类,这些因素会干扰对类固醇激素的分析检测。为选择适宜的提取溶剂,实验比较了乙腈与甲醇两种溶剂,发现采用这两种有机溶剂提取的多数类固醇激素有相似的回收率,但乙腈比甲醇沉淀蛋白质的效果好,乙腈提取物更为纯净,背景噪声小。本研究同时采用3%三氯乙酸溶液沉淀蛋白质,发现与乙腈溶剂提取法比较,样品净化效果并未明显改善。样品净化采用了液液萃取与Plexa、HLB、C18、Hybrid固相色谱柱的方法,发现该法使用后分析结果并无显著差异(图1)。再者固相萃取柱淋洗与洗脱的方法优化耗时,柱用量大,花费高(O’Mahony等,2013)。本实验采用在线固相萃取柱优化淋洗与洗脱条件,其即可脱机使用,也可与分析色谱柱串联应用,该方法也比传统方法更为快捷。
实验中过大的基质抑制效应可导致加标样品中分析物的回收率降低,当对样品进行液液萃取与固相萃取的净化处理后,基质干扰效果显著减小。一般认为,鸡蛋含有的磷脂具有两相性质而变得难以去除,从而干扰类固醇激素的测定。但有研究表明,二价金属离子(如 Zn2+、Pb2+、Cd2+)能够有效地结合且沉淀鸡蛋中的磷脂 (Yu等,2003),此法可用于鸡蛋样品的净化处理(Zhang等,2010)。另一项研究结果也认为ZnCl2可沉淀鸡蛋中的磷脂,提高类固醇激素的回收率(Wang等,2010)。柱后注射法常被用于研究ZnCl2对基质的净化效果。结果表明,添加ZnCl2后离子响应值出现明显的变化,阳离子梯度中7~11 min以及阴离子梯度中5~12 min基质抑制效应均明显减小,表明前处理过程中添加ZnCl2可使多数类固醇激素的回收率大幅提高(图2)。
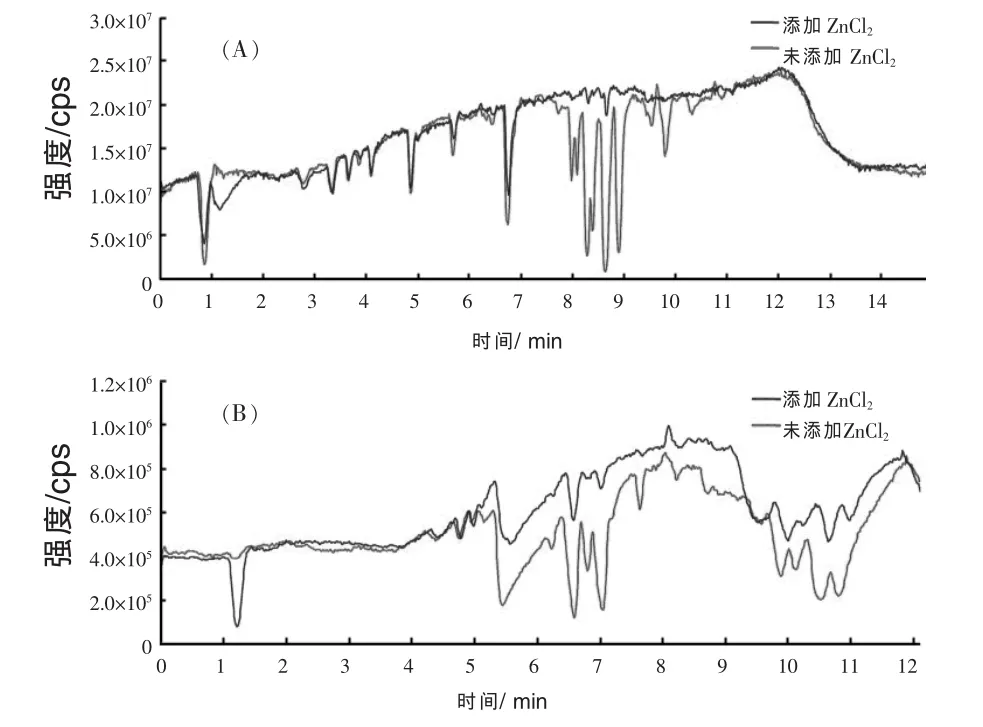
图2 柱后注射法检测基质效应的总离子流图:正离子(A)与负离子(B)
2.2 酶水解 生物组织如血浆、肝脏中的部分内源性类固醇激素是以结合态形式存在的,β-葡萄糖苷酸酶/芳香硫酸酯酶混合酶对鸡蛋样品中的类固醇激素的羟基化作用已有研究 (Wang等,2010;Hartmann 等,1998)。本实验研究从蜗牛中提取的β-葡萄糖醛酸酶/芳香硫酸酯酶混合酶对类固醇激素的水解效果发现,除孕酮外,添加酶与否,多数类固醇激素的响应值并未发生改变。图3A显示酶水解作用导致孕酮的响应值大幅提高,这是因为孕酮结构中缺乏羟基而使得其以游离形式存在。此外,图3B显示酶水解会引起孕烯醇酮的响应值显著降低。为解释此现象,分别使β-葡萄糖醛酸酶、芳香硫酸酯酶作用于鸡蛋样品,结果显示孕酮与孕烯醇酮并未发生含量改变。实验中还使用内标物(17β-雌二醇-17β-D-葡萄糖醛酸钠及雌一醇-3-硫酸钠)对样品的羟基化作用来验证β-葡萄糖醛酸酶与芳香硫酸酯酶的活性,结果表明,孕酮、孕烯醇酮不是以结合态形式在蛋类产品中存在,而且没有研究表明它们是以结合态形式存在的。研究还发现孕烯醇酮转变为孕酮可影响酶羟基化后的类固醇激素含量的变化,该现象表明蜗牛中提取的酶具有类固醇激素还原酶的活性,并且研究已发现酶水解是其原因(Noppe等,2008;Hartmann 等,1997),本实验进一步证实了这一点。因此研究认为应慎重选择针对类固醇激素中使用的水解酶类型。
2.3 方法验证 表3为26种类固醇激素标准曲线的线性关系,线性范围内各类固醇激素的相关系数均大于0.99。表4为三个不同加标浓度的类固醇激素的回收率和相对标准偏差(RSD)。由表4可看出,26种类固醇激素在低中高三个添加水平中,加标回收率分别为63.2%~95.6%(RSD为0.2%~14.9%)、66.0%~115.3%(RSD 为 0.3%~13.5% )、66.1% ~ 121.5% (RSD 为 0.3% ~12.6%)。 按照信噪比(S/N=3)和(S/N=10)确定分析物的检出限和定量限,其范围分别为0.015~7.5 ng/g和0.05~25 ng/g。表5显示为本实验的验证方法与已有研究方法结果的比较。已有研究中的方法回收率大于100%,负离子模式(ESI-)下的类固醇激素有较小定量限(24),而本实验建立的方法中正离子模式(ESI+)下类固醇激素有最小定量限。
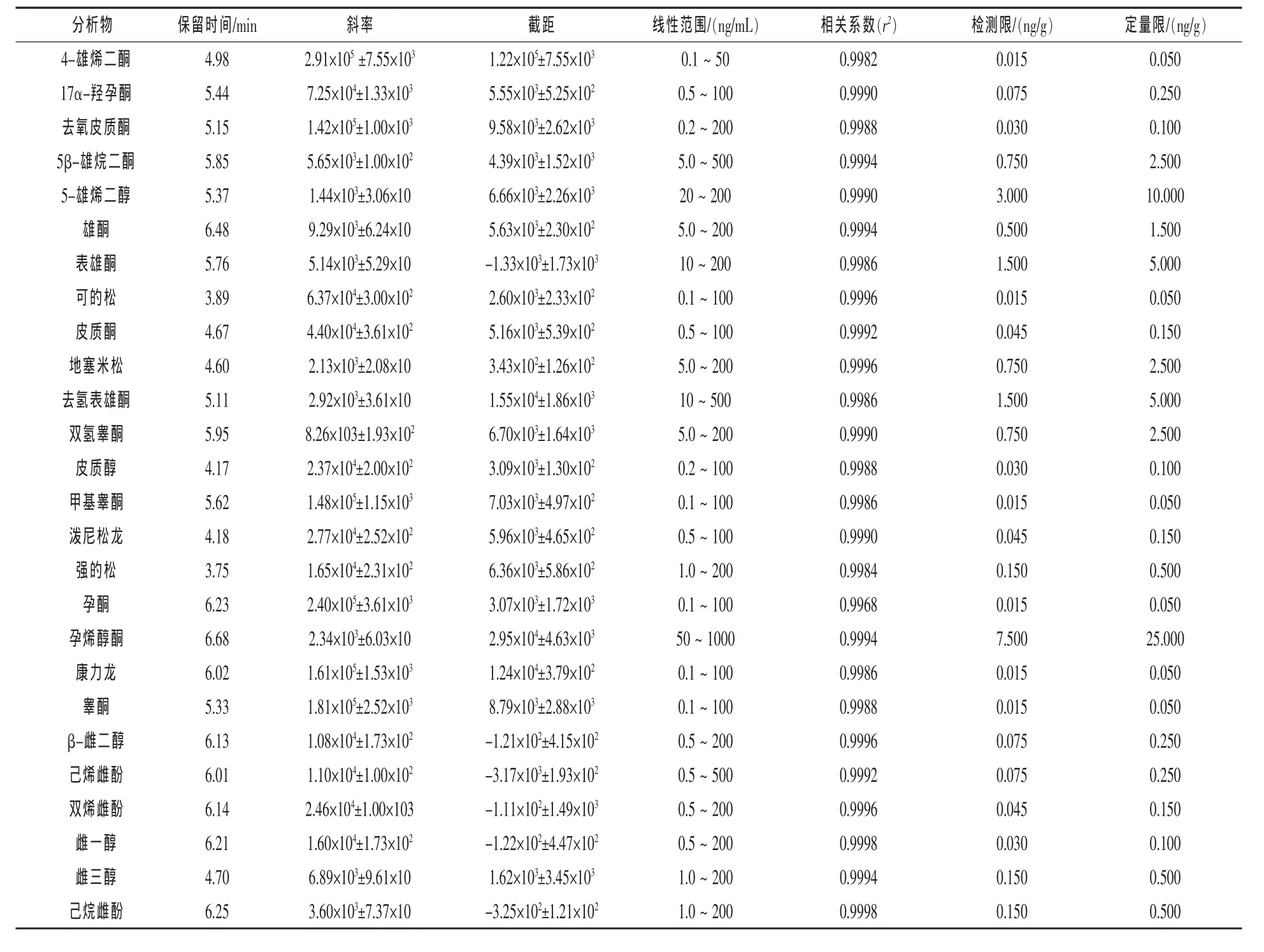
表3 类固醇激素的保留时间、线性曲线方程以及方法的检测限(LOD)与定量限(LOQ)
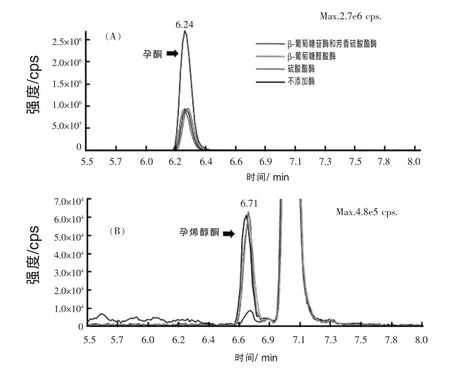
图3 鸡蛋样品中孕酮(A)与孕烯醇酮(B)使用不同水解酶的对比色谱图
2.4 实际样品检测 为了对蛋类产品中类固醇激素进行风险性评估,采用本实验建立的方法检测北京市场上所购的蛋类产品,每个品种选取10个样品进行检测,结果表明所有蛋类样品均含天然类固醇激素。表6为各种蛋类产品中的孕酮、4-雄烯二酮、睾酮、孕烯醇酮、5β-雄烷二酮、雌一醇等类固醇激素的含量。其中,孕酮和孕烯醇酮含量较高,分别为23.69~89.80 ng/g和18.74~116.03 ng/g,两种激素为类固醇激素在体内代谢的前体物质,且在胚胎发育阶段发挥重要生理功能。4-雄烯二酮是一种雄激素,在体内可以转化为睾酮,也是蛋类产品中含量很高的激素种类(3.98~8.15 ng/g)。其他具有生物活性的激素如睾酮、雌一醇也可在所有蛋类样品中被检出,含量分别为睾酮0.18~1.42 ng/g、雌一醇0.12~0.84 ng/g。另外,鸽子蛋中检测到的去氢表雄酮(DHEA)以及羟基化的孕酮、孕烯醇酮,在其他蛋类产品中均无检出。此外,在蛋类产品中检出5β-雄烷二酮(60.37~299.8 ng/g),其在体内转化成的双氢睾酮在前列腺癌发展中起重要作用(Chang等,2011),然而该激素尚未被报道。本实验研究结果表明人体摄入的蛋类含有一定量的类固醇激素,这也符合传统认识即鸡蛋源于具有合成类固醇激素的器官(Hartmann等,1998)。同时类固醇激素在孵化期蛋类的生理成长中起着重要作用。通过与文献所测鸡蛋中激素含量对比,可以看出本实验所测普通鸡蛋中的激素含量与文献(Hartmann等,1998)中测定的激素含量相符,而雌一醇含量与文献相比较低,这可能是由样品间的差异造成的,由文献报道还可知5个独立的鸡蛋个体中仅有一个样品中雌一醇含量较高 (0.89 ng/g),其余样品含量均低于0.4 ng/g(Hartmann等,1998)。本实验中17β-雌二醇在所有样品中均未被检出,且在已有蛋类产品检测实验中,有关不同种类的蛋类产品中的类固醇激素含量的对比未见报道。本实验结果表明,遗传因素与饲料组成的差异可能是不同品种蛋类产品含有不同含量类固醇激素的原因。实验还发现,不同品种蛋类产品间的蛋黄与蛋白含量比值不同,也可能影响蛋类产品中的类固醇激素含量,这是因为蛋黄的亲脂性特点可引起蛋黄富含有类固醇激素。此外,饲养方式也对蛋类产品中的类固醇激素的含量有较大影响。散养鸡蛋比普通鸡蛋具有更高含量的孕酮和5β-雄烷二酮。由于中国的散养鸡通常在野外放养,因此推测饲养环境和采食可能会影响具有生成类固醇激素的器官的成熟以及蛋类产品中类固醇激素的含量。综上,本实验结果能够为蛋类产品的风险评估提供可靠的数据。
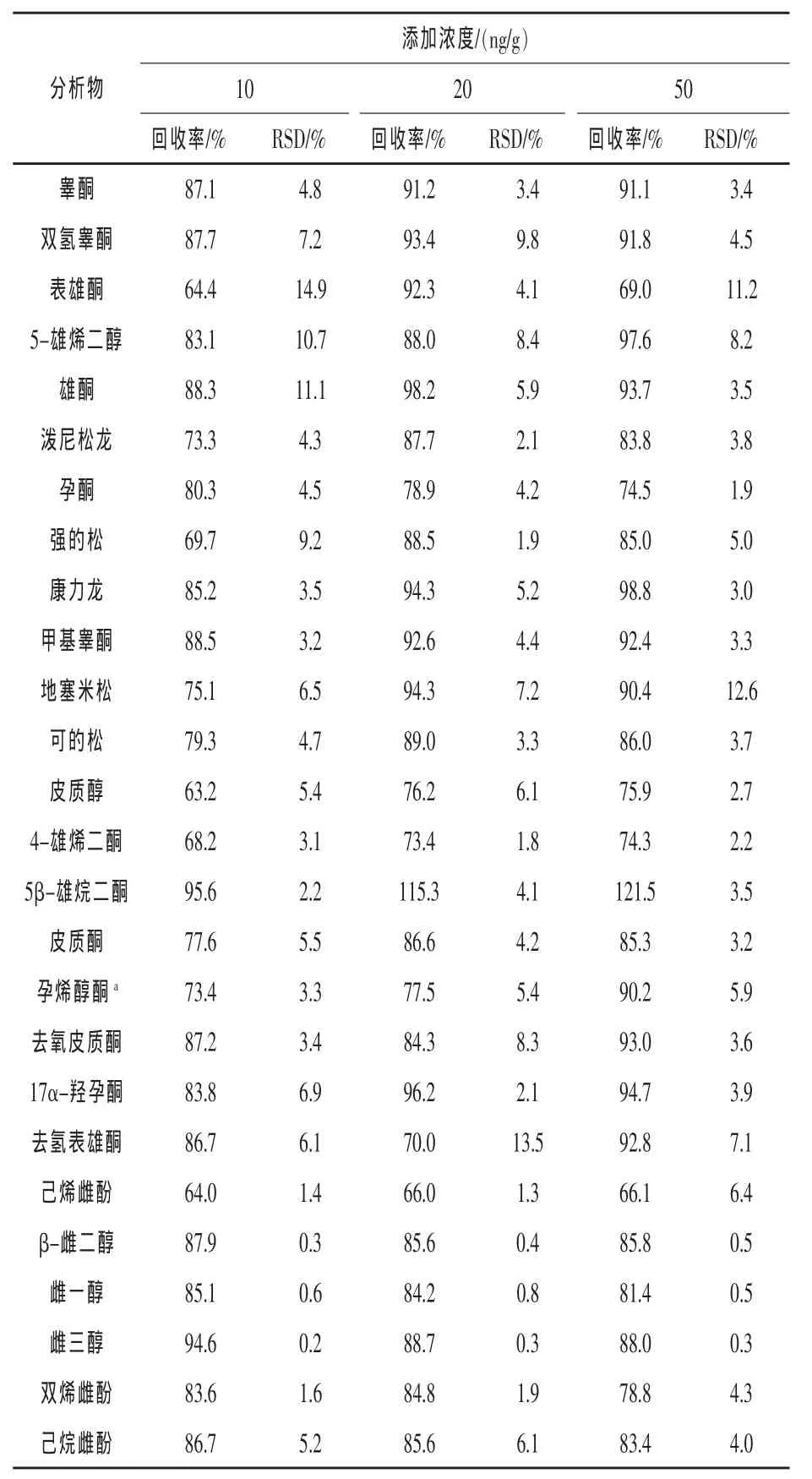
表4 鸡蛋空白基质添加回收实验结果(n=6)
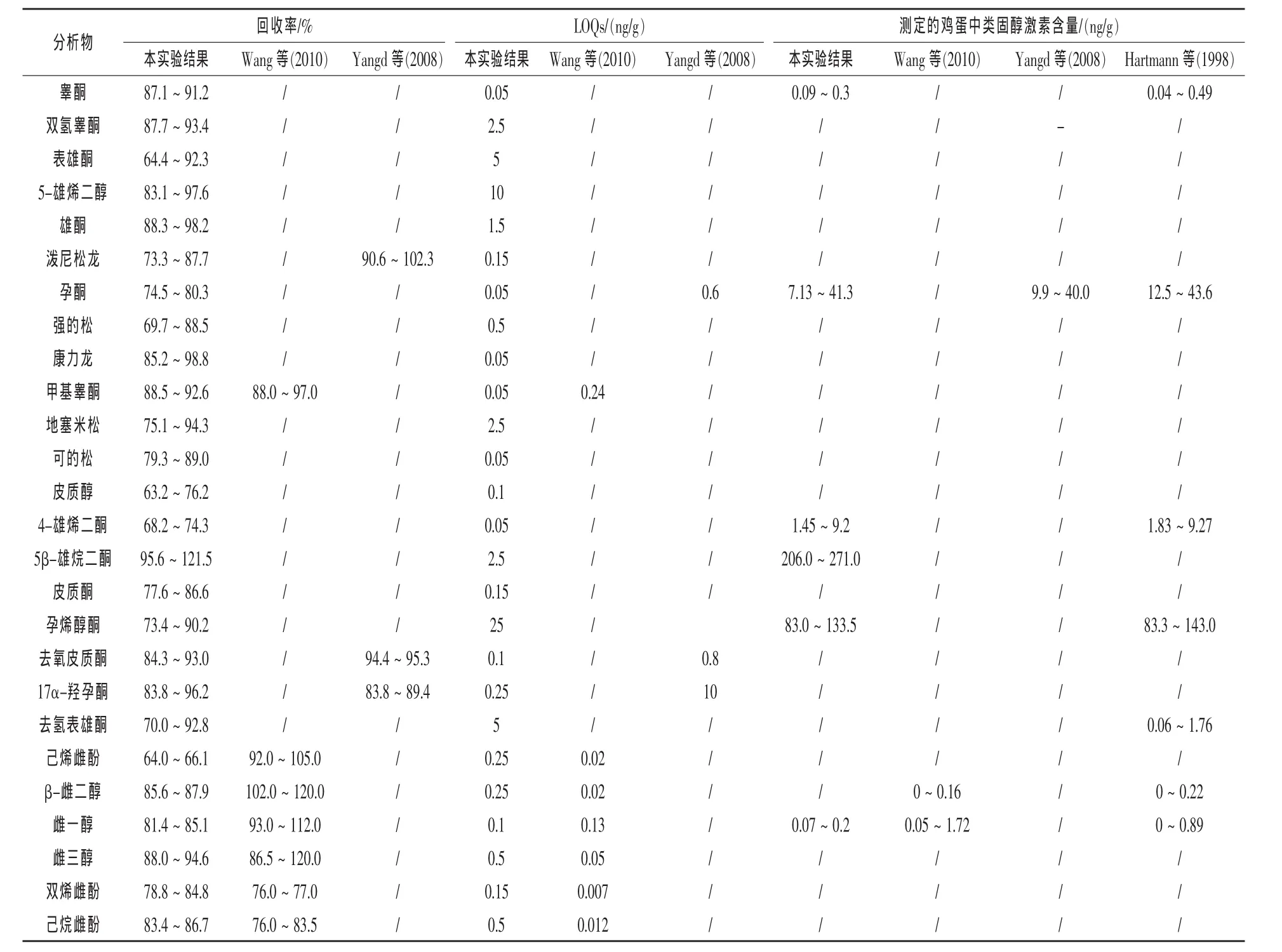
表5 方法的回收率与定量限比较
主成分分析(PCA)是用于区分种类不同的蛋类的方法。分析结果表明,前三个主成分可分别解释实验原始数据的39.35%、28.34%、20.18%。前两个主成分可解释原始数据的67.69%,选取前两个主成分绘制主成分的二维谱图,见图4A。由图4可见,不同种类的蛋类产品在谱图中可被完全分离,主成分1可以明显将鸡蛋与其它蛋类分开,而普通鸡蛋与有机鸡蛋可主要通过主成分2分开,鸭蛋与鸽子蛋、鹌鹑蛋也可由主成分2分开。图4A还显示,鸽子蛋比较分散,这可能是因为鸽子蛋含有的类固醇激素含量差别大。
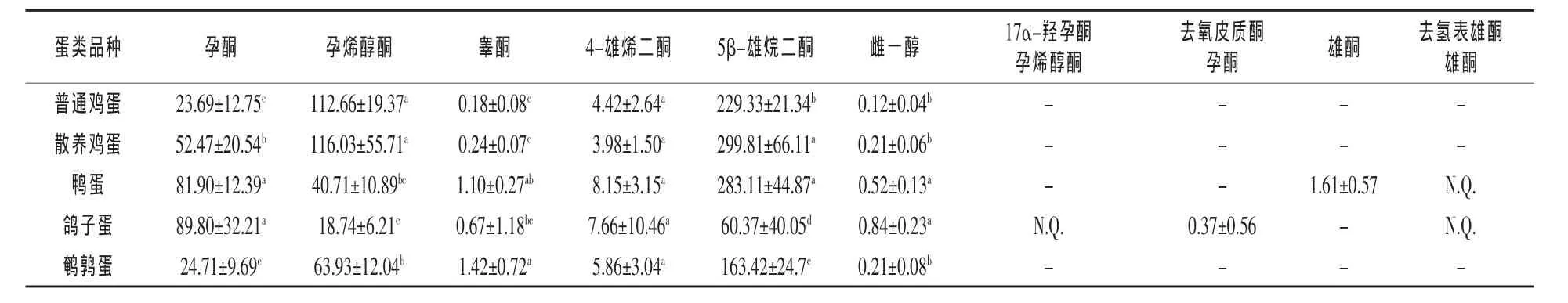
表6 蛋类产品中类固醇激素含量(n=10) ng/g
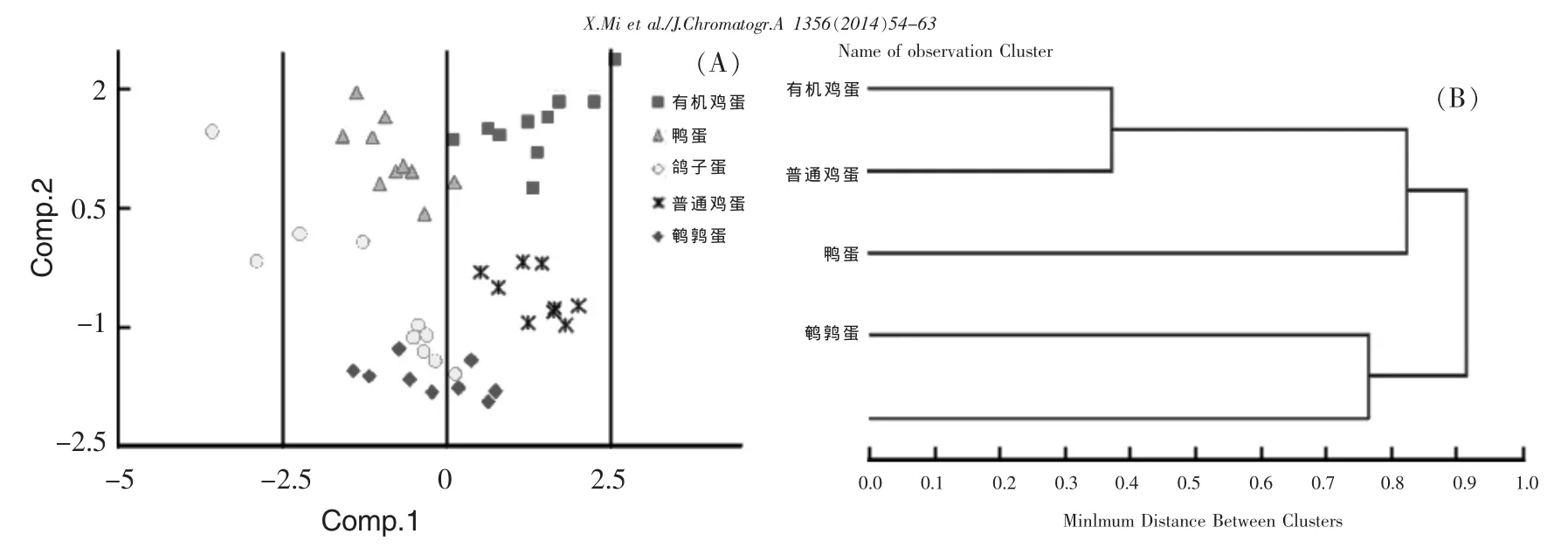
图4 不同种类和养殖方式的蛋产品中类固醇激素的主成分分析(A)及分层聚类分析(B)
实验也对5种蛋类产品进行分层聚类分析,采用最短距离法得到的聚类分析结果如图4B所示。图4B显示,5种蛋类产品分为两组,普通鸡蛋与有机鸡蛋一组,鸭蛋与鸽子蛋一组,普通鸡蛋与有机鸡蛋间距离最短,二者可与其他的蛋类品种有效地区分。实验中鹌鹑蛋并未归属于任何一组中。
3 结论
本实验建立了蛋类产品中26种类固醇激素的LC-MS/MS检测方法,检测限为μg/kg级。这些激素涵盖面广,包括雄激素、雌激素、皮质激素、孕激素以及违法添加的类固醇激素。本方法用于实际蛋类产品中的类固醇激素含量的检测,结果表明6种类固醇激素在所测的蛋类产品中检出。
[1]Ahmadkhaniha R,Shafiee A,Rastkari N,et al.Accurate quantification of endogenous androgenic steroids in cattle’s meat by gas chromatographymass spectrometry using a surrogate analyte approach[J].Analytica Chimica Acta,2009,631(1):80~86.
[2]Aufartova J,Santana C M,Ferrera Z S,et al.Determination of steroid hormones in biological and environmental samples using green microextraction techniques:An overview[J].Analytica Chimica Acta,2011,704(1-2):33~46.
[3]Bianchi F,Mattarozzi M,Careri M,et al.An SPME-GC-MS method using an octadecyl silica fibre for the determination of the potential angiogenesis modulators 17β-estradioland and 2-methoxyestradiol in culture media[J].Analytical and Bioanalytical Chemistry,2010,396(7):2639~2645.
[4]Bonfiglio R,King R C,Olah T V,et al.The effects of sample preparation methods on the variability of the electrospray ionization response for model drug compounds[J]Rapid Commun Mass Spectrom,1999,13(12):1175~1185.
[5]Brabander H F,Bizec B L,Pinel G,et al.Past,present and future of mass spectrometry in the analysis of residues of banned substances in meat-producing animals[J].Journal of Mass Spectrom,2007,42(8):983~998.
[6]Chang K,Li R,Zareei M P,et al.Dihydrotestosterone synthesis bypasses testosterone to drive castration-resistant prostate cancer[J].Proc Nat Acad Sci,2011,108(33):13728~13733.
[7]Cho H J,Kim J D,Lee W Y,et al.Quantitative metabolic profiling of 21 endogenous corticosteroids in urinebyliquid chromatography-triple quadrupole-mass spectrometry[J].Analytica Chimica Acta,2009,632 (1):101~108.
[8]Deceuninck Y,Bichon E,Monteau F,et al.Determination of MRL regulated corticosteroids in liver from various species using ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC)[J].Analytica Chimica Acta,2011,700(1-2):137~143.
[9]Devier M H,Labadie P,Togola A,et al.Simple methodology coupling microwave-assisted extraction to SPE/GC/MS for the analysis of natural steroids in biological tissues:Application to the monitoring of endogenous steroids inmarine mussels Mytilus sp[J].Analytica Chimica Acta,2010,657(1):28~35.
[10]Dusi G,Gasparini M,Curatolo M,et al.Development and validation of a liquid chromatography-tandem mass spectrometry method for the simultaneous determination of nine corticosteroid residues in bovine liver samples[J].Analytica Chimica Acta,2011,700(1-2):49~57.
[11]Eeckhaut A V,Lanckmans K,Sarre S,et al.Validation of bioanalytical LC-MS/MS assays:Evaluation of matrix effects[J].Journal of Chromatography B,2009,877(23):2198~2207.
[12]Gineys N,Giroud B,Vulliet E.Analytical method for the determination of trace levels of steroid hormones and corticosteroids in soil,based on PLE/SPE/LC-MS/MS[J].Analytical and Bioanalytical Chemistry,2010,397(6):2295~2302.
[13]Hartmann S,Lacorn M,Steinhart H.Natural occurrence of steroid hormones in food[J].Food Chemistry,1998,62(1):7~20.
[14]Hartmann S,Steinhart H.Simultaneous determination of anabolic and catabolic steroid hormones in meat by gas chromatography mass spectrometry[J].Journal of Chromatography B:Biomedical Sciences and Applications,1997,704(1-2):105~117.
[15]Malone E M,Elliott C T,Kennedy D G,et al.Development of a rapid method for the analysis of synthetic growth promoters in bovine muscle using liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta,2009,637(1-2):112~120.
[16]Muller C,Schafer P,Stortzel M,et al.Ion suppression effects in liquid chromatography-electrospray-ionisation transport-region collision induced dissociation mass spectrometry with different serum extraction methods for systematic toxicological analysis with mass spectra libraries[J].Journal of Chromatography B,2002,773(1):47~52.
[17]Noppe H,Bizec B L,Verheyden K,et al.Novel analytical methods for the determination of steroid hormones in edible matrices[J].Analytica Chimica Acta,2008,611(1):1~16.
[18]O’Mahony J,Clarke L,Whelan M,et al.The use of ultra-high pressure liquid chromatography with tandem mass spectrometric detection in the analysis of agrochemical residues and mycotoxins in food-Challenges and applications[J].Journal of Chromatography A,2013,1292,83~95.
[19]Passantino A.Steroid hormones in food producing animals:regulatory situation in Europe,in:Carlos C.Perez-Marin (Ed.),A Bird’s-Eye View of Veterinary Medicine,In Tech,Rijeka,2012,33~50.
[20]Poucke C V,Detavernier C,Cauwenberghe R V,et al.Determination of anabolic steroids in dietary supplements by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2007,586(1~2):35~42.
[21]Rambaud L,Monteau F,Deceuninck Y,et al.Development and validation of a multi-residue method for the detection of a wide range of hormonal anabolic compounds in hair using gas chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2007,586(1-2):93~104.
[22]Schmidt K S,Hackenberg R,Stachel C S,et al.Endogenous and syntheticsteroids in bovine urine-Preparation of in-house reference material,stability studies and results of a proficiency test[J].Analytica Chimica Acta,2012,717,85~91.
[23]Shao B,Zhao R,Meng J,et al.Simultaneous determination of residual hormonal chemicals in meat,kidney,liver tissues and milk by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2005,548(1-2):41~50.
[24]Touber M E,Engelen M C,Georgakopoulus C,et al.Multi-detection of corticosteroids in sports doping and veterinary controlusing high-resolution liquid chromatography/time-of-flight mass spectrometry[J].Analytica Chimica Acta,2007,586(1-2):137~146.
[25]USDA Report National Nutrient Database for Standard Reference Release26.Availablefrom (http://ndb.nal.usda.gov/ndb/foods/show/112?fg=&man=&lfacet=&format=&count=&max=25&offset=&sort=&qlookup=egg).
[26]Verheyden K,Noppe H,Bussche J V,et al.Characterisation of steroids in wooden crates of veal calves by accelerated solvent extraction(ASE®) and ultra-high performance liquid chromatography coupled to triple quadrupole mass spectrometry (U-HPLC-QqQ-MS-MS)[J].Analytical and Bioanalytical Chemistry,2010,397(1):345~355.
[27]Wang Q L,Zhang A Z,Pan X,et al.Simultaneous determination of sex hormones in egg products by ZnCl2 depositing lipid,solid-phase extraction and ultra performance liquid chromatography/electrospray ionization tandem mass spectrometry[J].Analytica Chimica Acta,2010,678(1):108~116.
[28]Yang Y,Shao B,Zhang J,et al.Analysis of eight free progestogens in eggs by matrix solid-phase dispersion extraction and very high pressure liquid chromatography with tandem mass spectrometry[J].Journal of Chromatography B,2008,870(2):241~246.
[29]Yang Y,Shao B,Zhang J,et al.Determination of the residues of 50 anabolic hormones in muscle,milk and liver by very-high-pressure liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of Chromatography B,2009,877(5-6):489~496.
[30]Yu K B,Yang Z L,Zhang L,et al.Influence of divalent metal ions on the aggregation properties of EYPC[J].Acta Physico-Chimica Sinica,2003,19,747~750.
[31]Zhang A Z,Wang Q L,Shen J,et al.Simultaneous determination of seven sex hormones in fish products using ultra performance liquid chromatographytandem mass spectrometry [J].Chinese Journal of Chromatography,2010,28,190~196.
(译自《Journal of chromatography A》2014 年第 1356期54~63页)
