青蒿琥酯对高糖诱导的肾小管上皮细胞凋亡及TNF-α、IL-8表达的影响
2015-12-21蒋姗姗龙艳苏珂聂寒黄漓莉杨帆李争明荀靖琼
蒋姗姗,龙艳,苏珂,聂寒,黄漓莉,杨帆,李争明,荀靖琼
青蒿琥酯对高糖诱导的肾小管上皮细胞凋亡及TNF-α、IL-8表达的影响
蒋姗姗,龙艳△,苏珂,聂寒,黄漓莉,杨帆,李争明,荀靖琼
目的探讨青蒿琥酯(Art)对高糖诱导的大鼠肾小管上皮细胞(NRK-52E)的凋亡及肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)表达的影响。方法传代培养大鼠肾小管上皮细胞,分为正常对照组、高糖组、高糖+不同浓度青蒿琥酯组(10、20、30 mg/L)、高糖+依那普利对照组(5 mg/L)。四甲基偶氮唑盐微量比色(MTT)法观察细胞增殖能力的改变;流式细胞仪AnnexinV-FITC/PI双染法检测细胞凋亡指数;酶联免疫吸附(ELISA)法检测细胞培养上清液中TNF-α和IL-8蛋白含量。结果(1)经高糖处理48 h后,NRK-52E细胞增殖抑制,细胞凋亡率增高,细胞上清液中TNF-α、IL-8蛋白浓度升高。(2)经青蒿琥酯干预后,与高糖组比较,NRK-52细胞增殖明显,细胞凋亡率减低,细胞上清液中TNF-α、IL-8蛋白浓度降低,其干预作用呈现剂量依赖性。结论青蒿琥酯可抑制高糖诱导的NRK-52E细胞凋亡及细胞上清液中炎症因子TNF-α、IL-8的表达。青蒿琥酯的抗炎和免疫调节作用可能有助于糖尿病肾病的治疗。
糖尿病肾病;细胞凋亡;肿瘤坏死因子α;白细胞介素8;青蒿琥酯;肾小管上皮细胞
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症之一,目前已成为糖尿病患者的主要死亡原因之一。DN发病机制复杂,肾内炎症反应的激活为其主要病理损伤机制之一,炎症因子及促炎症细胞因子在DN的发展中起着重要作用,肿瘤坏死因子(TNF)-α和白细胞介素(IL)-8就是其中两个启动炎症反应的关键细胞因子[1]。青蒿琥酯(artesunate,Art)是从传统中药菊科植物黄花蒿中提取的倍半萜内酯类化合物青蒿素的水溶性衍生物,为治疗疟疾的经典药物[2]。近年来研究发现,青蒿琥酯还具有抗炎[3]、抗肿瘤[4]、抗纤维化[5]、抗新生血管生成[6]等作用,已证实其可减轻肾间质炎性损伤[7],但目前国内外尚鲜见其应用于防治DN的研究报道。本实验以体外培养的大鼠肾小管上皮细胞(NRK-52E)为实验对象,观察青蒿琥酯对高糖诱导的炎症反应和肾小管细胞凋亡的抑制作用,为其临床应用于DN的防治提供初步的理论依据。
1 材料与方法
1.1 材料大鼠近端肾小管上皮细胞株(NRK-52E)购于上海复祥生物科技有限公司(源于ATCC,货号CRL-1571)。高糖、低糖DMEM培养基为美国GIBCO公司产品;胎牛血清为美国Hyclone公司产品。噻唑兰(MTT)粉末、二甲基亚砜(DMSO)、青链霉素混合液(×100)、胰蛋白酶消化液(0.25%)均为北京索莱宝科技有限公司产品。AnnexinV-FITC/PI凋亡检测试剂盒购于北京嘉美纽诺生物科技有限公司。IL-8 ELISA试剂盒购于武汉华美生物工程有限公司;TNF-α ELISA试剂盒购于欣博盛生物科技有限公司。注射用青蒿琥酯(批号LA130613,规格60 mg/支)由桂林南药股份有限公司生产,用1 mL 5%NaHCO3注射液助溶,配成60 g/L浓度的储存液保存于4℃,实验时用无血清培养基稀释成不同浓度的工作液。马来酸依那普利(Ena)原料药由武汉胜天宇生物科技有限公司生产,用PBS溶液(pH 7.4)配成1 mmol/L储存液,过滤除菌后保存于4℃,实验时用无血清培养基稀释成不同浓度的工作液。
1.2 细胞培养大鼠近端肾小管上皮细胞(NRK-52E)在含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的低糖DMEM培养基(D-葡萄糖浓度5.6 mmol/L)于37℃、5%CO2无菌培养箱中孵育。细胞呈单层贴壁铺路石样生长,长至80%左右用0.25%胰蛋白酶消化,1∶3传代培养,每2~3 d传代1次。取第5~10代细胞用于实验。
1.3 实验分组与处理细胞稳定传代生长至亚融合状态时加入无血清低糖DMEM培养基同步化24 h,根据预实验摸索的药物浓度,将NRK-52E细胞随机分为6组。(1)正常对照组(A组):低糖DMEM培养基(D-葡萄糖终浓度为5.6 mmol/L);(2)高糖组(B组):高糖DMEM培养基(D-葡萄糖终浓度25 mmol/L);(3)高糖+青蒿琥酯小剂量组(C组):高糖DMEM培养基+青蒿琥酯(终浓度10 mg/L);(4)高糖+青蒿琥酯中剂量组(D组):高糖DMEM培养基+青蒿琥酯(终浓度为20 mg/L);(5)高糖+青蒿琥酯大剂量组(E组):高糖DMEM培养基+青蒿琥酯(终浓度30 mg/L);(6)高糖+依那普利阳性药物对照组(F组):高糖DMEM培养基+依那普利(终浓度5 mg/L)。
1.4 四甲基偶氮唑盐微量比色(MTT)法检测细胞增殖情况MTT粉剂用高压灭菌处理的PBS溶液(pH7.4)配成浓度为5 g/L的储存液,过滤除菌,4℃保存。收集对数生长期的细胞,计数后调整细胞悬液浓度,将细胞以5×103个/孔接种至96孔培养板中,每孔200 μL培养基。细胞贴壁后,用无血清低糖DMEM培养基同步化24 h,细胞进入静止期后吸弃孔中的培养基,按以上实验分组每孔加入180 μL相应的含药物培养基,每组设6个复孔,并设置调零孔。将96孔板放回培养箱继续培养,等药物作用48 h后,避光条件下每孔加入20 μL MTT溶液,继续培养4 h后小心吸去上清液,每孔加入150 μL DMSO,置于摇床上避光低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪在490 nm波长下测量各孔的光密度值(OD490)。根据OD值推测出活细胞的数目,了解细胞的增殖能力。
1.5 AnnexinV-FITC/PI双标记流式细胞仪检测细胞凋亡率待细胞在6孔板中培养至对数生长期,换无血清低糖DMEM培养基培养24 h使细胞周期同步化,再按上述分组加药处理48 h后,收集各组细胞培养液中悬浮细胞和用胰酶消化的细胞,2 000 r/min离心5 min。用PBS洗涤细胞1次,收集并调整细胞浓度为1×106个/mL,取1 mL单细胞悬液,1 000 r/min离心5 min,弃上清。用400 μL缓冲液重悬细胞后,加入5 μL AnnexinV-FIFC,混匀后室温避光孵育15 min。再加入10 μL PI染色液,混匀后冰浴避光放置5 min。筛网过滤后,用流式细胞仪检测细胞凋亡率,计算各组细胞AnnexinV-FIFC和PI染色细胞百分含量。
1.6 酶联免疫吸附(ELISA)法检测TNF-α及IL-8水平细胞经上述分组加药处理培养48 h后收集各组上清液,同一标本设立复管。按ELISA试剂盒说明书操作,在操作前先进行预实验以建立最佳稀释倍数。用酶联免疫检测仪在450 nm处测定OD值。根据标准品的测量值绘制标准曲线,计算标本中TNF-α、IL-8的相应浓度。
1.7 统计学方法用SPSS 16.0软件进行统计分析,所有实验均重复3次,计量结果数据以表示,多个样本之间的比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 高糖和青蒿琥酯对NRK-52E细胞增殖能力的影响MTT结果显示,与低糖组(A组)比较,高糖组(B组)培养48 h后细胞OD490明显减低,提示高糖可抑制肾小管上皮细胞增殖。与B组比较,药物干预(C、D、E、F)组细胞OD490明显升高,但仍低于A组,提示用不同浓度青蒿琥酯和依那普利干预后细胞增殖能力较高糖组明显升高,且青蒿琥酯浓度越高,细胞增殖能力升高越明显(均P<0.05)。青蒿琥酯中剂量组(D组)与依那普利组(F组)比较差异无统计学意义(P>0.05),但青蒿琥酯小、大剂量组(C、E组)与依那普利组(F组)比较,差异有统计学意义(P<0.05),见表1。
2.2 高糖和青蒿琥酯对NRK-52E细胞凋亡的影响流式细胞仪检测结果显示,各组加药处理48 h后,与A组比较,B组细胞凋亡率(早期凋亡率+晚期凋亡率)明显增高,提示高糖可诱导NRK-52E细胞凋亡;与B组比较,C、D、E、F组细胞凋亡率均降低,但仍高于A组,提示用不同浓度青蒿琥酯和依那普利干预后均可抑制高糖诱导的NRK-52E细胞的凋亡,且D组和E组较C组抑制凋亡效应更加显著(均P<0.05)。C组与F组比较差异无统计学意义,但D、E组均低于F组(P<0.05),见图1、表1。
Tab.1The cell proliferations and apoptotic rates of in different groups of NRK-52E cells表1 各组NRK-52E细胞生长增殖及凋亡情况(n=6,)
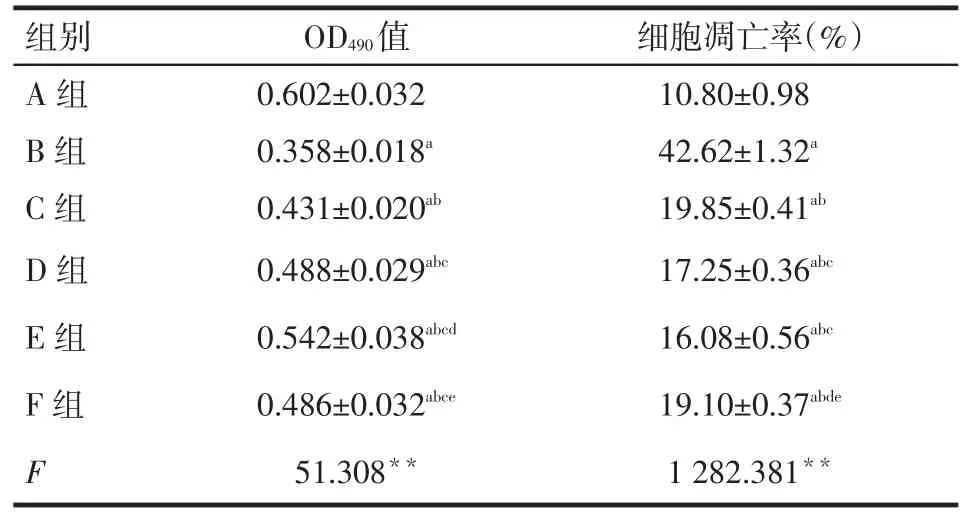
Tab.1The cell proliferations and apoptotic rates of in different groups of NRK-52E cells表1 各组NRK-52E细胞生长增殖及凋亡情况(n=6,)
**P<0.01;a与A组比较,b与B组比较,c与C组比较,d与D组比较,e与E组比较,P<0.05;表2同
OD490值0.602±0.032 0.358±0.018a 0.431±0.020ab 0.488±0.029abc 0.542±0.038abcd 0.486±0.032abce 51.308**组别A组B组C组D组E组F组F细胞凋亡率(%)10.80±0.98 42.62±1.32a 19.85±0.41ab 17.25±0.36abc 16.08±0.56abc 19.10±0.37abde 1 282.381**
2.3 高糖和青蒿琥酯对NRK-52E细胞上清液中TNF-α、IL-8水平的影响ELISA结果显示,各组培养48 h后,A组上清中TNF-α、IL-8呈较低水平,B组水平明显升高;而C、D、E、F组水平明显低于B组,但仍高于A组(P<0.05)。提示用不同浓度青蒿琥酯和依那普利干预后均可抑制高糖诱导的NRK-52E炎症因子TNF-α、IL-8的分泌,且青蒿琥酯浓度越高,抑制作用越明显。C、D、E组与F组TNF-α水平比较差异均有统计学意义(P<0.05)。C、D组与F组IL-8水平比较差异无统计学意义(P>0.05),E组IL-8水平低于F组(P<0.05),见表2。
Tab.2Expressions of TNF-α and IL-8 in different NRK-52E supernatant groups表2 各组NRK-52E上清液中TNF-α、IL-8表达水平(n=6,mg/L,)
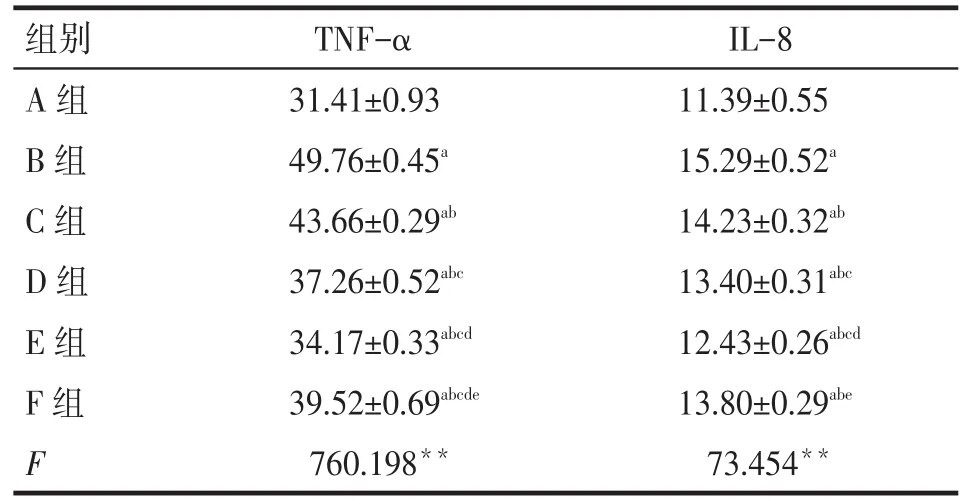
Tab.2Expressions of TNF-α and IL-8 in different NRK-52E supernatant groups表2 各组NRK-52E上清液中TNF-α、IL-8表达水平(n=6,mg/L,)
TNF-α 31.41±0.93 49.76±0.45a 43.66±0.29ab 37.26±0.52abc 34.17±0.33abcd 39.52±0.69abcde 760.198**组别A组B组C组D组E组F组F IL-8 11.39±0.55 15.29±0.52a 14.23±0.32ab 13.40±0.31abc 12.43±0.26abcd 13.80±0.29abe 73.454**
3 讨论
目前DN在临床治疗上尚无有效方法,主要以对症支持治疗延缓肾功能的损害为主。长时间的药物治疗,不仅影响患者的生活质量,其治疗费用也给患者及社会带来巨大的经济负担,因此如何在DN早期进行防治干预仍是当前及未来研究的热点。以往认为DN早期阶段主要是肾小球病变,但近年研究发现,在DN早期肾小管的损害可能早于肾小球的损害,因为临床中在尚无尿微量白蛋白时尿中已有多种肾小管蛋白存在[8]。因此近年来研究者越来越重视肾小管上皮细胞损伤和凋亡在DN发病机制中的作用。
3.1 高糖诱导与肾小管细胞的凋亡研究表明,高糖环境可通过多种途径诱导肾小管上皮细胞凋亡,如Toll样受体(Toll like receptor,TLR)途径[9]、细胞外信号调节激酶(extracellular regular protein kinase,ERK)途径[10]、c-Jun氨基末端激酶(C-jun N-terminal kinase,JNK)途径[11]、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MARK)[12]途径等,导致肾小管再吸收和分泌功能异常,促进肾脏小管间质纤维化改变,是DN进展为终末期肾病(End stage renal disease,ESRD)的重要因素。因此,肾小管上皮细胞凋亡在糖尿病肾损伤中具有重要的意义。本实验结果也证实,高糖培养可促进肾小管上皮细胞凋亡并抑制细胞增殖。
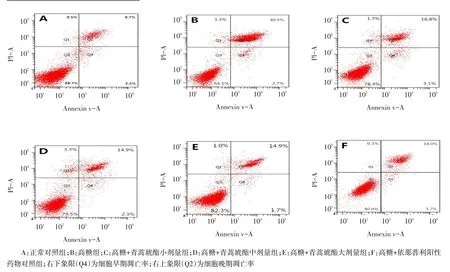
Fig.1The apoptotic rates in different groups of NRK-52E cells图1 各组NRK-52E细胞凋亡情况
3.2 高糖诱导与肾小管细胞的炎性细胞因子表达炎症反应是DN持续发展的重要因素,炎症反应越强烈,肾脏损伤越严重。本研究表明,高糖刺激下NRK-52E细胞上清液中TNF-α、IL-8浓度明显高于低糖组,说明高糖可激活肾小管上皮细胞分泌炎性分子。TNF-α和IL-8是2个在炎症反应中释放较早的内源性介质,在细胞分化和凋亡等过程中起着重要作用[1]。TNF-α可由肾小球系膜细胞、肾小管上皮细胞以及浸润的单核巨噬细胞产生,可诱导IL-1、IL-6、白三烯、前列腺素和血小板活化因子等炎症介质的合成,促进免疫炎症反应进展[13]。IL-8主要由单核-巨噬细胞产生,可使中性粒细胞趋化、脱颗粒并释放溶酶,加强炎症反应。炎症刺激肾小管上皮细胞分泌释放更多的免疫介质和细胞因子,使肾间质单核-巨噬细胞聚集,经上皮间叶转化来的肌纤维细胞和原基质成纤维细胞增殖,导致间质纤维化,促使肾病进入终末期[14]。同时,炎症反应并不是孤立的,它与其他机制如氧化应激、内质网应激、肾素-血管紧张素系统(renin-angiotensin system,RAS)过度激活、血流动力学改变等一起加快了肾病的进展[15]。因此目前治疗DN的药物很多都是通过抗炎治疗的,如他汀类、血管紧张素转换酶抑制剂(ACEI)类、醛固酮拮抗剂及麦考酚酸莫酯等。
3.3 青蒿琥酯对高糖诱导下肾小管细胞的影响青蒿琥酯作为经典抗疟疾中药,近年来研究显示其还具有抗炎和免疫调节作用[3]。众所周知,ACEI是目前在DN治疗中应用时间最长的药物,有很好的肾脏保护作用,其可通过多种机制,抑制DN炎症反应,故该研究采用依那普利作为阳性对照药物。本研究显示,高糖诱导后肾小管细胞凋亡率及培养上清液中TNF-α、IL-8浓度均升高,经青蒿琥酯及依那普利干预后细胞凋亡及TNF-α、IL-8浓度均出现不同程度的抑制;且青蒿琥酯大、中剂量的抑制程度强于小剂量浓度,呈现出剂量依赖性。由于本实验只观察了各组细胞加药诱导后48 h的变化,是否存在时间依赖性仍需进一步观察。此外,本实验发现青蒿琥酯小剂量对高糖诱导的细胞凋亡率升高及青蒿琥酯小、中剂量对高糖诱导后细胞上清液中IL-8浓度升高所呈现出的抑制程度与依那普利比较差异无统计学意义,说明青蒿琥酯在减少炎性因子的释放和抑制细胞凋亡方面可与ACEI类药物依那普利达到同样的效果。由此推测,青蒿琥酯可能是通过抑制高糖诱导的炎症反应,减少某些炎性因子的释放,阻断高糖的促凋亡作用,从而减轻肾小管上皮细胞损伤,进而防止肾损害的发生。
综上所述,青蒿琥酯可以抑制高糖诱导的炎症反应和肾小管细胞凋亡,提示肾小管上皮细胞是青蒿琥酯的抗炎作用靶点,也为防治DN提供了新的思路。青蒿琥酯极可能成为防治DN的新药物,但作用机制有待进一步探讨。另外,体外实验不能完全模拟复杂的体内环境,因此青蒿琥酯对DN的肾脏保护作用还有待于大量的动物实验和临床试验证实。
[1]Navarro-González JF,Mora-Fernández C,Muros de Fuentes M,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol,2011,7(6):327-340.doi: 10.1038/nrneph.2011.51.
[2]Nzila A,Al-Zahrani I.Drugs for the treatment of malaria in the Kingdom of Saudi Arabia[J].Saudi Med J,2013,34(6):569-578.
[3]Mo HY,Wang LF,Zhang LH.Effects of artesunate on tumor necrosis factor α and chemotactic factors in the serum and the synoviocyte culture supernate of collagen-induced arthritis rats[J].Chin J Integr Tradit West Med,2012,32(2):253-256.[莫汉有,王丽芳,张丽华.青蒿琥酯对佐剂性关节炎大鼠血清及滑膜细胞培养上清液中肿瘤坏死因子α及趋化因子的影响[J].中国中西医结合杂志,2012,32(2):253-256].
[4]Liu L,Zuo LF,Wang J.Effects of artesunate on membrane potential of mitochondria and cell apoptosis of Ec9706 cells[J].Med J Chin PLA, 2014,39(1):25-29.[刘亮,左连富,王静.青蒿琥酯对食管癌Ec9706细胞线粒体膜电位及凋亡的影响[J].解放军医学杂志,2014,39(1): 25-29].doi:10.11855/j.issn.0577-7402.2014.01.06.
[5]Wang CM,Chen J,Jiang M,et al.Relationship between artesunate influence on the process of TGF-β1 induced alveolar epithelial cells transform into mesenchymal cells and on idiopathic pulmonary fibrosis[J].Acta Pharm Sin,2014,49(1):142-147.[王昌明,陈娟,蒋明,等.青蒿琥酯干预TGF-β1诱导的肺泡上皮-间质细胞转分化与肺纤维化的关系[J].药学学报,2014,49(1):142-147].
[6]Liu Y,Peng HC,Tang H.Effects of artesunate on proliferation and expression of VEGF in human retinal capillary endothelial cells treated with high glucose[J].Int Eye Sci,2013,13(2):252-255.[刘逸,彭辉灿,唐虹.青蒿琥酯对高糖环境下人视网膜微血管内皮细胞增殖及VEGF表达的影响[J].国际眼科杂志,2013,13(2): 252-255].doi:10.3980/j.issn.1672-5123.2013.02.08.
[7]Ma XY,Wu WH,Zeng Y,et al.The anti-inflammatory effect and its mechanism of Artemisia on the renal of UUO rats[J].Chongqing Med, 2010,39(12):1514-1516.[马行一,吴蔚桦,曾燕,等.青蒿琥酯对UUO模型大鼠肾脏的抗炎作用及其机制研究[J].重庆医学,2010,39(12): 1514-151].doi:10.3969/j.issn.1671-8348.2010.12.013.
[8]Abdel Aziz MT,Wassef MA,Ahmed HH,et al.The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy[J].Diabetol Metab Syndr, 2014,6(1):34.doi:10.1186/1758-5996-6-34.
[9]Allam R,Scherbaum CR,Darisipudi MN,et al.Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4[J].J Am Soc Nephrol,2012,23(8):1375-1388.doi:10.1681/ASN.2011111077.
[10]Mohamed R,Jayakumar C,Ranganathan PV,et al.Kidney proximal tubular epithelial-specific overexpression of netrin-1 suppresses inflammation and albuminuria through suppression of COX-2-mediated PGE2 production in streptozotocin-induced diabetic mice[J].Am J Pathol,2012,181(6):1991-2002.doi:10.1016/j.ajpath.2012.08.014.
[11]Benedetti G,Fredriksson L,Herpers B,et al.TNF-α-mediated NF-κB survival signaling impairment by cisplatin enhances JNK activation allowing synergistic apoptosis of renal proximal tubular cells[J].BiochemPharmacol,2013,85(2):274-286.doi:10.1016/j. bcp.2012.10.012.
[12]Gong X,Wang Q,Tang X,et al.Tetramethylpyrazine prevents contrast-induced nephropathy by inhibiting p38 MAPK and FoxO1 signaling pathways[J].Am J Nephrol,2013,37(3):199-207.doi: 10.1159/000347033.
[13]Fernández-Real JM,Vendrell J,García I,et al.Structural damage in diabetic nephropathy is associated with TNF-α system activity [J].Acta Diabetol,2012,49(4):301-305.doi:10.1007/s00592-011-0349-y.
[14]Lima SM,Grisi DC,Kogawa EM,et al.Diabetes mellitus and inflammatory pulpal and periapical disease:a review[J].Int Endod J, 2013,46(8):700-709.doi:10.1111/iej.12072.
[15]Yang SM,Ka SM,Wu HL,et al.Thrombomodulin domain 1 ameliorates diabetic nephropathy in mice via anti-NF-κB/NLRP3 inflammasome-mediated inflammation,enhancement of NRF2 antioxidant activity and inhibition of apoptosis[J].Diabetologia,2014,57(2): 424-434.doi:10.1007/s00125-013-3115-6.
(2014-05-26收稿2014-08-29修回)
(本文编辑李鹏)
Effects of artesunate on high glucose-induced cell apoptosis,TNF-α and IL-8 expression in renal tubular epithelial cells
JIANG Shanshan,LONG Yan△,SU Ke,NIE Han,HUANG Lili,YANG Fan,LI Zhengming,XUN Jingqiong
Department of Endocrinology,Affiliated Hospital of Guilin Medical College,Guangxi 541004,China△
ObjectiveTo investigate the effects of artesunate(Art)on cell apoptosis,tumor necrosis factor-alpha(TNF-α)and interleukin-8(IL-8)expression induced by high glucose in rat renal tubular epithelial cells(NRK-52E).Methods NRK-52E cells were cultured and divided into normal control group,high glucose group,high glucose with different concentrations of Art(10 mg/L,20 mg/L and 30 mg/L)groups,and high glucose with Ena(5 mg/L)group.MTT assay was used to detect the cell proliferation.The apoptotic rate was evaluated by flow cytometry with AnnexinV-FITC/PI double stains.The protein levels of TNF-α and IL-8 in the cell culture supernatant were determined using ELISA.ResultsHigh glucose inhibited NRK-52E proliferation,induced its apoptosis,and the expressions of TNF-α and IL-8 in the supernatant.Application of Art obviously abolished the effects of high glucose,and the effects of Art were showed in dose-dependent manner.ConclusionArt can suppress high glucose-stimulated cell apoptosis,enhance TNF-α and IL-8 expression in NRK-52E cells. The anti-inflammatory action and immune regulation of Art could be a novel approach of treating diabetic nephropathy.
diabetic nephropathies;apoptosis;tumor necrosis factor-alpha;interleukin-8;artesunate;renal tubular epithelial cells
R587.24
A
10.3969/j.issn.0253-9896.2015.01.006
广西医疗卫生适宜技术研究与开发项目(S201316-07);广西自然科学基金项目(2012GXNSFAA053085);广西高等学校计划科研项目(201204LX246)
桂林医学院附属医院内分泌科(邮编541004)
蒋珊珊(1986),女,硕士在读,主要从事糖尿病及其并发症研究
△通讯作者E-mail:ly136988@163.com
