膝柄木叶片诱导愈伤组织研究
2015-12-21莫竹承庞万伟
莫竹承,庞万伟 ,刘 珏 ,李 滨
(1. 广西科学院广西红树林研究中心,广西 北海 536000;2. 广西红树林保护重点实验室,广西 北海536000;3. 北海市林业局,广西 北海 536000)
膝柄木叶片诱导愈伤组织研究
莫竹承1,2,庞万伟3,刘 珏3,李 滨3
(1. 广西科学院广西红树林研究中心,广西 北海 536000;2. 广西红树林保护重点实验室,广西 北海536000;3. 北海市林业局,广西 北海 536000)
为了抢救性保护我国濒危植物膝柄木,以叶片外植体为培养材料,在叶片背面划痕,配制MS培养基附加不同浓度的2,4-D和6-BA,设置不同的暗培养时间,做3个重复的L3(43)正交设计试验,探讨各因子对膝柄木叶片诱导愈伤组织的影响。结果表明各因素对愈伤组织诱导率的影响大小顺序为:暗培养时间>2,4-D>划痕数,6-BA的影响未能达到显著水平。诱导膝柄木叶片愈伤组织各因素最佳浓度组合是:2,4-D=1.0 mg/L,6-BA=0.5 mg/L,划痕=4~5条,暗培养=30天。
膝柄木;叶片;愈伤组织;诱导率
卫矛科植物膝柄木最早于1979年在广西北海市南康镇下担村被发现,当时定名为库林木属华库林木kurrimiasinicaChang et S.Y. Liang[1],是我国特有的热带树种[2],被收录入《中国植物红皮书》(第一册)中。1995年李先琨[3]用定量评价指标体系评估了广西珍稀濒危植物优先保护序列,把膝柄木Bhesa sinica列入了最优先予以保护的种类。联合国环境署保护监测中心2001年的报告中也将Bhesa sinica收录为中国特有濒危植物[4]。在诚静容和黄普华主编的《中国植物志》45卷3册(1999年)中将膝柄木Bhesa sinica归并到Bhesa robusta(Roxb.) D. Hou(见 http://frps.eflora.cn/frps/Bhesa%20robusta)膝柄木Bhesa robusta不再是中国特有种。1999年国务院批准《国家重点保护野生植物(第一批)》名录中,膝柄木Bhesa robusta为一级保护野生植物,在2004年《中国物种红色名录》中将一级保护植物膝柄木定为极危(CR)等级[5]。
膝柄木种群小(我国野生种群不到10株),种子量少且发芽率低,通过有性繁殖恢复种群极为困难[6],探讨无性繁殖技术对膝柄木种群的保护有重要意义。膝柄木属与南蛇藤属、美登木属、巧茶属同属于卫矛亚科Celastroideae南蛇藤族Celastreae。对与膝柄木同族的其它属植物,如对南蛇藤Celastrus orbiculatus[7-8]、苦皮藤Celastrus angulatus[9]、云南美登木Maytenus hookeri[10-11]]等种类开展的组织培养研究均取得了一定的进展,因此本文将参照相近亲缘种类的组培方案制定膝柄木组培研究方法,探讨膝柄木的无性繁殖技术,为种群的保护恢复探索新的技术路径。
1 材料与方法
1.1 叶片采集与消毒
在人工种植的膝柄木幼树上剪取新长出嫩叶,叶龄一般在10~30日之间,叶片长约10cm,红色、淡红色到嫩绿色,柔软。
将幼叶带回实验室用毛刷擦拭表面,放入烧杯中用流水冲洗1h。先用70%酒精浸泡30秒,无菌水冲洗1次;再用0.1%氯化汞(HgC12)浸泡8 min,无菌水冲洗3次后用无菌滤纸吸干,在无菌操作台上将叶背面划痕,切除叶中脉,将叶片分割成约2 cm2的小片用于接种。
1.2 接种及培养
按教材配方配制MS固体培养基[12],琼脂粉用量为4.0g/L,附加4%蔗糖。培养基附加的植物生长调节剂为:生长素类用二氯苯 氧 乙 酸(2,4-Dichlorophenoxyacetic acid ,简称2,4-D),细胞分裂素类用6-苄氨基嘌呤(6-Benzylaminopurine,简 称 6-BA 或 BAP),浓度分别为0.5,1.0,2.0mg/L;调节培养基pH至5.8~6.0,121℃高压灭菌15 min。接种时叶片外植体背面与培养基接触,背面划痕数分密(4~5条)、疏(1~2条)和零划痕3种类型,接种后置于培养架上暗培养10~30天。考察4种因素(生长素2,4-D、细胞分裂素6-BA、划痕数和暗培养时间)对膝柄木外植体诱导愈伤组织的影响,各因素水平见表1。
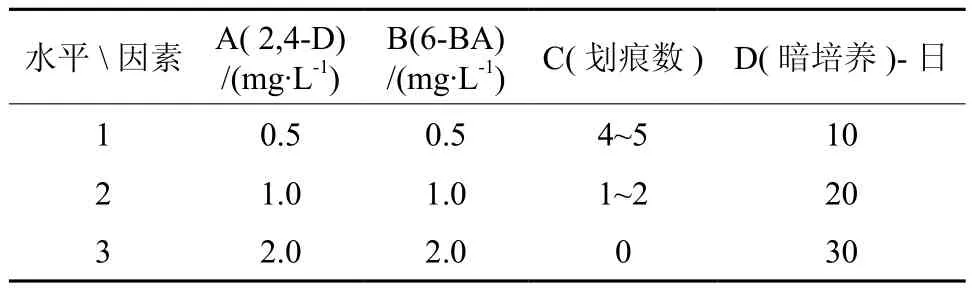
表1 膝柄木叶片组培试验各因素水平Table 1 Levels of different factors in leaf segments tissue culture test of Bhesarobusta
将表1中的4因子3水平用L9(34)正交表设计实验,共做9组实验,每组实验3个重复,每组接种20瓶,每1重复接种180瓶,每瓶接种1个叶片外植体,3个重复共接种了540瓶。培养第10天按设计方案保持暗培养或用日光灯连续光照培养,光照强度为1 500~2 000 Lx,培养室温度控制在25℃左右,每隔3d观察记录一次愈伤组织发育情况。当遇有发霉时立即将外植体消毒转瓶,接种到相同成份的培养基上。
考察指标为接种30日后愈伤组织诱导率,计算方法如下:
诱导率=(诱导出愈伤组织的外植体数/活外植体数)×100%。
用SPSS17.0统计分析软件进行分析。
2 结果分析
2.1 实验结果统计
在实验过程中观察记录发现:较密的划痕数外植体愈伤组织出现较早,在3个重复中,划痕数4~5条的外植体培养不到20天便开始出现愈伤组织,无划痕的外植体出现愈伤组织的时间最迟,通常在培养25~26天才出现。经30天培养后愈伤组织诱导率结果整理于表2.

表2 膝柄木叶片组培实验结果Table 2 Experimantal result of B.robustaleaf segments tissue culture
2.2 各因素对愈伤组织诱导的影响
通过单变量方差分析,比较各因素对愈伤组织诱导率的效应,见表3。
结果显示:A(2,4-D)、C(划痕数)、D(暗培养)的伴随概率p(表中Sig.)均小于显著性水平0.05,因此认为这3个因子对诱导率有显著影响,其中暗培养影响最大,其次是2,4-D,最后是划痕数,6-BA对诱导率无显著影响。

表3 因素间效应检验Table 3 Tests of Between-Subjects Effects
2.3 暗培养对愈伤组织诱导的影响
暗培养时长这一因素的3个水平的诱导率分别是水平1(暗培养10天)=83.444%,水平2(暗培养20天)=84.889%,水平3(暗培养30天)=90.556%,基于这些均值采用LSD(最小显著差异法)进行成对比较得到以下结果(见表4)。
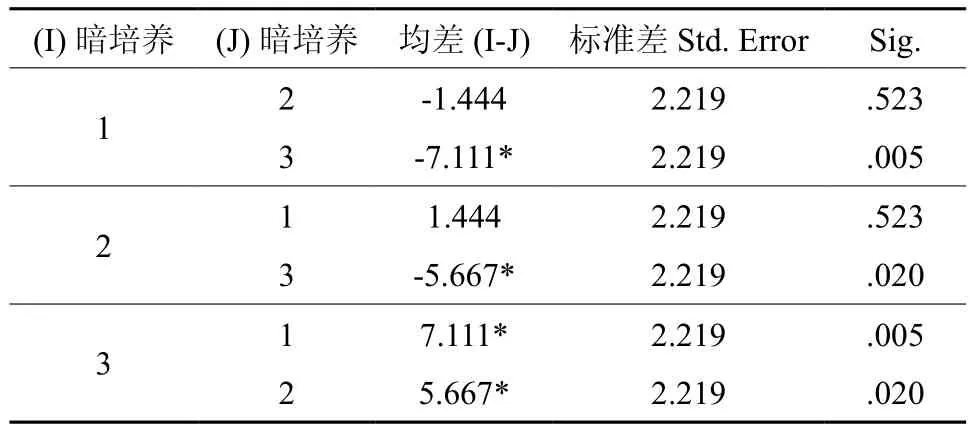
表4 暗培养各水平成对比较†Table 4 Pairwise comparisons of dark culture period
结果表明暗培养水平3与1、2之间的诱导率在0.05水平上有显著差异,即暗培养30天明显提高愈伤组织诱导率。
2.4 植物生长调节剂对愈伤组织的影响
生长素类激素2,4-D各水平的诱导率均值分别是:水平1=84.111%,水平2=89.778%,水平3=85%,成对比较结果见表5。
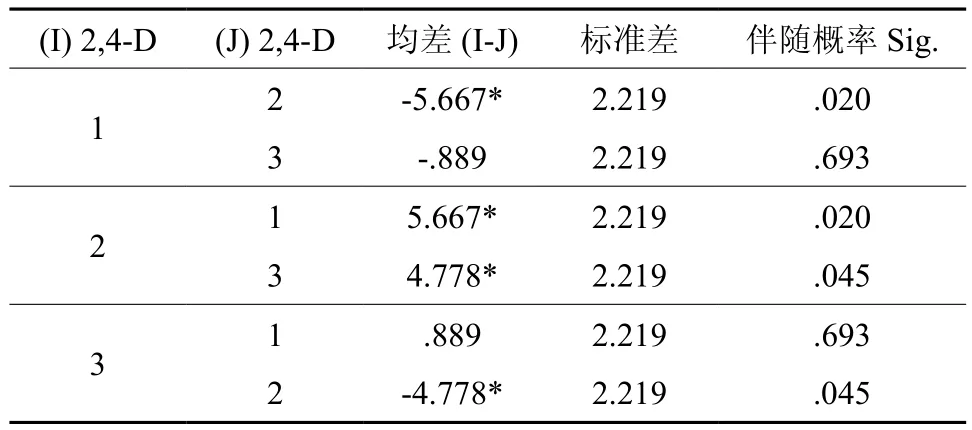
表5 2,4-D各水平成对比较†Table 5 Pairwise Comparisons of 2,4-D Concentrations
表中数据显示2,4-D水平2与1、3之间的诱导率有显著差异,即培养基中2,4-D最佳浓度为1 mg/L。
尽管6-BA在各因素中对诱导率的影响力不显著,但因素内不水平之间的诱导率可能会有显著性差异,为此计算6-BA各水平的平均诱导率分别是:水平1=89.667%、水平2=84.667%和水平3=84.556%,做成对比较结果见表6。
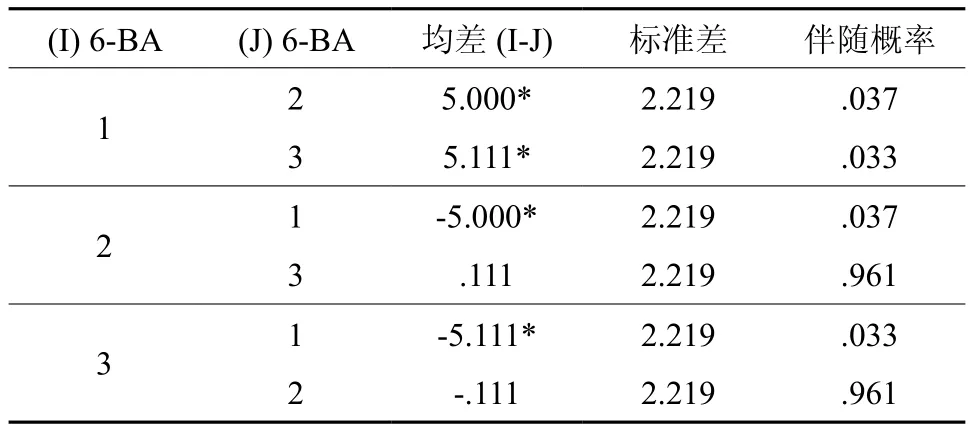
表6 6-BA各水平成对比较Table 6 Pairwise Comparisons of 6-BA Concentrations
比较结果表明,6-BA水平1与水平2、3之间的诱导率有显著差异,即在培养基中6-BA浓度0.5 mg/L比其它两种较高浓度能明显提高愈伤组织的诱导率。
2.5 划痕对愈伤组织诱导的影响
划痕数的3个水平的诱导率均值分别是水平1=89.667%,水平2=85.222%,水平3=84%,成对比较结果见表7。
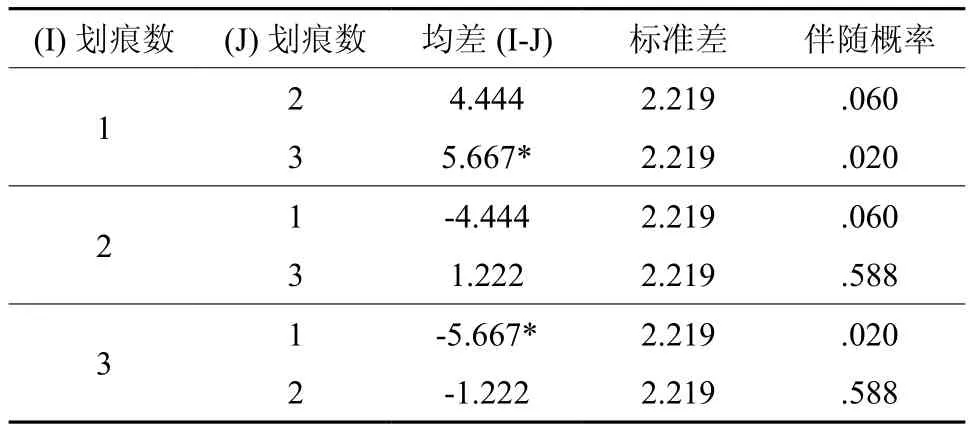
表7 划痕数各水平成对比较Table 7 Pairwise comparisons of scratch lines
结果表明,划痕数只有水平1与水平3之间的诱导率有显著差异,也就是说较密的划痕(4~5条)比无划痕外植体的愈伤组织诱导率明显较高。
由此可以认为这4个因素的最佳组合是:A2B1C1D3,即 2,4-D=1.0 mg/L,6-BA=0.5 mg/L,划痕=4~5条(密),暗培养=30天。
考虑到6-BA对诱导率的贡献达不到显著水平,从节约资源的角度考虑可以省掉,变成3因素组合,即A2C1D3,这一推测是否正确还应通过试验验证。
经过30天培养,9个试验组愈伤组织诱导结果见图1。图中显示第4、8组因出现愈伤组织较早,获得的愈伤组织块较大,具有较强的再生能力。其次是第6、3、5、2组,各愈伤组织已经成团块结构;第7、1、9组产生愈伤组织较晚,愈伤组织块较小且分散。
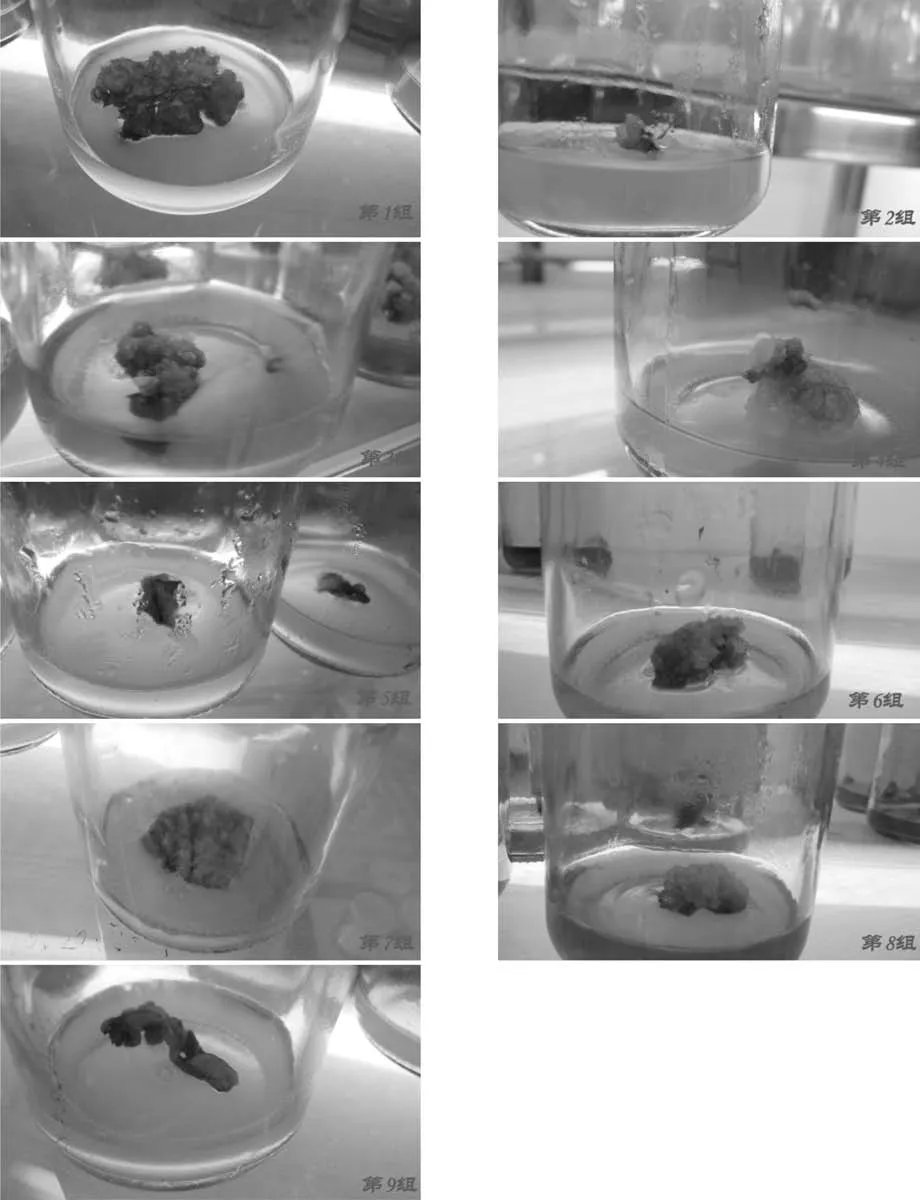
图1 膝柄木叶片愈伤组织诱导30天试验结果Fig.1 Bhesa robusta leaf Callus induced after 30 days culture in Orthogonal test
3 讨论与结论
叶片组培繁殖是对珍稀濒危植物抢救保护的重要措施,我国特有的珍稀植物金花茶Camellia nitidissimaChi.、单种属植物青钱柳Cyclocaryapaliurus(Bata1.)Iljinskaja的叶片组培均获得愈伤组织[13-14]。本文的实验结果表明了膝柄木也能通过组培快繁方式实现种群繁殖与保护。
植物生长调节剂种类、浓度与比例被认为是影响愈伤组织诱导的重要因素。生长素类2,4-D和细胞分裂素类6-BA(BAP)是叶片愈伤组织诱导培养中最常用的种类,2,4-D不但常用于叶片愈伤组织诱导,还对红花黄钟木Tabebuiarosea的子叶、下胚轴、胚根等不同类型外植体产生愈伤组织有促进作用[15]。6-BA主要作用是促进愈伤组织诱导,如在野生型拟南芥叶愈伤组织诱导中最佳浓度为0.5 mg/L[16],浓度过高易导致玻璃化。也有用于促进萌芽,如促进珍贵阔叶树种刺楸Kalpanaxseptemlobus休眠芽和幼嫩茎段的腋芽萌发[17]。
唐佳佳等[18]将2,4-D+ 6-BA激素组合用于黑荆树Acacia mearnsii叶片组织培养,结果表明在MS培养基中,6-BA 以0.5 mg/L、2,4-D 以1.5~2.0 mg/L 最 佳,MS+6-BA 0.5 mg/L +2,4-D 1.5 mg/L的愈伤组织诱导率高达60% 以上。在药用百合Liliusp.鳞茎增殖组培中,MS+6-BA 0.2 mg/L+2,4-D 0.4 mg/L是最适培养基[19]。在玉蕊Barringtoniaracemosa叶片愈伤组织诱导中,MS+2,4-D 1.5mg/L +Kinetin0.5 mg/L的诱导率达100%[20]。山楂树CrataegusazarolusL. var. aronia叶片在MS培养基中添加2,4-D 1.0 mg/L +BAP1.0 mg/L诱导愈伤组织最有效[21];在MS+2,4-D 2 mg/L + BAP 0.5 mg/L培养基中诱导浩浩巴树Simmondsiachinensis叶片20~22天获得愈伤组织[22]。这些结果与本文中的最佳植物生长调节剂比例培养基MS+2,4-D 1.0 mg/L +6-BA 0.5 mg/L一致。
对唇形科鼠尾草属两种植物Salvia officinalis和S. fruticosa的叶片组培发现较低的光密度(50 mmol·m-2s-1)促进愈伤组织产生并诱导形成体细胞胚[23]。在怀山药Dioscorea opposita叶片组培中,直接进行光培养,愈伤诱导率只有50~55%,先暗培养后再光培养叶片的愈伤组织诱导率可达100%,暗培养时间越长愈伤组织产量越大[24]。对苹果Maluspumila叶片组培发现,先暗培养14 d再光培养与先暗培养21 d再光培养叶片的愈伤组织诱导率都达100%,采用叶片远轴面接触培养基比近轴面接触培养基的愈伤诱导率高约25~30%[25]。白木香Aquilariasinensis叶片组培试验也表明暗培养和叶片背面接触培养基有利于愈伤组织诱导[26]。本文研究也认为暗环境条件有利于诱导膝柄木叶片愈伤组织。
膝柄木叶片外植体背面划痕可促进愈伤组织诱导为本文的新发现,在其它植物组培试验中尚未发现此类报道。主要原因是划痕能够增加外植体与培养基的有效接触,促进营养物质的吸收和细胞分裂与增殖。
本文的研究结论是在暗培养时间、叶片划痕数、2,4-D和6-BA四类因素中,暗培养时间对膝柄木叶片愈伤组织诱导率的影响最大,其次为2,4-D和划痕数,6-BA的作用不明显。
膝柄木叶片组培诱导愈伤组织最佳条件是:MS+2,4-D 1.0 mg/L+6-BA 0.5 mg/L,叶背划痕数4~5条,连续暗培养30天。
[1]张宏达, 粱盛业.中国卫矛科植物新记录的属-库林木属[J].中山大学学报: 自然科学版, 1981,(1):100-101.
[2]粱盛业.膝柄木属植物在我国首次发现[J].广西林业科技,1988,(1):33-34.
[3]李先琨.广西珍稀濒危植物优先保护评价[J]. 广西科学院学报 ,1997,13(3):9-16.
[4]H. Gillett.Forest occurring species of conservation concern: Review of status of information for FRA 2000 (July 2001)[M]. UNEP World Conservation Monitoring Centre, Cambridge, UK, 2001.
[5]汪 松,解 焱.中国物种红色名录[M].北京:高等教育出版社,2004.
[6]莫竹承,范航清,李蕾鲜,等.濒危植物膝柄木生存现状及其恢复对策[J].广西科学院学报,2008,24(2):134-137.
[7]尹淑莲,郭伟珍,林 艳,等.南蛇藤试管苗生根培养基及移栽基质的筛选[J].林业科学,2006,31(3):5-7.
[8]郭伟珍,林 艳,邢存旺,等.南蛇藤的组织培养和快速繁殖[J]. 植物生理学通讯,2005, 41(5):645.
[9]马 艳,肖娅萍, 胡雅琴.苦皮藤组织培养与植株再生[J].中草药 ,2003,34(10):4-7.
[10]福 圊,刘贤旺.云南美登木的组织培养[J].江西中医学院学报 ,1991,3(2):42-43.
[11]程治英,王锦亮,蒙桂英.美登木的茎段培养[J]. 植物生理学通讯 ,1984,(2):38.
[12]邱运亮,段鹏慧,赵 华.植物组培快繁技术[M].北京:化学工业出版社,2010.
[13]高宇琼,赖钟雄.金花茶体胚和叶片愈伤组织培养[J].亚热带农业研究,2010,6(2):130-135.
[14]上官新晨,郭春兰,蒋 艳,等.培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究[J].江西农业大学学报,2006, 28(5): 678-682.
[15]J. M. P. Porto,P. Duarte, R. Paiva,et al. Induction and Characterization of embryogeneic callus in Cotyledons Leaves ofTabebuiaroseo alba[J]. Journal of Agricultural Science and Technology B 2(2012), 950-955.
[16]LIN Na, YUHAN Kai-zong, XIAO Li-na,et al.Study on the Callus Induction of WildArabidopsis thalianaLeaves[J].Agricultural Science & Technology, 2011,12(1):82-84,107.
[17]张丽杰,赵丽蒙,韩冬雪,等.珍贵阔叶树种刺楸离体繁殖技术[J].经济林研究,2014,32(4):127-134.
[18]唐佳佳,尚旭岚,洑香香.黑荆树愈伤组织诱导、增殖与分化[J].中南林业科技大学学报,2014,34(9):38-43.
[19]金亚征,俞凤芳,车瑞香,等.药用百合组织培养快繁技术研究[J].经济林研究,2013,31(1):124-128.
[20]Z. D. Dalila,H. Jaafar and A. A. Manaf. Effects of 2,4-D and kinetin on callus induction ofBarringtonia racemosaleaf and endosperm explant in different types of basal media[J].Asian Journal of Plant Sciences,2013,12(1):21-27.
[21]G. Chaâbani,J. Tabart,C. Kevers,et al. Effects of 2,4-dichlorophenoxyacetic acid combined to 6-Benzylaminopurine on callus induction, total phenolic and ascorbic acid production,and antioxidant activities in leaf tissue cultures ofCrataegusazarolusL. var. aronia[J]. Acta Physiologiae Plantarum, 2015,37(16):
[22]S. Cumar, M. Mangal, A. K. Dhawan,et al. Callus induction and plant regeneration from leaf explants of jojoba[J]. India Journal of Biotechnology,2013,12:544-547.
[23]S. Kintzios, A. Nikolaou, M. Skoula. Somatic embryogenesis and in vitro rosmarinic acid accumulation in Salvia officinalis andS. fruticosaleaf callus cultures[J]. Plant Cell Reports, 1999, 18:462-466.
[24]郭君丽,王俊甫,蒋福稳,等.光质和2,4-D对47号怀山药叶片愈伤组织诱导形成的影响[J].北方园艺,2012,(15):174-176.
[25]崔 美,焦其庆,陈学森,等.苹果叶片愈伤组织的诱导培养[J].山东农业科学,2012,44(3):17-20.
[26]林 超,马新业,刘 锋,等.白木香叶片外植体愈伤组织诱导研究[J].北方园艺,2013, (8):97-100.
Study on callus induction ofBhesa robustaleaves
MO Zhu-cheng1,2, PANG Wan-wei3, LIU Jue3, LI Bin3
(1.Guangxi Mangrove Research Center,Guangxi Academy of Science, Beihai 536000, Guangxi, China; 2.Guangxi Key Lab of Mangrove Conservation, Beihai 536000, Guangxi, China; 3. Beihai Municipal Forestry Bureau, Beihai 536000, Guangxi, China)
To urgently conserve the national endangered plantBhesa robusta, a leaf tissue culture experiment under 4 factors condition of abaxial scratch, MS medium supplement with vary concentration of auxin 2,4-D andcytokinin 6-BA , dark culture period was carried on. The experiment was designed in L3(43) orthogonality experiment, 3 replicates. The results showed the ranking of factors activity to induce callus is Dark culture period > 2,4-D > abaxial scratch, the effect of cytokinin 6-BA is not significanctly. InB.robustaleaf tissue culture experiment, the optimum combination factors for callus induction is MS medium + 2,4-D1.0 mg/L + 6-BA0.5 mg/L, leaf abaxial scratchs = 4~5, about 30 days continuously culture in dark environment.
Bhesa robusta; leaf segments; callus; induction rate
S722.3+7
A
1673-923X(2015)10-0013-05
10.14067/j.cnki.1673-923x.2015.10.003
2015-04-22
中央财政林业补助资金项目(GXZC2015-G2-0021-JY);广西科学研究与技术开发计划课题(桂科转1346004-32);广西自然基金项目(2010GXNSFA013068);北海市科技项目(北科合201203033)
莫竹承,副研究员;E-mail:mo_zhucheng@126.com
莫竹承,庞万伟,刘 珏,等. 膝柄木叶片诱导愈伤组织研究[J].中南林业科技大学学报,2015, 35(10): 13-17, 39.
[本文编校:吴 彬]
