口腔黏膜下纤维性变中碱性成纤维细胞生长因子和CD34的表达及意义*
2015-12-16刘德裕翦新春徐普朱蓉周超王媛
刘德裕,翦新春,徐普,朱蓉,周超,王媛
(1.中南大学湘雅医学院附属海口医院口腔医学中心,海南 海口 570208;2.中南大学湘雅医院口腔颌面外科,湖南 长沙 410008)
·论著·
口腔黏膜下纤维性变中碱性成纤维细胞生长因子和CD34的表达及意义*
刘德裕1,翦新春2,徐普1,朱蓉1,周超1,王媛1
(1.中南大学湘雅医学院附属海口医院口腔医学中心,海南 海口 570208;2.中南大学湘雅医院口腔颌面外科,湖南 长沙 410008)
目的评价不同阶段口腔黏膜下纤维性变(OSF)的CD34和碱性成纤维生长因子(bFGF)表达及其在计数新生血管中的价值。方法30例OSF患者纳入本研究,免疫组织化学法检测CD34和bFGF表达,根据CD34和bFGF染色强度计数口腔黏膜组织新生血管数目。结果采用CD34评价时,对照组及早、中、晚期OSF的平均血管密度(MVD)分别为42.08、20.48、17.40和14.85。采用bFGF评价时,对照组及早、中、晚期OSF的MVD分别为32.50、15.55、13.88和14.50。OSF组和对照组的MVD比较,差异有统计学意义(P=0.000)。对照组上皮细胞层厚度(ET)(高倍镜下上皮细胞数)为20~37,平均32.90。OSF组平均ET值为16.10。OSF组和对照组ET值比较,差异有统计学意义(P=0.000)。早、中、晚期OSF的平均ET值分别为15.45、17.29和9.50。结论随着OSF进展,MVD和ET显著降低。
碱性成纤维生长因子;CD34;口腔黏膜下纤维性变
1950年口腔黏膜下纤维性变(oral submucous fibrosis,OSF)首先在印度被发现,OSF是一种口腔慢性癌前病变,临床上表现为口干、灼痛、进食刺激性食物疼痛、进行性张口受限、吞咽困难等[1]。随着OSF进展,患者口腔上皮萎缩和表皮突丢失。一般认为,OSF上皮萎缩是由结缔组织基质中血管减少导致血液灌注缺少引起。最近有研究表明,OSF进展过程中血管数量并没有减少[2]。
目前,OSF的血管分布程度仍然存在争议,虽然不能直接检测新生血管数量,但是可以通过检测CD34、CD31和CD105等内皮细胞标记物计算平均血管密度(mean vascular density,MVD),从而间接反映新生血管生成。CD34为人类造血祖细胞抗原,是高度糖基化的i型跨膜糖蛋白,分子量为110 kD。CD34也是重要的血管生成标记物,能够反映组织微血管密度[3]。CD34在造血干细胞、内皮细胞、间质细胞及真皮层树突细胞中表达,分布在血管周围和神经鞘内。免疫组织化学法检测显示,CD34主要在小血管或新生血管、内皮及肿瘤内皮细胞中表达[4]。
碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、血小板衍生生长因子(platelet derived growth factor,PDGF)及低氧诱导因子(hypoxia inducible factor,HIF)等生长因子在维持OSF结缔组织血管完整性中发挥重要作用。成纤维细胞生长因子(fibroblast growth factor,FGF)是一种肝素结合蛋白(heparin-binding protein,HBP),FGF的信号传导需要FGF与细胞表面乙酰肝素蛋白聚糖的结合[5]。FGF家族包括22个成员,所有成员都能通过促进内皮细胞增殖及形成管状结构,从而促进血管生成。bFGF不但能促进血管形成,还能促进多种细胞有丝分裂[6]。
本研究采用免疫组织化学法检测OSF中CD34和bFGF的表达,并根据CD34和bFGF的免疫组织化学法检测结果对OSF组织中新生血管进行定量分析。比较不同组织学分级OSF的平均血管密度,并探讨不同组织学分级OSF中CD34和bFGF的表达意义及相关性,旨在进一步阐明微血管系统在OSF进展中的作用。
1 资料与方法
1.1 研究对象
选取2014年1月-2014年12月在中南大学湘雅医学院附属海口医院口腔科就诊,经临床和病理确诊的OSF患者30例为实验组,取患者口腔颊部黏膜。其中男性19例,女性11例;平均年龄42.5岁。对照组10例标本取自本院口腔外科拔除埋伏阻生牙的健康口腔黏膜,所有健康志愿者无槟榔咀嚼史。30例OSF组织样本中,早期11例,中期17例,晚期2例。对照组包括7例男性和3例女性,平均年龄30.6岁。30例OSF患者中,17例患者(56.7%)有槟榔咀嚼史,12例患者(40.0%)吸烟时咀嚼槟榔。
1.2 免疫组织化学法
所有标本4μm石蜡连续切片,60℃烤片2 h,常规脱蜡至水,30 ml/L过氧化氢灭活内源过氧化物酶10 min,0.1 mol/L磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤,枸橼酸修复液(pH=6.0)微波加热修复15 min,0.1 mol/L PBS洗涤,正常山羊血清封闭液封闭15min,滴加CD34或bFGF抗体,常温放置30 min,4℃湿盒过夜,0.1 mol/L PBS洗涤,滴加二抗工作液室温孵育20 min,0.1 mol/L PBS洗涤,滴加辣根酶标记链霉卵自素工作液,37℃孵育20 min,0.1 mol/L PBS洗涤。滴加新鲜配制的二氨基联苯胺(Diaminobenzidine,DAB),高倍镜下控制染色,充分水洗终止反应,苏木精复染、透明、脱水,中性树脂封片。免疫组织化学法染色以背景清晰及胞浆、胞膜上出现棕黄色颗粒为CD34或bFGF阳性结果;组织细胞仅为淡淡的浅黄背景,无棕黄色颗粒为CD34或bFGF阴性结果。高倍镜下(×200)每张切片采集5个视野,计算每个视野内细胞总数及阳性细胞数,得到阳性细胞的百分率(阳性细胞的百分率=阳性细胞数/计数细胞总数×100%),取平均值。按阳性细胞数所占比例不同分为4级:无染色或阳性率<5%为阴性(-),6%~30%为阳性(+),31%~50%为较强阳性(++),>50%为强阳性(+++)。以已知CD34或bFGF阳性切片为阳性对照,0.01 mol/L PBS代替一抗为阴性对照组。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,计数资料以率表示,用χ2检验和Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学法
CD34蛋白及bFGF阳性细胞的胞膜或胞质呈棕黄色,主要表达于上皮基底细胞和血管内皮细胞上,而成纤维细胞极少见其表达分布。CD34蛋白在正常口腔黏膜组织和OSF组织中的阳性表达率分别为90%(9/10)和30%(9/30),OSF组显著低于对照组(χ2=14.697,P<0.05)(见图1);bFGF蛋白在正常口腔黏膜组织和OSF组织中的阳性表达率分别为80%(8/10)和23.3%(7/30),OSF组显著低于对照组(χ2=21.372,P<0.05)(见图2)。

图1 免疫组织化学法检测CD34的表达(×200)
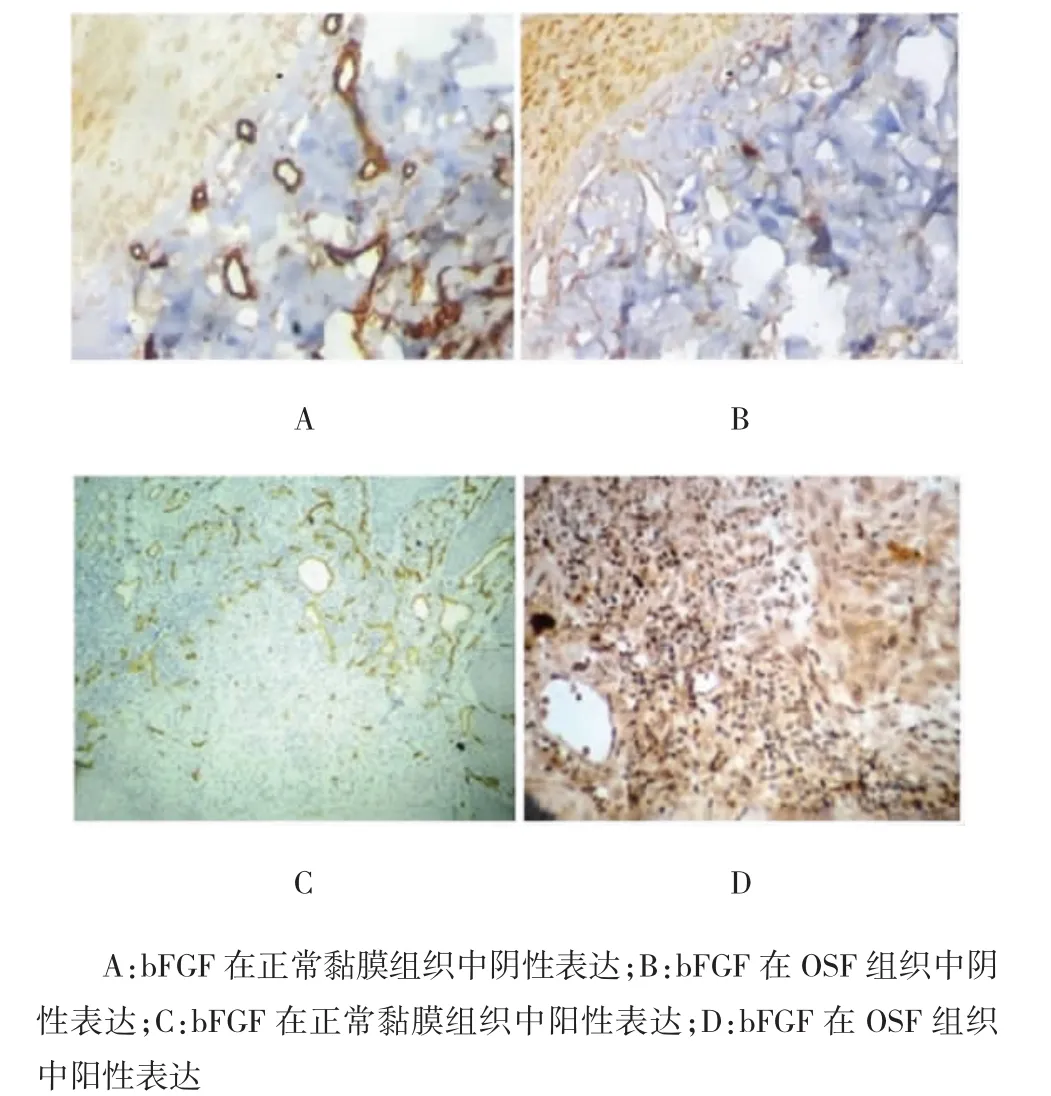
图2 免疫组织化学法检测bFGF的表达(×200)
2.2 OSF组织中的新生血管分布
本实验根据CD34和bFGF免疫组织化学法的阳性染色强度,评估受试者口腔黏膜组织中新生血管分布。采用CD34评价时,对照组及早、中、晚期OSF的MVD分别为42.08、20.48、17.40和14.85。采用bFGF评价时,对照组及早、中、晚期OSF的MVD分别为32.50、15.55、13.88和14.50。OSF组和对照组的MVD比较,差异有统计学意义(P=0.000)。见图3。
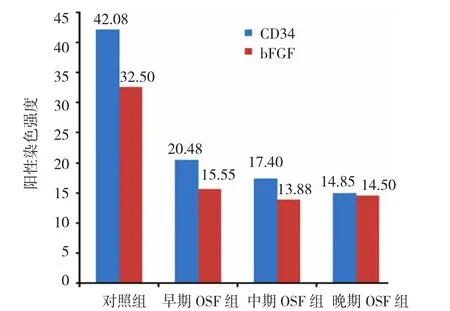
图3 OSF组织中的新生血管分布
2.3 上皮细胞层厚度
对照组上皮细胞层厚度(epithelial cell layer thickness,ET)(高倍镜下上皮细胞数)为20~37,平均32.90。OSF组平均ET值为16.10。由于OSF组ET值大致为对照组的1/2,因此可以将对照组ET值(32.90)的1/2作为上皮萎缩临界值。OSF组和对照组ET值比较,差异有统计学意义(P=0.000)。早、中、晚期OSF的平均ET值分别为15.45、17.29和9.50。早、中、晚期OSF的ET值与对照组比较,差异有统计学意义(P=0.002、0.000和0.014)。见图4。
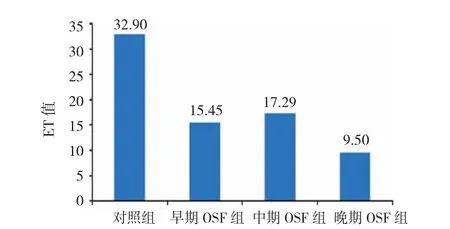
图4 各组平均ET值比较
3 讨论
OSF是影响口腔黏膜的潜在慢性纤维化病变,少数情况下也会影响咽部和食管上段[7]。随着疾病发展,上皮和黏膜纤维化导致口腔黏膜及深层组织僵硬,张口和舌活动受限,造成吃饭、吞咽、发声困难。上皮细胞发育不良和萎缩是晚期OSF的标志。
目前,OSF血管形成机制仍然存在争论。一般认为随着OSF进展,灌注缺失,上皮萎缩导致血管减少。近期有研究表明,疾病进展期并没有明显减少血管[2]。血管不能直接计数,但是可以通过血管生成标志物间接测量。本研究采用CD34和bFGF评估OSF血管数目。
平均血管密度是微血管计数平均值,是通过显微镜观察一定区域内(3或4个视野)的血管计数得到,主要选择有血管的区域(热点)进行计数。本实验中,CD34计数所得微血管数比bFGF多,提示CD34表达是评估肿瘤血管数量的更可靠方法。以往有研究表明,CD34作为标志物比血管性假血友病因子和凝血因子Ⅷ更好[8]。方厂云等[9]研究分析OSF组织中黏膜血管分布,表明微血管增生发生在早期OSF,中期和晚期反而显著减少。本实验结果表明,MVD与不同阶段OSF相关,与对照组比较,MVD显著减少。CD34计数MVD时,早、中、晚期OSF的血管数量逐渐减少,bFGF计数也同样逐渐减少,与方厂云等[9]的研究结果一致。本研究也显示,bFGF计数MVD时,晚期OSF略高于中期,这可能是由于晚期样本量较少导致。
与之相反,DESAI等[10]采用免疫组织化学法计算MVD,发现MVD随着疾病进展而增加。RAJENDRAN等[2]通过图像分析也发现OSF组的MVD与对照组比较,差异无统计学意义,认为MVD增加是黏膜组织短暂性缺血、缺氧的适应性反应。DESAI等[10]采用CD34阳性细胞计数发现血管数目增加,从而推测恶变时,血管增长在肿瘤增殖中发挥重要作用。本研究结果表明,OSF组的MVD明显低于对照组,差异有统计学意义,与DESAI等[10]的研究结果不一致。本实验结果还表明,OSF组的ET值与对照组比较,差异有统计学意义。同时,进展阶段OSF的ET值显著低于对照组,与DESAI等[10]的研究结果相似。
大多数研究中,瘤内高MVD常常和不良组织学预后相关。PAZOUKI等[11]也报道血管减少常发生在正常组织向发育异常早期癌症阶段的转变过程中。笔者推测,OSF进展阶段血管减少导致短暂性缺血、缺氧,而缺氧使细胞外基质增加,从而在纤维化过程中起重要作用。肾纤维化体外研究发现,缺氧能够刺激成纤维细胞增殖,促进细胞外基质(extracellular matrixc,ECM)蛋白(Ⅰ型胶原、Ⅲ型胶原和纤连蛋白)、组织抑制因子-1(tissue inhibitor of matrix metalloprotease-1,TIMP-1)和组织抑制因子-3(tissue inhibitor of matrix metalloprotease-3,TIMP-3)mRNAs表达,抑制MMP-1 mRNA水平,与ECM的积累一致。TILAKRATNE等[12]注意到OSF成纤维细胞和内皮细胞中HIF-1α表达上升,提示缺氧在OSF中具有重要意义。因此,认为基质玻璃样变和随之发生的上皮细胞缺氧会导致上皮缺血性萎缩。但与RAJENDRAN等[2]的观点不一致,推测诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)可能在OSF上皮萎缩中起作用,认为细胞缺少是由于角质细胞和基质细胞的细胞毒性和基因毒性作用。本研究证实TILAKRATNE等[12]的观点,即真皮层纤维化和血管减少伴随细胞因子活动变化,为烟草和槟榔中的致癌物质创造一个独特的环境,从而作用于上皮细胞。可以认为槟榔中致癌物长时间积累在上皮组织下,使得致癌物可以长时间作用于上皮组织而不侵入到更深层中。同时,血管减少也会减慢致癌物吸收到体循环中。
笔者谨慎地认为除基质纤维化和血管减少外,致癌物积累也会影响已经受累的上皮细胞。上皮细胞发育异常及侵入到结缔组织,为肿瘤细胞迅速生长创造良好的微环境。血管生长因子释放导致血管生成和肿瘤细胞增殖,这也可以解释OSF恶变过程中MVD上升的机制。DESAI等[10]发现,CD34阳性基质细胞减少或缺失,尤其在OSF近上皮位置,与正常黏膜CD34阳性基质细胞均一分布不同。本实验结果显示,近上皮和基质内CD34阳性基质细胞完全缺失。但是与DESAI等[10]发现正常黏膜CD34阳性基质细胞均一分布相反,本研究未发现CD34阳性基质成纤维细胞。这可能是由于方法差异导致,包括内皮标志物敏感性。本研究结果表明,bFGF免疫反应性在成纤维细胞和早期OSF组织上皮细胞中升高,在晚期纤维化基质中bFGF表达显著降低,与BISHEN等[13]的研究结果一致。不同阶段OSF血管减少以及明显ET改变进一步证实灌注缺少可导致上皮细胞萎缩,进而引起上皮细胞发育异常。
总之,本研究有助于更好地理解OSF的发生、发展,及OSF发生、发展过程中CD34和bFGF的具体作用机制。本研究为CD34和bFGF作为OSF的诊断标志物、治疗靶点及临床预后提供基础实验数据。
[1]翦新春,郑廉.口腔黏膜下纤维性变研究进展[J].中国实用口腔科杂志,2011,4(2):21-26.
[2]RAJENDRAN R,PAUL S,MATHEWS PP,et al.Characterisation and quantification of mucosal vasculature in oral submucous fibrosis[J].Indian J Dent Res,2005,16(9):83-91.
[3]SIDNEY LE,BRANCH MJ,DUNPHY SE,et al.Concise review: evidence for CD34 as a common marker for diverse progenitors[J]. Stem Cells,2014,32(6):1380-1389.
[4]YE Y,LIU X.Recent advances in research on CD34+cell proliferation[J].Journal of Brain Science,2013,41(7):37-47.
[5]ORNITZ DM,ITOH N.The fibroblast growth factor signaling pathway[J].Wiley Interdisciplinary Reviews Developmental Biology,2015,4(3):215-266.
[6]武艳,杨岚,张羽飞,等.bFGF对成纤维细胞增殖和胶原及纤维连接蛋白的影响[J].医药导报,2014,18(11):21-24.
[7]王金龄.活血化瘀解毒法治疗老年口腔黏膜下纤维化96例[J].中国老年学杂志,2013,33(12):2970-2971.
[8]GUTTMAN D,STERN Y,SHPITZER T,et al.Expression of MMP-9,TIMP-1,CD-34 and factor-8 as prognostic markers for squamous cell carcinoma of the tongue[J].Oral Oncol,2004,40(9): 798-803.
[9]方厂云,韩为农,冯德云.口腔粘膜下纤维性变微血管形态定量分析[J].湖南医科大学学报,2000,25(1):55-57.
[10]DESAI RS,MAMATHA GS,KHATRI MJ,et al.Immunohistochemical expression of CD34 for characterization and quantification of mucosal vasculature and its probable role in malignant transformation of atrophic epithelium in oral submucous fibrosis[J]. Oral Oncol,2010,46(9):553-558.
[11]PAZOUKI S,CHISHOLM DM,ADI MM,et al.The association between tumour progression and vascularity in the oral mucosa[J]. J Pathol,1997,183(23):39-43.
[12]TILAKARATNE WM,IQBAL Z,TEH MT,et al.Upregulation of HIF-1alpha in malignant transformation of oral submucous fibrosis[J].J Oral Pathol Med,2008,37(9):372-377.
[13]BISHEN KA,RADHAKRISHNANR,SATYAMOORTHYK. The role of basic fibroblast growth factor in oral submucous fibrosis pathogenesis[J].J Oral Pathol Med,2008,37(11):402-411.
(申海菊 编辑)
Expression of CD34 and basic fibroblast growth factor and its significance in oral submucous fibrosis*
De-yu LIU1,Xin-chun JIAN2,Pu XU1,Rong ZHU1,Chao ZHOU1,Yuan WANG1
(1.Stomatology Center,the Affiliated Haikou Hospital,Xiangya Medical School,Central South University,Haikou,Hainan 570208,P.R.China;2.Department of Oral and Maxillofacial Surgery,Xiangya Hospital,Central South University,Changsha,Hunan 410008,P.R.China)
【Objective】To evaluate the immunoreactivity of CD34 and basic fibroblast growth factor (bFGF)in different histological grades of oral submucous fibrosis(OSF).【Methods】A total of 30 cases of OSF were included in the study and mean vascular density(MVD)was calculated using CD34 and bFGF.【Results】Using CD34,MVD in the controls,the early OSF,the moderately advanced OSF and the advanced OSF was 42.08,20.48,17.40 and 14.85,respectively.As evidenced by bFGF expression,MVD in the controls,the early OSF,the moderately advanced OSF and the advanced OSF was 32.50,15.55,13.88 and 14.50,respectively.The difference in MVD between the cases and the controls was statistically significant(P =0.000).Epithelium thickness(ET)in the controls was in the range of 20~37 with the mean ET of 32.90 while the OSF cases showed mean ET of 16.10.The ET was statistically different between the OSF cases and the controls(P=0.000)as the mean ET was 15.45 in the early OSF,17.29 in the moderately advanced OSF and 9.50 in the advanced OSF.The correlation of ET amongst different stages of OSF and controls was also statistically significant.【Conclusion】Mean vascular density and ET significantly decrease as OSF advances.
basic fibroblast growth factor;CD34;oral submucous fibrosis
R739.85;R781.59
A
1005-8982(2015)29-0007-05
2015-06-25
国家自然科学基金(No:81260166)
翦新春,E-mail:jianxinchun@hotmail.com
