菰黑粉菌分离方法的研究
2015-12-07曹乾超张雅芬崔海峰俞晓平叶子弘
曹乾超,张雅芬,崔海峰,俞晓平,叶子弘
(中国计量学院生命科学学院/浙江省生物计量及检验检疫技术重点实验室,杭州,310018)
茭白(Zizania latifolia)为禾木科菰属多年生宿根草本植物,广泛种植于太湖一带的江苏、浙江两省[1]。作为我国仅次于莲藕的第二大水生蔬菜,茭白具有很高的经济价值和营养价值。分析表明,茭白膨大的肉质茎内含有较多蛋白质、膳食纤维及钾、钠、镁等元素[2]。除此之外,茭白还含有一些药用成分,对高血压、心脏病等的防治大有裨益[3]。茭白孕茭是茭白植株与专一性寄生在其体内的菰黑粉菌(Ustilago esculenta)共同作用的结果。形成的可食用肉质茎为正常茭,另有肉质茎内布满褐色孢子堆为灰茭[3,4]。研究表明,寄生于正常茭和灰茭的菰黑粉菌属于两种不同类型,其中与正常茭白共生的菰黑粉菌为MT(mycelia-teliospore)型,多以菌丝形态存在;而侵染灰茭的菰黑粉菌为T(teliospore)型[3],其菌丝潜育期较短。由于灰茭中布满菰黑粉菌孢子堆,故分离灰茭中的菰黑粉菌方法比较成熟,常通过挑取菰黑粉菌孢子堆并稀释涂布的方法[5~7]进行分离培养。而正常茭白中菰黑粉菌多以菌丝态存在,分离较为困难,目前尚未有详细的分离方法报道。
菰黑粉菌的分离是研究菰黑粉菌种群与茭白品种表型相关性以及茭白孕茭机制的基础,因此建立标准、快速、有效的菰黑粉菌分离方式具有重要意义。本研究分别采用切片、研磨两种方法从正常茭白中分离得到菰黑粉菌,通过扩增其ITS-5.8S rDNA序列进行鉴定,并对2种分离方法进行比较,结果表明,2种方法均能分离得到菰黑粉菌,但是对于新鲜组织,研磨法分离效率较高,而对于放置较久的样品,切片方法可以更好地控制杂菌污染,所以可以根据茭白组织的新鲜程度选择合适的分离方法。
1 材料与方法
1.1 试验材料
本研究以浙江茭白品种龙茭2号正常茭为试验材料。
1.2 试剂
Taq 酶、dNTP、10×PCR buffer、pMD19-T Vector、solutionⅠ购自宝生物工程(大连)有限公司,真菌DNA提取试剂盒、DNA胶回收试剂盒、羧苄青霉素、卡那青霉素均购自生工生物工程(上海)有限公司,大肠杆菌DH5α为本实验室保存。
1.3 培养基
YEPS双抗固体培养基:酵母粉10 g,蛋白胨20 g,蔗糖20 g,加蒸馏水溶解后定容至1 000 mL,分装,每100 mL液体培养基中加入1.5 g琼脂,高压灭菌,使用过程中加入羧苄青霉素和卡那霉素至终浓度为100 ng/mL。
1.4 试验方法
①菰黑粉菌的分离 剥掉新鲜茭白肉质茎外包裹的叶鞘,流水冲洗,再用蒸馏水冲洗,晾干。在超净工作台上,按无菌操作方法进行以下操作:先在无菌滤纸上将茭白切成适宜大小,用75%乙醇浸泡30 s,再放入无菌水中洗涤30 s,用无菌滤纸吸干水分,切去外皮,保留白嫩部分。
a.切片分离法将白嫩组织切成0.5 cm×0.5 cm×0.2 cm的薄片,贴在YEPS双抗培养基上,每皿贴8~10片,用封口膜将培养皿密封,先正置于28℃恒温培养箱中,2~3 h后倒置培养。
b.研磨分离法将白嫩组织切成薄片,取4~5片置于灭菌研钵中,加入1 mL灭菌水,将组织研碎,吸取200 μL汁液均匀涂布于YEPS双抗培养基上,用封口膜将培养皿密封,倒置于28℃恒温培养箱中培养。
②形态鉴定 待YEPS双抗培养基上长出菌株后,肉眼观察菌落形态,同时用牙签挑取菌落置于无菌水中,取10 μL菌液置光学显微镜下观察。
③分子鉴定 a.基因组DNA的提取。挑取纯培养物在YEPS固体培养基上划线,3 d后,用真菌DNA提取试剂盒提取基因组DNA。
b.ITS-5.8S rDNA序列的PCR扩增。应用真菌通用引物ITS1和ITS4扩增两种方法分离得到菌株的ITS-5.8S rDNA,引物由杭州擎科梓熙生物技术有限公司合成(表1)。
PCR 反应体系为:10×PCR buffer 5 μL,dNTP 4 μL,Primer ITS1 1 μL,Primer ITS4 1 μL,template 1 μL,Taq 酶 0.5 μL,加ddH2O至50 μL。PCR反应程序为94℃4 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min;4℃ forever。
c.琼脂糖凝胶电泳。向PCR扩增产物中加入适量6×loading buffer,1%琼脂糖凝胶电泳检测,凝胶成像仪观察并拍照。
d.TA克隆及序列分析。将目的条带割胶回收,回收产物与pMD19-T载体连接,连接体系为:回收产物 4.5 μL,solutionⅠ5 μL,pMD19-T 0.5 μL。连接产物转化感受态 DH5α,37℃培养 12~14 h后,挑取单菌落,进行菌落PCR验证。将含有目的基因的菌液送至杭州擎科梓熙生物技术有限公司进行序列测定,测序结果在NCBI数据库中进行BLAST比对。
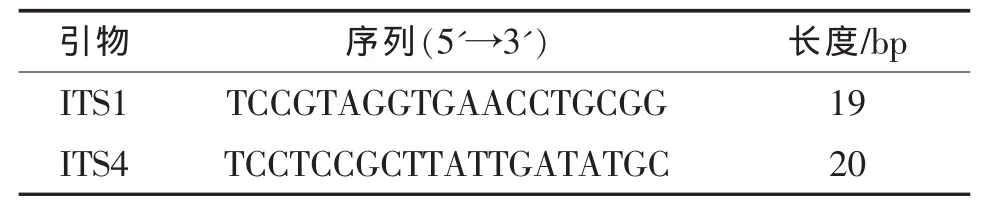
表1 引物ITS1和ITS4的序列信息
2 结果与分析
2.1 菰黑粉菌的分离及形态特征
①切片分离法 在YEPS双抗培养基上培养4~5 d后茭白组织开始呈现褐色,7~9 d后,茭白切片与平板接触面处长出淡黄色的菌落(图1)。
②研磨分离法 在YEPS双抗培养基上培养5 d后,肉眼即可观察到微小的菌落形成,培养7~9 d后长出淡黄色菌落伴有向四周延伸的白色菌丝(图1)。
挑取菌落至新的YEPS双抗培养基上,28℃纯化培养,2~3 d后长出淡黄色菌落,4 d后菌落周围长出白色菌丝(图2A),显微镜下观察发现菰黑粉菌存在2种形态:一种为酵母型,短杆状,芽殖;一种为菌丝型,中间部分呈透明状(图2B)。
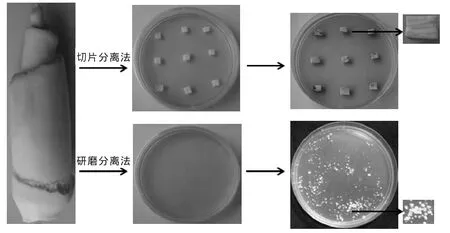
图1 切片、研磨法分离菰黑粉菌示意
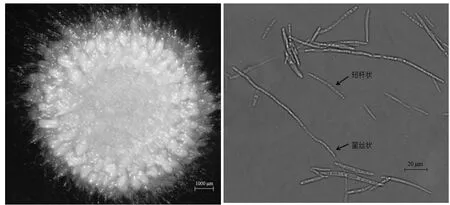
图2 菰黑粉菌形态观察
2.2 菰黑粉菌的分子鉴定
将用切片法和研磨法分离得到的菌株提取DNA,对其ITS-5.8S rDNA序列进行扩增克隆并测序,扩增片段大小均在750 bp左右,结果见图3。测序结果在NCBI数据库中进行BLAST比对,结果表明,与菰黑粉菌(序列号:AB211915.1)的相似度为96%,具有较高同源性,可认定为菰黑粉菌。新鲜程度,根据不同的样品选择合适的方法。
茭白的产生与菰黑粉菌的侵染密切相关,因此对菰黑粉菌的研究将有利于明确茭白的孕茭机理及灰茭的形成机制。在分离得到菰黑粉菌的基础上,后续能够有效地针对菰黑粉菌展开相关试验,从而揭示菰黑粉菌的种群特点及其在茭白植株中的作用机制。
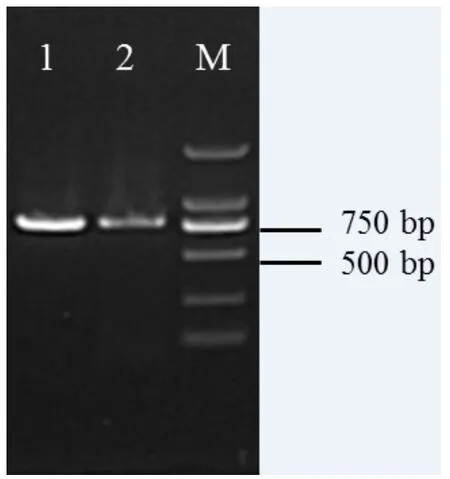
图3 菰黑粉菌ITS-5.8S rDNA序列扩增
3 讨论与结论
传统的真菌鉴定主要从真菌的孢子形态、菌落特征、生理生化特征等方面进行,而真菌种类繁多,这些早已无法满足真菌分类鉴定的需求。随着现代分子生物学的发展,基于rDNA-ITS多态性的序列分析成为真菌分类及鉴定研究的热点[8,9]。由于真菌通用引物ITS1和ITS4既能扩增内转录间隔区ITS1和ITS2,又能扩增其间高度保守的5.8S rDNA,广泛应用于真菌的分子鉴定。
植物内生真菌的分离方法有很多,针对不同的内生真菌各有不同[10]。目前对菰黑粉菌的研究刚刚起步,其分离方法尚不成熟。本研究采用切片、研磨2种方法从新鲜的正常茭中分离菰黑粉菌,经形态及分子生物学方法鉴定为菰黑粉菌。试验过程中应当注意,正常茭白组织最好是新鲜的。另外,试验过程中发现,新鲜的茭白组织通过研磨更容易分离出菰黑粉菌;若茭白组织长时间放置,茭白表面容易孳生霉菌,研磨分离容易污染,而切片分离法则能够较好的分离。因此,在试验中应当注意试验样品
[1]Guo H B,Li S M,Peng J,et al.Zizania latifolia Turcz.cultivated in China[J].Genetic Resources and Crop Evolution,2007,54(6):1211-1217.
[2]翟成凯,孙桂菊,陆琮明,等.中国菰资源及其应用价值的研究[J].资源科学,2000,22(6):22-26.
[3]You W Y,Liu Q,Zou K Q,et al.Morphological and molecular differences in two strains ofUstilago esculenta[J].Current microbiology,2011,62(1):44-54.
[4]Zhang J Z,Chu F Q,Guo D P,et al.Cytology and ultrastructure of interactions betweenUstilago esculentaandZizania latifolia[J].Mycological Progress,2011,11(2):499-508.
[5]李志兰,尤文雨,邹克琴,等.菰黑粉菌孢子萌发过程形态学观察及系统发育研究[J].中国计量学院学报,2010(2):140-145.
[6]赵海伟,邹克琴,叶子弘,等.菰黑粉菌的分离鉴定研究[J].中国新技术新产品,2010(4):22.
[7]Chan Y S,Thrower L B.The host-parasite relationship betweenZizania laducifloraTrucz.andUstilago esculentaP.Heen.III.Carbohydrate metabolism ofU.esculentaand the host-parasite combination[J].Phytol New,1980(85):217-224.
[8]燕勇,李卫平,高雯洁,等.rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志,2008(10):1 958-1 961.
[9]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007(13):3 785-3 792.
[10]王利娟,贺新生.植物内生真菌分离培养的研究方法[J].微生物学杂志,2006(4):55-60.
