血小板衍生生长因子BB亚型在毕赤酵母中的表达及纯化
2015-11-29房婷张晓鹏章晟戴萌萌杨秀旭付玲于长明
房婷 ,张晓鹏,章晟,戴萌萌,杨秀旭,付玲,于长明
1.军事医学科学院科学院 生物工程研究所,北京 100071;2.北京军区总医院 附属八一儿童医院,北京 100700
血小板衍生生长因子(platelet-derived growth factor,PDGF)是一种耐热、耐酸及易被胰蛋白酶水解的阳离子糖蛋白,主要由成熟的血小板分泌,1974年由Ross 等首先从血小板中获得[1]。PDGF 作为一种有丝分裂促进剂,可以刺激成纤维细胞和平滑肌细胞的分裂和趋化功能、促进巨噬细胞产生和分泌生长因子,在胚胎发生、创伤愈合、动脉硬化及恶性肿瘤等体内多个病理、生理过程中均发挥重要作用,尤其在创伤愈合方面作用更为显著[2-8]。PDGF 是阳离子糖蛋白,相对分子质量为28×103~35×103,等电点为9.8,由A、B 两条肽链通过二硫键构成同型或异型的二聚体[9]。PDGF 家族有5 个亚型,即PDGF-A(AA)、PDGF-B(AB 和BB)、PDGF-C(CC)和PDGFD(DD)[10];5 个亚型通过2 种特异性受体(PDGF receptor,PDGFR)α和β调节多种细胞功能[11]。
重组人PDGF-BB(rhPDGF-BB)的相关研究展现出良好的临床应用前景,受到广泛关注[12]。1997年美国FDA 批准Regranex 上市,用于慢性糖尿病引发的神经性溃疡的治疗,其活性成分就是酿酒酵母表达的0.01%的rhPDGF-BB。N 端氨基酸分析表明,从人血小板提取物中分离纯化的PDGF-BB 存在3 种不同的剪切形式,即20%的Ser1、45%的Thr6 及35%的Thr33,这些切割的异质性导致PDGF 的不均一性[13]。酿酒酵母表达的109 个氨基酸的重组PDGF-BB,N 端氨基酸序列同样存在2 种形式,即109 个氨基酸的全长B 链和104 个氨基酸的缺失B链Thr6-PDGF-BB,使得PDGF-BB 的精确质量控制较困难,而且104个氨基酸的B 链蛋白保持与109个氨基酸同样的生物学活性[14]。
在本研究中,我们采用巴斯德毕赤酵母(Pichia pastoris)表达系统,构建了104个氨基酸的PDGF-BB基因,并进行了高密度发酵培养,利用三步层析对发酵上清进行纯化,并对蛋白进行初步鉴定和生物学活性测定,获得了适于毕赤酵母表达系统的、适度糖基化且纯度和生物学活性符合要求的rhPDGF-BB。
1 材料与方法
1.1 材料
人早幼粒白血病细胞系HL-60 细胞为本室保存;BALB/c 小鼠3T3 细胞株购自中国药品生物制品检定所;毕赤酵母GS115、大肠杆菌DH5α由本室保存;pMEX9K由本实验室构建并保存。
限制性内切酶、T4DNA 连接酶购自Promega 公司;TRIzol 总RNA 提取试剂盒为Gibco 公司产品;低分子量蛋白标准购自Sigma 公司;YNB 为Difico 公司产品;PDGF-BB 国际标准品IS94/728 购自英国国家生物制品检定所(NIBSC);PVDF 膜为Millipore 公司产品;PDGF-B(F-3)抗体为Santa Cruz Biotechnology 公司产品;二抗Anti-mouse IgG、HRP-linked Antibody 为Cell Signaling Technology 公司产品;层析介质Phenyl Sepharose 6 Fast Flow(High Sub)、Source 30S、Superdex 75 prep grade 购 自GE Healthcare公司。
1.2 目的基因的获得
采用TRIzol 试剂盒从人早幼粒白血病细胞系HL-60 细胞中提取总RNA。以提取的RNA 为模板进行RT-PCR,正向引物为5'-CCGCTCGAG(XhoⅠ)AAAAGAACCATTGCTGAGCCGGCCA-3',反向引物为5'-GGAATTC(EcoRⅠ)TTAGGTCACAGGCCGT-3',引物由生工生物工程(上海)股份有限公司合成。
50 μL 反应体系:AMV/Tf15×缓冲液10 μL,dNTP 1 mmol/L,MgSO4(50 mmol/L)1 μL,上、下游引物各50 pmol,AMV 逆转录酶5 U,Tf1DNA 聚合酶5 U,总RNA 50 ng。反应条件:48℃逆转录45 min,94℃灭活逆转录酶2 min,然后以94℃变性30 s、60℃复性30 s、72℃延伸40 s进行35个循环,最后72℃总延伸7 min。回收PCR 产物。
1.3 表达载体的构建
将回收获得的目的基因片段与分泌型酵母表达载体pMEX9K 片段按照分子摩尔比>3∶1 的比例构建连接体系,用T4DNA 连接酶连接,转化大肠杆菌DH5α感受态菌株,随机挑取若干转化后的克隆进行菌类PCR 鉴定,鉴定为阳性的克隆提取质粒后委托生工生物工程(上海)股份有限公司进行测序。
1.4 电转化重组质粒DNA至酵母感受态细胞
将鉴定为阳性的pMEX9k-PDGF-B 克隆接种至LB(含氨苄西林)培养基中,37℃、220 r/min 振荡培养过夜,次日提取重组质粒,用SalⅠ-HF 酶线性化,电转化至酵母菌株GS115 中,转化产物涂布MD 平板,筛选得到his+重组克隆,随机挑取若干重组克隆进行菌类PCR 鉴定,鉴定为阳性的克隆提取质粒后委托生工生物工程(上海)股份有限公司进行测序。
1.5 高表达菌株的筛选
由于pMEX9K 载体具有G418 抗性,因此取his+重组克隆涂布在不同G418浓度的YPD平板上,用于筛选多拷贝插入子。分别取200 μL 细胞悬液涂于平板上,G418 终浓度为0.25、0.5、1.0 和2.0 mg/mL,30℃培养2~3 d,筛选具有高G418抗性、且生长良好的菌株作为表达菌株。分别挑取单克隆接种于5 mL BMGY 培养基中,30℃、250 r/min 振荡培养过夜,室温3000 r/min离心5 min,弃上清,用BMMY重悬菌体,30℃、250 r/min 振荡诱导表达,每24 h 补加甲醇至0.5%,诱导72 h 后,室温8000 r/min 离心20 min 收集上清。非还原SDS-PAGE 检测各克隆表达情况,选取目的蛋白(相对分子质量约30×103条带)表达量高的菌株,测定表达上清的蛋白浓度(Lowrry法,见2010 年版《中华人民共和国药典》(三部)附录ⅥB 第二法),并对非还原SDS-PAGE 的结果扫描进行灰度分析。
1.6 重组蛋白的诱导表达
用BMGY/BMMY培养基诱导蛋白表达。挑取新鲜平板上单菌落到装有25 mL BMGY 培养基的250 mL 摇瓶中,28~30℃、250 r/min 振荡培养至D600nm为2~6(16~18 h)。将25 mL 过夜培养物接种至含1 L BMGY 培养基的5 L 摇瓶中,28~30℃、250 r/min 继续培养至对数生长期(D600nm为2~6),离心收集菌体。去除原培养基,用1 L BMMY 培养基重悬酵母细胞,28℃、250 r/min 开始诱导表达,每隔24 h 添加甲醇至终浓度为0.5%,诱导表达72 h 后,8000 r/min离心20 min,收集酵母表达上清。
1.7 重组蛋白的纯化
1.7.1 Phenyl HS 疏水层析 表达上清用1/2 体积的调节缓冲液[60 mmol/L PB,3 mol/L(NH4)2SO4,pH7.2]调节电导,8000 r/min 离心20 min,上样于用20 mmol/L PB、1 mol/L(NH4)2SO4(pH7.2)溶液平衡好的Phenyl Sepharose 6 Fast Flow(High Sub)疏水层析柱,上样结束后,用20 mmol/L PB、1 mol/L(NH4)2SO4(pH7.2)的溶液再平衡,重组蛋白用洗脱液(20 mmol/L PB,50%乙二醇,pH7.2)洗脱,收集目的蛋白峰。
1.7.2 Source 30S 离子层析 用平衡缓冲液(20 mmol/L PB,pH7.2)稀释Phenyl HS 洗脱峰至电导值为6 ms/cm 以下,直接上样于用平衡缓冲液平衡好的Source 30S离子层析柱,用20 mmol/L PB、1 mol/L NaCl(pH7.2)梯度洗脱,收集目的蛋白。
1.7.3 Superdex 75 凝胶层析 目的蛋白峰用0.45 μm 孔径的滤膜过滤后,用Superloop 分次上样,每次上样体积不超过柱体积的3%。采用Hiload Superdex 75 pg 凝胶滤装柱,平衡液为20 mmol/L PB、0.15 mol/L NaCl(pH7.2),一步法收集洗脱峰。
1.8 重组蛋白的鉴定和活性测定
将纯化的rhPDGF-BB 进行还原及非还原SDSPAGE,分离胶浓度为15%,上样量分别为10 和2 μg。Western 印迹条件:15% SDS-PAGE,电转条件为300 mA 稳流1 h,将蛋白转到PVDF 膜上,抗PDGF-B 的一抗按1∶1000 稀释,二抗按1∶10000 用封闭液稀释。采用Edman 化学降解法测定N 端前5个氨基酸序列。
采用BALB/c 小鼠3T3 细胞株/MTT 法测定纯化后的rhPDGF-BB 生物活性。具体方法如下:取对数生长期的BALB/C 3T3 细胞,计数后以测定培养液调整细胞密度至1×105/mL,接种于96 孔细胞培养板,每孔100 μL,37℃、5% CO2条件下培养18~24 h。取PDGF-BB 国际标准品,以无血清DMEM 培养液溶解并稀释至40 U/mL,同法稀释待测样品,将已预稀释的参考品和待测样品于96 孔板上用无血清DMEM 培养液进行倍比梯度稀释,共做12 梯度浓度,每一梯度设2 个复孔;将梯度稀释好的参考品和待测样品每孔加入100 μL至已接种BALB/c 3T3细胞的96 孔细胞培养板中,37℃、5% CO2条件下培养64~72 h。加入MTT 溶液,培养5 h 后加入DMSO 裂解液,室温放置30 min 后比色,测定D510nm值,计算rhPDGF-BB的生物活性。
实验数据采用四参数回归计算法进行处理。
2 结果
2.1 目的基因的获得和酵母表达株的构建
RT-PCR 一步法获得目的基因312 bp,命名为PGBF-BB,经10 g/L 琼脂糖凝胶电泳分析,目的条带大小正确(图1),与本室保存的pMEX9K 载体[14]连接构建pMEX9K-PGBF-B 表达连接载体。pMEX9K由毕赤酵母蛋白表达专用载体pPIC9K 改构而来,通过AXO1(alochol oxidase,乙醇氧化酶)启动子调控外源蛋白的表达,并且有由α交配因子(α-factor)分泌的信号序列引导外源蛋白分泌表达。鉴定为阳性的表达载体经SalⅠ酶线性化后电转化受体菌GS115,得到his+重组克隆。PCR 法鉴定重组克隆,检测引物为5'AXO1引物和3'AXO1引物,结果(图2)为2 条带,一条为约2.2 kb 的野生型AXO1基因,另一条为789 bp 的含目的基因的片段,其中目的基因312 bp,AXO1基因侧翼序列长480 bp。
2.2 高表达株的筛选
pMEX9K载体赋予重组克隆对G418的抗性,而这种抗性的水平与整合入酵母基因组中载体的拷贝数呈正相关[15]。经过4 轮筛选,最终在含有2.0 mg/mL G418 的YPD 平板上筛选到6 个克隆,将重组克隆进行诱导表达,15% SDS-PAGE 显示(图3)发酵上清中主要为目的蛋白条带,可见重组蛋白为分泌表达;2.0 mg/mL G418 平板的重组克隆经诱导后重组蛋白的表达量最高,振荡培养后加甘油冻存作为发酵用种子。
2.3 重组蛋白的诱导表达
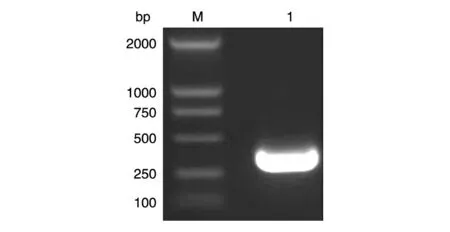
图1 RT-PCR扩增PDGF-BB基因
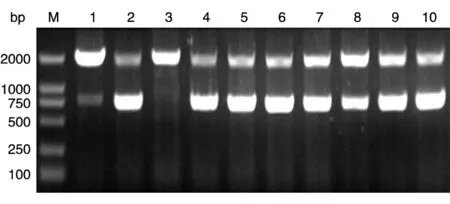
图2 菌落PCR结果
毕赤酵母是甲醇营养型酵母,可利用甲醇作为其惟一碳源。在代谢甲醇的过程中,由于相关酶的结合效率低,使得毕赤酵母代偿性地产生大量的酶,而调控该酶的启动子也正是驱动外源基因在毕赤酵母中表达的启动子。因此,通过BMGY 培养基增菌过程及更换BMMY 培养基诱导蛋白表达,在每个时间点取样,SDS-PAGE 分析目的蛋白在发酵上清中的表达情况,结果见图4。随着诱导时间的增加表达量逐渐升高,48 和72 h 差异不明显,72 h 时表达量最高,且很据蛋白浓度测定和BandScan 灰度扫描结果计算,目的蛋白的表达量高于100 μg/mL。
2.4 PDGF-BB的纯化
发酵上清调节电导后先经Phenyl HS 捕获,通过一步洗脱将目的蛋白有效富集,同时去除了大部分发酵培养基中的色素和其他杂蛋白(图5);第二步为Source 30S,此步基于目的蛋白与杂蛋白离子性质的不同,同时由于该填料粒径较小、分布均匀具有很高的分辨率,通过进一步的梯度洗脱可将绝大部分杂蛋白和剩余色素去除,同时将目的蛋白进一步富集浓缩(图6);最后通过Superdex 75 凝胶过滤柱进行精细纯化,去除痕量杂质并完成缓冲液置换(图7)。
2.5 PDGF-BB的鉴定和活性测定
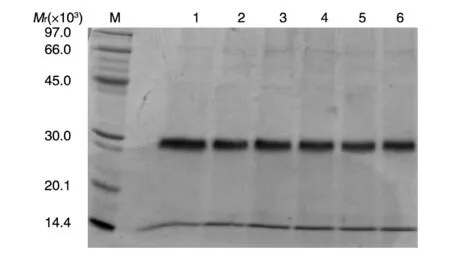
图3 高拷贝筛选后蛋白表达水平结果
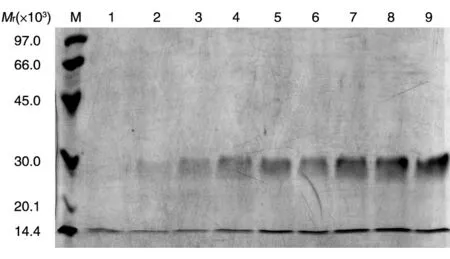
图4 PDGF-BB不同诱导时间的SDS-PAGD图
非还原及还原SDS-PAGE 结果(图8A)扫描后经BandScan 5.0 软件分析显示,获得的目的蛋白为同源二聚体形式,纯度大于95%,单体形式表观相对分子质量约为14.5×103。Western 印迹结果(图8B)表明目的蛋白能特异地与一抗结合,而阴性对照菌株和未经诱导表达菌株的发酵上清均无阳性条带。N 端测序结果见图9,前5 个氨基酸残基为T-I-AE-P,与理论一致,说明该重组蛋白N 端加工正确,未发生不正确剪切。Lowrry 法测定的PDGF-BB 浓度为3.21 mg/mL,采用BALB/c 3T3 细胞株/MTT 法测定的纯化后目的蛋白的活性为1.61×106IU/mL,比活为5.0×105IU/mg(图10)。

图5 Phenyl HS层析结果图

图6 Source 30S层析结果图
3 讨论
毕赤酵母表达系统是20 世纪80~90 年代发展起来的极具潜力的酵母表达系统[17],利用该系统已成功表达了几百种酶、药用和疫苗用蛋白[18]。该系统具有许多其他蛋白表达系统所不具备的优点,如可进行高密度发酵培养,培养基成分简单、廉价、适于工业化生产,外源基因不易丢失,表达量高,许多蛋白甚至可达每升克级以上[19],作为真核表达系统,可对表达的蛋白进行翻译后正确加工和修饰,即二硫键的形成、蛋白的磷酸化、折叠、信号序列的加工和糖基化,而且不会像酿酒酵母产生超糖基化[20]。PDGF 已在多种系统中成功表达,如大肠杆菌[21]、酿酒酵母[14]、CHO 真核细胞[22]等,但具有如大肠杆菌表达为包含体、需要复性;酿酒酵母表达量低、难以量产;CHO系统成本高昂、生产周期长等缺点。
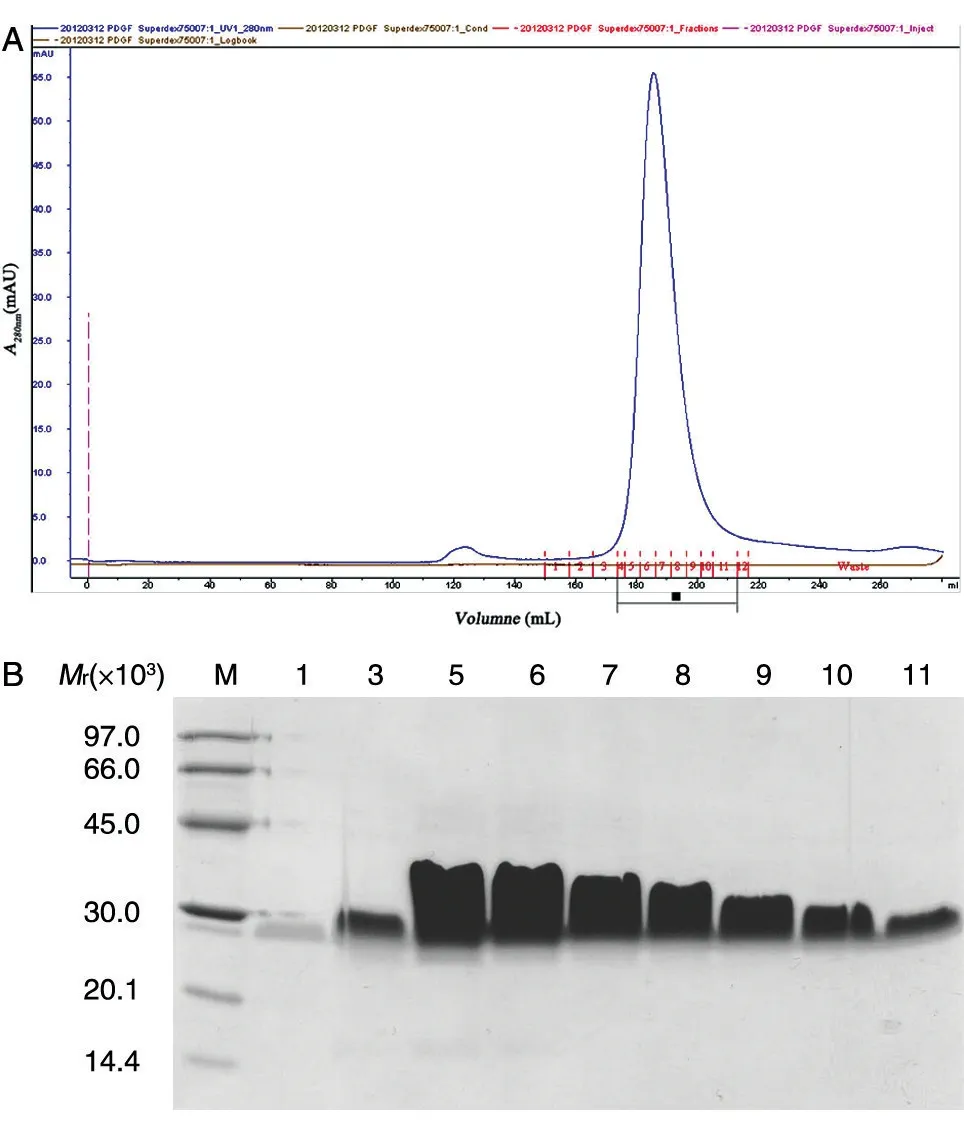
图7 Superdex 75层析结果图
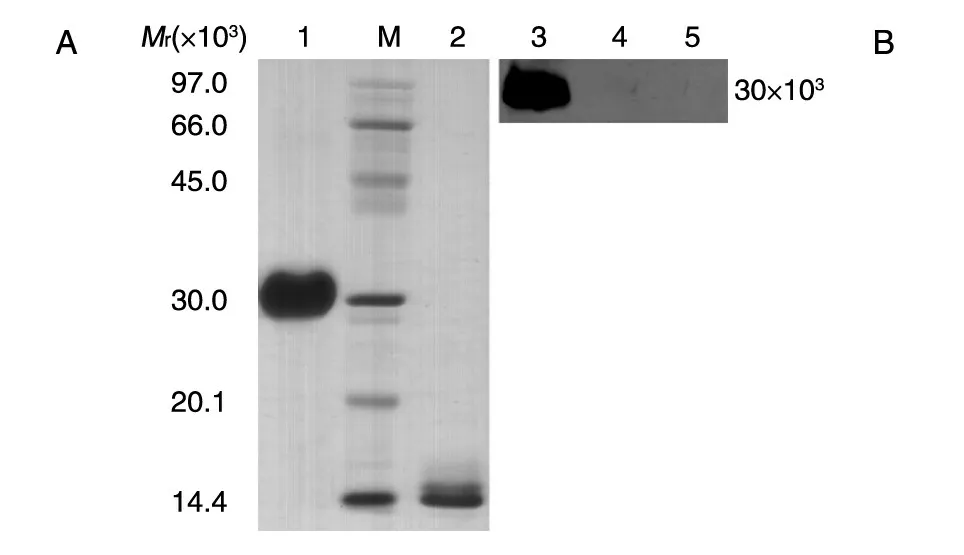
图8 PDGF-BB蛋白SDS-PAGE(A)和Western印迹(B)分析
我们用毕赤酵母系统以分泌形式表达rhPDGFBB,表达量可达每升百克级别,而且目的蛋白直接分泌到培养基中,不需复杂的破菌过程,且上清中杂蛋白含量很低,便于分离纯化。通过三步实现了重组蛋白的高效纯化,获得了N 端整齐均一、纯度和活性都符合要求的rhPDGF-BB 蛋白。综上,我们利用毕赤酵母表达系统表达重组人PDGF-BB,表达产量高,成本低,工艺简单,易于工业化放大,有良好的市场前景。
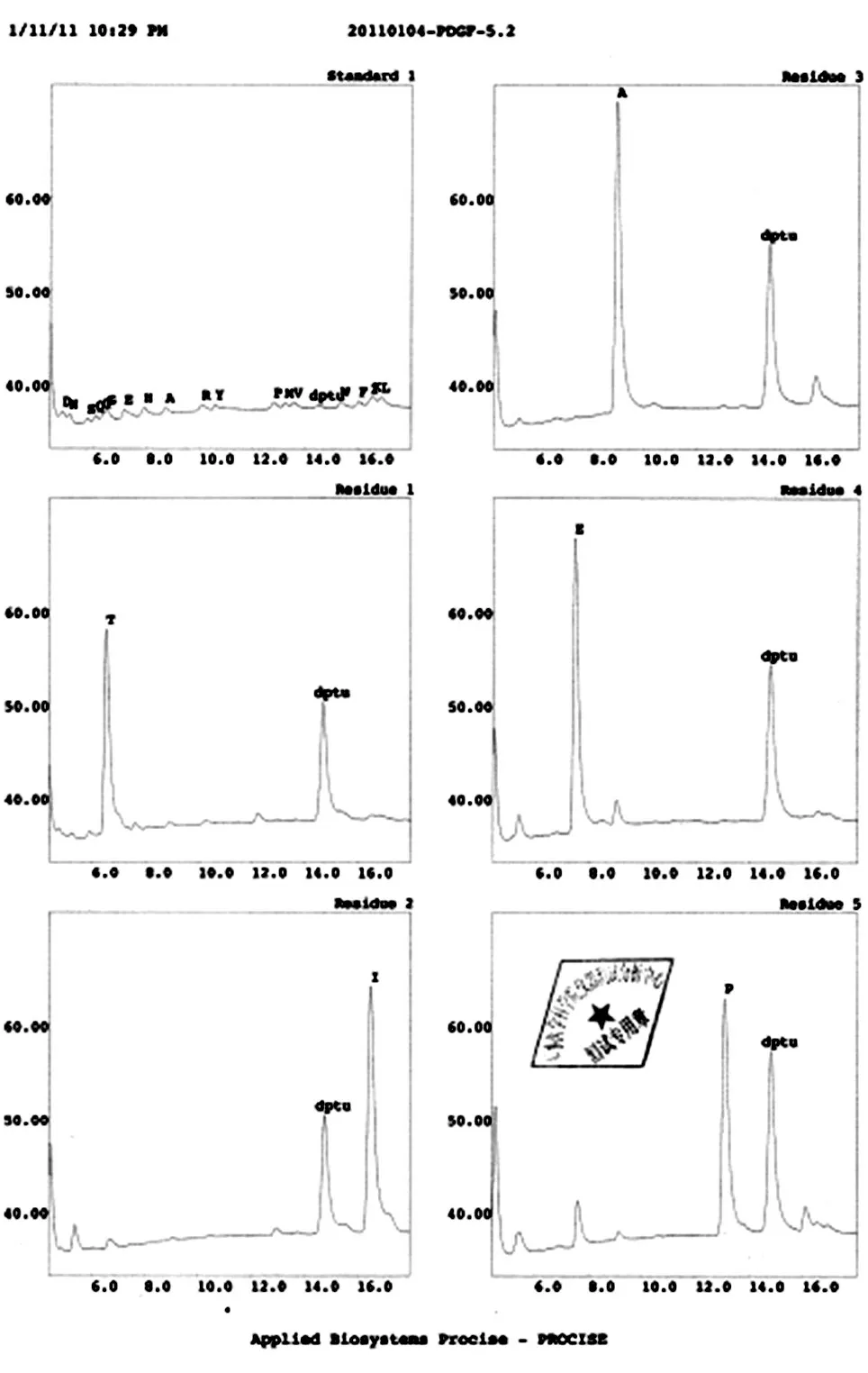
图9 PDGF-BB蛋白N端测序结果
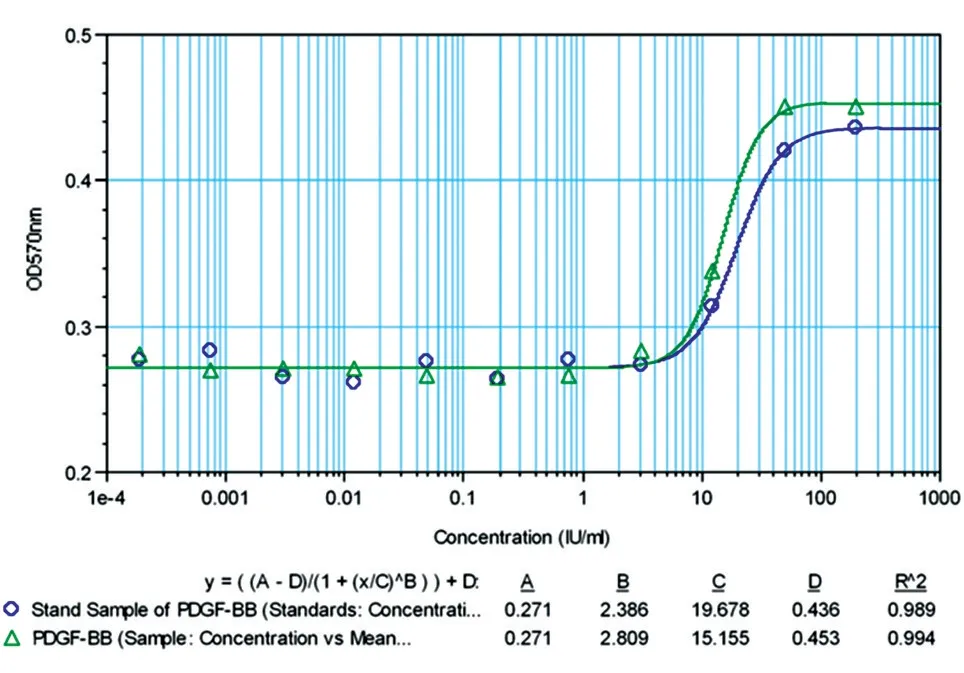
图10 PDGF-BB蛋白的MTT法活性测定结果
[1]Kohler N,Lipton A.Platelets as a source of fibroblast growth-promoting activity[J].Exp Cell Res,1974,87:297-301.
[2]Beer H D,Longaker M T,Werner S.Reduced expression of PDGF and PDGF receptors during impaired wound healing[J].J Invest Dermatol,1997,109:132-138.
[3]Kaltalioglu K,Coskun-Cevher S,Tugcu-Demiroz F,et al.PDGF supplementation alters oxidative events in wound healing process:a time course study[J].Arch Dermatol Res,2013,305:415-422.
[4]Leveen P,Pekny M,Gebre-Medhin S,et al.Mice deficient for PDGF B show renal,cardiovascular,and hematological abnormalities[J].Genes Dev,1994,8:1875-1887.
[5]Ding H,Wu X,Bostrom H,et al.A specific requirement for PDGF-C in palate formation and PDGFR-alpha signaling[J].Nat Genet,2004,36:1111-1116.
[6]Raines E W.PDGF and cardiovascular disease[J].Cytokine Growth Factor Rev,2004,15:237-254.
[7]Heldin C H.Autocrine PDGF stimulation in malignancies[J].Ups J Med Sci,2012,117:83-91.
[8]Wu Q,Hou X,Xia J,et al.Emerging roles of PDGF-D in EMT progression during tumorigenesis[J].Cancer Treat Rev,2013,39:640-646.
[9]Johnsson A,Heldin C H,Westermark B,et al.Platelet-derived growth factor:identification of constituent polypeptide chains[J].Biochem Biophys Res Commun,1982,104:66-74.
[10]Heldin C H,Eriksson U,Ostman A.New members of the platelet-derived growth factor family of mitogens[J].Arch Biochem Biophys,2002,398:284-290.
[11]Fredriksson L,Li H,Eriksson U.The PDGF family:fourgene products form five dimeric isoforms[J].Cytokine Growth Factor Rev,2004,15:197-204.
[12]Robson M C,Phillips L G,Thomason A,et al.Platelet-derived growth factor BB for the treatment of chronic pressure ulcers[J].Lancet,1992,339:23-25.
[13]Hart C E,Bailey M,Curtis D A,et al.Purification of PDGF-AB and PDGF-BB from human platelet extracts and identification of all three PDGF dimers in human platelets[J].Biochemistry,1990,29:166-172.
[14]Craig S,Clements J M,Cook A L,et al.Characterization of the structure and conformation of platelet-derived growth factor-BB(PDGF-BB) and proteinase-resistant mutants of PDGFBB expressed in Saccharomyces cerevisiae[J].Biochem J,1992,281(Pt 1):67-72.
[15]齐连权,陈薇,于长明,等.两个新型多拷贝毕赤酵母表达载体的构建[J].军事医学科学院院刊,2002,(4):264-266.
[16]Cregg J M,Vedvick T S,Raschke W C.Recent advances in the expression of foreign genes in Pichia pastoris[J].Nat Biotechnol,1993,11:905-910.
[17]Cregg J M,Barringer K J,Hessler A Y,et al.Pichia pastoris as a host system for transformations[J].Mol Cell Biol,1985,5:3376-3385.
[18]Macauley-Patrick S,Fazenda M L,Mcneil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[19]Lin Cereghino G P,Sunga A J,Lin Cereghino J,et al.Expression of foreign genes in the yeast Pichia pastoris[J].Genet Eng(NY),2001,23:157-169.
[20]Gemmill T R,Trimble R B.Overview of N-and O-linked oligosaccharide structures found in various yeast species[J].Biochim Biophys Acta,1999,1426:227-237.
[21]Lyons D E,Thomason A R.Production of platelet-derived growth factor B-chain heterodimers from high expression host cell system[P].US 5428135.1995-06-27.
[22]叶秀珍,金健健,徐链,等.外源血小板衍生生长因子(PDGF)B链基因在CHO 细胞的表达[J].实验生物学报,1989,(3):313-323.
