人表皮生长因子受体结构域蛋白的原核表达、纯化及活性检测
2015-11-29郭靖王涛李齐宏李玲梁迎春洪甜梅国徽冀全博纪贝贝徐小洁叶棋浓
郭靖 ,王涛,李齐宏,李玲,梁迎春,洪甜,梅国徽,冀全博,纪贝贝,徐小洁,叶棋浓
1.大连医科大学 肿瘤干细胞研究院,辽宁 大连 116044;2.军事医学科学院 生物工程研究所,北京 100850;3.军事医学科学院 附属医院,北京 100071
表皮生长因子受体(epithelial growth factor receptor,EGFR)是Ⅰ型受体酪氨酸激酶家族成员[1]。EGFR 是一种跨膜糖蛋白、细胞膜受体,其基因位于人类第7 号染色体短臂上。EGFR 由1186 个氨基酸残基构成,相对分子质量为170×103,由胞外区、胞内配体结合区、跨膜区三部分组成[2]。胞外区包含L-1/2两个富含亮氨酸序列和CR-1/2两个富含半胱氨酸序列,是621 个氨基酸残基构成的与配体结合的N端区;跨膜区是23个氨基酸残基构成的α螺旋;胞内区由近膜区(juxtam embrane region,JM)、酪氨酸蛋白激酶区和C 端构成,含有542 个氨基酸残基。受其相应配体诱导激活之后,EGFR 可参与细胞信号通路,通过不同的受体类型和磷酸化结合位点,激活不同的信号蛋白,参与细胞分化、增殖、迁移、侵袭和损伤修复[3]。因此,EGFR 发挥生物学效应依赖于其胞外区和胞内激酶区的完整性及稳定性。
为了进一步探索EGFR 在肿瘤发生发展中的具体功能,我们将EGFR 的胞外结构域(extracellular domain,ED)和胞内激酶结构域(protein kinase domain,PKD)分别构建在原核表达载体上,表达获得融合蛋白GST-EGFR-ED 和GST-EGFR-PKD,为深入研究EGFR在肿瘤中的作用奠定了实验基础。
1 材料和方法
1.1 材料
大肠杆菌DH5α、Rossate,原核表达载体pGEXKG 为本室保存;DNA 胶回收试剂盒、PCR 产物回收试剂盒为北京天根生物科技有限公司产品;XbaⅠ和XhoⅠ限制性核酸内切酶、Prime STAR HS DNA 聚合酶、T4DNA 连接酶为TaKaRa 公司产品;质粒提取试剂盒为Promega 公司产品;GST-Sepharose 4B 珠子购自Pharmacia 公司;DMEM 及小牛血清均购自Gibco 公司;VigoFect 为威格拉斯生物技术有限公司产品;辣根过氧化物酶偶联的抗GST、Flag 单克隆抗体购自Sigma 公司;引物由北京赛百盛生物技术有限公司合成;测序由北京奥科生物技术公司完成。
1.2 人EGFR ED、PKD编码基因的扩增
分别设计人EGFR ED 和PKD 基因扩增引物序列(表1),上、下游引物分别含XbaⅠ和XhoⅠ酶切位点。以人乳腺文库为模板,用Prime STAR HS DNA聚合酶PCR 扩增目的片段。扩增条件:95℃5 min预变性;95℃30 s、58℃30 s、72℃130 s,32 个循环;72℃延伸50 s。扩增产物以1.5%琼脂糖DNA 胶检测,用琼脂糖DNA胶回收试剂盒回收。
1.3 重组表达质粒的构建及原核表达鉴定
EGFR ED 和PKD 胶回收产物用XbaⅠ、XhoⅠ双酶切,载体pGEX-KG也经相同酶双酶切胶回收载体大片段;酶切产物经T4DNA 连接酶于16℃连接4 h 后,转化大肠杆菌DH5α,涂LB(含氨苄西林)平板,37℃培养过夜;挑选单克隆,做菌液PCR,再挑选阳性克隆,接种于LB(含氨苄西林)培养基中,37℃振荡活化14 h;提取质粒进行双酶切鉴定,正确质粒送北京奥科生物技术公司测序。
1.4 融合蛋白的小量诱导表达及鉴定
将测序正确的重组表达质粒转化大肠杆菌Rossate 感受态细胞,挑取单个菌落,37℃振荡培养至D600nm为0.6~1.0,加入IPTG 至终浓度1 mmol/L,诱导4 h后收集菌液离心,菌体行Western印迹检测。
1.5 融合蛋白的纯化
将小量诱导表达的重组Rossate 菌和含有pGEX-KG 空载体的Rossate 菌接种于LB(含氨苄西林)培养基中,37℃振荡活化过夜;按10%的比例转接同种液体培养基中,29℃振荡培养至D600nm为0.4~0.6时加入IPTG 至终浓度0.1 mmol/L,19℃继续培养20~24 h;离心收集菌体,按Pharmacia 公司提供的纯化方法行蛋白纯化:加入裂解液,超声波破碎菌体,12 000 r/min 离心收集上清,加入适量GST-Sepharose 4B珠子,4℃旋转结合3 h,3000 r/min低速离心收集珠子,缓冲液充分洗脱未结合蛋白质,以Western印迹鉴定纯化的蛋白,作为诱饵蛋白。
2 结果
2.1 人EGFR ED、PKD编码区基因的克隆
以人乳腺文库为模板,按前述条件分别扩增EGFR ED 和PKD 编码序列,获得的ED 片段大小为582 bp,PKD为811 bp,与预期一致(图1)。
2.2 重组表达载体pGEX-GST-EGFR-ED、pGEXGST-EGFR-PKD 的构建与鉴定
用Xba Ⅰ和XhoⅠ双酶切EGFR ED、PKD 的PCR 产物,分别与经同样酶切的pGEX-KG 载体连接,2种连接产物均转化大肠杆菌DH5α,涂布LB(含氨苄西林)平皿,挑取克隆提质粒进行酶切鉴定,得到与预期片段大小相符的外源基因插入片段,对照空载体双酶切后无此片段,表明EGFR ED、PKD 基因的编码序列已正确插入载体上游的多克隆位点中。DNA 测序结果显示,插入表达载体pGEX-KG中的EGFR ED 和PKD 编码序列完整,方向正确,无突变发生(数据略)。见图2、3。
2.3 融合蛋白GST-EGFR-EDG 和GST-EGFRPKD的诱导表达及鉴定

图1 目的基因的PCR扩增
将pGEX-KG 空载体、pGEX-EGFR-ED 和pGEX-EGFR-PKD 融合表达质粒分别转化大肠杆菌Rossate 感受态细胞,经IPTG 小量诱导后,Western 印迹检测,GST-EGFR-ED 和GST-EGFR-PKD 融合蛋白获得正确表达(图4)。
2.4 融合蛋白GST-EGFR-ED、GST-EGFR-PKD 的纯化
利用GST-Sepharose 4B 亲和珠子纯化获得融合蛋白,考马斯亮蓝染色检测结果显示获得一定量的纯度较高的GST、GST-EGFR-ED 和GST-EGFRPKD融合蛋白(图5)。
2.5 GST pull-down分析
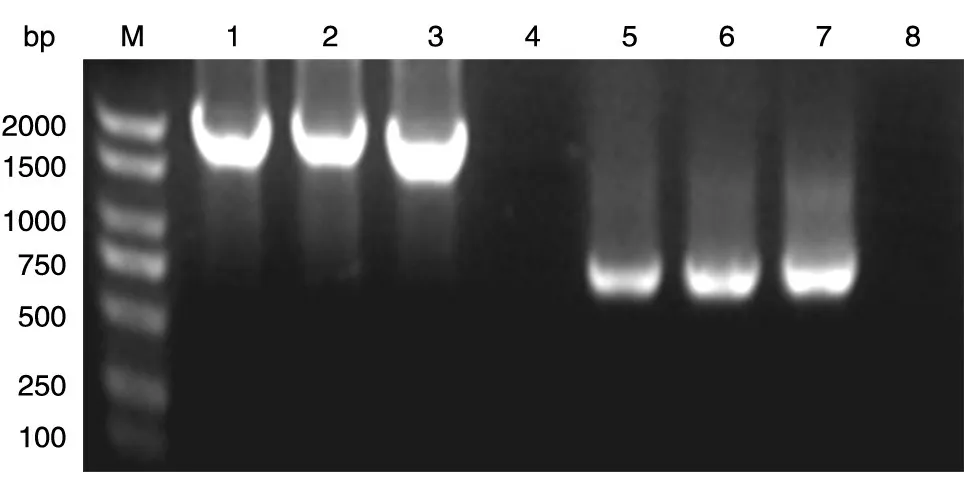
图2 重组质粒pGEX-GST-EGFR-ED 和pGEX-GST-EGFR-PKD 的菌液PCR电泳结果
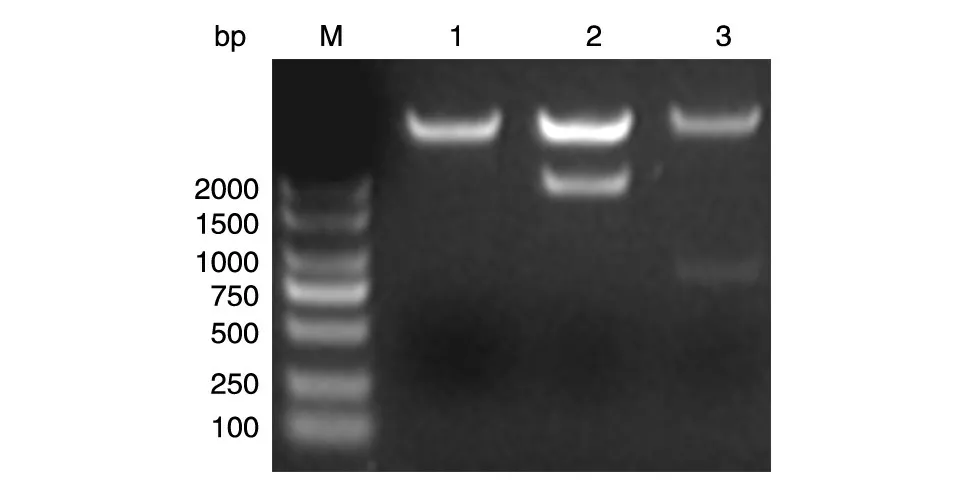
图3 重组质粒的双酶切鉴定
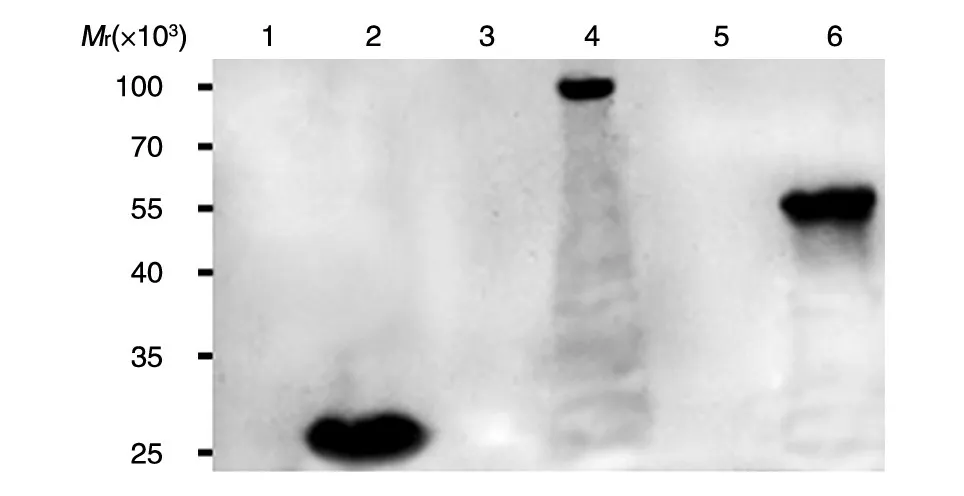
图4 融合蛋白的Western印迹分析
为进一步研究纯化的GST-EGFR-ED 和GSTEGFR-PKD 能否与Memo(mediator of ErbB2-driven cell motility)蛋白相互作用,将带有GST-EGFRED 和GST-EGFR-PKD 的纯化珠子与过表达Myc-Her2 的293T 细胞裂解液于4℃结合后,用Myc-Her2抗体行Western 印迹检测。结果显示,GST-EGFRPKD 可与Myc-Her2 结合,在符合Myc-Her2 大小的相对分子质量约180×103位置显示出特异性条带(图6),而GST 载体蛋白及GST-EGFR-ED 在同一位置无此条带,说明GST-EGFR-PKD 能够与Myc-Her2特异地相互作用,GST 标签并不影响蛋白的结构及生物学功能。
3 讨论
细胞表面EGFR 的表达是其下游信号转导通路激活的基础,也是原癌基因的表达产物[4]。EGFR 在多种肿瘤中高表达,可促进血管生成及肿瘤细胞的增殖、黏附、侵袭和转移,抑制肿瘤细胞的凋亡[5-7]。并且,EGFR 过度表达的细胞表现出对促凋亡药的抵抗性[8]。另外,EGFR 直接参与肿瘤发生、发展过程[9]。EGFR 的活化需要经过3 个过程[10]:①EGFR 与配体结合后导致受体形成同源二聚体,也可与其他EGFR 家族成员形成异源二聚体;②形成的二聚体促使EGFR 胞内区6 个特异的受体酪氨酸残基磷酸化,分别将外界各种信号转导至胞内;③当细胞核接收到信号传导后,核内的基因转录水平增加,EGFR的表达增加。
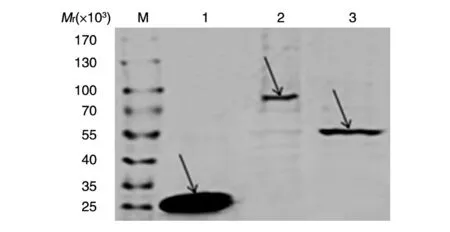
图5 纯化的GST-EGFR-ED、GST-EGFR-PKD 融合蛋白SDS-PAGE分析

图6 GST pull-down检测目的蛋白与Myc-Her2蛋白的相互作用
Her2 过表达引起Ras/MAPK、PI3K/Akt 等信号通路的一系列反应[11-12]。王琼等证明Her2 和EGFR正相关,并推测两者可能在肿瘤的发生和转移等方面存在协同作用[13]。同时,Ling等证明EGFR和Her2之间存在相互作用[14]。本实验构建了EGFR 不同区域的原核表达载体,并与Her2 进行了GST pulldown 实验,结果显示Her2 结合在EGFR 胞内激酶区,而不与EGFR 胞外区结合。这可以解释Her2 与EGFR 正相关并能协同影响信号通路的现象,为进一步研究两者的功能提供了另一条途径。
EGFR 是具有良好前景的肿瘤诊断和治疗靶点。阻断EGFR 表达的靶向抑制剂能够增加肿瘤细胞的放射敏感性,提高放射治疗的疗效,其机制可能是EGFR 的靶向抑制剂抑制了肿瘤细胞的EGFR 表达,阻断了EGFR 信号传导通路,从而加速细胞凋亡,干扰细胞周期分布及细胞辐射后DNA 损伤的修复[15]。但是,EGFR 在肿瘤发生、发展及预后等方面中的具体作用机制还有待探究。我们克隆了GSTEGFR-ED 和GST-EGFR-PKD 基因并获得其原核表达融合蛋白,为后续进一步研究其在肿瘤发生发展、蛋白相互作用及抗体制备等方面的作用奠定了实验学基础。
[1]Harari P M,Huang S M.Head and neck cancer as a clinical model for molecular targeting of therapy:combining EGFR blockade with radiation[J].Int J Rediat Oncol Bid Phys,2001,49(2):427-433.
[2]Perez-Soler R.HER1/EGFR targeting:refining the strategy[J].Oncologist,2004,9(1):58-67.
[3]Yarden Y,Sliwkoski M X.Untangling the ErbB signaling network[J].Nat Rev Mol Cell Biol,2001,2(2):127-137.
[4]Ritter C A,Arteaga C L.The epidermal growth factor receptor-tyrosine kinase:a promising therapeutic target in solid tumors[J].Semin Oncol,2003,30(Suppl 1):3-11.
[5]Roskoski R Jr.The ErbB/HER receptor protein-tyrosine kinases and cancer[J].Biochem Biophys Res Commun,2004,319(1):1-11.
[6]Stonecypher M S,Chaudhury A R,Byer S J,et al.Neuregulin growth factors and their ErbB receptors form a potential signaling network for schwannoma tumorigenesis[J].J Neuropathol Exp Neurol,2006,65(2):162-175.
[7]Mendelsohn J,Baselga J.Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J].J Clin Oncol,2003,21(14):2787-2799.
[8]Castillo L,Etienne-Grimaldi M C,Fischel J L,et al.Pharmacological background of EGFR targeting[J].Ann Oncol,2004,15(7):1007-1012.
[9]Arteaqa C L.Epidermal growth factor receptor dependence in human tumors:more than just expression[J]? Oncologist,2002,7(Suppl 4):31-39.
[10]Ciardiello F,Tortora G.EGFR antagonists in cancer treatment[J].N Engl J Med,2008,358(11):1160-1174.
[11]Michael P D.Clinical significance of HER2/neu over exprcssion:Part l[J].Princ Pract Oncol,1999,13(1):1-9.
[12]池苗苗,戴飞飞,王亚坤,等.Her-2表达在食管胃结合部腺癌中的作用研究进展[J].中国肿瘤,2015,24(1):49-52.
[13]王琼,袁静,吕亚莉,等.结直肠癌中的HER-2、EGFR和Ki-67的蛋白表达及其临床病理学意义[J].中华临床医师杂志,2012,6(10):2589-2593.
[14]Ling B C,Wu J,Miller S J,et al.Role for the epidermal growth factor receptor in neurofibromatosis-related peripheral nerve tumorigenesis[J].Cancer Cell,2005,7(1):65-75.
[15]Reuter C W,Morgan M A,Eckardt A.Targeting EGF-receptor-signalling in squamous cell carcinomas of the head and neck[J].Br J Cancer,2007,96(3):408-416.
