海洋着色菌Marichromatium gracile YL28静息细胞对无机三态氮的相互转化作用
2015-11-19蒋鹏洪璇赵春贵杨素萍
蒋鹏,洪璇,2,赵春贵,杨素萍
(1.华侨大学 化工学院,福建 厦门361021;2.厦门医学高等专科学校 药学系,福建 厦门361008)
集约化水产养殖的迅速发展,水体残饵、药物、代谢和排泄物以及其他有机物的滞留和沉积,造成了NH3-N,NO-2-N,H2S和药物残留等有害污染物的形成,严重制约了水产养殖业的健康发展[1-2].如何尽快去除水体中NH3-N和NO-2-N等有毒有害物质一直备受关注[3].不产氧光合细菌(anoxygenic phototrophic bacteria,APB)在水产养殖和水体氮素污染控制等方面已有广泛的研究和应用[4].菌种(株)不同,对无机三态氮的代谢能力以及对环境的适应能力也不同,如RhodobactersphaeroidesP4[5]和Rhodopseudomonassp.wps[6]能在氨氮存在时去除水体中的硝氮和亚硝氮,RhodopseudomonaspalustrisPS1[7]则不能去除亚硝氮.某些菌株如RhodobactercapsulatusE1F1[8]能以硝酸盐为唯一氮源生长,但能以亚硝酸盐为唯一氮源生长并高效去除亚硝氮的APB菌株鲜有报道,仅本课题组报道了一株海洋着色菌MarichromatiumgracileYL28[9-10].关于光、氧、pH值和温度等环境因素以及不同碳源对APB菌株,如Rhodobactersphaeroide2-8[11]和Rhodopseudomonassp.wps[12]去除无机三态氮的影响已有较多报道,表明环境因素和营养基质对微生态制剂的功效有明显影响,但还未见APB静息细胞对无机三态氮的去除和转化能力的系统报道.静息细胞代谢主要是指限制性非生长条件下细胞内酶的代谢,静息细胞法已在生物和医学方面有广泛应用[13].在水体环境中,APB制剂的菌体可能处于水体底部黑暗厌氧环境中,即使温度和pH值适宜,菌体也生长缓慢,似静息细胞,在此环境中APB是否具有无机三态氮转化能力,目前还不清楚.YL28菌株能以亚硝氮为唯一氮源生长,具有良好去除无机三态氮和环境适应能力[9-10].因此,本文研究了YL28菌株静息细胞厌氧去除和转化无机三态氮的能力.
1 实验部分
1.1 材料与仪器
海洋着色菌MarichromatiumgracileYL28菌株,16SrRNA基因GenBank登录号为JF719917,由本实验室分离鉴定并保存.氯化铵、亚硝酸钠和硝酸钾为国产优级纯试剂;氯化汞、氢氧化钾、酒石酸钾钠、盐酸萘乙二胺、磷酸氢二钾等为国产分析纯试剂.
UV-3200PCS型紫外可见分光光度计(上海美普达MAPADA公司);TGL-20M型台式高速冷冻离心机(上海卢湘仪公司).
1.2 实验方法
1.2.1 菌体的培养与静息细胞的制备 采用改良的Pfennig紫色硫细菌无机选择性培养基[14],添加24.3mmol·L-1无水乙酸钠,0.75mmol·L-1Na2S2O3取代1.5mmol·L-1Na2S·9H2O,调节pH值为7.0.接种量为5%(体积浓度),接种后用无菌培养基充满培养瓶,于28℃,3 000lx光照厌氧培养5d.无菌操作,高速离心,收集菌体,用pH值为7.0,质量浓度为3%的NaCl溶液洗涤菌体3次,并制备成光密度D(660)约为1.3的菌种悬液,在28℃静置孵育48h即为静息细胞悬液,使用时准确测量.
1.2.2 实验体系的设置 精确称量,配制无机氮(氯化铵、亚硝酸钠和硝酸钾)储备液,调整pH值为7.0,用二次水定容,过滤除菌,其氮素质量浓度均为30.00g·L-1.
在静息细胞悬液中添加无机氮储备液,配制成含有不同无机氮(氯化铵、亚硝酸钠、硝酸钾和无机三态氮共存)的菌悬液体系,用质量浓度为3%的NaCl溶液补满培养瓶,旋紧瓶盖,将培养瓶置于28℃培养箱中厌氧培养.菌悬液体积为310mL,溶液起始pH值为7.0,每个处理设置3个重复,定时取样1 mL,用于无机三态氮质量浓度和生物量的测定.
1.2.3 生物量和无机三态氮的测定 采用比浊法测定生物量,以D(660)表示菌体的生物量,用光程为1cm的石英比色杯,于紫外可见分光光度计上测定波长为660nm处光密度D(660).
采用钠氏试剂光度法测定NH3-N的质量;采用N-(1-萘基)-乙二胺光度法测定NO-2-N的质量;采用紫外分光光度法[15]NO-3-N测定.无机氮去除率(R)计算式为
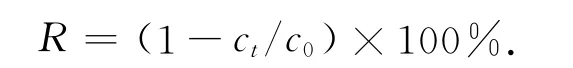
上式中:c0和ct分别表示无机三态氮的初始浓度和测定时刻的浓度.
无机三态氮的质量均以氮素的质量浓度计算,重复测定3次.
2 结果与分析
2.1 对氨氮的去除和转化
YL28菌株静息细胞对氨氮去除及其转化过程,如图1所示.图1中,NH3-N的起始浓度为3.12 mmol·L-1(空心图示□和○),6.18mmol·L-1(实心图示■和▲).由图1可知:随处理时间的延长,体系中菌体生物量降低,氨氮去除率升高;1~2d内检测到了少量亚硝氮和硝氮的生成,随后又被完全去除.低氨氮浓度(3.12mmol·L-1)体系处理5.1d,菌体生物量降低了约17.90%,氨氮去除量和去除率分别为0.28mmol·L-1和9.86%;高浓度氨氮(6.18mmol·L-1)时,体系中菌体生物量未明显降低,氨氮去除量未见明显变化,但氨氮去除率明显降低.

图1 YL28菌株静息细胞对氨氮的去除和硝氮、亚硝氮的生成过程Fig.1 Removal of ammonium and the production of nitrate and nitrite by YL28resting cells
结果表明:YL28菌株静息细胞对氨氮去除能力很弱,能将氨氮转化为少量的亚硝氮和硝氮,在体系中的菌体有一定程度的自溶,使生物量降低.已有研究表明,YL28菌株在生长过程中均具有良好的去除氨氮的能力[10],而本实验中静息细胞去除氨氮的能力很低.由此可知,YL28菌株主要通过铵同化作用去除氨氮,由于静息细胞体系中缺乏营养物质,菌体不能通过铵同化作用生长,表现出对氨氮的去除能力较微弱.
2.2 对亚硝氮的去除和转化
YL28菌株静息细胞对亚硝氮的去除及转化过程,如图2所示.图2中,NO-2-N的起始浓度为5.12 mmol·L-1(□和○),10.08mmol·L-1(■和▲).由图2可知:随着处理时间的延长,亚硝氮去除率逐渐升高,然后被完全去除(图2(a));在1~3d内能检测到硝氮的生成,随后又消失,在整个过程中未检测到氨氮的生成(图2(b)).与低浓度亚硝氮体系相比,高浓度亚硝氮体系中亚硝氮的去除速率降低,生成的硝氮摩尔浓度较高.结果表明:菌株的静息细胞对亚硝氮有良好的去除作用,能将亚硝氮转化为硝氮;与氨氮体系相比,由于亚硝氮具有毒性,能加快菌体自溶,致使体系中生物量明显降低.
Shapleigh[16]报道了许多APB菌株具有反硝化作用,并阐明了反硝化作用的相关酶系;Schott等[17]报道了Thiocapsasp.KS1和Rhodopseudomonassp.LQ17能够在厌氧条件下通过亚硝酸盐氧化还原酶将亚硝氮转化为硝氮.由此可知,YL28菌株具有亚硝酸盐氧化还原酶和反硝化作用的相关酶系.因而,其静息细胞能利用这些酶系将亚硝氮转化为硝氮,也能够通过反硝化作用去除体系中亚硝氮和硝氮.

图2 YL28菌株静息细胞对亚硝氮的去除和氨氮、硝氮的生成过程Fig.2 Removal of nitrite and the production of ammonium and nitrate by YL28resting cells
2.3 对硝氮的去除和转化
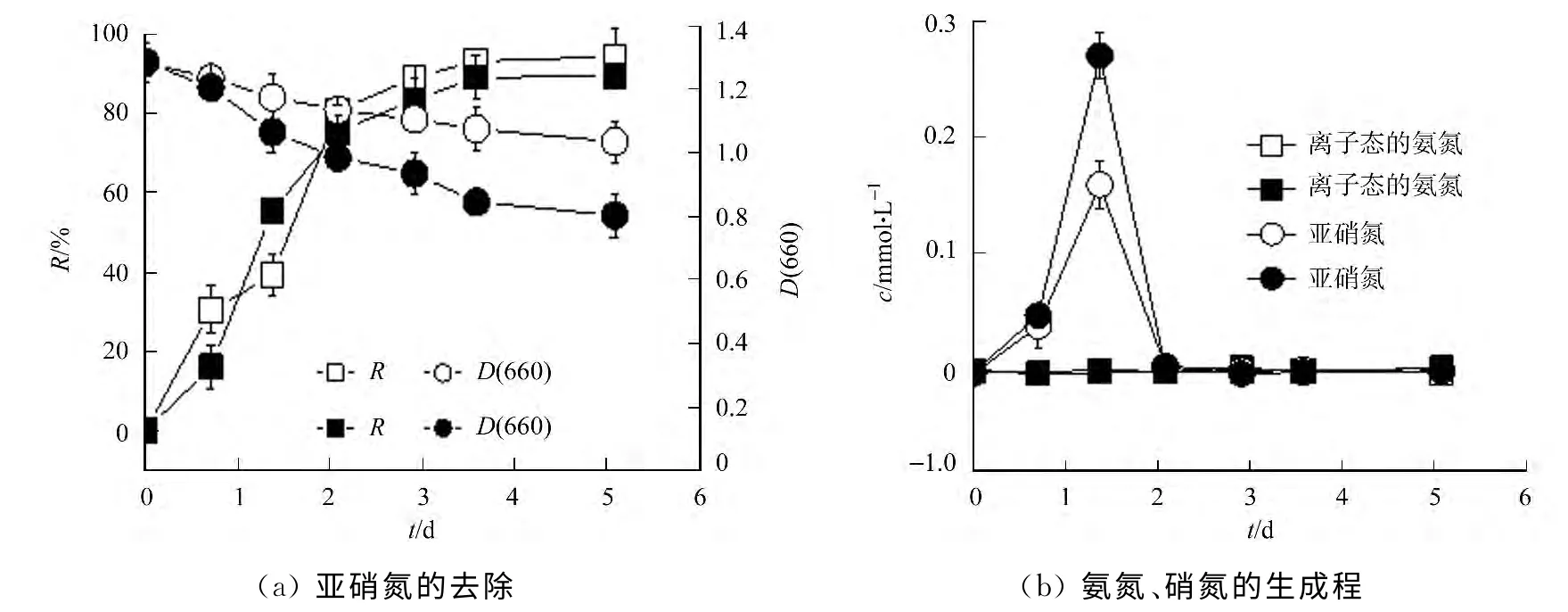
图3 YL28菌株静息细胞对硝氮的去除和氨氮、亚硝氮的生成过程Fig.3 Removal of nitrate and the production of ammonium and nitrite by YL28resting cells
YL28菌株静息细胞对硝氮的去除及其转化过程,如图3所示.图3中,NO-3-N的起始浓度为4.25 mmol·L-1(□和○),8.18mmol·L-1(■和●).由图3可知:随着处理时间的延长,硝氮去除率升高,生物量逐渐降低(图3(a));在1~2d内水体中产生的亚硝氮达到最大(图3(b)),随后又被完全去除,整个过程中未检测到氨氮的存在.与低浓度相比,高浓度硝氮体系中硝氮的最大去除率降低,暂时性生成的亚硝氮升高,菌体生物量有所降低.结果表明:YL28菌株静息细胞具有良好去除硝氮的能力,能通过反硝化作用将硝氮转化为亚硝氮.
2.4 对无机三态氮共存的去除和转化特性
无机三态氮共存体系中,YL28菌株的静息细胞对无机氮的去除和转化特性,如图4所示.图4中,NH3-N,NO-2-N,NO-3-N的初始浓度分别为3.12,5.12,4.25mmol·L-1.从图4可知:菌株的静息细胞在处理过程中,随着处理时间的延长,在处理1d时,水体中亚硝氮的摩尔浓度先升高;随后迅速降低,水体中氨氮和硝氮的去除率缓慢升高至趋于稳定,最终水体中亚硝氮完全去除,硝氮的去除率为94.25%,氨氮的去除率为10.89%.
结果表明:YL28菌株的静息细胞对亚硝氮和硝氮具有良好的去除作用,而对氨氮的去除能力较为微弱.水体中亚硝氮摩尔浓度暂时性升高,主要是由于反硝化的作用将硝氮转化为亚硝氮.
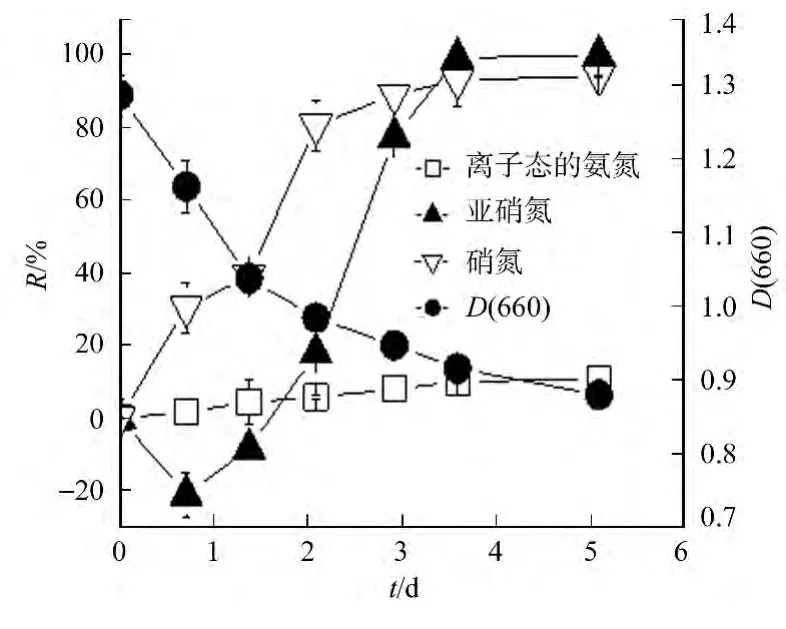
图4 YL28菌株静息细胞对无机氮的去除过程Fig.4 Removal of inorganic nitrogen by YL28resting cells
3 结论
研究YL28菌株静息细胞对无机三态氮的去除和转化特性,与菌株在生长过程中对无机三态氮的去除结果[10]相比,菌株对亚硝氮和硝氮的去除速率明显下降,菌株对氨氮的去除量也远远偏低.通过分析认为,在YL28菌株的静息细胞中,硝化作用并非是转化无机三态氮的主导途径,该菌株仅在厌氧光照条件下,以氨氮作为唯一氮源的生长过程中,才能表现出较强的硝化作用.YL28菌株静息细胞对亚硝氮和硝氮的良好去除和转化作用,体现了该菌株本身具有良好的反硝化和亚硝酸盐厌氧氧化作用.但是,由于微生物静息细胞对无机三态氮的去除转化研究较为少见,尚不能比较菌株的静息细胞对无机三态氮的转化途径是否相一致.虽然菌株的静息细胞对氨氮去除和转化作用较微弱,但是研究过程中,还是发现氨氮能被转化为少量的硝氮和亚硝氮,这为YL28菌株中存在的氮转化途径也提供了一定实验依据.
YL28菌株的静息细胞对亚硝氮和硝氮具有良好的去除能力,对氨氮的去除能力很微弱,能通过反硝化作用将硝氮转化为亚硝氮而去除,也能将亚硝酸盐厌氧氧化为硝氮,几乎不能通过铵同化作用去除氨氮.实验结果表明:在适宜的温度和pH值条件下,该菌株在黑暗厌氧等生存环境中,虽然生长缓慢,但仍具有良好去除环境中亚硝氮和硝氮的能力.本研究为针对性地开发适应特定环境的APB制剂及其应用提供参考.
[1]COREY P,KIM J K,DUSTON J,et al.Bioremediation potential ofPalmariapalmataandChondruscrispus(Basin Head):Effect of nitrate and ammonium ratio as nitrogen source on nutrient removal[J].Journal of Applied Phycology,2013,25(5):1349-1358.
[2]HERBECK L S,UNGER D,WU Y,et al.Effluent,nutrient and organic matter export from shrimp and fish ponds causing eutrophication in coastal and back-reef waters of NE Hainan,tropical China[J].Continental Shelf Research,2013,57(S1):92-104.
[3]NEWAJ-FYZUL A,AL-HARBU A,AUSTIN B.Review:Developments in the use of probiotics for disease control in aquaculture[J].Aquaculture,2014,431:1-11.
[4]QI Zi-zhong,ZHANG Xiao-hua,BOON N,et al.Probiotics in aquaculture of China-Current state,problems and prospect[J].Aquaculture,2009,290(1/2):15-21.
[5]俞吉安,张承康,陈峰.光合细菌P4株的反硝化作用[J].上海交通大学学报,2000,34(11):1579-1582.
[6]陈慧,张德民,王龙刚,等.一株反硝化光合细菌的生物学特性及系统发育分析[J].微生物学报,2011,51(2):249-255.
[7]杨莺莺,曹煜成,李卓佳,等.PS1沼泽红假单胞菌对集约化对虾养殖废水的净化作用[J].中国微生态学杂志,2009,21(1):4-6.
[8]PINO C,OLMO-MIRA F,CABELLO P,et al.The assimilatory nitrate reduction system of the phototrophic bacteriumRhodobactercapsulatusE1F1[J].Biochemical Society Transactions,2006,34(1):127-129.
[9]赵江艳,傅英楠,赵春贵,等.一株高含玫红品的红树林海洋紫色硫细菌分离鉴定及特性[J].微生物学报,2011,51(10):1318-1325.
[10]蒋鹏,赵春贵,贾雅琼,等.一株以亚硝氮为唯一氮源生长的海洋紫色硫细菌对无机三态氮的去除特性[J].微生物学通报,2014,41(5):824-831.
[11]陈燕红,杨紫红,喻国辉,等.光照,氧气,pH和盐度对沼泽红假单胞菌2-8菌株生长和亚硝酸盐消除的影响[J].南方水产科学,2010,6(4):1-5.
[12]郑卉,张德民,王一农,等.红假单胞菌去除养鱼废水三态氮及COD的研究[J].生态科学,2012,31(4):435-440.
[13]杨大娇,任天宝,王风芹,等.静息细胞在发酵工业中的研究进展[J].食品与发酵工业,2013,39(8):187-191.
[14]TRÜPER H,PFENNIG N.The family Chlorobiaceae[M].New York:Springer,1992:3583-3592.
[15]EATON A D,CLESCERI L S,RICE E W,et al.Standard methods for the examination of water and wastewater[M].Washington D C:American Public Health Association,American Water Works Association,Water Pollution Control Federation,1998:547-565.
[16]SHAPLEIGH J P.Dissimilatory and assimilatory nitrate reduction in the purple photosynthetic bacteria[M].Netherlands:Springer,2008:623-642.
[17]SCHOTT J,GRIFFIN B M,SCHINK B.Anaerobic phototrophic nitrite oxidation byThiocapsasp.strain KS1andRhodopseudomonassp.strain LQ17[J].Microbiology,2010,156(8):2428-2437.
