微生物法生产肌醇研究进展
2015-11-08黄贞杰陈由强
黄贞杰,陈由强
(1.泉州医学高等专科学校,福建泉州362010;2.福建师范大学生命科学学院,福建福州350108)
微生物法生产肌醇研究进展
黄贞杰1,陈由强2
(1.泉州医学高等专科学校,福建泉州362010;2.福建师范大学生命科学学院,福建福州350108)
肌醇是一种具有旋光性及生物活性的环状糖醇,具有许多重要的生理活性,广泛应用于医药、食品及饲料等行业。利用微生物法生产肌醇具有很好的应用前景。文中介绍了肌醇的功能,综述了肌醇的微生物酶解法和发酵法生产的研究进展,并对其前景进行了展望。
肌醇,发酵,微生物催化,酿酒酵母,研究进展
肌醇(inositol)又称环己六醇,分子式为C6H12O6,相对分子量是180.16,其外观为白色结晶粉末,味微甜,易溶于水,微溶于乙醇、冰乙酸、乙二醇、甘油;不溶于氯仿、乙醚等有机溶剂。肌醇在理论上有9种可能的异构体(图1),都为葡萄糖的同分异构体。通常在自然界中发现的有4种,分别称为肌肉肌醇(myoinositol)、D-手性肌醇(D-chiro-inositol)、L-手性肌醇(L-chiro-inositol)和鲨肌醇(scyllo-inositol),广泛存在的为肌肉肌醇(myo-inositol)。
随着肌醇的新用途不断被开发,市场需求旺盛,肌醇已成为国际市场上紧俏的医药化工和保健产品之一。2013年全球医药级肌醇年需求量达4000余吨,我国是肌醇生产和出口大国,2012年,我国肌醇出口量达4156 t,同比增加19.58%。
肌醇的传统生产方法可分为水解提取法和化学合成法。目前普遍使用加压水解法,以脱脂米糠为主要原料生产肌醇,从米糠或麸皮中提取出植酸钙,再加压水解制得肌醇,植酸盐水解后肌醇得率一般在10%左右,肌醇产率约为1%,但由于肌醇的提取要经过浸提制备植酸盐、植酸盐水解为肌醇及其溶液的制备等过程,而这些过程中需要耐酸设备,且存在制备过程复杂,生产投入高,污染环境等缺点。这与现代化学工业的发展趋势矛盾。所以肌醇供求之间的矛盾必须通过其他有效途径来解决,而用微生物发酵法生产肌醇正是解决这一矛盾的途径。以下介绍了肌醇的生物活性作用,归纳了国内外关于肌醇的微生物法生产的研究进展。
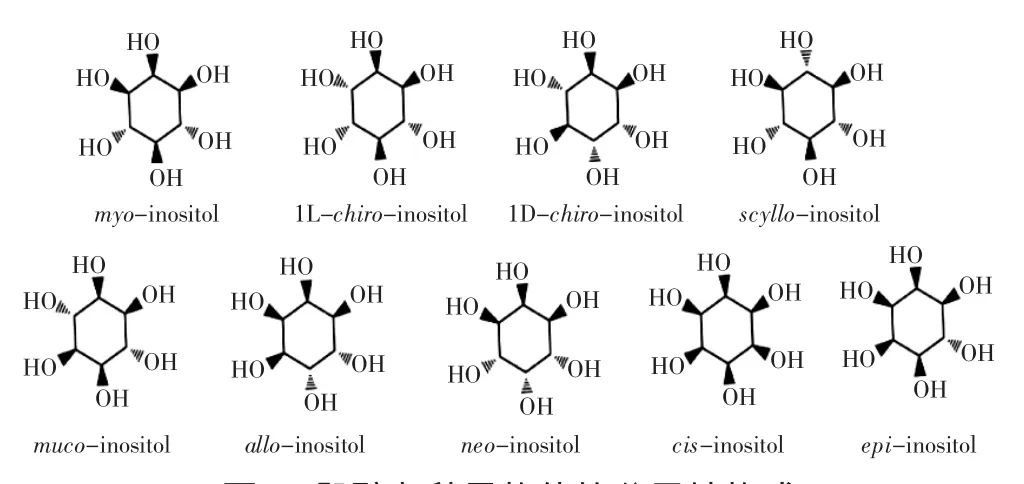
图1 肌醇九种异构体的分子结构式Fig.1 The structures of nine isomers of inositol
1 肌醇生物活性概述
肌醇存在于动植物、微生物体内,具有诸多生理功能,是动物、微生物的生长因子,是细胞膜的组成成分之一,在膜磷脂平衡中扮演着重要的角色。它不仅是胞内第二信使磷脂酰肌醇(phosphatidylinositol,PI)合成的前体,而且对与磷脂酰肌醇(PI)、磷脂酰胆碱(PC)和心磷脂(CL)合成有关的酶类的表达具有调控作用[1],在钙平衡和信号传递方面起到重要作用[2],并能够保持脑细胞的结构完整[3]。1928年Eastcott从生物活素中提成了纯净态的肌醇,并首次发现其为酵母菌生长因子[4]。此后,人们对肌醇的生理药理活性及应用作了更深入的研究。
1.1医药领域
在医药领域中,由于肌醇有类似维生素B1和生物素的功能,作为“生物活素”参与体内的新陈代谢活动,具有促进细胞生长、预防和治疗某些疾病等多种作用。因此临床上肌醇可直接被制成肌醇片,作为药物辅助治疗精神及神经性疾病[5]、维生素缺乏症、血管硬化、糖尿病、肝硬化等多种疾病。肌醇浓度还被证实与新生儿脑病、阿尔茨海默病、唐氏综合症等持续性神经功能障碍有关[6]。另外,以肌醇为药物中间体制得的肌醇硒酸酯、氟代肌醇、脉通、烟酸肌醇酯等药物在治疗动脉硬化、糖尿病、胆固醇过高症、癌症等方面有很好的疗效[7]。Nishino等[8]研究报道口服肌醇对肺癌和肝癌有抑制作用。肌醇的甲基衍生物,如松醇、红杉醇等同样具有降血糖的作用[9]。另外,肌醇在胰岛素的信号传递中发挥着重要作用,可用于糖尿病的治疗[10]。对于糖尿病的治疗起作用的主要是D-手性-肌醇(DCI)。Xia等[11]以富含DCI的荞麦和苦瓜治疗糖尿病大鼠,效果显著。人类缺硒可导致癌症、心血管疾病并加速衰老,而肌醇硒酸酯可用于制备富硒的抗癌药物、食品。肌醇还可改善PCOS(多囊卵巢综合症)女性的胰岛素敏感性和排卵功能,治疗妇女代谢综合症[12-14]。通过补充肌肉肌醇和D-手性-肌醇(DCI)都可以治疗PCOS,且它们属于不同的信号通路,Unfer V等[15]比较了肌肉肌醇和DCI对患PCOS的不育妇女的治疗效果,发现服用肌肉肌醇组有更好更多的成熟卵子,怀孕的人数也比服用DCI的更多。Nordio M等用复合的DCI和肌肉肌醇以及单一的肌肉肌醇治疗超重的PCOS患者,三个月后复合肌醇组更有效果,降低了患代谢综合症的风险[16]。
1.2食品领域
在食品领域,肌醇常作为营养强化剂,美国1987年就推荐含奶婴儿食品中应加入一定量肌醇。90年代,人们发现肌醇可与L-肉毒碱结合使用,可使脂肪很快转化为热能消耗掉,防止脂肪在人体内特别是心血管内沉积,具有减肥功效[17]。肌醇还具有抗氧化、抗衰老、抗炎功能,DCI和其他的抗氧化物不同,主要对超氧阴离子(·O2-),过氧化氢和羟自由基(·OH)表现出更高的抗氧化活性[18]。
1.3饲料工业领域
在饲料工业领域,肌醇主要作为生物促进剂。饲料中加入肌醇,可促进牲畜生长和防止出现毛发脱落及体内生理活动失去平衡等症状。在对虾及鱼类干饲料中,肌醇添加量通常为300~500 mg/kg。否则将发生肌醇缺乏症,症状为食欲不振、饲料转化率降低、生长停滞。Hada B等发现向果蝇饲料里添加DCI和松醇,与对照组相比,通过激活S6K和JKN通路,增加了转录因子dFOXO的核定位,最终表现为延长果蝇的寿命[19]。
2 微生物酶催化法产肌醇
微生物酶催化法产肌醇主要是应用微生物产生的植酸酶(phytase)和磷酸酯酶(phosphotase),将植酸及其菲丁水解转化为肌醇的方法。一般植酸盐在植酸酶作用下分解为肌醇-2-磷酸,然后肌醇-2-磷酸进一步在磷酸酯酶作用下生成肌醇。另外,也发现能将植酸直接水解成肌醇的植酸酶。因此,通过筛选等手段获得大量表达植酸酶和磷酸酯酶的菌种产肌醇;或分离出能将植酸直接水解成肌醇的植酸酶,成为微生物酶催化法产肌醇的途径。由于酶的反应条件比较温和,可在常温常压下进行,利用酶催化法生产肌醇,能够提高产品得率、降低生产成本,能耗低、环境友好,是肌醇生产发展新趋势。
2.1植酸酶产生菌
植酸酶属磷酸单酯水解酶,能够依次分离植酸分子中的磷,将植酸(盐)降解为肌醇和无机磷,同时释放出与植酸(盐)结合的其他营养物质。植酸酶来源于天然,一种存在于植物体、真菌和细菌中,另一种存在于植物的贮藏器官(如种子、块茎)中。在产植酸酶的微生物中,特别值得一提的有:黑曲霉(A.niger)、米曲霉(A.oryzoe)、青霉(Penicillium)、毛霉(Mucor)和少孢根霉(Rhizopcos.oligorporus)等真菌;细菌:假单胞菌(Pseudomonassp.)、克雷白杆菌(Klebsiella sp.)、大肠杆菌(Escherichia coli)、枯草杆菌(Bacillus subtilis);酵母:酿酒酵母(Saccharomyces cerevisiae)、热带假丝酵母(Candidatropicalis)、球拟酵母(Torulopsis Candida)、汉氏德巴利氏酵母(Debaryomycescastellii)、脆 壁 克 鲁 维 酵 母(Kluyveromyces fragilis)等能分泌相对多量的植酸酶。但一般天然植酸酶产生菌菌株生产植酸酶的量较低,每毫升发酵液只有100~500单位(100~500 U/mL)。中国农业科学院饲料研究所姚斌研究员小组与生物技术研究中心范云六院士小组经过几年的努力采用基因工程技术建构的“工程毕赤酵母”(Pichia pastoris),表达的植酸酶能分泌到培养基中,表达产物稳定,与天然植酸酶在酶学性质上没有差异,具有正常的生物学活性,大大提高酶的产率,经5 L发酵罐实验,产量达到15000单位/毫升(约每毫升发酵液收获5 mg植酸酶蛋白),比原植酸酶产生菌(Aspergillus niger-963)的产量高3000倍以上;比国外报道的“工程菌”(P.pastoris)植酸酶产量高约37倍[20-21]。2010年Gunashree等[22]利用原生质体融合技术提高了菌株植酸酶的活力,固体发酵培养6~7 d,可达到最大酶活产量为126.2 U/gds。为获得在低温环境中生长良好的植酸酶产生菌,张庆芳等[23]对微生物发酵生产低温植酸酶进行研究,将产生植酸酶的微生物逐级低温驯化后在12~18℃逐级扩大培养,低温发酵结束后分离纯化植酸酶。低温植酸酶具有低温高催化活力和高催化效率;能缩短加工过程的时间并节省了昂贵的加热或冷却费用;在节能方面具有相当大的优势。
2.2植酸酶和磷酸酯酶催化产肌醇
自然界分离到的能同时分泌植酸酶和磷酸酯酶的微生物很少,而且产酶能力低,肌醇产率低。无花果曲霉能同时分泌植酸酶(E.C.3.1.3.8)和磷酸酯酶(E.C.3.1.3.2),且这两种酶均具有底物专一性,王建玲等[24]通过对无花果曲霉(A.ficuum A.s3.324)产生植酸酶和磷酸酯酶的条件进行研究,在确定的最佳条件下,植酸酶和磷酸酯酶活力分别达到5.7、0.533 U/mL。用所得发酵液水解菲丁制备肌醇,使肌醇的转化率达10.3%,该转化率与传统加压水解法制备肌醇的转化率接近。
Xingen Lei等[25]通过核酸定点突变获得多株曲霉植酸酶突变体,提高了植酸酶活力、热稳定性和适宜pH范围。随后克隆了Escherichia coli的植酸酶基因phyA和酸性磷酸酶基因appA,分别构建表达载体,转化酵母菌获得重组菌,利用重组菌过表达植酸酶和酸性磷酸酶,通过发酵玉米、大豆粉、麸皮,使植酸水解转变为肌醇和无机单磷酸[26]。
2.3高效表达植酸酶催化产肌醇
目前发现的绝大部分微生物来源的植酸酶分解植酸盐形成的终产物均是单磷酸肌醇和无机正磷酸,但Mochizuki等从Schwanniomyces occidentalis中分离出的植酸酶可将植酸盐分解为肌醇和无机磷酸[21]。Melanie等通过疏水层析从汉氏德巴利氏酵母Debaryomyces castellii分离纯化得到能将植酸彻底水解成肌醇的植酸酶,并通过基因重组技术过表达这种酶,所得酶的性质与原酶相同[27-28]。
埃莱娜·布兹等[29]对Debaryomyces castellii CBS 2923植酸酶的生物合成进行研究,克隆该菌株植酸酶基因,进行重组过表达,获得的重组株分别产生100(PIC株)和10(GAP株)倍高于野生型Debaryomyces castellii CBS 2923株的植酸酶,随后进行了植酸酶组合对植酸水解的协同效应研究,将酵母Schwanniomyces castellii的植酸酶或酵母Debaryomyces castellii的植酸酶与黑曲霉Natuphos(AN)的植酸酶等组合,用于将植酸水解为无机单磷酸、较低磷酸化水平的肌醇以及游离的肌醇[30]。Ann-Sofie等[31]通过表达和敲除植酸酶相关基因的方法构建了提高植酸酶活力的酿酒酵母基因工程菌株,可以用于发酵产肌醇磷脂异构体和肌醇。
生物酶催化在实现绿色化工方面具有许多优势:新型、高效率、周期短、选择性提高、常温、常压。酶的反应条件比较温和,通过避免使用高温、高压,避免金属和有机溶剂的大量消耗,来大大降低单位产品的废物产生量。由此可见,利用生物酶催化的方法生产肌醇是必要的,具有很好的应用前景。
3 微生物发酵法产肌醇
3.1自然选育与诱变菌株发酵产肌醇
微生物发酵法生产肌醇,主要以混合糖类合成培养基为原料,以酿酒酵母或假丝酵母等为主要生产菌,经一二级发酵分泌肌醇到发酵液中,再对发酵液进行处理,经纯化、浓缩、结晶最后得到高纯度的肌醇。
早期日本的shirai M团队对选育产肌醇菌株做了重要的研究,通过诱变选育出3种突变株,其中对葡萄糖代谢拮抗物有抗性的假丝酵母DGR1-14(FERM P-1439或FERMBP-5070等菌种),通气发酵34~96 h,肌醇产量在0.4~3 g/L[32-33]。白井真等[34]通过以诱变获得的博伊丁假丝酵母IP-2发酵培养向细胞外分泌肌醇,可在细胞外积累1.5 L的肌醇。勾秋芬等[35]研究利用酿酒酵母对苦荞粉进行发酵,提高D-手性肌醇含量。正交优化及其验证实验表明最佳发酵条件组合是温度为28℃,发酵时间为34 h,pH为5.5,料液比为1∶10;D-手性肌醇平均含量可以达到1.82%。
此外,也有研究利用黑曲霉发酵制取肌醇。刘晓永等[36]以麸皮为原料利用黑曲霉WS-65进行固态发酵制取肌醇,优化后的最佳发酵条件下的最高肌醇产量为55 mg/100mL。欧仕益等对利用黑曲霉发酵麦麸制备阿魏酸、肌醇和低聚糖进行了初步研究,结果表明,黑曲霉能部分释放麦麸膳食纤维上所束缚的阿魏酸,并将多糖和植酸分别水解成低聚糖和肌醇。不过,由于黑曲酶在释放这些物质的同时又将它们作为营养源,因此,利用黑曲霉直接发酵麦麸生产这三种物质是不经济的,而利用它们产生的酶来生产阿魏酸、肌醇和低聚糖可能是更好的选择[37]。
3.2基因工程菌发酵产肌醇
近几十年来细胞生物学的研究不断深入,使得酵母菌的肌醇代谢途径已基本明晰。自然选育的菌株肌醇产率通常较低,因此,采用基因工程和代谢工程技术,针对具有清晰基因组信息以及成熟基因操作工具的酵母菌以及大肠杆菌等菌株进行改造,以获得高效肌醇生产菌株。主要表现在两个方面:利用基因高效表达和基因敲除技术改造酵母菌;产肌醇大肠杆菌工程菌的构建。
酵母从葡萄糖开始合成肌醇的生物合成与代谢途径见图2[38]。在肌醇的合成过程中,肌醇-3-磷酸合成酶是关键酶,该酶的表达受到其产物肌醇的反馈抑制,野生菌株中肌醇-3-磷酸合成酶只在对数期或缺少肌醇的情况下表达。编码该酶的基因为ino1,该基因已从酵母菌中克隆得到,并进行了序列分析[39]。ino1基因是酵母中受控制最严格的基因之一,Ino1′转录子是细胞内转录装置缺陷的敏感元件,如破坏TATA结合蛋白或敲除普遍性转录因子TFIIA,都会影响Ino1的激活,导致肌醇营养缺陷体的出现[40]。对ino1基因启动子的研究发现,在其基因的启动子的上游存在一些重复序列,称之作UASINO元件。有研究[41]指出UASINO是对肌醇敏感的序列,如果培养基中含有肌醇,它会被激活而影响ino1的表达,酵母细胞中的肌醇-3-磷酸合成酶便受到阻遏,酶活力下降,细胞中的肌醇合成停止。ino1的表达需要转录激活物Ino2p和Ino4p结合到UASINO元件上,ino2和ino4基因编码基本的螺旋-环-螺旋蛋白(basic helix-loop-helixproteins)作为异质二聚体结合在UASINO元件上[42]。J Anthony Graves和Susan A Henry[43]研究发现ino2或ino4基因缺陷菌株,不能在缺少肌醇的培养基中生长。在含有限肌醇的液体培养基里,opi1、ino4基因缺陷菌株Ino1的表达量要比对照菌株高,但在含有足量肌醇的培养基中生长,Ino1的表达就会受到抑制,因此研究表明Opi1p、Sin3p、和Ino2p/Ino4p复合体会影响Ino1表达的总体水平,但与Ino1对肌醇的反馈应答无关。Rundlett等研究发现,ume6和rpd3是Ino1的负转录调控基因,RPD3是一种组蛋白去乙酰化酶,rpd3缺陷菌株Ino1的表达量是野生菌的32倍[44]。Yina Wang等研究分析了新生隐球菌肌醇转运蛋白基因itr,结果表明itr1a和itr3c是10个候选基因中唯一的两个itr基因,它们能够弥补酿酒酵母肌醇转运蛋白缺陷株的生长。异源表达itr1a或itr3c的酿酒酵母菌株表现出高的肌醇吸收活力,说明Itr1a、Itr3c是主要的肌醇转运蛋白,因此肌醇的吸收和生物合成途径对肌醇生成都是极其重要的[45]。Ye C等[46]研究发现ino1的转录受肌醇焦磷酸合成的调控,并提出通过调整肌醇焦磷酸激酶的编码基因kcs1来合成肌醇焦磷酸,从而调控ino1的转录。在早期,shirai M团队通过以利用葡萄糖为诱导物的启动子,将酿酒酵母的磷酸酶基因和假丝酵母的肌醇-1-磷酸合成酶基因在假丝酵母中过表达来生产肌醇[47]。Justin AM等在Escherichia coli中过表达拟南芥的磷脂酰肌醇合成酶1,从而发酵制取肌醇[48]。张厚程等[1]用含有肌醇合成的关键酶基因ino1的两不同质粒对肌醇营养缺陷型粟酒裂殖酵母菌进行转化,得到两株肌醇合成能力有巨大差异的菌株。

图2 酵母肌醇的生物合成与代谢途径Fig.2 The flow chart of biosynthesis and metabolism of myo-inositol in yeast
以上研究表明,为提高肌醇的高效合成,通过调控肌醇生物合成与代谢途径中相关基因的表达是非常必要的,特别是肌醇合成过程中的关键酶基因ino1。通过基因工程技术直接或间接的调控肌醇合成酶基因的表达,构建高效表达ino1基因的肌醇基因工程菌,从而提高肌醇的产量,为微生物发酵法产肌醇奠定基础。
另一方面,Breenberg等采用遗传工程方法研究揭示了,S.cerevisiaes中至少存在opi1、opi2、opi4三个基因位点,这些基因对肌醇的生物合成关键酶的合成起阻遏作用,它们之间及与肌醇合成关键酶基因ino1互不连锁[38]。随后,White和Henry采用基因工程技术发现并证明了opi1是磷脂生物合成的一个负调控基因,它编码的蛋白质是肌醇生物合成的一个负调节子,Ashburner的研究也指出,opi1基因表达产物是肌醇应答的主要靶目标,能够抑制Ino2转录子决定靶基因的表达程度;在包含gal1-ino2的菌株中,通过敲除opi1基因能够解除肌醇对目标基因表达的影响[49]。在诸多研究的基础上,White等通过敲除opi1基因位点获得了能多产肌醇的基因工程菌YS2(ATCC-74033)等[50]。A grawal.P等[51]利用敲除了opi1基因的野生S.cerrevisae,即基因工程菌YS2(ATCC-74033)和YS3(ATCC-74034)进行发酵产肌醇。采用含葡萄糖100 g/L、硫酸铵作为氮源的合成营养培养基进行发酵,肌醇产率是单糖发酵液中肌醇浓度的10倍。利用杏仁壳浸渍汁的物料进行连续发酵实验,发酵结束后肌醇含量达9 g/L(接近或超过了化学提取法水平),使肌醇浓度提高50%。从实验结果分析知,因培养基不同,其发酵类型表现为一、二型发酵,较高浓度的葡萄糖对肌醇产生有抑制作用。该团队随后研究[52],发现了一种从糖类混合发酵液中纯化肌醇的方法。方法中采用不优先利用肌醇作为碳源的野生S.cerrevisae(DD2、aDD2)对含糖、肌醇、山梨醇等不同成分的培养基进行发酵,发酵后除山梨醇仍有小部分剩余外,其他糖类物质均在38 h内被完全转化。经DD2、aDD2发酵处理过的肌醇发酵液再浓缩结晶后得到了高纯度的肌醇结晶产品。因此,加大对培养基等发酵条件和发酵液后处理的研究,有利于目标产物肌醇的积累和分离纯化,提高肌醇生产效益。
2013年日本再次公布了多篇关于微生物法生产肌醇方面研究的相关专利。KONISHI Kazunobu[53]团队利用基因重组技术结合使用合成生物学技术,对不具有内源肌醇生物合成途径的大肠杆菌进行重组改造,得到能够生产肌醇和肌醇衍生物(1-4-O-β-D-吡喃葡萄糖基-肌-肌醇)的工程菌株,分别是AKC-018菌株和AKC-016-G22菌株。AKC-018菌株在含30 g/L葡萄糖的LB培养基中发酵23.5 h,肌醇产量为1.84 g/L。该团队还研究提供了一步法发酵生产鲨肌醇的方法,通过构建含有肌醇-1-磷酸合成酶基因、肌醇单磷酸酶基因、肌肌醇脱氢酶基因、鲨肌醇脱氢酶基因的重组菌株,该菌株在合成培养基中发酵培养68 h后,分离发酵液上清液,HPLC检测结果显示,鲨肌醇含量量高达12.4 g/L[54]。SEMBA Hisashi等[55]通过降低糖酵解酶的活性,高表达肌醇合成酶基因,获得高产肌醇的酿酒酵母突变株,通气发酵培养31.5 h,检测结果肌醇产量为4.0 g/(L·day)。
此外,Yamaoka M等[56]报道,枯草芽孢杆菌能够代谢合成肌醇,包括肌肌醇、D-手性肌醇、鲨肌醇等。Kosei Tanaka等[57]研究进一步提高枯草芽孢杆菌内鲨肌醇转化效率。通过在已敲除相关基因的枯草芽孢杆菌MYI04细胞内过表达肌醇转化为鲨肌醇代谢途径中的关键酶基因iolG、iolW,工程菌在含有2%(w/v)蛋白胨的培养基中发酵鲨肌醇生产率为10 g/L·48 h以上。
在肌醇基因工程菌研究方面,作者所在课题组已克隆得到酿酒酵母ino1基因序列全长,构建了超表达ino1基因的整合表达载体[58],转化酿酒酵母Y01,获得重组菌。并研究证实肌醇对酵母细胞生长有调控作用,能够提高酿酒酵母细胞活力,对酵母耐高乙醇起着重要作用,与Hong ME等研究一致[59]。
4 展望
综上,微生物法生产肌醇,具有巨大的优势和潜力,发展和应用生物高新技术,用其推动肌醇生产,提高产品纯度,逐步降低产品成本,是肌醇生产研究的趋势。为适应市场多方面的需求,微生物发酵工程及其产业化的发展是必然趋势,而获取优化的微生物发酵肌醇产品的关键还在于加强选育高产、高效、优质的生产菌种,并保持其在生产过程中的稳定性和适应性,因此,如何利用基因工程手段获得高产率的生产菌株和通过发酵优化实现肌醇的高效生产是未来的研究热点和重点。可以从以下几个方面着手:利用基因工程技术进一步改造菌种,对肌醇合成途径的正负调控同时改造,先过表达肌醇合成酶基因ino1,再敲除对肌醇的生物合成起阻遏作用的基因opi1,并敲除用于筛选用的抗生素抗性基因,最终构建安全无毒害的肌醇基因工程菌株,为工业化生产奠定基础。选育葡萄糖结构类似物等抗性高产菌株。深入研究肌醇发酵机理,实行有效代谢调控方案。优化发酵培养基,以廉价非粮生物质为发酵底物,降低肌醇发酵生产的底物利用成本,提高生产效益。上述研究成果正是完成肌醇发酵法工业化生产的基础,巩固已有的研究成果,继续探索和创新,微生物法生产肌醇前景广阔。
[1]张厚程,池振明.INO1基因在粟酒裂殖酵母中的表达及对蔗糖酶分泌和磷脂合成的影响[J].山东大学学报:理学版,2002,37(6):544-547.
[2]Divecha N,Irvine RF.Phospholipid signaling[J].Cell,1995,80(2):269-278.
[3]Kim H,McGrath BM,Silverstone PH.A review of the possible relevance of inositol and the phosphatidylinositol second messenger system(PI-cycle)to psychiatric disorders-focus on magnetic resonance spectroscopy(MRS) studies[J].Human Psychopharmacology:Clinical and Experimental,2005,20(5):309-326.
[4]Nikawa J-I,Tsukagoshi Y,Yamashita S.Isolation and characterization of two distinct myo-inositol transporter genes of Saccharomyces cerevisiae[J].Journal of Biological Chemistry,1991,266(17):11184-11191.
[5]Taylor M,Wilder H,Bhagwagar Z,et al.Inositol for depressive disorders[J].Cochrane Database of Systematic Reviews,2004,2: CD004049.
[6]Haroon E,Watari K,Thomas A,et al.Prefrontal myo-inositol concentrationandvisuospatialfunctioningamongdiabetic depressed patients[J].Psychiatry Research:Neuroimaging,2009,171(1):10-19.
[7]Vucenik I,Shamsuddin AM.Cancer inhibition by inositol hexaphosphate(IP6)and inositol:from laboratory to clinic[J]. The Journal of nutrition,2003,133(11):3778S-3784S.
[8]Nishino H,Murakoshi M,Masuda M,et al.Suppression of lung and liver carcinogenesis in mice by oral administration of myo-inositol[J].Anticancer research,1998,19(5A):3663-3664.
[9]舒向荣.红杉醇等肌醇类物质降血糖作用机制的研究[D].长沙:中南大学,2009.
[10]Larner J.D-chiro-inositol-its functional role in insulin action and its deficit in insulin resistance[J].Experimental Diabetes Research,2002,3(1):47-60.
[11]Xia T,Wang Q.D-chiro-inositol found in Momordica charantia fruit extract plays a role in reducing blood glucose in streptozotocin-diabetic rats[J].Journal of food biochemistry,2007,31(4):551-562.
[12]Genazzani AD,Santagni S,Rattighieri E,et al.Modulatory role of D-chiro-inositol(DCI)on LH and insulin secretion in obese PCOS patients[J].Gynecological Endocrinology,2014,30(6):438.
[13]Genazzani AD,Santagni S,Ricchieri F,et al.Myo-inositol modulates insulin and luteinizing hormone secretion in normal weight patients with polycystic ovary syndrome[J].Journal of Obstetrics and Gynaecology Research,2014,40(5):1353-1360.
[14]Genazzani AD,Prati A,Despini G,et al.PCOS from Lifestyle to the Use of Inositol and Insulin Sensitizers[M].Frontiers in Gynecological Endocrinology,Springer International Publishing,2014:59-67.
[15]Unfer V,Carlomagno G,Rizzo P,et al.Myo-inositol rather than D-chiro-inositol is able to improve oocyte quality in intracytoplasmic sperm injection cycles.A prospective,controlled,randomizedtrial[J].EuropeanReviewforMedicaland Pharmacological Sciences,2011,15(4):452-457.
[16]Nordio M,Proietti E.The combined therapy with myoinositol and D-chiro-inositol reduces the risk of metabolic disease in PCOS overweight patients compared to myo-inositol supplementation alone[J].European Review for Medical and Pharmacological Sciences,2012,16(5):575-581.
[17]张芹,王芳,陈雅蕾.肌醇生产及应用研究进展[J].中国稻米,2012,18(3):19-21.
[18]Coballase-Urrutia E,Pedraza-Chaverri J,Camacho-Carranza R,et al.Antioxidant activity of Heterotheca inuloides extracts and of some of its metabolites[J].Toxicology,2010,276(1):41-48.
[19]Hada B,Yoo M-R,Seong KM,et al.D-chiro-inositol and pinitol extend the life span of Drosophila melanogaster[J].The Journals of Gerontology Series A:Biological Sciences and Medical Sciences,2013,68(3):226-234.
[20]Yao B,Zhang C,Wang J,et al.Recombinant Pichia pastorisoverexpressing bioactive phytase[J].Science in China Series C:Life Sciences,1998,41(3):330-336.
[21]姚斌,范云六.植酸酶的分子生物学与基因工程[J].生物工程学报,2000,16(1):1-5.
[22]Gunashree B,Venkateswaran G.Enhanced phytase production through interspecific protoplast fusion of Aspergillus niger CFR 335 and Aspergillus ficuum SGA 01 auxotrophic mutants[J]. Enzyme and microbial technology,2010,46(7):562-567.
[23]张庆芳,迟乃玉,窦少华.微生物发酵生产低温植酸酶的方法:CN,102093987 B[P].2013-5-1.
[24]王建玲,王敏.利用酶法生产肌醇初步研究[J].天津轻工业学院学报,1998(2):15-19.
[25]Xingen L,Edward JM,Abul HJU.Using mutations to improve aspergillus phytases:WO2004024885 A2[P].2004-3-25.
[26]Xingen L.Overexpression of phytase genes in yeast systems:EP,1090129 B2[P].2013-5-1.
[27]Ragon M,Aumelas A,Chemardin P,et al.Complete hydrolysis of myo-inositol hexakisphosphate by a novel phytase from Debaryomyces castellii CBS 2923[J].Applied microbiology and biotechnology,2008,78(1):47-53.
[28]Ragon M,Neugnot-Roux V,Chemardin P,et al.Molecular gene cloning and overexpression of the phytase from Debaryomyces castellii CBS 2923[J].Protein expression and purification,2008,58(2):275-283.
[29]埃莱娜·布兹.卡氏德巴利酵母植酸酶:CN,101263226 B[P].2011-8-17.
[30]埃莱娜·布兹.植酸酶组合对植酸水解的协同效应:CN,101258239 B[P].2012-12-12.
[31]Ann-Sofie S,Tomas A.Saccharomyces cerevisiae yeast strain with improved phytase activity:EP,1495116 B1[P].2012-5-30.
[32]YUICHIRO N,TORU Y,MAKOTO S.Production of inositol and production of strain resistant to tertiart amine:JP,9117295(A)[P].1997-05-06.
[33]MAKOTO S,TETSU Y.Process for production of inositol and microorganism used therefore:USP,5618708(A)[P].1997-04-08.
[34]白井真,米原彻.肌醇的制备方法以及所用微生物:CN,1118006 A[P].1996-03-06.
[35]勾秋芬.酿酒酵母发酵对苦荞中D-手性肌醇含量的影响[D].成都:四川师范大学,2009.
[36]刘晓永,钱和,杨天宝.黑曲霉WS—65固态发酵生产肌醇的研究[J].饲料工业,2003,24(11):41-43.
[37]欧仕益,陈喜德,符莉,等.利用黑曲霉发酵麦麸制备阿魏酸,肌醇和低聚糖的研究[J].粮食与饲料工业,2003(5):31-32.
[38]刘文宝,金玉坤,游松.肌醇制备方法的现状与进展[J].沈阳药科大学学报,2012,29(3):234-240.
[39]Klig LS,Antonsson B,Schmid E,et al.Inositol biosynthesis:Candida albicans and Saccharomyces cerevisiae genes share common regulation[J].Yeast,1991,7(4):325-336.
[40]Shirra MK,Arndt KM.Evidence for the involvement of the Glc7-Reg1 phosphatase and the Snf1-Snf4 kinase in the regulation of INO1 transcription in Saccharomyces cerevisiae[J].Genetics,1999,152(1):73-87.
[41]Kagiwada S,Zen R.Role of the yeast VAP homolog,Scs2p,in INO1 expression and phospholipid metabolism[J].Journal of Biochemistry,2003,133(4):515-522.
[42]Ambroziak J,Henry SA.INO2and INO4gene products,positive regulators of phospholipid biosynthesis in Saccharomyces cerevisiae,form a complex that binds to the INO1 promoter[J]. Journal of Biological Chemistry,1994,269(21):15344-15349.
[43]Graves JA,Henry SA.Regulation of the yeast INO1 gene:The products of the INO2,INO4and OPI1 regulatory genes are not required for repression in response to inositol[J].Genetics,2000,154(4):1485-1495.
[44]Rundlett,Stephen E,Carmen,et al.Transcriptional repression by UME6 involves deacetylation of lysine 5 of histone H4 by RPD3[J].Nature,1998,392(6678):831-835.
[45]Wang Y,Liu Tb,Delmas G,et al.Two major inositol transporters and their role in cryptococcal virulence[J].Eukaryotic cell,2011,10(5):618-628.
[46]Ye C,Bandara WMS,Greenberg ML.Regulation of inositol metabolismisfine-tunedbyinositolpyrophosphatesin Saccharomyces cerevisiae[J].Journal of Biological Chemistry,2013,288(34):24898-24908.
[47]Yonehara T,Shirai M,Kanai S,et al.Promoter DNA of yeast belonging to genus candida having activity in presence of glucose,recombinant DNA containing the same,transformant and production of inositol using the same:JP,1998-271995[P]. 1998-10-13.
[48]Justin A-M,Kader J-C,Collin S.Synthetic capacity of Arabidopsisphosphatidylinositolsynthase1expressedin Escherichia coli[J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2003,1634(1):52-60.
[49]Ashburner BP,Lopes JM.Regulation of yeast phospholipid biosynthetic gene expression in response to inositol involves two superimposedmechanisms[J].ProceedingsoftheNational Academy of Sciences,1995,92(21):9722-9726.
[50]Henry SA,White MJ.Inositol-excreting yeast:US,5599701 A[P].1997-02-04.
[51]AgrawalP.Microbial method of producing inositol:US,5296364[P].1994-03-22.
[52]AGRAWAL P,Rabinowitz I.Method of purifying cyclitiol:US,5626847 A[P].1997-05-06.
[53]KONISHI K.Method for producing myo-inositol and myoinositol derivative:WO,2013073483 A9[P].2013-07-25.
[54]KONISHI K.Method for producing scyllo-inositol:WO,2013115012 A1[P].2013-08-08.
[55]Hisashi S,Yusuke M.Microorganism producing inositol with high yield,and method for manufacturing inositol by using same:WO,2013125666 A1[P].2013-08-29.
[56]Yamaoka M,Osawa S,Morinaga T,et al.A cell factory of Bacillus subtilis engineered for the simple bioconversion of myoinositol to scyllo-inositol,a potential therapeutic agent forAlzheimer’s disease[J].Microbial cell factories,2011,10:69.
[57]Tanaka K,Tajima S,Takenaka S,et al.An improved Bacillus subtilis cell factory for producing scyllo-inositol,a promising therapeutic agent for Alzheimer’s disease[J].Microbial Cell Factories,2013,12(1):124.
[58]黄贞杰,陈玲,张积森,等.ScINO1基因克隆及酵母多基因多拷贝整合表达载体的构建[J].福建师范大学学报:自然科学版,2012,28(6):100-105.
[59]Hong M-E,Lee K-S,Yu BJ,et al.Identification of gene targets eliciting improved alcohol tolerance in Saccharomyces cerevisiae through inverse metabolic engineering[J].Journal of Biotechnology,2010,149(1):52-59.
Advances in microbial production of inositol
HUANG Zhen-jie1,CHEN You-qiang2
(1.Quanzhou Medical College,Quanzhou 362010,China;2.College of Life Sciences,Fujian Normal University,Fuzhou 350108,China)
Inositol,a kind of cyclic sugar alcohol which has optical activity and biological activity,has significant physiological functions and it is widely used in the fields including medicine,food and feed.Microbial production of inositol had broad application potentials.In this article,the functions of inositol,research development of fermentation and microbial enzymatic hydrolysis ways to produce inositol were described.Furthermore,prospect and tendency of microbial production of inositol were addressed.
inositol;fermentation;microbial catalyzing;Saccharomyces cerevisiae;advances
TS201.1
A
1002-0306(2015)16-0384-07
10.13386/j.issn1002-0306.2015.16.070
2014-10-28
黄贞杰(1987-),男,硕士,助教,研究方向:应用微生物与发酵技术,E-mail:hzj887@126.com。
福建省医药卫生科研人才培养项目资助计划(2014-1-87);泉州医学高等专科学校“国家骨干院校建设”重点资助科研项目(XJ1317);国家现代农业产业技术体系建设专项资金资助项目(CARS-20-4-4)。
